Method Article
항체 단편의 라이브러리를 스크리닝에 대한 세균 내부 멤브레인 디스플레이
요약
We provide a method to simultaneously screen a library of antibody fragments for binding affinity and cytoplasmic solubility by using the Escherichia coli twin-arginine translocation pathway, which has an inherent quality control mechanism for intracellular protein folding, to display the antibody fragments on the inner membrane.
초록
Antibodies engineered for intracellular function must not only have affinity for their target antigen, but must also be soluble and correctly folded in the cytoplasm. Commonly used methods for the display and screening of recombinant antibody libraries do not incorporate intracellular protein folding quality control, and, thus, the antigen-binding capability and cytoplasmic folding and solubility of antibodies engineered using these methods often must be engineered separately. Here, we describe a protocol to screen a recombinant library of single-chain variable fragment (scFv) antibodies for antigen-binding and proper cytoplasmic folding simultaneously. The method harnesses the intrinsic intracellular folding quality control mechanism of the Escherichia coli twin-arginine translocation (Tat) pathway to display an scFv library on the E. coli inner membrane. The Tat pathway ensures that only soluble, well-folded proteins are transported out of the cytoplasm and displayed on the inner membrane, thereby eliminating poorly folded scFvs prior to interrogation for antigen-binding. Following removal of the outer membrane, the scFvs displayed on the inner membrane are panned against a target antigen immobilized on magnetic beads to isolate scFvs that bind to the target antigen. An enzyme-linked immunosorbent assay (ELISA)-based secondary screen is used to identify the most promising scFvs for additional characterization. Antigen-binding and cytoplasmic solubility can be improved with subsequent rounds of mutagenesis and screening to engineer antibodies with high affinity and high cytoplasmic solubility for intracellular applications.
서문
접는 및 세포 내 환경에서 작동 할 수있는 항체는 연구 및 치료 응용 프로그램 모두를위한 유망한 도구입니다. 이들은 단백질 - 단백질 상호 작용을 방지 단백질 - 핵산 상호 작용을 방해하거나 효소 1-5 기판 액세스를 방지하기 위해 셀 내부의 표적 단백질에 결합하여 단백질의 활성을 조절하는 능력을 갖는다.
항체가 세포 내 애플리케이션 많은 잠재력을 가지고 있지만, 표적 항원에 결합하는 능력을 유지하면서 세포 내 환경의 적절한 폴딩 및 용해성을 설계하는 것은 어려운 것이다. 환원 세포질 환경은 일반적으로 전장 항체의 단일 사슬 가변 단편 (scFv를) -6,7- 항체를 포함한 항체 단편의 폴딩 안정에 필요한 이황화 결합의 형성을 방지한다. 지향 진화 접근 방법은 시간과 함께 항체를 엔지니어에게 이용되어왔다대상에 대한 고등학교의 친화력은 8-10 항원. 이러한 접근은 일반적으로 11-13 항체의 대규모 라이브러리를 선별, 파지 디스플레이, 효모 표면 디스플레이, 박테리아 표면 디스플레이를 사용한다. 이러한 방법은 대상에 결합하는 항체를 식별하기위한 강력하고 효과적이다, 그러나 그들은 14 ~ 16을 표시됩니다 단백질을 수송하기 위해 분비 경로에 따라 달라집니다. 분비 경로는 효모 나 박테리아의 페리 플라 즘에 소포체 내강으로 감소 세포질에서 펼쳐진 단백질으로 전위. 단백질은 산화 조건 하에서 접어 세포 표면 상에 표시하거나 친화 17,18 래핑 선별 파지 입자로 패키징된다. 그 결과, 이들 기술을 이용하여 분리 된 항체는 반드시 세포질에서 잘 접하지 않으며, 항체는 세포 내 용도로 사용할 경우, 세포 내 용해도는 종종 개별적으로 설계되어야한다.
개선하기또한 세포질에 접어 공학 항체의 효율성, 우리는 이전 MAD-TRAP (연관 단백질 타트 기반 인식 막 - 고정 디스플레이)의 성공 대장균 inner- 사용 된 scFv 항체 라이브러리를 스크리닝하기위한 방법을보고 막 디스플레이 19. 세균 내 멤브레인 디스플레이 분비 경로를 사용하는 다른 공통의 표시 방법과 대조적으로, 표시된 항체 수송 트윈 아르기닌 전좌 (TAT) 경로에 의존한다. 타트 경로는 수용성 정확하게 접힌 단백질은 E.에서 이송 될 수 있도록하는 품질 제어 메커니즘을 포함 막을 가로 지르는 내측 및 주변 세포질 (20, 21)에 대장균의 세포질. 잘 세포질에 접어합니다 (문신 신호 펩타이드 ssTorA에 N- 말단 융합과 문신 경로를 대상으로 예. 단백질)가 과발현 문신 기판은 N 말단에 중간 긴 수명 전위를 형성 전세포질 및 주변 세포질 (19)의 C 말단 N. 이는 E.의 세포질 표면에 항체 단편을 포함 올바르게 접혀 타트 기판의 표시를 허용 대장균 내부 막. spheroplasts를 생성 효소 절단에 의해 상기 외부 막을 제거한 후, 항체는 세포 외 공간 (도 1)에 노출된다. 이 내막에 표시 문신 기판이 특정 대상에 대한 결합에 대해 스크리닝 할 수 있습니다. 중요한 것은, 세포 표면 디스플레이를 위해 문신 경로를 활용하는 것은 아니라 세포질에 접어 라이브러리 만 항체 친 화성 세포 폴딩 결합 동시 엔지니어링을 가능 바인딩 심문 될 것임을 보장한다. 이 프로토콜에서, 우리는 E.에서의 scFv 라이브러리를 표시하는 방법에 대해 설명합니다 콜라이 내막은 표적 항원에 대한 라이브러리를 패닝 및 라이브러리의 가장 유망한 성분을 식별하기위한 보조 스크린을 수행한다. 우리는 초점 동안 scFvs의 프로토콜은,이 방법은 그 응용 결합하고 세포 내 접힘이 필요한 단백질을 설계에 적용 할 수있다.
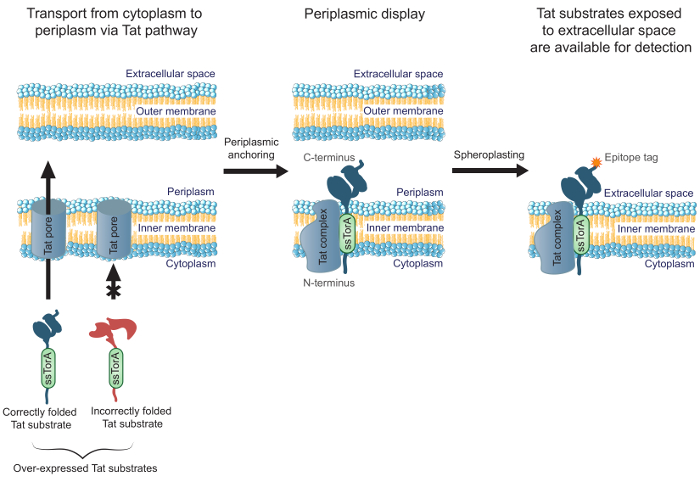
그림 1. 문신 내부 멤브레인 표시됩니다. E.에서 대장균은 ssTorA 신호 서열에 융합으로 표현 올바르게 세포질 접어의 scFv 항체는 내막을 가로 질러 전송된다. scFvs가 세포질에서 N 말단 및 주변 세포질의 C- 말단과 내부 막에 고정되는 전위의 중간 형태. E. 대장균 세포 외막 효소는 이에 외 공간에 고정 된 항체를 노광 및 디스플레이 항체의 C 말단 융합 된 에피토프 태그에 결합하는 항체를 사용하여 검출하기에 사용할 수 있도록 spheroplasts을 형성하도록 분해된다.로드 / 54583 / 54583fig1large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. ssTorA 신호 순서에 융합로의 scFv 라이브러리를 준비
- 의 scFv 유전자의 변이를 포함하는 디옥시리보 핵산 (DNA) 라이브러리를 가져옵니다.
주 : 라이브러리는 전체의 scFv 유전자 또는 표적 영역을 통해 다이버 시티를 생성하기 위해 임의의 적절한 모드를 사용하여 구성 될 수있다 (22) (예를 들어, 영역을 결정하는 제 상보성 CDR3s.). - 표준 분자 클로닝 방법 (23)를 사용하여 PIMD 플라스미드 (그림 2)에 DNA 라이브러리를 삽입합니다.
참고 :이 플라스미드 (의 scFv에 N 말단)에 ssTorA 신호 서열과 유전자 융합과 FLAG 에피토프 태그합니다 (scFv를로 C 터미널)로 scFvs을 표현한다. 내막 표시 용 플라스미드의 설계는 이전 19 설명되었다. PIMD 플라스미드은 저자에서 사용할 수 있습니다.
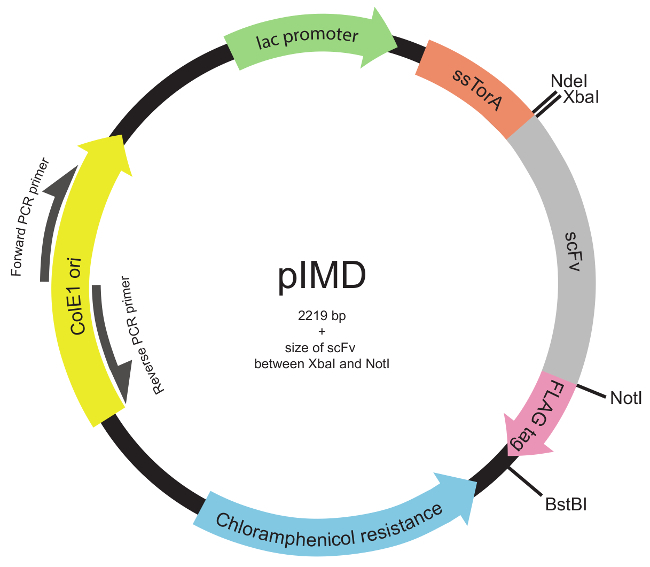
그림 2. 내부 멤브레인 표시 플라스미드 (PIMD)지도 (단계 1.3을 통해 1.2).이 플라스미드는 락 촉진제, 복제의 ColE1 기원하고, 클로람페니콜 내성 유전자가 포함되어 있습니다. 삽입의 scFv 유전자는 동일한 판독 프레임에 세 더불어, 문신 경로에와 FLAG 에피토프 태그에의 scFv를 대상으로 ssTorA 신호 서열에 융합된다. 제한 효소 부위를 나타낸다. 를 XbaI 및 NotI을 제한 효소 사이트 사이에 삽입 된 라이브러리의 경우, 플라스미드의 크기가 2219 bp의 플러스의 scFv의 크기입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- MC4100 E.으로 라이브러리를 포함하는 플라스미드 DNA를 변형 대장균 세포 23. 복구 및 라이브러리의이 박테리아 형태로 성장합니다. 실온에서 15 분 동안 4,000 × g에서 원심 분리기 세포를 수집합니다. 상층 액을 제거하고, 수집 된 세포를 재현 탁루리아 - 베르 타니 (LB) 배지에서 25 % 글리세롤있다. -80 ° C에서 보관 씩 필요, 2 단계로 진행까지.
참고 : 프로토콜이 다른 E. 불구하고, MC4100 세포가 확인되었다 콜라이 균주는 프로토콜과 호환 될 것으로 예상된다. 전기는 높은 변환 효율로 인해 변환을위한 선호하는 방법입니다. 라이브러리는 전형적으로 적어도 10의 scFv이 단계에서 변형 9로 구성되어야하고, 각 분취 라이브러리는 100 배를 피복하도록 충분한 셀들을 포함한다.
2. Spheroplasts을 라이브러리를 표현하고 준비
- 실온에서 (단계 1.3에서) 박테리아 라이브러리 중 하나 나누어지는을 녹여, 20 μg의 / ㎖ 클로람페니콜 (CM) 100 ml의 LB 미디어를 포함하는 플라스크에 분취 량을 추가합니다. 37 ° C에서 3 시간 및 배양 통에서 225 rpm으로 위해 성장.
- 3 시간 후, 37 ° C 배양 통에서 플라스크를 제거합니다. 하기의 scFv 라이브러리의 발현을 허용배양 통에서 15 rpm으로 20 ° C에서 시간 22 및 225에 대한 O / N을 진행합니다.
주 : 유도가 필요하지 프로모터가 누설 한, PIMD 플라스미드를 사용하는 경우. MC4100 세포가 락 리프레을 과발현하지 않습니다 (그리고 Laci 팀이 플라스미드에 발견되지 않는)합니다.

도 3 대장균 세포 spheroplasts. (A) E. 대장균 세포는 원통형이다. (B) EDTA와 리소자임 상기 E.의 외막을 사용 spheroplasting 후 대장균 세포는 파열되고, 생성 spheroplasts 모양 구면이다. 미분 간섭 대비 (DIC) 현미경 이미지. 거꾸로 현미경에 100X 목적을 사용하여 얻었다 하시기 바랍니다 다이 그림의 더 큰 버전을 보려면 여기를 핥아.
- 라이브러리 spheroplasts를 준비합니다.
참고 : E. Spheroplasts는 외막의 파열에 의해 형성된다 대장균 및 (그림 3) 모양의 구형이다.- 필요한 버퍼를 준비합니다.
주 : 모든 버퍼는 멸균해야한다.- 증류수 1000 ㎖의 최종 부피로 2 O 2 PO 4 HPO 4 내지 8 g의 NaCl, 0.2 g의 KCl, 1.44 g이 나트륨을 용해하여 (pH 7.4의 PBS), 및 0.24 g의 KH 1 × 인산염 완충 식염수를 준비한다. 얼음에 보관하십시오.
- 0.1 %와 PBS를 준비 200ml의 1 × PBS에 0.2 g의 BSA를 용해하여 소 혈청 알부민 (BSA) (/ V w). 얼음에 보관하십시오.
- 멸균 여과 한 M 수 크로스, 1 M 트리스 완충액 (pH 8.0), 1.5 ml의 1 ml의 증류수 H 2 O 7.5 ml를 혼합하여 분별 버퍼 (FB)를 준비 얼음에 보관하십시오.
- 30 μL O를 첨가하여 1 mM의 에틸렌 디아민 테트라 아세트산 (EDTA)를 준비H 2 O 증류 F 0.5 M EDTA에 14.97 ml의
- 100 mL에 4.76 g의 MgCl 2를 용해시켜 0.5 M의 MgCl 2를 준비하여 H 2 O를 증류 얼음에 보관하십시오.
- 진탕 플라스크로부터 제거하고, 세포 밀도를 결정하는 분광 광도계를 사용하여 600 nm에서의 광학 밀도 (OD)를 측정한다. 유도 배양 부피 spheroplasting 각 샘플은 1 × 10 10 세포를 갖도록 필요한 계산한다.
참고 : E. 대 109 세포 / ml의 농도를 나타내는 OD (1)의 (600)의 근사 콜라이 24을 사용할 수있다. - 원심 분리기 5 분 동안 실온에서 12,000 × g에서 1.5 ml의 microcentrifuge 관에 의한 문화의 계산 된 볼륨. 문제는 샘플 준비에 발생하는 경우에 적어도 두 개의 샘플을 준비합니다.
- 원심 분리 배양에서 뜨는을 제거하고 얼음처럼 차가운 FB 100 ㎕의 각 세포 펠렛을 재현 탁. 12,000 × 원심 분리기1 분 동안 실온에서 g, 다음은 피펫으로 상층 액을 제거합니다. 10 ㎎ / ㎖의 리소자임을 3.5 μL로 보충 빙냉 FB 350 ㎕를 각각의 펠렛을 재현 탁.
- , 적하 1 mM의 EDTA 700 μL 중에 천천히 각 튜브를 와동 천천히 샘플을 혼합 튜브 회 전자에 회전시키면서 20 분 동안 RT에서 튜브를 배양한다. 상기 회 전자에서 튜브를 분리 각 튜브에 빙냉 0.5 M의 MgCl 2의 50 μL를 추가하고, 10 분 동안 얼음을 배양한다. 원심 분리기 10 분 동안 4 ° C에서 11,000 × g에서 튜브가.
- 스페 로플 라스트 펠렛을 분리합니다.
- 천천히 펠릿의 일부를 당겨 1 ml의 팁과 마이크로 피펫을 사용합니다. 직접 새 1.5 ML 튜브 위의 개구 각도로 튜브를 들고 있지만, 천천히 뜨는에서 피펫 팁을 들어 올려 새로운 튜브에 펠렛을 밀어 넣습니다.
- 뜨는의 큰 볼륨이 새로운 튜브로 전송되는 경우, 피펫 팅하여 제거합니다. 펠렛은 회사의 ENO가 아닌 경우우 다시 2 분, 시도 펠렛 격리를 위해 11,000 × g에서 다시 원심 분리기, 전송합니다.
- 빙냉 1 × PBS 1 ㎖를 각 튜브의 스페 로플 라스트 펠렛을 재현 탁. 피펫 펠렛을 완전히 재현 탁 될 때까지 서서히 와류 홀더 텍싱 교대. 한 번에 2 개 이상의 분 동안 얼음 떨어져 샘플을 유지하고, 다시 얼음에서 제거하기 전에 적어도 5 분 동안 얼음에 반환하지 않습니다. 4 단계에서 패닝에 사용할 때까지 (최대 2 일) 4 °의 C에서 spheroplasts을 유지합니다.
- 필요한 버퍼를 준비합니다.
3. 자석 구슬에 대상 항원을 무력화
- E. 재조합 생산시 생체 내에서 표적 항원을 비 오티 대장균 세포. 또한, 화학 결합 (25) 또는 이미 오티 닐화 된 구매 표적 항원을 사용하고, 3.2 단계로 진행합니다.
- 10 × bicine 버퍼를 만들기 위해 50 ml의 물에 816g의 bicine를 추가합니다. 버피를 희석50 ° C에 증류수 H 2 O 열에서 선봉에 1 ×. 10 mM의 bicine 버퍼 5 MM의 비오틴 인 비오틴 솔루션을 만들기 위해 가열 된 1 × bicine 버퍼의 12 ml의 14.7 mg을 비오틴을 추가합니다. 필요할 때까지 -20 ° C에서 보관하십시오.
- 고속 및 비오틴 카복실 담체 단백질 (BCCP)에 융착으로 표적 항원의 생산을 허용 pAK400cb BCCP-26 플라스미드를 이용하여 표적 단백질을 비 오티 닐.
참고 : E. 콜라이 세포 기본적 오티 BCCP, 정제 및 화학적 종래 스트렙 타비 딘 - 코팅 된 비드에 고정화하여 표적 단백질을 비 오티 닐 할 필요가 없다. 네이티브 E. 콜라이 비오틴 리가 피라은 융합 단백질을 biotinylating 충분하다.- E. 성장 대장균 O (BCCP의 N 말단에 융합으로 삽입 표적 항원)이 비 오티 닐화 된 플라스미드를 함유 / N 대에서 진탕하면서 37 ℃에서 용액 CM 20 μg의 / 보충 된 LB 배지 15 시간 내지 18의 5 ml의 225 rpm으로.
- 20 μg의 / ㎖ CM이 식을 이용하여 0.05 25 ml의 신선한 LB 미디어의 시작 OD에서 하위 문화에 문화 필요한 (V 추가 기능)의 볼륨을 분광 광도계를 사용하여 600 nm에서 OD를 측정하고 계산 : V 추가 = (0.05 ×를 25 ㎖) / (OD 600 - OD 600이 O / N 문화와 V 추가의 광학 밀도 0.05), 신선한 (LB)에 추가 할 수있는 O / N 문화의 볼륨 하위 문화와 37 ° C, 225 rpm으로에서 배양 통에서 0.8 0.5의 OD로 성장한다.
- 이소 프로필 β-D-1-D- 티오 갈 락토 피 라노 시드 5 μM의 최종 농도에 최종 100 μM의 농도 및 비오틴을 추가합니다. 20 ° C, 225 rpm에서 15 시간 (22)에 대한 배양 통에서 발현을 유도.
- 10 분 동안 4 ° C에서 4,000 × g에서 원심 분리하여 수확 박테리아. 뜨는을 제거합니다. 사용할 준비가 될 때까지 -20 ° C에서 펠렛을 저장합니다.
- 더하다세포 펠렛을 0.2 g 당 세포 용해 세제 1 ㎖. 피펫으로 재현 탁하고 부드럽게 세포를 용균 20 분 동안 회전합니다. 용해 후, 16,000 × g에서 원심 분리기 20 분 동안 4 ° C. 새로운 1.5 ML 튜브에 용해 해물 (상층 액)을 피펫.
- 언 바운드 비오틴을 제거하기 위해 3 kDa의 분자량 차단 열을 사용합니다. 제조업체의 지침에 따라 20 ° C에서 컬럼에 해물, 원심 분리기를 피펫. 분해물의 바이오틴 100 배 희석 한 상기 세정 용해질의 부피는 해물 원래 볼륨과 동일 할 때까지 1 × PBS로 세척 하였다. 새로운 튜브에 해물을 전송합니다.
- 스트렙 타비 딘 - 코팅 된 자성 비드 상에 비 오티 닐화 표적 항원을 고정시킨다.
- 단계 2.3.1에 설명 된대로 1 × PBS와 BSA (/ V w) 0.1 %와 1 × PBS를 준비합니다.
- 자기 구슬을 준비합니다.
주 :이 자기 분리 랙의 사용을 필요로한다.- 재현 탁의 streptav원래 유리 병에 자석 구슬을 미딘은 코팅. 적어도 30 초 동안 어느 소용돌이는 5 분 동안 회전합니다.
- 1.5 ML 튜브에 7-10 × 10 9 구슬을 전송합니다.
참고 : 필요한 볼륨이 제조업체에서 제공 비드 농도에 의존 할 것이다. - 튜브의 측면에 비드를 수집하기 위해 2 분 동안 자석 선반에 비드를 포함하는 튜브를 놓는다. 자석에 여전히 튜브, 조심스럽게 구슬을 방해하지 않고 피펫으로 상층 액을 제거합니다.
- 세척 자석에서 튜브를 제거하고, 기포를 발생시키지 않고 피펫으로 1 × PBS 1 ㎖에 비드를 재현 탁. 구슬을 수집하기 위해 2 분 동안 자석에 튜브를 돌려 조심스럽게 피펫으로 뜨는을 제거합니다. 세 세척 총 과정을 두 번 더 반복한다. 어떤 액체가 최종 세척 후 튜브에 남아 있지 않은지 확인합니다.
- 자기 BEA에 비오틴 화 항원을 포함하는 추가 분해물DS.
- 자석에서 관을 제거하고 (단계 3.1.5)에서 파쇄 액 1 ㎖에 비드를 재현 탁. 부드럽게 회전시키면서 실온에서 30 분 동안 인큐베이션.
- 3 분 항원 코팅 구슬을 수집하는 자석에 튜브를 놓습니다. 단계 3.2.2.4에 3.2.2.3에서 설명 된 것과 같은 방법으로 0.1 % BSA와 함께 1 × PBS로 코팅 된 비드를 다섯 번 세척 하였다. 최종 세척 후, 단계 3.2.2.2에서 사용 된 것과 동일한 부피로 0.1 %의 BSA와 함께 1 × PBS에서 비드를 재현 탁.
- 고정 된 표적 항원은 4 ° C에서 안정적 경우 패닝에 필요한 때까지 4 ℃에서 코팅 된 구슬을 저장합니다. 그렇지 않으면, 4 단계로 진행합니다.
4. 화면 대상 항원에 대한 패닝으로의 scFv 라이브러리 (그림 4)
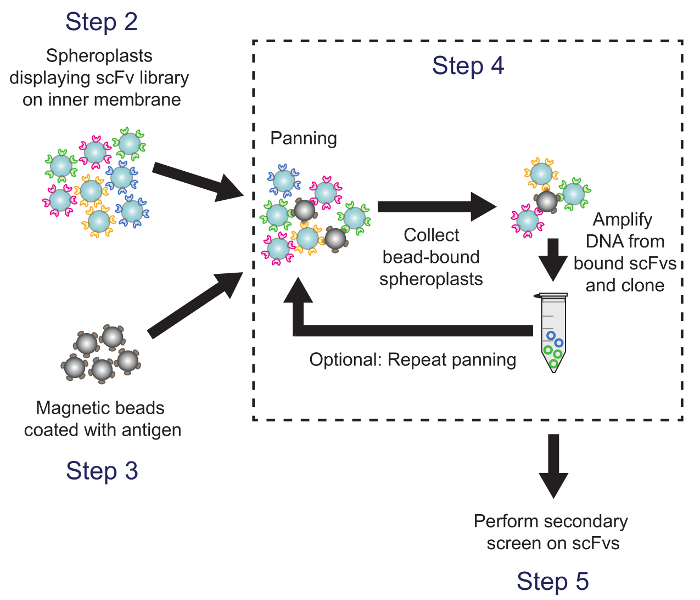
도 4 패닝 (단계 4). 항원 - 코팅 된 자성 비드는 아칸소전자는 항체 라이브러리 변형을 표현 spheroplasts 배양. 비드 바인딩 spheroplasts로부터 플라스미드 DNA를 회수하여 ELISA 기반 보조 스크린을 사용하여 선별 된 서브 라이브러리를 생성하기 위해 사용된다. 프로토콜 단계가 설명되어 해당. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- spheroplasts로 코팅 구슬을 품어.
- 약 5의 비율을 구슬하는 스페 로플 라스트를 사용 : 1. 멸균 15 ML 튜브에 4 × 10 9 spheroplasts 8 × 10 8 구슬을 추가합니다.
참고 : 농도가 여전히 1 × 10 10 spheroplasts / ㎖ 그래서 더 셀의 spheroplasting 과정에서 손실되지 않았 음을 가정합니다. - 4 ml의 총 부피를 가지고 0.1 % BSA와 1 × PBS를 추가합니다. 1 ml를 각각 네 개의 1.5 ml의 튜브로 나누어지는. 부드럽게 회전하면서 5 시간 동안 4 ° C에서 반응을 품어.
- 약 5의 비율을 구슬하는 스페 로플 라스트를 사용 : 1. 멸균 15 ML 튜브에 4 × 10 9 spheroplasts 8 × 10 8 구슬을 추가합니다.
- 홍보중합 효소 연쇄 반응 (PCR)에 비드를 결합 spheroplasts epare.
- 3 분의 자석에 패닝 반응 튜브를 놓습니다. 피펫으로 상층 액을 제거하고, 스텝 3.2.2.4 3.2.2.3에서 설명 된 것과 같은 방법으로 0.1 % BSA와 함께 1 × PBS 차가운 얼음 비드 바인딩 spheroplasts 네 번 씻는다. 증류수 H 2 O의 25 μl를 각 튜브 비드 바인딩 spheroplasts를 재현 탁 -20 ° C에서 구슬을 저장 또는 4.3 단계로 진행합니다.
- 비드 바인딩 scFvs의 유전자를 포함하는 플라스미드를 증폭 비드 바인딩 spheroplasts에 전체 플라스미드 PCR을 수행합니다.
- 다음과 같은 순서로 프라이머를 얻 5'CCAACTCTTTTTCCGAAGGTAACTG3 '(정방향 프라이머) 및 5'TAGCTCTTGATCCGGCAAACAAA3'(역방향 프라이머).
주 : 이러한 종단 간 PIMD 플라스미드의 반대 가닥에 (도 2)에 결합되며, PIMD의 일반적인 특징에 어닐링하도록 설계되기 때문에, 증폭에 관계없이 발생할 것이다scFv를 변형 시퀀스. - 프라이머를 인산화.
참고 : 인산화하지 않고, 다시 결찰가 발생하지 않습니다. 프라이머는 오히려이 프로토콜이 인산화 방법을 사용하는 것보다, 5'- 인산화에 주문할 수 있습니다.- 0.5 ㎖의 튜브에, 표 1에 기재된 바와 같이 PCR 정방향 프라이머에 대한 인산화 반응을 설정한다. 역방향 프라이머에 대해이 과정을 반복한다.
- 1 시간 동안 37 ℃에서 반응을 부화. 20 분은 T4 폴리 뉴클레오티드 키나제 (PNK)를 비활성화하는 다음 65 ° C에서 그들을 품어. -20 ° C에서 인산화 프라이머를 저장합니다.
- PCR을 수행합니다.
- 표 2에 기재된 바와 같이 PCR 튜브에서, PCR 반응을 준비한다.
참고 : 여러 반응이 더 높은 수율 제조 할 수있다. 미사용 비드 바인딩 spheroplasts는 -20 ° C에서 저장 될 수있다. - 완전 용해를 위해 열 순환기에서 15 분 동안 98 ° C에서 PCR 반응을 가열 spheroplasts의. 열 자전거 타는 사람에서 튜브를 제거하고 각각에 높은 충실도 중합 효소 0.5 μl를 추가합니다. 열 자전거 타는 사람에 튜브를 반환 표 3에 설명 된 프로그램을 사용하여 실행합니다.
- 적절 PCR 제품 풀. -20 ° C에서 보관 또는 4.4 단계로 진행합니다.
- 표 2에 기재된 바와 같이 PCR 튜브에서, PCR 반응을 준비한다.
- 다음과 같은 순서로 프라이머를 얻 5'CCAACTCTTTTTCCGAAGGTAACTG3 '(정방향 프라이머) 및 5'TAGCTCTTGATCCGGCAAACAAA3'(역방향 프라이머).
표 1. PNK 인산화 반응 (단계 4.3.2.1).
| 시약 | 볼륨 (μL) |
| 증류수 H 2 O | (15) |
| 배 T4 DNA 리가 제 반응 완충액 | 이 |
| 100 μM 프라이머 | 이 |
| T4 폴리 뉴클레오티드 키나제 (PNK) | 1 |
| 시약 | 볼륨 (μL) |
| 증류수 H 2 O | 28.5 |
| 5 배 높은 충실도 중합 효소 버퍼 | (10) |
| 10 μm의 인산화 정방향 프라이머 | 2.5 |
| 10 μm의 인산화 역방향 프라이머 | 2.5 |
| 40 밀리미터의 dNTP 믹스 (10 mM의 각각의 dNTP) | 1 |
| 구슬 바인딩 spheroplasts | (5) |
표 3. PCR 프로그램 (단계 4.3.3.2).
| 단계 | 온도 (° C) | 시간 (분 : 초) | 사이클의 수 |
| 초기 변성에 | 98 | 0시 반 | 1 |
| 변성하다 | 98 | 0시 10분 | (35) |
| 가열 냉각 | 69 | 0시 반 | |
| 신장 | (72) | 킬로바이트 당 0시 반 | |
| 최종 확장 | (72) | 6시 | 1 |
| 보류 | (12) | 무한의 | 1 |
- 전체 플라스미드 PCR 제품을 다시 회람 및 MC4100 E. 변형 할 결찰 생성물을 사용하여 대장균 세포.
- , 아가로 오스 겔 (23)에 대한 PCR 반응을 실행하는 겔 (23)의 DNA를 염색하고,를 이용하여 PCR 생성물을 정제하여젤 정리 키트는 제조 업체에서 제공 한 지침에 따라 선형화 된 플라스미드를 정화합니다. 260 nm에서 분광 광도계를 사용하여 농도를 측정한다. 필요할 때까지 -20 ° C에서 정제 된 조각을 저장, 또는 4.4.2 단계로 진행합니다.
- PCR 산물로부터 플라스미드를 다시 회람.
- 저농도 1 NG / PCR 생성물 μL의 27 결찰 반응을 상기 PCR 생성물의 분자 내 라이 게이션을 방지한다. 이 농도에서 800 ㎕의 결찰 반응물을 제조하는데 필요한 부피를 계산한다.
- 얼음에 연결 반응을 준비합니다. 튜브에 800 μL까지 상기 PCR 산물의 단계에서 계산 된 부피 4.4.2.1 10 × DNA 리가 아제 완충액 80 μL와 증류수 H 2 O를 추가한다. T4 DNA 리가 아제의 4 μl를 추가하고 즉시 물을 욕조 또는 열 자전거 타는 16 ° C에서 튜브를 배치합니다. 14 ~ 18 시간 동안 16 ° CO / N에 품어. -20 ℃에서 반응이 완료 결찰 보관필요할 때까지, 또는 4.4.3 단계로 진행합니다.
- 한 DNA 리가 열 - 불 활성화 15 분 동안 65 ℃에서 가열 블럭에 연결 반응을 놓는다. 그 후 출혈도 잡았 DNA를 소금을 해제하기 위해 미세 투석 막 또는 DNA 정리 키트를 사용합니다. 20 ° C에서 보관 또는 4.4.4 단계로 진행합니다.
- MC4100 E. 변환하는 전체 열 - 불 활성화 된, 역 소금 결찰 생성물을 사용하여 대장균 세포 23. -80 ° C에서 얻어진 패닝 서브 라이브러리를 포함하는 세포, 및 저장 분취의 단계 1.3에 기재된 바와 같이, 글리세롤 주식을 준비한다.
- 서브 라이브러리에 두 번째 패닝을 수행하는 단계 4.4.4에서 나누어지는을 사용하여 전체 4 단계를 반복.
참고 : 두 번째 팬은 표적 항원 (19)에 잘 결합 라이브러리 구성 요소에 대해 풍부하게하는 데 도움이됩니다.
5. 또한 특성화를위한 유망 클론을 확인합니다 (그림 5)는 효소 면역 분석 방법을 사용하여 보조 화면을 수행합니다
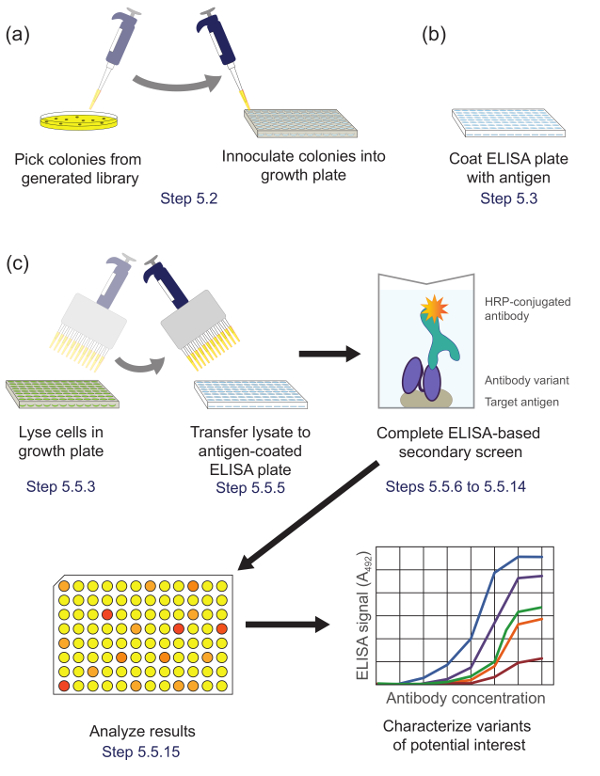
그림 5. ELISA 기반 차 심사 (5 단계). 패닝 동안 농축 서브 라이브러리에서 (A) 라이브러리 변형은 성장과 표현을위한 문화 판의 각 웰에 접종한다. (B)를 ELISA 플레이트는 표적 항원으로 코팅된다. (c) 상기 라이브러리 변형 프로토콜에 기재된 ELISA 기반 보조 스크린을 사용하여 스크리닝한다. 보조 화면에서 얻은 데이터의 분석에 관심 변종을 선택하고 추가 특징으로한다. 프로토콜 단계가 설명되어 해당. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- LB 한천 플레이트 위에 접시 (단계 4.4.4에서)를 패닝 서브 라이브러리 중 하나 튜브를 해동. 플레이트 여러 희석(- 10 6 -fold 희석 예를 들어, 10 2) 개별 식민지를 보장하기 위해 충분히 낮은 농도에서. 37 ° C에서 15 시간 18의 번호판을 품어. 4 ° C에서 번호판을 보관 또는 5.2 단계로 진행합니다.
- 패닝 서브 라이브러리에서 문화 유도 식민지. 무균 조건 하에서 모든 단계를 수행합니다. 96 웰 플레이트를 포함하는 단계 멀티 채널 피펫을 사용합니다.
- A-둥근 바닥 96 웰 배양 플레이트의 각 웰에 20 μg의 / ㎖ CM과 LB 200 μl를 추가합니다.
- , 피펫 팁과 한천 플레이트에서 개별 식민지 선택 96 웰 플레이트의 제 1 웰에 팁을 배치하고 부드럽게 접종 저어. 각 웰을위한 새로운 팁을 사용합니다. 각 웰에 한 식민지의 예방. 대조군으로, 적어도 하나의 불임 제어도 함께 접종없이 식민지를 포함한다.
- 반복 단계 5.2.1과 5.2.2은 몇 96 웰 플레이트에 접종합니다.
- 310 rpm에서 마이크로 통에 96 웰 플레이트를 놓습니다. 37 품어6; 20 시간 24 용 C는 scFvs을 표현합니다.
- 단계 5.2에서 제조 된 각각의 배양 접시 코팅 표적 항원 한 96- 웰 ELISA 용 플레이트.
- 코팅 용액을 1 × PBS에 적당한 농도 (μg의 4 / ㎖로 예를 들면, 1 μg의가 / ㎖)로 정제 표적 항원을 희석. 각 96 웰 플레이트에 대한 코팅 용액 5 ㎖를 확인합니다.
주 : 적절한 농도는 사용되는 특정 항원에 의존하고 조정해야 할 수도 있습니다. - 96 웰 고 결합 폴리스티렌 분명 ELISA 플레이트의 각 웰에 코팅 용액 50 μL를 추가한다. 부드럽게 각 웰의 표면 전체에 도포되도록 벤치 탑 표면 상에 플레이트를 살짝 누르. 각 플레이트에 대해 반복합니다. 4 ° CO / N에서 번호판을 품어.
- 코팅 용액을 1 × PBS에 적당한 농도 (μg의 4 / ㎖로 예를 들면, 1 μg의가 / ㎖)로 정제 표적 항원을 희석. 각 96 웰 플레이트에 대한 코팅 용액 5 ㎖를 확인합니다.
- 아가 플레이트 상에 96 웰 배양 플레이트에서 콜로니를 복제.
- 액체 비누 소량 수집 배양 플레이트의 웰에 멸균 폴리스티렌 리플리케이터 배치신분증. 조심스럽게 복제를 높이고 모든 팁 플레이트를 터치되도록 15 센티미터 LB 한천 플레이트에 전송할 수 있습니다. 액체가 전송되면, 똑바로 복제기를 들어 올립니다. 각각의 문화 판을 반복합니다.
- 상기 특성이 요구되는 경우, 96 웰 플레이트에 보조 화면의 결과가 판의 정확한 복제 콜로니과 일치 될 수 있도록 정확한 방향으로 한천 플레이트 라벨. 15 시간 18 37 ° C에서 성장하고, 필요한 때까지 4 ° C에 저장합니다.
- 엘리사 보조 화면을 수행합니다.
- 1 × PBS에서 분유 (/ V 승) 2 %를함으로써 차단 솔루션을 준비합니다. ELISA를 플레이트로부터 코팅 용액을 비우고. 각 웰에 차단 용액 100 μl를 추가합니다. 4 ° C에서 적어도 2 시간, 또는 블록 O / N RT에서 품어.
- 1 × PBS에 0.05 %의 최종 농도로 폴리 소르 베이트 20을 첨가하여 세척 완충액을 준비한다. ELISA 플레이트 당 250 mL로.
- (A)의 20 μl를 추가농축 된 세포 용해 둥근 바닥 배양 판의 각 웰에 세제 및 15 내지 20 분 동안 실온에서 마이크로 진탕 배양 플레이트를 배양한다. 용해 및 세척 단계 5.5.4이 동시에 수행 될 수 있도록 ELISA 플레이트의 차단이 완료된 동시에 용해를 시작한다.
- 엘리사 플레이트에서 차단 솔루션을 비 웁니다. 세척 당 잘 당 세척 버퍼 200 μL와 차단 된 ELISA 플레이트 네 번 씻으십시오. 우물에서 세척 버퍼를 비 웁니다.
- 웰마다 새로운 팁을 사용하여, 잘 ELISA 플레이트의 대응하는 전송 세포 용해 플레이트의 각 웰에 50 μl를. 1 ~ 2 시간 동안 RT에서 ELISA 플레이트를 품어.
- 바운드 scFvs를 검출 항체 용액을 제조한다.
- 고추 냉이 퍼 옥시 다제 (HRP)이 라이브러리 scFvs에 융합 FLAG 에피토프 태그에 결합 차 항체를 π 공역 사용합니다.
- (AN ELISA에서 사용하는 공급 업체 & #을 확인하기 위해 적절한 희석 항체를 희석39; 2 %에서의 권장 사항) (1 × PBS에 0.05 % 폴리 소르 베이트 20 / v)의 분유 w 각 플레이트에 대한 5 mL를 준비합니다.
- 단계 5.5.4에 기재된 바와 같이 ELISA 플레이트를 세척 완충제로 4 회 세척 하였다.
- 엘리사 플레이트의 각 웰에 항체 용액 50 μl를 추가합니다. 실온에서 1 ~ 2 시간 동안 품어.
- 빛을 피하면서 제조 업체의 프로토콜에 따라 증류수 H 2 O를 O를 -phenylenediamine 디 하이드로 클로라이드 (OPD) 정제를 용해하여 HRP 기판을 준비합니다. ELISA 플레이트 당 20 ㎖를 준비합니다.
- 필요에 따라 증류수 H 2 O로 농축 된 H 2 SO 4를 희석하여 3 MH 2 SO 4를 준비합니다. ELISA 플레이트 당 5 mL를 준비합니다.
주의 : H 2 SO 4 강산이다. 적절한 개인 보호 장비를 착용해야합니다. - 단계 5.5.4에 설명 된대로 세척 버퍼와 ELISA 플레이트 네 번 씻으십시오.
- HRP의 substra와 ELISA 플레이트를 품어테.
- 각 웰에 HRP 기판의 200 μl를 추가합니다. 광 노출을 최소화 한 번에 한 ELISA 플레이트에 기판을 추가 한 다음 플레이트를 진행하기 전에 알루미늄 호일로 포장. 어둠 속에서 실온에서 30 ~ 60 분 동안 접시를 품어.
- 처음 30 분 후, 상기 기판의 어둡게 위해 접시를 확인하고, 발색 시각화 필요 이상 배양한다.
- 반응을 종결 각 웰에 3 MH 2 SO 4의 50 μl를 추가합니다. 물론 각각에 대해 서로 다른 팁을 사용하여 거품을하지 않고 부드럽게 피펫 팅에 의해 아래로 우물에서 솔루션을 섞는다. 일관성과 채도를 방지하기 위해, 각 판의 솔루션을 혼합하기 전에 ELISA 플레이트의 모든 SO 4 신속하고 신중 H 2를 추가합니다.
- 플레이트 판독기를 사용하여 492 nm에서 플레이트의 각 웰의 흡광도를 측정한다.
- scFv를 그 exhib 변종 식별 흡광도 데이터를 분석그것은 결합 신호를 약속하고이 약속 scFvs의 특징. 각각의 접시에 평균 신호보다 배경 신호보다 더 높은 흡광도 신호를 나타내는 scFvs을 선택합니다.
주 : 흡광도 레벨이 검사에서 분리 된 scFv를 변형 강도와 함께 사용되는 항원 및 항 - FLAG 항체의 성질에 의존 할 것이다.
결과
E.에 문신 경로의 세포 내 단백질 접힘 품질 제어 메커니즘 대장균 잘 환원 세포질 환경에 접어 단백질 내부 세포 막에 걸쳐 전송을 제한합니다. ssTorA 신호열 (자연스럽게 타트 통로 (20)에 의해 반송되는 토라 단백질로부터의 신호 서열)에 scFv를 융합 과발현으로 전좌가 내막 19 scFvs 표시 결과 스톨된다. 외막 효소의 중단 후, 표시 항체는 항원 - 결합 활성을 스크리닝 가능하게한다. scFv를 표시 용 타트 경로를 이용할 수있는 능력은 칼슨 등으로 도시 하였다. (19) (도 6). scFv가 항체 및 scFv13 scFv13.R4는 인식 아르기닌 - 아르기닌 잔기 쌍을 결여 네이티브 ssTorA 서열 또는 변성 ssTorA 중 하나에 융합 된문신 경로. scFv13.R4는 직접 진화의 네 라운드를 통해 scFv13에서. 마티 등에 의해 설계되고 세포질 9 잘 배 것으로 알려져있다. 이 scFv를는 내막에 표시 되었으나 네이티브 ssTorA 신호 서열에 융합으로 표현 만 (도 6). 반대로, scFv13 잘 세포질 9 절첩 아니므 관계없이 신호 서열의 어떤가 융합하는 내막 잘 표시되지 않는다. 또한, 경우 scFvs은 디스플레이 내부 멤브레인 디스플레이와 문신 경로 사이의 중요한 연결을 보여 관찰되지 않았다는 TatC 단백질의 문신 기계 20,28의 중요한 구성 요소를 결여 세포에서 발현되었다. 이러한 결과는 세포 FOL위한 화면으로서 기능 할 타트 경로를 통해 전송을 허용하는 문신 신호 펩티드를 포함하는 단백질만을 정확하게 내막에 표시되는 세포질 접어 입증땡땡.
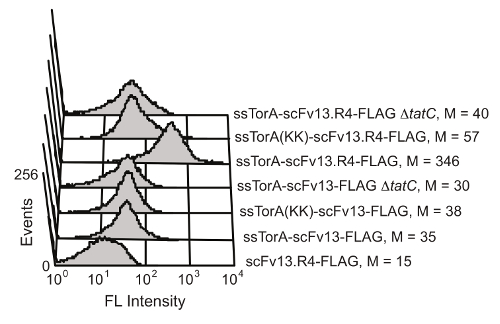
도 내막 표시 scFvs 6. 검출. 유동 세포 계측법 분석은 내막에 잘못 접힌 scFv13 잘 접혀진 scFv13.R4의 표시를 검출하기 위해 수행 하였다. scFvs는 ssTorA 시퀀스에서의 Arg, 인수 쌍리스 -리스로 수정 된 기본 ssTorA 또는 ssTorA (KK)에 융합되었다. scFvs의 C 말단 FLAG 에피토프 태그는 형광 염료 (FITC)로 검출 하였다는 항 FLAG 항체를 π 공역. 플래그 태그없이 TatC 단백질 (ΔtatC) 및 ssTorA-scFv13없이 세포는 대조군으로 시험 하였다. M은 평균 형광 값을 나타냅니다. 허가 기준 19 일부터 재판. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
내부 - 막 디스플레이 성공적으로 표적 단백질에 대한 친 화성이 높은 수준 및 세포 내 용해도가 높은 수준의 scFv 항체를 분리 할 수있다. 또한, 내부 - 막 디스플레이를 사용하여 지시 진화의 후속 발사 항체 특성 (19)을 향상시킨다. 이를 설명하기 위해, β 갈 락토시다 제에 대한 결합 친화도가 낮은 레벨이 scFv13에 기초하여 에러가 발생하기 쉬운 PCR 라이브러리는, 프로토콜에 기재된 방법을 표시하여 패닝 표적 항원 β 갈 락토시다 제에 대해 패닝 하였다. scFv를 1-4 돌연변이 및 패닝 중 하나 라운드 후에 단리하고 scFv13 (도 7a)보다 세포질 용해도보다 높은 레벨 (도 7b) β 갈 락토시다 제를 더 높은 결합 친화도를 나타냈다.
scFv를 1-4을 기반으로하는 새로운 라이브러리는 오류가 발생하기 쉬운 PCR을 사용했고, 대해이 2 세대 라이브러리의 패닝했다β - 갈 락토시다 제는 설명 프로토콜의 변형을 사용하여 수행 하였다. 진화의 두 번째 라운드를위한 β 갈 락토시다 제에 대해 패닝의 scFv 1-4보다 높은 친화 클론 분리의 가능성을 개선하기위한 경쟁자로 정제 용해 scFv를 (14)의 존재하에 수행 하였다. 돌연변이 유발 및 패닝의 두 번째 라운드 후, scFv를 2-1 scFv를 2-3은 ELISA 기반 차 심사를 사용하여 분리 하였다. 이러한 scFvs은 scFv13보다 β - 갈 락토시다 아제에 대한 높은 결합 친 화성을 전시뿐만 아니라 1 라운드 클론의 scFv 1-4보다 더 바인딩 전시 없습니다. scFv를 2-1 scFv13.R4 (도 7A)에 필적 결합 β 갈 락토시다 제를 나타냈다. scFv를 2 ~ 3도 용해도 및 항원 결합의 동시 공학을 강조하는 scFv (14)에 비해 세포질 용해도 추가 증가를 보여줍니다. scFvs의 친 화성 및 수용성식이 동시에 스크리닝하기 때문에, 선택된의 scFv는 모드 (mod) 것을 가능생이 용해도하지만 높은 결합 또는 그 반대의 경우도 마찬가지. 예를 들어, 2-1의 scFv의 scFv 2-3보다 낮은 수용성 발현을 가지고 있지만 베타 - 갈 락토시다 제를 더 높은 결합력을 나타낸다.

그림 7. 대상 바인딩과의 scFv의 세포질 발현이 내부 멤브레인 디스플레이를 사용하여 격리 변형. (A) scFvs는 E.의 세포질에서 발현되었다 대장균 a를 헥사 히스티딘 (6 × -His) 태그합니다 (ssTorA 신호 순서없이 예.) 전지와 니켈 - 니트릴 로트리 아세트산 스핀 컬럼을 사용하여 정제. - 갈 락토시다 아제와 β 정제 scFvs의 결합은 ELISA로 측정 하였다. 정제 scFvs는 β 갈 락토시다 제 - 코팅 ELISA 플레이트 상에 로딩하고, 바인딩은 scFvs 항 6 × -His 항체를 검출 하였다. 데이터는 여섯 복제의 평균이며, 오차 막대는 평균값의 표준 오차를 나타낸다.(B) 세포질 항 6 × -His 항체로 프로빙 웨스턴 블롯에 의해 분석 하였다 scFvs를 발현하는 세포로부터의 세포 용 해물의 가용성 및 불용성 분획. 총 단백질 농도는 시료의 로딩을 표준화 하였다. (A) 재판 및 허가 기준 (19)에서 (B) 적용. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
세포질 행위 항체 엔지니어 인해 이황화 결합 -6,7- 안정화의 형성을 방해 세포질의 환원 환경에 어려운 작업이다. 이것은 그들이 결합 친 화성을 위해 설계되는 이외에 세포질에서 안정성 및 용해도를 위해 설계되지 않는 비활성 세포질 대부분 항체를 야기한다. 파지 디스플레이, 박테리아 표면 디스플레이, 효모 표면 디스플레이 방법은 기존의 방법은 모든 설계 항체의 표시 분비 경로 14-16를 사용하지만, 이러한 방법은 세포 내 접힘 엔지니어링 할 수단이 없다. 타트 경로의 폴딩 품질 관리가 잘못 접힌 세포질 불안정 항체의 전위를 방지하기 때문에 내부 멤브레인 디스플레이를 사용하여 조작 된 항체는 세포 내 안정성 및 용해도를 개선했다. 이 방법은 친 화성 A에 대한 엔지니어링 세포 내 항체의 반복적 인 프로세스를 단순화차 용해도, 두 특성이 한 단계로 설계되어있다. 이 방법은 감소 세포 환경에서 용해도와 항체 공학적 설계되었지만, 또한 단백질이 방법은 페리 플라 즘의 산화성 환경에서 폴딩을 유지하여 설계되기 때문에, 비 환원성 조건에서 작동하도록 설계 항체에 적용될 수있다.
이 기술은 높은 친 화성이 높은 세포질 용해도 항체 엔지니어링 프로세스를 간소화 있지만, 몇 가지 제한 사항이 프로토콜을 사용할 때 고려해야 할 중요하다. 보조 화면 ELISA 신호를 분석 할 때의 scFv 변종 약속 확인하려면, 적절한 항원 결합을 전시하지 않을 수 잠재적으로 흥미 변형과 그 사이의 안목에 대한 임계 값은 몇 클론 추가 특징으로 한 때까지 알 수있을 것 같지 않다. 이 모 항체에 걸쳐 개선 된 결합을 찾기 위해 중요하다; 하나,비정상적으로 높은 신호는 결합력 29 또는 응집 효과 (30), 내부 멤브레인 디스플레이 검사 방식에 고유하지 않은 문제를 나타내는 수 있습니다. 이 프로토콜을 사용하여 패닝 후 spheroplasts를 복구 할 수없는 경우가 아닌 실행 가능한 (게시되지 않은 데이터)만큼 키 제한은 기억한다. 이 항체를 코딩하는 플라스미드를 복구하는 DNA 증폭 및 변환 단계를 필요로한다.
프로토콜의 몇 가지 중요한 단계는 접는과 항체의 결합의 동시 공학을 할 수 있습니다. 심사에 성공하려면, 상영되는의 scFv 라이브러리는 ssTorA 신호 펩타이드 융합으로 표현해야합니다. 이 순서없이, 항체는 문신 경로로 이동하지 않으며, 따라서 페리 플라 즘 (19)에 전좌되지 않습니다. 또한,이 C 말단 에피토프 태그는 bin에 기재된 항체의 검출을 허용하는 항체에 융합하는 것이 필수적이다땡 분석. 분명히, E. 대장균은 또한 필요한 경로 문신 기계가 있어야 scFvs를 표현하는 데 사용하지만, 이는 통상적으로 사용 된 E. 마찬가지다 대장균 균주.
이 프로토콜에 대한 수정이 원하는 특성을 가진 항체를 분리 할 가능성을 향상시킬 수 있습니다. 감산 패닝 단계 전에 원하지 않는 구성 요소의의 scFv 라이브러리를 고갈 표적 항원에 대해 패닝을 완료 할 수있다. 라이브러리 spheroplasts 비 목적 단백질 단독 또는 코팅 BCCP 피복 자성 비드와 함께 배양 할 수 있고, 이러한 비드에 결합하는 spheroplasts 원하는 표적에 대한 결합에 대한 나머지 바운드 spheroplasts 선별 전에 폐기 될 수있다. 대표 결과에 언급 된 바와 같이, 방법은 고립 된 scFv의 친 화성이 spheroplasts에 표시 scFvs과 경쟁 패닝 반응 가용성 선수를 포함하는 개선한다. 가용성 빌려 때문에etitor에는 DNA가 spheroplasts에 표시 scFvs 그렇게 만 서열은 PCR 반응에서 회수되며, 그것에서 증폭되지 않는, 정제 된 단백질이다. 또한,이 방법은 항체 또는 비 - 항체 결합 단백질에 대한 다른 유형의 엔지니어링 확장 될 수있다.
대장균 내부 멤브레인 디스플레이는 높은 친 화성 및 세포 내 용해도가 높은 수준의 엔지니어링 항체를위한 강력한 플랫폼입니다. 이 방법은 세포 내 환경에서 작동하도록 설계 항체의 효율적인 엔지니어링에 특히 적합하다. 이러한 세포 내 항체는 이미 신경 퇴행성 질환, 암 및 바이러스 감염 (31)를 포함하는 필드의 수의 잠재적 치료제로 모색되고있다. 이 기술은 연구와 의학 이러한 필드 및 동일계에서 단백질 표적이 요구된다 공부 다른 필드 도구와 같은 세포 내 항체의보다 광범위한 사용을 가능하게 할 것이다.
공개
The authors declare that they have no competing financial interests.
감사의 말
We thank Tomer Zohar for work on scFv screening and characterization assays. A portion of this work was supported by award number F32CA150622 from the National Cancer Institute (to AJK). The content is solely the responsibility of the authors and does not necessarily represent the official views of the National Cancer Institute or the National Institutes of Health.
자료
| Name | Company | Catalog Number | Comments |
| scFv library | Varies | A suitable scFv library should be obtained from a commercial or academic source. | |
| MC4100 E. coli cells | Coli Genetic Stock Center | 6152 | Cells need to be chemically competent or electrocompetent, depending on the selected transformation method. |
| Glycerol | Fisher Scientific | BP229-4 | |
| Difco dehydrated culture media LB Broth, Miller (Luria-Bertani) | BD | 244610 | |
| Chloramphenicol (Cm) | Fisher Scientific | BP904-100 | |
| Sodium chloride (NaCl) | Fisher Scientific | BP358-1 | |
| Potassium chloride (KCl) | Fisher Scientific | BP366-500 | |
| Sodium phosphate, dibasic (Na2HPO4) | Fisher Scientific | BP332-500 | |
| Potassium phosphate, monobasic (KH2PO4) | Fisher Scientific | BP362-500 | |
| Bovine serum albumin (BSA) | Fisher Scientific | BP9706-100 | |
| Sucrose | Fisher Scientific | BP220-1 | |
| Tris base | Fisher Scientific | BP1521 | |
| Ethylenediaminetetraacetic acid (EDTA), 0.5 M | Fisher Scientific | BP2482-500 | |
| Magnesium chloride (MgCl2) | Fisher Scientific | BP214-500 | |
| Lysozyme | Sigma Aldrich | L3790-10X1ML | |
| Vortex mixer | VWR | 97043-564 | |
| Bicine | Fisher Scientific | BP2646100 | |
| D-Biotin | Fisher Scientific | BP232-1 | |
| Isopropyl β-D-1-thiogalactopyranoside | Fisher Scientific | BP1755-1 | |
| BugBuster Master Mix (cell lysis detergent) | EMD Millipore | 71456 | |
| Vivaspin 2 MWCO, 3,000 daltons | GE Healthcare Sciences | 28932240 | |
| Target antigen | Varies | N/A | Purified target antigen may be purchased or produced/purified. |
| Dynabeads MyOne Streptavidin T1 | Invitrogen | 65601 | |
| Dynamag-2 magnet | Invitrogen | 12321D | |
| Tube rotator | VWR | 13916-822 | |
| PCR primers | IDT | N/A | Primer sequences are as described in the protocol. |
| 10x T4 DNA ligase reaction buffer | New England BioLabs | B0202S | |
| T4 Polynucelotide kinase (PNK) | New England BioLabs | M0201S | Make sure the T4 ligase buffer used in the primer phosphorylation reaction contains 1 mM ATP. |
| 5x Phusion HF buffer pack | New England BioLabs | B0518S | |
| Deoxynucleotide (dNTP) solution mix, 10 mM each dNTP | New England BioLabs | N0447L | |
| Phusion DNA polymerase | New England BioLabs | M0530S | Other high-fidelity polymerases may be used as an alternative, but the annealing temperature in Table 3 must be adjusted. |
| C1000 Touch thermal cycler with dual 48/48 fast reaction module | Bio-Rad | 185-1148 | |
| Agarose | Promega | V3121 | |
| SYBR Safe DNA gel stain | Invitrogen | S33102 | |
| Wizard SV gel and PCR clean-up system | Promega | A9281 | |
| T4 DNA ligase | New England BioLabs | M0202S | |
| Microdialysis membrane filter | EMD Millipore | VSWP04700 | |
| Agar | BD | 214030 | |
| 96-well polystyrene round-bottom cell culture plates | VWR | 10062-902 | |
| Costar general polystyrene assay plate lids | Corning | 3931 | |
| Microtitre plate shaker | VWR | 12620-926 | |
| Costar 96 well EIA/RIA Easy Wash clear flat bottom polystyrene high bind microplate | Corning | 3369 | |
| Bel-blotter polycarbonate 96-well replicating tool | Bel-Art Products | 378760002 | |
| Instant nonfat dry milk | Quality Biological | A614-1000 | |
| Tween 20 (polysorbate 20) | Fisher Scientific | BP337-500 | |
| PopCulture reagent (concentrated cell lysis detergent) | EMD Millipore | 71092-3 | |
| Monoclonal ANTI-FLAG M2-Peroxidase(HRP) antibody produced in mouse | Sigma Aldrich | A8592 | |
| SigmaFast OPD | Sigma Aldrich | P9187-50SET | |
| Sulfuric acid (H2SO4), 10 N solution | Fisher Scientific | SA200-1 | |
| Reynolds Wrap aluminum foil | VWR | 89079-075 | |
| BioTek Epoch microplate spectrophotometer | Fisher Scientific | 11120570 |
참고문헌
- Biocca, S., Pierandrei-Amaldi, P., Campioni, N., Cattaneo, A. Intracellular immunization with cytosolic recombinant antibodies. Biotechnology (NY). 12 (4), 396-399 (1994).
- Chen, S. Y., Bagley, J., Marasco, W. A. Intracellular antibodies as a new class of therapeutic molecules for gene-therapy. Hum. Gene Ther. 5 (5), 595-601 (2008).
- Gargano, N., Biocca, S., Bradbury, A., Cattaneo, A. Human recombinant antibody fragments neutralizing human immunodeficiency virus type 1 reverse transcriptase provide an experimental basis for the structural classification of the DNA polymerase family. J Virol. 70 (11), 7706-7712 (1996).
- Mhashilkar, A. M., et al. Inhibition of HIV-1 Tat-mediated LTR transactivation and HIV-1 infection by anti-Tat single chain intrabodies. Embo J. 14 (7), 1542-1551 (1995).
- Strube, R. W., Chen, S. Y. Characterization of anti-cyclin E single-chain Fv antibodies and intrabodies in breast cancer cells: enhanced intracellular stability of novel sFv-F-c intrabodies. J. Immunol. Meth. 263 (1-2), 149-197 (2002).
- Mössner, E., Koch, H., Plückthun, A. Fast selection of antibodies without antigen purification: adaptation of the protein fragment complementation assay to select antigen-antibody pairs. J. Mol. Biol. 308 (2), 115-122 (2001).
- Wörn, A., et al. Correlation between in vitro stability and in vivo performance of anti-GCN4 intrabodies as cytoplasmic inhibitors. J Biol Chem. 275 (4), 2795-2803 (2000).
- Knappik, A., Plückthun, A. Engineered turns of a recombinant antibody improve its in vivo folding. Protein Eng. 8 (1), 81-89 (1995).
- Martineau, P., Jones, P., Winter, G. Expression of an antibody fragment at high levels in the bacterial cytoplasm. J Mol Biol. 280 (1), 117-127 (1998).
- Steipe, B., Schiller, B., Plückthun, A., Steinbacher, S. Sequence statistics reliably predict stabilizing mutations in a protein domain. J. Mol. Biol. 240 (3), 188-192 (1994).
- Daugherty, P. S. Protein engineering with bacterial display. Curr Opin Struct Biol. 17 (4), 474-480 (2007).
- Lener, M., et al. Diverting a protein from its cellular location by intracellular antibodies. Eur. J. Biochem. 267 (4), 1196-1205 (2000).
- Lynch, S. M., Zhou, C., Messer, A. An scFv intrabody against the nonamyloid component of α-synuclein reduces intracellular aggregation and toxicity. J. Mol. Biol. 377 (1), 136-147 (2008).
- Gai, S. A., Wittrup, K. D. Yeast surface display for protein engineering and characterization. Curr. Opin. Struc. Biol. 17 (4), 467-473 (2007).
- Kieke, M. C., et al. Selection of functional T cell receptor mutants from a yeast surface-display library. Proc. Natl. Acad. Sci. USA. 96 (10), 5651-5656 (1999).
- Steiner, D., Forrer, P., Stumpp, M. T., Pluckthun, A. Signal sequences directing cotranslational translocation expand the range of proteins amenable to phage display. Nat. Biotechnol. 24, 823-831 (2006).
- Pugsley, A. P. The complete general secretory pathway in gram-negative bacteria. Microbiol. Rev. 57 (1), 50-108 (1993).
- Rapoza, M. P., Webster, R. E. The filamentous bacteriophage assembly proteins require the bacterial SecA protein for correct localization to the membrane. J. Bacteriol. 175 (6), 1856-1859 (1993).
- Karlsson, A. J., et al. Engineering antibody fitness and function using membrane-anchored display of correctly folded proteins. J. Molec. Biol. 416 (1), 94-107 (2012).
- DeLisa, M. P., Tullman, D., Georgiou, G. Folding quality control in the export of proteins by the bacterial twin-arginine translocation pathway. Proc Natl Acad Sci U S A. 100 (10), 6115-6120 (2003).
- Fisher, A. C., Kim, W., DeLisa, M. P. Genetic selection for protein solubility enabled by the folding quality control feature of the twin-arginine translocation pathway. Protein Sci. 15 (3), 449-458 (2006).
- Maynard, J., Georgiou, G. Antibody engineering. Annu Rev Biomed Eng. 2, 339-376 (2000).
- Green, M. R., Sambrook, J. . Molecular Cloning: A Laboratory Manual. 1, (2012).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers--the database of key numbers in molecular and cell biology. Nucleic Acids Res. 38, D750-D753 (2010).
- Hermanson, G. T. . Bioconjugate Techniques. , (2013).
- Tayapiwatana, C., Chotpadiwetkul, R., Kasinrerk, W. A novel approach using streptavidin magnetic bead-sorted in vivo biotinylated survivin for monoclonal antibody production. J Immunol Methods. 317 (1-2), 1-11 (2006).
- Zhu, G., Song, L., Lippard, S. J. Visualizing inhibition of nucleosome mobility and transcription by cisplatin-DNA interstrand crosslinks in live mammalian cells. Cancer Res. 73 (14), 4451-4460 (2013).
- Bogsch, E. G., et al. An essential component of a novel bacterial protein export system with homologues in plastids and mitochondria. J. Biol. Chem. 273, 18003-18006 (1998).
- Julian, M. C., et al. Co-evolution of affinity and stability of grafted amyloid-motif domain antibodies. Protein Eng. Des. Sel. 28 (10), 339-350 (2015).
- Garber, K. Bispecific antibodies rise again. Nat. Rev. Drug. Discov. 13 (11), 799-801 (2014).
- Marschall, A. L., Dübel, S., Böldicke, T. Specific in vivo knockdown of protein function by intrabodies. MAbs. 7 (6), 1010-1035 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유