Method Article
Ters transkripsiyon enfekte hücreleri içinde belirleyici 3'-Termini ve HIV-1 sırasında doğmakta olan tek iplikçikli Viral DNA moleküllerinin dizileri
Bu Makalede
Özet
Burada yeni doğmakta olan 3'-termini tarafsız bir belirlenmesi yanı sıra tek iplikçikli DNA moleküllerinin mutational profilleri sağlar bir derin sıralama yaklaşım mevcut. Ana uygulama doğmakta olan retroviral tamamlayıcı DNA'lar (cDNAs), retroviral Ters transkripsiyon işlemi sırasında oluşturulan ara ürün karakterizasyonudur.
Özet
Nükleik asit Ortalayıcılar virüs çoğaltma sırasında izleme viral DNA sentezi etkileri ve antiviral bileşikler ve konak hücre proteinleri eylem mekanizmaları sağlar. Burada biz virüs enfeksiyonu fizyolojik bağlamında retroviral Ters transkripsiyon ara ürün tanımlama kapasitesine sahip bir hücre-esaslı, yüksek-kapsam ve yüksek çözünürlüklü tahlil eksikliği adresi. Açıklanan yöntemi HIV-1 enfekte hücreleri tek nükleotid çözünürlükte içinde doğmakta olan tamamlayıcı DNA (cDNA) moleküllerinin 3'-termini yakalar. Protokol bütün hücre DNA'sı, viral DNA via hibrid yakalama, adaptör ligasyonu, boyut ayırma jel arıtma, PCR güçlendirme, derin sıralama ve veri analizi tarafından hedeflenen zenginleştirme hasat içerir. 3'-DNA termini açmak için adaptör moleküllerin etkili ve tarafsız ligasyonu önemli bir adımdır. Açıklanan yöntemi uygulanması ters transkript her belirli uzunlukta verilen örnek bir bolluk belirler. Herhangi bir potansiyel mutasyonlar (iç) sıra varyasyon ters transkript ve böylece ilgili bilgi de sağlar. Şablon sırası bilinir olması koşuluyla genel olarak tahlil için DNA ' 3'-uzantısı, ilgili herhangi bir sorunuz için uygundur.
Giriş
İncelemek ve viral çoğaltma tam olarak, giderek daha rafine çoğaltma yakalama teknikleri anlamak için ara ürün gereklidir. Bugüne kadar pek çok viral çoğaltma mekanizması var bu yana özellikle, yeni anlayışlar, bağlamı içinde viral nükleik asit tür enfekte hücreleri hassas tanımını sağlayabilir edilmiştir izole vitro tepkiler incelenir. Bir ilk örnek retrovirüsler, insan immün yetmezlik virüsü (HIV-1) 1 gibi ters transkripsiyon sürecidir. HIV-1 ters Transkripsiyon sırasında çift iplikçikli DNA'ya tek iplikçikli RNA genomu viral enzim ters transkriptaz (RT) kopyalar, çeşitli adımlar astar uzantısı deneyleri saf protein ile başta okudu ve nükleik olmuştur asitler1,2,3,4,5. Temel ilkeleri kuruldu, bu tür deneyleri tüm viral ve hücresel bileşenleri dahil değil ve ilgili faktörler biyolojik ilgili stoichiometries yansıtmıyor olabilir. Bu nedenle, biz güçlü bir teknik hassas cDNA 3'-termini (tam onların uzunlukları belirlemeyani ) ve enfeksiyonlar yaşam bağlamında nükleotit dizileri ile ters transkripsiyon intermediates spectra belirlemek için tasarlanmış hücreleri6. Saat ders deneyler transkript antiviral molekülleri veya proteinler, verimlilik ve DNA sentezi processivity etkileyebilecek varlığı gibi çeşitli koşullarda profil karşılaştırmak için kullanılan veri toplama ve birikimi. Bu kez hedeflenen uyuşturucu tasarım ve başarılı terapötik müdahale temelidir doğal patojen yaşam döngüsü daha ayrıntılı bir anlayış sağlar.
HIV-1 Ters transkripsiyon birbirini izleyen olaylar tRNA astar sonra bir eksi-strand güçlü-stop adı verilen bir kısa tek iplikçikli cDNA transkript üretmek için RT tarafından genişletilmiş genomik RNA şablona TAV tarafından başlatılan bir dizi oluşur (-sss) (bkz: Şekil 1). Daha sonra 3'-LTR için nerede o anneals ve hizmet devam RT için astar eksi uzama aracılı gibi DNA strand genomik RNA'ın 5' uzunluğundaki terminal tekrar (LTR) - sss cDNA aktarılır (Ters transkripsiyon1 üzerinde incelemelere bak , 2 , 3 , 4). bu ilk strand transfer Ters transkripsiyon; hızı sınırlaması adımlardan biri Bu nedenle, - sss cDNA birikir bilinmektedir. Enfekte hücreleri Ters transkripsiyon ürünlerinde yakalamak için temel iş akışı ve Kütüphane Tasarım Şekil 2asıraladı. Ters transkripsiyon cDNA ara ürün uzunluğu Aralık 23 ~ ile 650 $ içinde belirli astar ve iletişim kuralında kullanılan ve bir Tablo 1 ' de listelenen tüm erken hedef analiz nt, 180-182 nt - sss DNA içerir. Ancak, stratejisine uygun küçük uyarlamalar amaç 3'-OH içeren DNA uçları algılamaya olduğu sadece geç ters transkripsiyon ürünleri ama aynı zamanda diğer virüsler ve sistemleri, uygulanmasını sağlayacaktır. Önemli göz önüne alınacak sınırlamalar nihai PCR ürün uzunluğu dizi kitaplığa ekleme; Özellikle, açık 3'-terminus bağdaştırıcısında ve ters yönde astar site arasındaki mesafe ~ 1000 nt aşan şablonları büyük olasılıkla daha az verimli, potansiyel olarak teknik önyargıları Kütüphane hazırlık () sırasında yanıltıcı tanıtan sıralı daha fazla bilgi ve adaptasyon öneriler için konuya bakın).
Daha önce bildirilen teknikleri 3'-termini nükleik asit iplikçiklerinin sistematik belirlenmesi için RNA DNA, moleküller üzerinde odaklanmıştır. MRNA Poliadenilasyon üzerinde dayanıyor 3' yarış (hızlı amplifikasyon cDNA biter)7, bir örnektir. Buna ek olarak, hangi RLM-yarış (RNA ligaz aracılı RACE)8 veya Dantel (cDNA biter amplifikasyon ligasyonu tabanlı)9dahil ettik RNA Ligazlar istihdam adaptör ligasyonu tabanlı stratejileri geliştirilmiştir. Tüp ligasyonu tabanlı arttırımlar ligasyonu tepki kendisi tarafından sunulan herhangi bir önyargı duyarlı olduğunu vurgulamak önemlidir. Örneğin, tüp ligasyonu pozisyon 3', sıra, toplam molekül uzunluğu veya yerel yapısı belirli bir nükleotit bağlı olarak daha fazla veya daha az verimli olabilir. Böyle ligaz tercihleri molekülleri ve yanlış beyan biz ve diğerleri9,10gözlemledim okuma eksik yakalanması neden. Tüp ligasyonu önyargı burada açıklanan protokol adaptör ek adımları sırasında en aza indirmek için biz ve ligasyonu stratejileri bir dizi test T4 DNA ligaz bir saç tokası tek iplikçikli DNA adaptörle bulunan (Kwok ve arktarafından açıklandığı gibi. 11) ile tek işlem kontrol oligonucleotides6özel olarak seçilen bir dizi ile değerlendirirken ligasyonu verimliliği önemli farklılıkların sonuçlanmamıştır nicel ligasyonu yakın olmak için. Bu tüp ligasyonu strateji seçimi, bu nedenle, bu protokol başarısında önemli bir özelliği var.
Bugüne kadar enfekte hücreleri ilerlemesinde HIV-1 RT izlenmesi öncelikle benzersiz olarak daha kısa veya daha uzun ölçmek astar-sonda kümesi'ni kullanma Ters transkripsiyon ürünleri çeşitli uzunlukta kantitatif PCR (qPCR) ile ölçerek tamamlandıktan (erken ve geç, sırasıyla) cDNA ürünleri12,13,14. Bu qPCR yaklaşım Ters transkripsiyon süreci içsel verimliliği hücresel sistemleri belirlemek uygun olsa da, bu çıktı nispeten düşük çözünürlüğe sıra bilgi elde edilen yok değildir. Bizim yeni bir yaklaşım, en iyi duruma getirilmiş adaptör ligasyonu, PCR-aracılı Kütüphane üretimi ve derin sıralama adresleri teknoloji farkı dayalı ve nicelik ve tek nükleotit, HIV-1 enfeksiyonu sırasında ters transkripsiyon izlemek için bir fırsat sunuyor çözünürlük.
Biz ile belgili tanımlık yarar girişimine iki önerilen modeller arasında HIV-1 kısıtlama faktörü APOBEC3G kapasite (apolipoprotein B mRNA düzenleme enzimin katalitik polipeptid benzeri 3 G) seçkin bir çalışmada bu yöntemin resimli üretim viral ters transkript6.
Protokol
Not: Belirli reaktifler ve bu protokol için kullanılan ekipman için Malzemeler tablo için lütfen bakın.
1. virüs üretim ve hücre enfeksiyon
Dikkat: Enfeksiyon HIV-1 yalnızca onaylanmış Biyogüvenlik çevreleme laboratuvarlarda ele alınmalıdır.
Not: Üretim HIV-1 partikülleri içinde belirtildiği gibi hücreleri, 1.1 adım, standart bir prosedür ve olmuştur insan embriyonik böbrek (HEK) 293T geçici transfection tarafından daha önce15,16nitelendirdi. Genel hücre kültürü prosedürler var17daha önce açıklanan.
- HIV-1 virüs üretim.
- % 10 fetal Sığır serum (FBS) ve % 1 penisilin/streptomisin (tam DMEM) bir standart hücre kültür kuluçka17daha önce açıklandığı gibi 37 ° C ve % 5 CO2 ile takıma kartal Orta (DMEM) Dulbecco'nın 293T hücrelerde değişiklik korumak.
- Standart laminar akış doku kültürü başlıklı büyüme ortamını çıkarın ve önceden ısıtılmış (37 ° C) tripsin 3 mL bir birleşmesi yakınındaki 10 cm hücre kültür yemek 293T hücre için (~1.2 x 107 hücreleri) ekleyin. Yemek için 2-3 dk da kuluçka geri koyun.
- Bulaşık kuluçka makinesi geri doku kültürü kapağın alıp tam orta 7 mL ekleyin. Yukarı ve aşağı çanak içinde birkaç kez hücreleri resuspend için pipet. Yeni bir 10 cm tabak hücre süspansiyon 2.5 mL ekleyerek hücreleri 1:4 Böl ve tam orta 7.5 mL ile doldurun.
- Ertesi gün, proviral HIV-1 plazmid DNA (örneğin pNL4.3) 10 µg ile 1 mL serum içermeyen en az gerekli orta mix ve polyethylenimine (PEI) çözüm (25.000 mW, 1 mg/mL pH 7) 1 µg DNA başına 4.5 µL ekleyin. RT, 10 min için kuluçkaya ve dropwise 293T hücrelere ekleme.
- 24 h transfection sonra orta kaldırmak ve tam DMEM RNase free DNaz, 20 U/mL orta içeren 6 mL ile değiştirin. 6 h sonra orta tam DMEM 10 mL ile değiştirin.
- 48 h transfection sonra süpernatant hasat ve 15 mL polipropilen boru bir 10 mL şırınga kullanarak bir 0,22 µm filtre aracılığıyla filtre.
- Steril % 20 sükroz 1 fosfat tamponlu tuz (PBS) x 2 mL bir üstü açık ince duvarlı ultracentrifuge tüp ekleyin. Yavaş yavaş filtre uygulanmış hücre süpernatant ile sükroz yerleşimi.
- Santrifüj 134,000 x g bir ultracentrifuge kullanarak 4 ° C'de 1 saat 15 dakika için.
- Tüpler ultracentrifuge dikkatli bir şekilde çıkarın. Yavaş yavaş süpernatant hem bir emme veya bir pipet kullanarak sükroz alır. Daha küçük bir pipet kullanın ve son sükroz çözüm çekerken tüp tilt. Tüpün dibinde pelleted virüs bırakın.
Not: Pelet görünür olmaz. - 1 x PBS 200 µL eklemek, buzdolabında 4 için 12 saat bırakın, resuspend ve 20 µL aliquots-80 ° C'de dondurmak
- P24Gag içerik kullanarak belirlemek p24 HIV-1 antijen ELISA kiti (aşağıdaki üretici yönergelerine).
- T-hücre satırı enfeksiyon.
- Ölümsüzleştirdi bir T-hücre kültürünü Kültür (Örn., CEM-SS hücreleri) % 10 FBS ve % 1 penisilin/streptomisin ile (tam RPMI) takıma Roswell Park Memorial Enstitüsü (RPMI) 1640 orta. Bir hemasitometre18 ve tohum 1 de örnek başına 2 x 106 hücre/mL 12-iyi biçim hücre kültür plaka ile tam RPMI 1 mL ile kullanarak hücreleri saymak.
- HIV-1 parçacıkları ekleyin 150 ng p24 eşdeğerGag ve yer bir sallanan içine plaka santrifüj kapasitesi kova spin-2.000 x g 30 ° C'de 2 h için benchtop santrifüj Santrifüjü tarafından enfekte oluşturdum kapakları ile
- Plaka santrifüj kaldırmak ve bir standart doku kültürü kuluçka 37 ° C ve % 5 CO21 h için dinlenme sağlar.
- Giriş virüsü yıkamak için hücre süspansiyonlar microcentrifuge tüpler aktarıp, 500 x g 2 min için de bir microcentrifuge, RT (RT) içinde centrifuging hücreleri toplamak. Süpernatant hücre Pelet bozmadan al.
- Hücre granül resuspend önceden ısıtılmış (37 ° C), 1 mL steril 1 x PBS. Santrifüjü, süpernatant kaldırma ve resuspension adımları iki kez daha tekrarlayın.
- Tekrar santrifüj kapasitesi, süpernatant kaldırmak ve hücre topakları 1 mL tam RPMI resuspend. Bir de yeni bir 12 iyi plaka her süspansiyon ekleyin.
- 6 h sonrası ilk ek virüs (4 h sonrası Santrifüjü), hücreleri Santrifüjü tarafından aynı adım 1.2.4 bitmiş hasat. Kaldırmak ve süpernatant atın. Hücre granül-80 ° C'de dondurulmuş ya da doğrudan DNA ekstraksiyon için işlenir.
2. DNA ekstraksiyon, HIV-1 DNA miktar ve zenginleştirme hibrid yakalama tarafından
- Bütün hücre DNA bir kan ve doku toplam DNA ekstraksiyon kiti ile doku kültürü hücrelerin seti kılavuzu izleyerek ayıklayın. Tek değişiklik nükleaz ücretsiz h 200 µL içinde elüsyon olduğunu2O sağlanan elüsyon tampon yerine.
Not: chaotropic lizis arabellek (Kit'in "AL tampon") ve İndinavir eklenmesinden sonra örnekleri olabilir Biyogüvenlik çevreleme laboratuardan kaldırıldı ve protokol geri kalanı için bir standart güvenlik düzey laboratuvar, yapılır. - QPCR tarafından HIV-1 cDNA kopya sayısını belirleyin.
- 2.1. adımdaki eluate 17 µL alıp 10 x Restriksiyon enzimi arabelleği DpnI Restriksiyon enzimi 1 µL birlikte 2 µL ekleyin. 37 ° C'de herhangi bir potansiyel kalan giriş plazmid DNA transfection kaldırmak için 1 h için kuluçkaya.
- QPCR için eksi-strand güçlü-stop cDNA aşağıdaki astar sonda kümesi kullanarak gerçekleştirmek: oHC64 (5 '-taactagggaacccactgc-3) ve oHC65 (5 '-gctagagattttccacactg-3) ve oHC66 sonda (5 '-FAM-acacaacagacgggcacacacta-TAMRA-3 '). qPCR kurulum ve kesin şartlar başvurular6,13' te bulunabilir. PNL4.3 proviral plazmid seri bir seyreltme cDNA moleküllerin kopya numaraları belirlemek için standart bir eğri olarak örnekleriyle birlikte taşımak.
Not: beklenen miktarları için bkz.
- HIV-1 DNA zenginleştirme hibrid yakalama tarafından.
Not: Bu adım düşük nükleik asit bağlama özellikleri yanı sıra aerosol Filtre Pipet ipuçları tüm DNA örnekleri için microcentrifuge tüpleri kullanmak tercih edilir. Mümkünse, bir PCR iş istasyonu iş. Tüm adımları ve Kimyasalları RT (RT) Aksi belirtilmedikçe bulunmaktadır.- Manyetik streptavidin boncuk ana bir karışımını hazırlamak için bir tek microcentrifuge tüpüne pipet örnek başına 100 µL boncuk. Tüp bir mıknatıs üzerinde microcentrifuge tüpler için uygun yer.
- Boncuk (~ 1 dk) tüp mıknatıs tarafına doğru yerleşmiş sonra depolama tampon al, tüp mıknatıs kaldır ve boncuk bağlama 500 µL içinde resuspend ve arabellek (BW tampon, 5 mM Tris-HCL pH 7.5, 0,5 mM EDTA yıkama 1 M NaCl) yıkamak için.
- Tüp mıknatıs üzerinde yer, süpernatant kaldırmak ve 500 µL kazein çözüm ekleyin. Mıknatıs ve almak, resuspend ve RT, 10 min için kuluçkaya sonra BW arabellek ile yıkayın.
Not: Bir yıkama tüp üzerinde mıknatıs yerleştirerek, süpernatant ayırdığınız, tüp mıknatıs, kapalı tampon ekleme alıp resuspending için anlamına gelir. - Geri mıknatıs üzerinde tüp yerleştirmek, süpernatant almak ve boncuk BW arabellek 500 µL içinde resuspend. Her yakalama biotinylated oligonucleotides 50 pmol (bkz. Tablo 1, üç oligos bu durumda) örnek ekleyin. (5 DNA örnekleri işlenecek, örneğin, kimden adım 2.3.1 ve 250 pmol her oligonükleotid, manyetik boncuklar 500 µL kullanın).
- RT, 30 min için bir bitti sıra karıştırıcı sallanan süre kuluçkaya.
- Boncuk iki kez ile 1 x 10 arabelleği (10 mM Tris HCl pH 8.0, 1 mM EDTA, 100 mM NaCl) 500 µL immobilize oligonucleotides ile yıkayın.
- 1 x 10 arabelleği örnek başına 10 µL boncuk resuspend.
- Her örnek için bir microcentrifuge tüp etiket ve boncuk süspansiyon 10 µL, DNA'ın 170 µL (adımından 2.1) ekleyin ve 3 on tampon x 90 µL. DNA'yı denatüre 2 min için 92 ° C'de bir kuru sıcak bloğundaki kuluçkaya.
- Tüpler 52 ° C olarak ayarlanır, bir farklı kuru sıcak blok hareket ve 1 h. ters çevir'i düzenli olarak karıştırmak için kuluçkaya (~ her 10 min) bu kuluçka sırasında.
- Bir kez 1 on tampon x 500 µL ile yıkama ve 35 µL nükleaz ücretsiz resuspend H2O.
- Elute için bir kuru sıcak blok 2 dk içinde 92 ° C'de tüpler kuluçkaya. Sonra hızlı bir şekilde tüpler mıknatıs (bir seferde bir tüp) üzerine taşıyın. Bir kez boncuk tüp tarafına bağlı olan, taze bir tüp için HIV-1 DNA içeren süpernatant aktarın.
- İsteğe bağlı: qPCR (adım 2.2.2 yapılır gibi) kurtarılan HIV-1 cDNA belirlemek için yineleyin.
Not: beklenen miktarları için bkz.
3. adaptör ligasyonu
- Adaptör hazırlanıyor
- Resuspend liyofilize adaptörü (bkz. Tablo 1 "tam Kwok + MiSeq"), nükleaz ücretsiz h 100 µM2O.
- Örnek artı bir denetim örnek 0,45 µL birleştirmek 10 T4 DNA ligaz arabellek, 4 µL bağdaştırıcısının ve 0,05 µL nükleaz ücretsiz h x2O. ısı 92 ° c için 2 dk ve izin yavaş yavaş sakin olun.
Not: seçeneği kullanılabiliyorsa, ayarlanabilir soğutma oranı (kullanım %2 oranı) ile bir PCR makinesi kullanın. Bu 16 ° c 92 ° C yaklaşık 30 dakika sürer Alternatif olarak, bir kuru sıcak blok 92 ° C'de kullanın ve devre dışı. Isı blok geri RT. olduğunda adaptör mastermix çıkar Bu bir saç tokası yapısı oluşturmak adaptör izin vermektir (bkz: Şekil 2b).
- (Bkz. Tablo 2) sentezlenmiş oligonucleotides hücrelerinden çıkarılan DNA yerine bir dizi denetim tepki hazırlayın.
- Her oligonükleotid 100 µM stokları olun. Her birinin 17 oligonucelotides 1 µL mix ve H2O ekimolar bir oranı için 8 µL 25 µL son bir hacim içinde ekleyin.
- Mix 1:2,500 nükleaz ücretsiz h seyreltik2O seri seyreltme. Mix 1 µL nükleaz ücretsiz H 17,3 µL ile birleştirmek böylece her oligonükleotid 1.6 fmol mevcut denetim örnek ligasyonu 3.3.1. adımda kullanmak için2O (0.026 eşdeğer nM 60 µL tepki olarak).
- D kurma
- 10 T4 DNA ligaz x 6 µL PCR tüpleri 60 µL son hacim tepkileri birleştirmek için arabellek, % 40'lık 24 µL PEG, 5 M Betan, 4,5 µL (400 pmol) adaptörü (pre-annelead, adım 3.1.2 olduğu gibi), 6 µL 1.2 µL T4 DNA ligaz (2.000.000 adet/mL) ve (DNA'dan 18.3 µL Adım 2.3.11)
: Dikkat özel bakım % 40 gibi yapışkan çözümleri ile doğru birimleri korumak için PEG. Bir mastermix yapmayın. - Aynı tepki kadar adım 3.3.1 ama 3.2.2. adımda hazırlanan denetim oligonükleotid karışımı ile gerçekleştirilen gibi ayarlayın.
- Tepkiler karıştırın ve PCR makinesi 16 ° C'de gecede kuluçkaya.
- 10 T4 DNA ligaz x 6 µL PCR tüpleri 60 µL son hacim tepkileri birleştirmek için arabellek, % 40'lık 24 µL PEG, 5 M Betan, 4,5 µL (400 pmol) adaptörü (pre-annelead, adım 3.1.2 olduğu gibi), 6 µL 1.2 µL T4 DNA ligaz (2.000.000 adet/mL) ve (DNA'dan 18.3 µL Adım 2.3.11)
4. adaptör kaldırma ve boyut ayırma
- Denaturing Jel Elektroforez
- Formamide içeren DNA jel her tüp ligasyonu tepki arabelleğe yükleme 30 µL ekleyin. De pipetting tarafından karıştırın.
- PCR makinesi 94 ° C'de 2 min için ısı, sonra hemen buza koy.
- Prekast % 6 Tris/bor/EDTA (TBE) denaturing üre polyacrylamide jel (10-iyi tarak) bir uygun jel tankı yerleştirin. 1 x TBE (89 mM Tris-Merkez, 89 mM Borik asit, 2 mM EDTA) çalışan arabellek ekleyin ve 20 dk için jel 250 V/max sabiti önceden çalıştırın.
- Bir şırınga ve 21 G iğne kullanarak arabellek çalışan ile jel cepler dışarı yıkamak.
- Yük her 90 µL üç kuyular (iyi başına 30 µL) ve 20 dk (250 V/max) koyu mavi boya açık kadar koşuya hakkında yarım jel örneğidir.
- Boyama ve kesim nükleik asitlerden jel
- 3 küçük microcentrifuge tüpler (0.5 mL) örnek 21 G şırınga iğne (take dikkat "Sharps" ile çalışırken) kullanarak alt içine delikleri poking tarafından hazırlayın. Hazırlanan tüpler 2.0 mL microcentrifuge tüp içine yerleştirin ve onları örnek adı artı "düşük", "Orta" veya "yüksek" etiket.
- Dışarı çıkarıp meraklı jel kaset açın. Jel cömertçe şerit yüklü örnekleri 3 kuyu ile tüketim için bir tıraş bıçağı ile dikey olarak kesin. Jel şerit 1 x TBE (yaklaşık 30 mL) ve siyanür nükleik asit leke 5 µL içeren bir kapsayıcı ekleyin. 3-5 min için kuluçkaya.
Not: Jel ayıklama adım çapraz bulaşma özellikle duyarlıdır. Sadece 1 örnek başına jel ve her jel boyama için ayrı, temiz bir kapsayıcı kullanarak çalıştırmak için tavsiye edilir. Jel partikülleri eldivenli parmak başvurduğunuzda eldiven değiştirilmelidir. - Mavi bir ışık transilluminator GKD2O. ile iyice yüzeyini temizlemek Boyama konteyner dışarı jel parça alın ve ışık kutusu ekleyin.
- Işık kutusunu açın ve lekeli nükleik asitler turuncu filtreden incelemek.
Not: Adaptör genellikle aşırı yüklenmiş görünür ve büyük "ve birleştirilmiş HIV-1 yukarıda bir çizgi çalışan DNA ile blob" çalışır. - Hiçbir örnek ile alanlar varsa jel tarafını kesip yeni bir tıraş bıçağı kullanarak hala mevcut dolu. Ardından, adaptör adaptörü çıkarın ve alt bölümleri jel için kesti. Son olarak, sadece... Kes gitsin jel de dahil olmak üzere en jel yaklaşık 1 mm, hangi sık sık yüksek molekül ağırlıklı DNA bir keskin yoğun sinyal var cepler.
- Genellikle ~ 2 x 3. örnek içeren kalan jel parça bölmek cm boyutunda üç hatta parçalar halinde yatay olarak: "low", "Orta" ve "yüksek" moleküler ağırlıklı alanlarda.
Not: Her parça şimdi ayrı ayrı ele alınacaktır [i.e., (düşük, orta ve yüksek) üç tüpler olacak] Orijinal örnek başına. - Her üç jel parçalarının (~ 2 x 2 mm parçacıklar) daha küçük parçalara kesilmiş ve hazırlandı 0.5 mL microcentrifuge tüpler (adım 4.2.1) içine aktarabilirsiniz.
- Jel adet delikten bir jel rüşvet oluşturmak için 2 mL tüp içine sıkmak 1 dk için açık kapakları ile üst hızda çevir. Herhangi bir jel partikülleri 0.5 mL tüp alt kalırsa, onları el ile bir iğne veya pipet ucu kullanarak 2 mL tüp aktarın.
- DNA ekstraksiyon
- Üre jel ayıklama arabellek (0,5 M NH4CH3CO2, 1 mM EDTA, % 0,2 SDS) 1 mL jel rüşvet için ekleyin. En az 3 h tüpler döndürmek (gecede kabul edilir), RT bir bitti sıra karıştırıcı ile.
- Cımbız set temiz bir küçük yuvarlak cam elyaf filtre membran tıkanmasını önler selüloz asetat membran filtreleri ile (0.2 µm), santrifüj sütunları eklemek için kullanın. Filtre bir ters pipet ucu ile koymak.
- Kısaca bir microcentrifuge jel rüşvet ve ayıklama arabelleği ile 2 mL tüpler spin ve süpernatant ile 700 µL hazırlanmış filtre sütun aktarın. Jel rüşvet ve kalan süpernatant tutun.
- 1 dk. Transfer flowthrough bir yeni 2.0 mL microcentrifuge tüp içine üst hızda bir microcentrifuge filtre sütunlara santrifüj kapasitesi.
- Kalan süpernatant sütunlarla yeniden yükleyin. Kadar sıvı mümkün olduğunca çekme--dan rüşvet almaya çalışın. Transfer jel adet bir endişe değil. Tekrar ve flowthroughs aynı ayıklama örnekleri birleştirebilirsiniz.
- DNA yağış
- PolyA RNA 3 µL ekleyin (1 µg/µL; bir taşıyıcı olarak), glikojen ve flowthrough için isopropanol adım 4.3.5 0.7 mL 1 µL. Kısaca girdap ve donma-80 ° C'de bir gecede.
- -80 ° C dondurucudan örnekleri almak ve onlara kısaca çözülme. Soğutmalı (4 ° C) microcentrifuge ve üst hızda 30 dk Tur koymak onları.
- Kaldırmak ve süpernatant atın. Pelet değil çıkarmak için dikkatli olun. O Pelet Aksi takdirde kaldırılıyordu belirsiz ise 30-50 µL sıvı bırakın.
Not: Genellikle "Orta" ve "düşük" örnekleri daha daha görünür bir Pelet tüm "yüksek" örnekleri göster. - 800 µL % 80 etanol ekleyin. Tüpler ve spin üst hızda 1 dk. için tekrar tersine çevirin. Bir pipet ile etanol çoğunluğu kaldırmak, kısaca tüpler yine spin ve daha küçük bir hacim pipet ile daha fazla etanol kaldırın.
- Kalan herhangi bir etanol tüpler açık bir kapak ile 55 ° C kuru sıcak bloğu içine yerleştirerek buharlaşmasına izin. Ne zaman örneklerdir kuru (2-4 dk) Ekle 20 µL nükleaz ücretsiz H2O ve DNA Pelet sağlamak için tüp alt etrafında yayılmış çözünmüş. DNA örneği-20 ° C'de depolanan
5. PCR güçlendirme ve Kütüphane hazırlık
- Bir 40 µL PCR reaksiyonu DNA polimeraz öncesi karışımı ile 20 µL ayarla, 18 µL çöktürülmüş ve redissolved DNA adım 4.4.5, 1 µL ileri astar "MP1.0 + 22HIV" (10µM) (bkz. Tablo 1) ve (bkz: Ma Tablo 1 µL multiplex oligo astar (Dizin astar 1-24), terials).
Not: her örnek ayrı PCR reaksiyonları, ancak aynı üç reaksiyonları (düşük, orta, yüksek) astar dizine çalıştırın. Farklı bir dizinin her orijinal enfeksiyon örnekleri için kullanın.- PCR reaksiyonları aşağıdaki koşullar altında çalıştırın: 94 ° C denatürasyon, 2 dk sonra 18 döngüleri 3 adımlı PCR; 15 94 ° C denatürasyon, s 15 s tavlama 55 ° C ve 68 ° C'de 30 s uzantısı
- Bir kalite kontrol seçeneği olarak PCR reaksiyonları yüksek hassasiyet otomatik jel elektroforez sistemi ile analiz. 2 µL üreticisinin yönerge başı olarak çalıştırmak için düşük, orta ve yüksek örneği al.
Not: İki astar görünür ve hesaplanan bir uzunluğu 45 ve 95 nt (gerçek uzunluğu farklı olarak) hakkında genellikle çalışma olmalıdır. Ayrıca, DNA 150-500 arasında tespit edilmelidir nt. Sinyal yok varsa, ek PCR arasında geçiş yapar, 2 ve 10 ek döngü eklemek için tavsiye edilir. 3.3.2. adımda oluşturduğunuz oligonükleotid kontrol örnekleri için ek döngü eklemek değil. - Kaldırmak için bir paramagnetic boncuk-PCR temizlik sistemi tabanlı astar kullanın.
- Her PCR reaksiyon 20 µL al ve örnekleri birlikte (tüm örnekleri bu noktada mix) havuz. Kalan 20 µL tepkiler olarak yedekleme-20 ° C'de dondurmak
- RT için gelmek ve havuza alınan PCR reaksiyonları boncuk çözüm hacmi x 1,8 ile karıştırın paramagnetic boncuk izin. Pipetting tarafından mix ve 5 min için kuluçkaya.
Not: bir örnek, Eğer 4 örnekleri hazırlanmıştır ve her düşük, orta ve yüksek tepkiler olarak, birim 4 x 3 x 20 µL olurdu = 240 µL PCR reaksiyonları ile 432 µL boncuk çözüm. - Tüpler bir microcentrifuge tüp mıknatıs koymak, boncuk ~ 1 dk için bağlamak ve süpernatant almak atmak için izin. Tüpler üzerinde mıknatıs bırakın ve 500 µL % 80 etanol ekleyin.
- Etanol için 30 bırakın s, daha sonra iyice çıkar ve boncuk airdry ~ 5 dk. 40 eklemek µL nükleaz ücretsiz h için izin2O, tüpler mıknatıs kapalı almak ve pipet birden çok kez yukarı ve aşağı.
- İzinli süspansiyon 5 dk. yerine tüp için geri mıknatıs yanına yerleşmek ve süpernatant aktarmak için yeni bir tüp boncuk izin. Bu kütüphane olduğunu. 10 µL kalite denetimleri için aliquot almak ve geri kalanı-20 ° C'de dondurmak
6. değerlendirme Kütüphanesi
- Derişim, konsantrasyon ve Kütüphane kalitesini belirler.
- Fluorometrik miktar yöntemini kullanın. 1 µL ve Kütüphane ile yüksek hassasiyet dsDNA tahlil teçhizat üretici yönergelerine göre 3 µL ölçmek.
Not: 1 ile 10 ng/µL arasında tipik konsantrasyonları vardır. - Ölçü Kütüphane DNA molekül ağırlığı spektrum yüksek hassasiyet tarafından jel elektroforez (yukarıdaki adım 5.2) açıklandığı gibi otomatik.
- Otomatik jel elektroforez analiz Kütüphane ortalama molekül ağırlığı belirlemek için ve nükleaz ücretsiz H kütüphanede sulandırmak için hesaplamak kullanım2O 4 nM. Tüm dizinler benzersiz olduğu sürece birkaç kütüphaneleri kombine edilebilir.
- Fluorometrik miktar yöntemini kullanın. 1 µL ve Kütüphane ile yüksek hassasiyet dsDNA tahlil teçhizat üretici yönergelerine göre 3 µL ölçmek.
- İsteğe bağlı iş hızı düşük kalite kontrol
- DNA Kütüphane Kütüphane molekülleri amplifikasyon için vektörel çizimler eklemek için TA19 klonlama tabi. Kit'in yönergeleri izleyin, ~ 10-20 büyümek kolonileri ve burada20açıklandığı gibi özü DNA ile miniprep protokolleri,.
- Yerel sıralama Hizmetleri ve ekler istenilen HIV-1 içeren onay kullanarak sıra vektör dizileri ve Kütüphane özel adaptörleri türetilmiştir.
7. yüksek üretilen iş sıralama Çalıştır
- Sıralama platformu ile sağlanan ticari yazılım ile bir sıralama örnek sayfası oluşturur.
- Seçili sıralama seti gösterir. Tipik olarak, bir 150-döngüsü kiti tercih, ama diğerleri istediğiniz okuma uzunluğu bağlı olarak uygun.
- "Sadece Fastq" uygulama iş akışı olarak seçin. 24 Endeksi (kit el kitabında belirtildiği gibi) multiplex oligonükleotid kitleri mevcut içerir şablonlardan birini seçin.
- Seçin "25 nt" Read1 için ve "125 nt" Read2 için. Devam 6 nt tek dizin okumak için.
Not: kurum içi analiz sadece Read2 çözümlemede kullanılır. Read1 en az 25 tutmak nt platformu algoritması amaçlı sıralama için.
- Üreticinin yönergelerini tam olarak önceden çalıştırma kitaplığı hazırlık ve kurulumu için. En fazla 20 için tercih am konsantrasyon ve % 15 PhiX ani bir kütüphane olarak çok düşük karmaşıklık düzeyini kullanın.
8. veri analizi
- Pass filtre yüzde ve ortalama Q30 kalite puanı platformu üreticisinin yönergeleri sıralama başı olarak kabul edilebilir olup olmadığını kontrol edin.
Not: Geçiş filtresi genellikle > %90 ve Q30 puanları genellikle > %80. - Download. üreticinin sıralama hub dosyalarından fastq.gz.
- Sıralama komut dosyası ayarlama
- "AnalysisXYZ" adlı yeni bir dizin (klasör) oluşturun ve bu dizine tüm kaynak kodu dosyalarını (parse_sam.pl, rc_extract.pl, parse.sh) indirmek için https://github.com/malimlab/seqparse gidin.
- Kısa okuma aligner papyon, sürüm 1.1.2, http://bowtie-bio.sourceforge.net/index.shtml aynı dizin içine yükleyin.
- Belgili tanımlık download içinde "AnalysisXYZ" "Papyon-1.1.2" adlı bir alt dizin oluşturur. Bu dizin içindeki alt dizin "Dizin" açın ve 6 eğe ile .ebwt uzatma oluşan sağlanan şablon dizileri indir.
- Araç fastx-0.0.13 http://hannonlab.cshl.edu/fastx_toolkit/download.html gelen "AnalysisXYZ" dizine ön işleme FASTQ/A kısa okuma indir.
- Samtools (https://sourceforge.net/projects/samtools/files/) ve bam-readcount (https://github.com/genome/bam-readcount) "Belgeler" dizine yükleyin.
- Taşımak. tüm 8.2, adım karşıdan fastq.gz dosya okumak 2s (içinde..... _R2_001.fastq.gz biten) "AnalysisXYZ" dizine.
- Komut konsol/terminal açın. "AnalysisXYZ" cd komutları kullanarak geçerli dizin taşıyın. Komut dosyalarını çalıştırmak için türü "./parse.sh.".
- .Csv dosyaları özetleri ile tüm örnekleri için toplam okuma sayıları bulmak, uzunluğu ayarlanabilir sayar, okumak ve okuma sayar normalleştirir, yanı sıra bir dizinde parse_results "Analiz XYZ" Dizin içindeki her örnek için temel çeşitlemesiyle dosyaları.
Not: analiz süreci hakkında daha fazla bilgi için bkz. Komut dosyası csv dosyaları için her nükleotit ilk strand transfer ve HIV-1NL4.3 güçlü-stop dizileri birlikte toplam okuma ile nükleotit 635 kadar döndürür. Bir kılavuz, 50.000-100.000 benzersiz okuma genellikle--dan hastalık belirtilen hücrenin sayı ve viral inocula ve antiviral proteinler veya bileşikler olmadan örneklerdeki gözlenir. Oligonükleotid denetimi örneğini genellikle 100.000-200.000 okuma üretir.
Sonuçlar
Bu makalede açıklanan tekniği HIV-1 Ters transkripsiyon (A3G) tarafından antiretroviral insan proteini APOBEC3G inhibisyonu yatan mekanizmaları adrese daha geniş bir çalışma için uygulanan6. Şekil 3 CEM-SS T-hücreleri vifile enfekte örnekleri protokolünde istihdam sonra elde temsilcisi sonuçları gösterir-eksik HIV-1'de yokluğu veya A3G varlığı. Benzersiz okuma toplam sayısını elde edilen her örnek aynı 6 var herhangi bir PCR çoğaltmaları filtreleme sonra nt barkod ve (sağlanan analiz yazılımı tarafından yapılır) aynı uzunlukta çizilen Şekil 3biriçinde. A3G artan düzeylerde A3G inhibitör etkisi daha önce açıklanan ve qPCR6,13,21,22tarafından ölçülen aracılı RT cDNA sentez yansıtan toplam okuma sayısını azaltın. Şekil 3bmolekülleri ilk 182 içinde olası her boyu kısmını nt gösterilir. HIV-1 A3G için yokluğunda, en bol türler ana 180 enfeksiyondur nt güçlü-stop molekül kendisi, bazı birikmesi ile okur daha kısa aralıkta (23-40 nt) (en iyi grafik, mavi çubuk grafikler). Bu keskin bir artış, daha kısa, kesilmiş gibi birkaç çok özel, tekrarlanabilir pozisyonlarda cDNA molekülleri açıktır A3G değişiklikleri eklenmesi (orta ve alt grafikler) algıladı. A3G (C T tanımlanır) olan sitozin Üridin sitidin birdeaminaz olduğundan A3G bulaşmasını virions21,23,24' te mevcut cDNA mutasyonların meydana gelir. Elde edilen sıralama bilgileri kullanarak, C T mutasyonlar yüzdesi aynı grafikte (kırmızı noktalı çizgi) çizildi. Mutational profil tüm benzersiz Okunma kombine türetilir ve her nükleotit kapsama değişir unutulmamalıdır. Ancak, Eğer her molekül için ilgili ve bir belirli 3'-terminus ile ilişkili sırası bilgi gerekli. Sağlanan veri Pollpeter ve ark. alınmıştır 6 ve mutational arasındaki ilişki ve cDNA uzunluğu profilleri gösterdi DNA onarım makineleri algılama ve hücresel tarafından deaminated cDNA bölünme nedeniyle olmak.
3'-eşlemeyi approach için olumlu bir denetim bilinen sıra, uzunluk ve konsantrasyon sentetik oligonucleotides bir havuz işleyerek kolayca üretilmektedir. Bu denetim adaptör ligasyonu adım 3.3.2 ekledi ve tüm çoğaltılmış kitaplıklarda dahil edilecek tavsiye. Bir denetim örnekten alınan verileri tüm oligonucleotides çok küçük arka plan okuma ile beklenen giriş oranları, olmalıdır. Şekil 4 17 kimyasal olarak sentezlenmiş oligonucleotides olumlu denetim kümesi sonuçlarını gösterir (dizileri için bkz: Tablo 2), hangi ekimolar oranlarıyla karışık. Beklendiği gibi tüm molekülleri yalnızca küçük varyasyonlar (en iyi grafik) ile eşit bereket yakın görünür. Bir oligonükleotid tarafından temsil değildi çoğu pozisyonlar - sss DNA dizisi içinde sıfır okuma sayar verirken, biz 1 veya 2 nt gerçek denetim oligonucleotides kısa olan küçük türler gözlenen. Biz daha fazla bu küçük türler soruşturma değil ama onlar bozulmuş ya da eksik ürünleri satın aldığınızda verilen oligonükleotid hisse potansiyel olarak mevcut temsil varsayıyorum (oligonucleotides HPLC, kendisi için saf gibi sipariş Üretici > %80 saflıkta gösterir). Alt grafik denetimi örneğini çalıştırmak, nerede varyasyon arasında 17 oligonucleotides biraz daha yüksek ve daha uzun kontrol molekülleri daha verimli bir şekilde algılanır o toplam uzunluğu ile karşılıklı olarak ilişkilendirir sonra daha kısa olanlar farklı kütüphaneden gösterir. Bu küçük bir önyargı PCR reaksiyonları veya INSERT boyutu en uygun olan MiSeq sıralama sırasında kümeleme nedeni olabilir ve özellikle geniş Ekle aralıkları taşıyan kütüphaneleri ile oluşabilir. Bu önyargı sorunu çözmek için bir temel uyguladığımız molekül uzunluğu (Pembe hat) birleştiriliyor önyargı gösterir yamaç dayalı bir normalleştirme faktör uygulamadır. Gerekli hesaplamaları analiz programın içerdiği (bkz. Adım 8.3 iletişim kuralı).

Resim 1: HIV-1'in ilk adımları ters transkripsiyon gösteren diyagram. Süreç astar bağlama siteye (PBS) tRNA(Lys,3) (turuncu) tavlama ile başlatma ve viral cDNA (mavi, adım 2) uzama sağlar genomik viral RNA (adım 1), başlar. Kullanılazlar, şablon genomik RNA RT (adım 3) RNaseH etkinliği tarafından bozulmuş. İlk tam orta Ters transkripsiyon sürecinde eksi-strand güçlü-(-) sss cDNA, katalize RT polimerizasyon bölgesinin gRNA tekrar (R) (adım 3) 5'-terminus ulaştığında hangi tamamlandıktan durağıdır. (-) Sss orta 3'-terminus için genomik RNA şablonunun tamamlayıcı 3' uzunluğundaki terminal tekrar (LTR) R bölgeye TAV tarafından aktarılır. Buradan, polimerizasyon (adım 4) devam ediyor. Açıklanan yöntemde Ters transkripsiyon ilerleme doğmakta olan viral cDNA (mavi) tam olarak uzunluğunu eşleme tarafından belirlenir. PPT, polypurine yolu; U5, benzersiz 5'-sıra; U3, benzersiz 3'-sıra. Bu rakam bir önceki yayın6yayınlanacaktır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
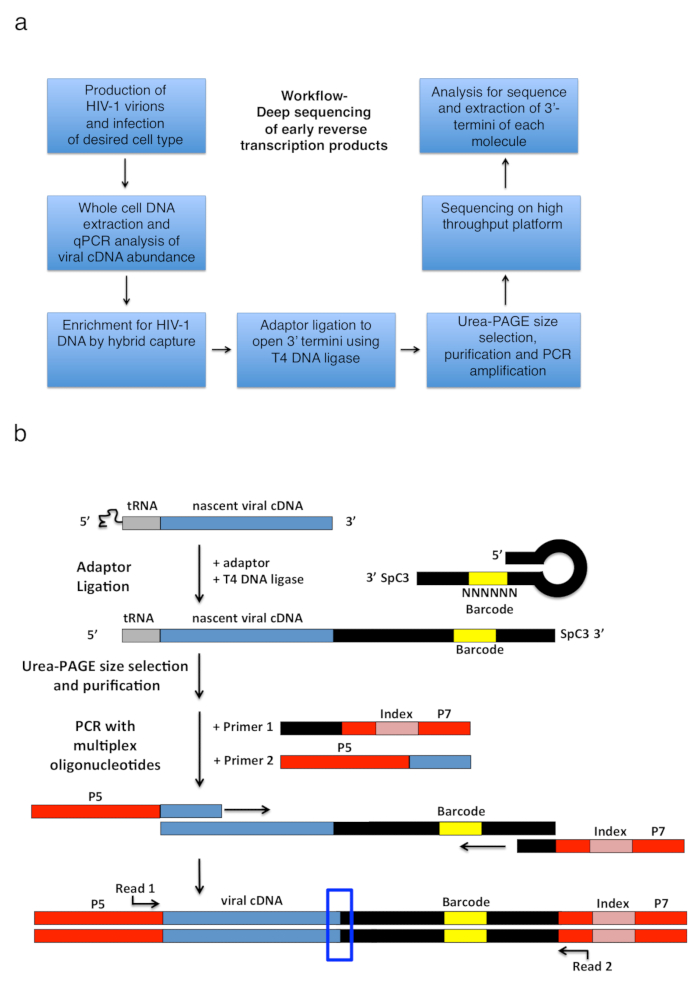
Resim 2 : İş akışı anahat ve şemaları bağdaştırıcısı ligasyonu ve PCR güçlendirme stratejisi. (a) açıklanan tekniği ana adımları özetleyen 3'-termini HIV-1'in belirlemek için iş akışı transkript enfekte hücreleri içinde ters. Bir önceki yayın6adapte bir rakamdır. (b) şeması adaptör ligasyonu ve PCR güçlendirme stratejisi. Önceki adımlarda saf doğmakta olan cDNA farklı uzunluk moleküllerinin T4 DNA ligaz kullanarak tek iplikçikli DNA adaptör tane. Saç tokası adaptörü (adlandırılmış "Kwok + MiSeq bkz. Tablo 1tam,") tasarım Kwok ve arktarafından ilham kaynağı oldu. 11. bağdaştırıcı bir rasgele taşır Bankası-tüp ligasyonu kolaylaştırmak için eşleştirme için sağlar ve aynı anda tanımlayıcı olarak için benzersiz okuma 6 nt barkod sıra. Bağdaştırıcısının 3'-termini ayırıcı (SpC3) öz ligasyonu önlemek için taşır. Ve birleştirilmiş ürünler aşırı adaptör polyacrylamide jel elektroforez (sayfa) denaturing tarafından ayrılır. Nükleik asitler jel içinde lekeli ve adaptörü de yukarıdaki alanda üç ayrı, eşit büyüklükteki jel parçalar halinde25içinde bitmiş gibi kesti. Elüsyon, yağış ve resuspension sonra adaptör bilinen serisine tavlama astar ile güçlendirilmiş PCR ürünlerdir (ilk 1, multiplex oligonükleotid kiti, bkz Malzemeler tablo) ve ilk 22 taşıyan bir astar nt HIV-1 TRNA (astar 2, MP1.0 + 22HIV) hemen ardından 5'-soldan sağa sıralı. Seçilen astar, 5'-termini adaptörler için seçtiğiniz sıralama platformu (P5 ve P7) yanı sıra bireysel örneği aynı kitaplığa çalıştırmak ayırt etmek için bir dizin sıra taşırlar. Nasıl yapılacağını başlangıç noktaları astar gösterilir okuyun. Mavi kutu bölgenin özgün 3'-termini yakalanan molekülünün belirlemek ilgi gösterir. Bu rakam bir önceki yayın6adapte. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
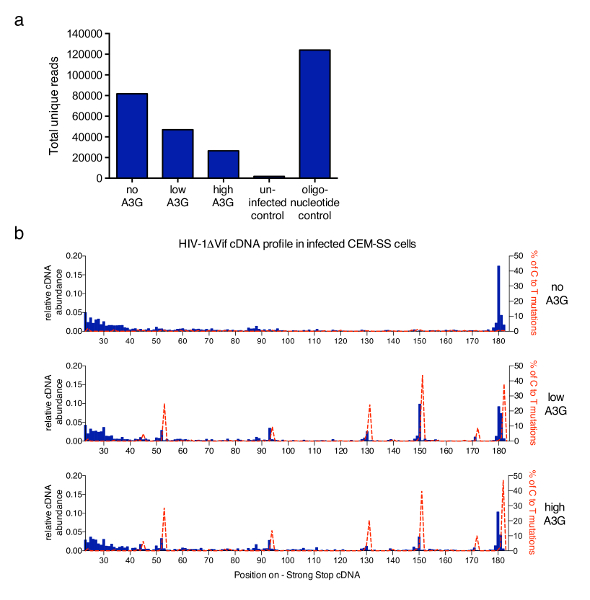
Şekil 3 : Temsilcisi sonuçları. (a) Toplam okuma sayısı temsilcisi örnekleri açıklanan protokolü ile işlenmiş. Bu HIV-1 molekülleri benzersiz okuma onların 3'-termini ilk 635 içinde ile tespit edilmiştir tüm dizileri içerir eksi nt strand cDNA (PPT kadar Şekil 1bakınız). Oysa A3G cDNA sentezini engeller ve böylece okuma sayısı toplam azaltır enfeksiyon HIV-1 A3G taşımıyor okuma, en yüksek sayısı verir. Sentetik oligonucleotides bir dizi olumlu denetim sağlarken virüs bulaşmamış hücreleri bir negatif kontrol görev yaptı. b) cDNAs nt pozisyonlar 23 ve 182 arasında her uzunluk için göreli bereket (tam uzunlukta - sss cDNA olduğunu 180-182 nt) HIV-1NL4.3 sırasını (x ekseni) mavi çubuk grafikler (soldaki y ekseninde ölçekte) gösterilir. CDNA göreli bolluk dizileri tüm okuma 182nt ölçme toplamına bölünmesiyle - sss cDNA dizisi içinde belirli bir nükleotit, Sonlandırıcı veya daha az mutlak sayı hesaplanır. Kesik çizgili kırmızı satırlarda gösterildiği C-için-T/U mutasyonlar (doğru y-eksende ölçek) ilgili konumda taşıyan okuma yüzdelerdir. Şekil 3 b bir önceki yayın6yayınlanacaktır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
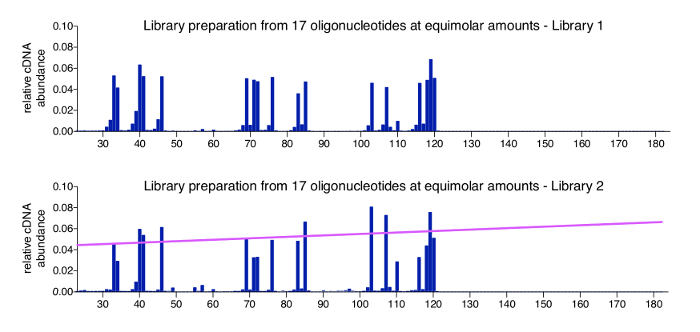
Şekil 4 : Temsilcisi kontrol örnekleri sonuçlarını. 17 farklı uzunlukta sentetik oligonucleotides ekimolar miktarda içeren havuzlar için iki profili gösterilmiştir. Bu oligonucleotides serileri HIV-1NL4.3 dan sahiptir ve çeşitli uzunluklarda kapak ve tüm 4 üsleri bir 3'-nükleotid sunmak üzere seçildi (bkz. Tablo 2). En iyi grafik Şekil 3birgelen olumlu denetimi örneğini gösterir. Önemli hiçbir önyargı molekül uzunluğu ya da açık 3'-termini doğru algılanır. Alt grafiğin kaç, hangi sıralama bir küçük uzunluk önyargı üretilen farklı bir kitaplık gösterir. Bu durumda, boyutu sapma gösteren (pembe renkte gösterilir) yamaç türetilmiş bir normalleştirme faktör uygulamanız önerilir. Bu rakam bir önceki yayın6yayınlanacaktır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Oligo adı | Nt uzunluğu | Sıra | Amaç | Üretici (arıtma) | ||||||||||||||
| tam Kwok + MiSeq | 61 | 5'-PHO-tgaagagcctagtcgctgttcannnnnnctgcccatagagagatcggaagagcacacgtct-SpC3-3' | Adaptör | IDT DNA Teknolojileri (HPLC) | ||||||||||||||
| 2xBiotin SS yem | 40 | 5'-biotin-cagtgtggaaaatctctagcagtggcgcccgaacagggac-biotin-3' | Hibrid yakalama | MWG Eurofins (HPLC) | ||||||||||||||
| Biotin 1-16 ss | 22 | 5'-cagtgtggaaaatctctagcag-BiTEG-3' | Hibrid yakalama | MWG Eurofins (HPLC | ||||||||||||||
| Biotin tRNA + CTG | 16 | 5'-cagtggcgcccgaaca-BITEG-3' | Hibrid yakalama | MWG Eurofins (HPLC) | ||||||||||||||
| MP1.0 + 22HIV | 82 | 5'-aatgatacggcgaccaccgagatctacactctttccctacacgacgctcttccgatctcactgctagagattttccacactg-3' | PCR güçlendirme | MWG Eurofins (HPLC | ||||||||||||||
Tablo 1: uzunluk, dizileri ve kullanılmaktadır değişiklikler açıklanan protokol de dahil olmak üzere oligonucleotides tablo. Bir önceki yayın6adapte tablodur. Bu tablo bir excel dosyası olarak indirmek için buraya tıklayınız.
| Oligo adı | Nt uzunluğu | Sıra | Üretici (arıtma) | |||||||||||||
| HTP con uzun C | 120 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactttgagcactcaaggcaagctttattgaggcttaagc-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP con uzun G | 119 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactttgagcactcaaggcaagctttattgaggcttaag-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP con uzun T | 116 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactttgagcactcaaggcaagctttattgaggctt-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP con uzun A | 118 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactttgagcactcaaggcaagctttattgaggcttaa-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP con C orta | 76 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcac-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP con G (a) orta | 71 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacg-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP con G (b) orta | 72 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgg-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP con A orta | 69 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacaga-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP con T orta | 85 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactt-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP con kısa A | 40 | 5'-ctgctagagattttccacactgactaaaagggtctgaggga-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP con kısa T | 33 | 5'-ctgctagagattttccacactgactaaaagggt-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP con kısa G | 41 | 5'-ctgctagagattttccacactgactaaaagggtctgaggg-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP con kısa C | 34 | 5'-ctgctagagattttccacactgactaaaagggtc-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP Con 46 (T) | 46 | 5'-ctgctagagattttccacactg actaaaagggtctgagggatctct-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP Con 83 (C) | 83 | 5'-ctgctagagattttccacactg actaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactac-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP Con 103 (C) | 103 | 5'-ctgctagagattttccacactg actaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactttgagcactcaaggcaagc-3' | MWG Eurofins (HPLC) | |||||||||||||
| HTP Con 107 (A) | 107 | 5'-ctgctagagattttccacactg actaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactttgagcactcaaggcaagcttta-3' | MWG Eurofins (HPLC) | |||||||||||||
Tablo 2: 17 sentetik kontrol oligonucleotides bir olumlu denetim örnek kullanılan tablo. 13 top oligonucleotides dayalı boyutu seçilmiştir [uzun (116-120 nt), Orta (69-85 nt), kısa (33-41 nt)] onların 3'-termini yanı sıra. Bir önceki yayın6adapte tablodur. Bu tablo bir excel dosyası olarak indirmek için buraya tıklayınız.
Tartışmalar
Hızlı, güvenilir ve düşük maliyetli derin sıralama durumu birçok yönleri, yaşam bilimleri, büyük bir derinlik-dayandırılmış analizleri izin alanında devrim yarattı. Kalan bir meydan okuma yenilikçi tasarım ve oluşturma temsilcisi sıralama kitaplıkları yatıyor. Burada biz yeni doğmakta olan viral cDNA molekülleri, özellikle ara ürün HIV-1 Ters transkripsiyon sürecinin yakalamak için bir protokol tanımlamak.
Bu strateji en kritik adımda bir adaptör açık 3'-termini için ligasyonu nicel ve tarafsız bir şekilde var. D iki ssDNA termini arasında verimliliği, her ikisi de Inter- ve intramolecular, incelenmiş ve çeşitli uygulamalar11,26,27,28,29için en iyi duruma getirilmiş. 3.3. adımda açıklanan koşullar altında T4 DNA ligaz ile bir saç tokası adaptörü kullanarak seçim ampirik optimizasyon içinde farklı Ligazlar, adaptörler ve sentetik oligonucleotides temsil eden ligasyonu kimyasalları değerlendirildi sonucudur HIV-1 dizileri (Tablo 2) (veri gösterilmez). Bu vitro test tepkiler T4 DNA ligaz ligasyonu saç tokası bağdaştırıcısının aracılı Kwok ve arktarafından açıklandığı gibi doğruladık. 11, çok düşük bir önyargı vardır ve adaptör aşırı kullanıldığında alıcısı molekülleri tam ligasyonu erişir. Tüp ligasyonu verimliliği adaptör multiplex astar sistemi için uyumlu işlemek için nükleotid dizisi eklenmesiyle etkilenmedi (bkz. Şekil 4). Buna karşılık, alıcısı olarak ssDNA ile tüp ligasyonu verimliliği artırmak için kısmen geliştirilmiş bir mühendislik RNA ligaz olan bir transfer 5' DNA/RNA ligaz ("A ligaz" için bkz: Tablo malzemeleri tam Ligazlar burada karşılaştırıldığında) bulduk 27, RNA ligaz ("ligaz B"), ama güçlü ligasyonu verimliliği bile oligonucleotides tek temel uzunluk farkları [Tablo 2 arasındaki farkları ile önemli bir önyargı vardı daha iki ssDNA birleştirilmesi (ligasyon) gerçekten de daha etkili ; HTP con orta G (a) ve (b)]. Ayrıca, yalnızca en az bir önyargı tepkileri "Ligaz bir randomize 5'-termini taşıyan bir adaptör ile kombine c" bulduk (bir strateji bilinen nükleotit önyargı "Ligaz c" dengelemek için kullanılan; örneğin Ding ve arkbkz. 30). ancak, "Ligaz C"-aracılı cins d eksik, üstün seçim T4 DNA ligaz sistemi oluşturma.
Protokol seyri ve pozitif ve negatif denetimleri dahil çeşitli kalite kontrol adımları tahlil devamı önce potansiyel sorunların tespiti için izin ve çabaları sorun giderme ile ilgili yönergeler sağlar. Adım 2.2.2 ve 2.3.12 qPCR quantifications giriş malzeme miktarını yeterli olduğundan emin olun. Tipik cDNA kopya sayıları yaklaşık 10.000 için 300.000 µL başına 200 µL elüsyon (Kimden adım 2.1) aralığında. Hibrid yakalama adım genel HIV-1 bazı kaybına neden olabilir cDNA miktar ancak belirli HIV-1 cDNA güçlü bir zenginleştirme öncesi ve sonrası zenginleştirme tarafından genomik DNA ölçmek için uygun astar kullanarak belirlenebilir hücresel DNA üzerinde neden qPCR veya toplam DNA toplama ölçme tarafından. Melez yakaladıktan sonra adımları kurtarılan HIV-1 cDNA giriş en az yüzde 10'u olmalıdır. Malzeme başlayan düşük Aksi takdirde başarılı oligonükleotid olumlu denetim açıklamak (bkz. Adım 3.3.2) ama sadece sınırlı örneklerinde elde defa okundu. Düşük sayılar genel tahmindi MiSeq adaptör olmadan alakasız DNA türlerin varlığı nedeniyle Kütüphane konsantrasyon tarafından açıklanabilir okuyun. Bu düşük küme dansitesi neden olur ve HIV-1 dizileri kütüphanede konsantrasyonu qPCR yanı sıra toplam DNA tutar tarafından Fluorometrik deneyleri tarafından belirlenerek geliştirilebilir. Yöntem son derece hassas doğası gereği, hem de diğer örnekleri (özellikle, yüksek konsantrasyon kontrolü oligonükleotid hisse senetleri) Labaratuar donanımları gibi gelen yanı sıra bile alt düzey kirlenmesini önlemek için özel bakım alınmalıdır. PCR iş istasyonu sterilize bir UV çalışma bu konuda faydalıdır. Otomatik jel elektroforez son Kütüphane (adım 6.1.2) daha fazla kalite kontrol ölçüsüdür. Genellikle gözlenen nükleik asit boyutu algılanabilen isteğe bağlı denetiminde PCR sonra ve arıtma (bkz: Not Adım 5.2) şimdi yok olmalıdır önce 150-500 nt. astar aralıktır. Temsil edici bir sonuç, örnek yoğunluğu eğrisi bir tepe vardır yaklaşık 160-170 nt ve ikinci bir daha keskin zirve yaklaşık 320-350 nt. Bu büyük olasılıkla kısa (1-20 nt Ekle uzunluğu) ters transkript ve tam uzunlukta güçlü-stop (180-182 nt Ekle uzunluğu) sık görülen yüksek bereket yansıtır (Şekil 3b).
Sunulan Protokolü ve seçilen astar erken HIV-1 Ters transkripsiyon yapıları için belirli olmakla birlikte, genellikle açık 3'-termini DNA'ın belirlemeye yönelik herhangi bir çalışma için uygun bir yöntemdir. Diğer bağlamlarda gerekli ana değişiklikler hibrid yakalama ve astar tasarım stratejisi için yöntem olacaktır. Örneğin, hedef için geç HIV-1 transkript adapte için ise cDNA uzunluğu boyunca tavlama farklı yakalama biotinylated oligonucleotides daha çok sayıda tavsiye edilmektedir ve büyük olasılıkla hibrid yakalama adım kaybına azalacak. Giriş bölümünde de belirtildiği gibi kısıtlamalar 3'-termini vardır farklı kaynaklardan önyargı önlemek için tespit aralığı tasarlarken göz önünde bulundurun önemlidir. İlk olarak, bir önyargı PCR reaksiyonları büyük ölçüde değişik uzunluğu şablonlarıdır adaptörle durumunda olabilir. İkincisi, burada kullanılan sıralama platformu (Örneğin, MiSeq) en uygun kümeleme için bir tercih edilen Ekle uzunluk alanı vardır ve önemli ölçüde daha kısa ve daha uzun ürünleri aynı verimlilik ile sıralı değil. Kısmen, bu hesaplama açısından, doğrusal uzunluğu önyargı için düzeltme faktörü hesaplayarak yapıldığı gibi ele alınabilir (bkz. Şekil 4, alt grafik). Ancak, nerede 3'-termini eşleme istenilen bölge uzun ise (> 1000 nt), tepkiler ve birleştirilmiş tutanaklar ile bölünmüş ve 3'-termini bölümlerde değerlendirmek için birden fazla ters yönde astar kullanmak için daha fazla tavsiye.
Analiz programı şirket içinde her iki son nükleotit sabit adaptör dizisine bitişik HIV-1 dizisinin yanı sıra herhangi bir mutasyon tanımlamak için tüm üsleri temel varyasyonu analiz belirli amaç için yazılmıştır. Bireysel adımlar aşağıdakileri kapsamaktadır: adaptör dizileri fastx-0.0.13 araç takımı; kullanarak ilk olarak, kesildikten o zaman, (barkod da dahil olmak üzere aynı sıraları anlamına gelir) çoğaltılır herhangi bir dizileri kaldırılır. Tüm kalan benzersiz okur sonra üç üssü ayarlayın maksimum uyumsuzluğu ile Papyon (http://bowtie-bio.sourceforge.net/index.shtml) kullanarak HIV-1 sıra hizalanır. Şablon sıra ilk 635 oluşur - sss sıra ve ilk strand transfer ürün kadar polypurine parça (U5-R-U3-PPT; bkz: Şekil 1) içeren HIV-1 cDNA (NL4.3 zorlanma), nt. Böylece, sağlanan yazılım ve şablonları yalnızca aynı uygulamayı (HIV-1NL4.3erken ters tutanaklar tespiti) yöntemi kullanılırsa doğrudan uygundur. Ayarlamalar için diğer hedef sıraları yapılması gerekir. Her okuma için 3'-termini konumlarını tarafından hizalama bulunduğu belirlendi. Her bir pozisyon için temel aramalar kaydedilir ve mutasyon oranları değişir, okuma farklı uzunluklarını ve uzun ekler tamamen Read2 125-base sıralama tarafından kaplı değil gibi her Bankası toplam kapsama üzerinden hesaplanır.
Sonuç olarak, çeşitli çalışmalar için değerli bir araç olmak açıklanan yöntemi inanıyorum. Açık uygulamalar araştırmalar Ters transkripsiyon inhibisyon antiretroviral ilaçlar veya hücresel kısıtlama faktörler aracılığıyla temel mekanizmaları içerir. Ancak, nispeten küçük ayarlamalar 3'-termini mevcut Örneğin, parvovirus çoğaltmasında, diğer tek iplikçikli DNA viral intermediates içinde eşleme sisteme uyum için gerekli olmalıdır. Ayrıca, yöntem, özellikle onun en iyi duruma getirilmiş ligasyonu adım, prensibi hücresel çift iplikçikli DNA tarafından katalize elongations de dahil olmak üzere herhangi bir 3'-DNA uzantıları karakterizasyonu için Kütüphane hazırlık tasarım temel bir parçası sağlayabilir polimerazlar.
Açıklamalar
Yazarlar onlar ifşa birşey yok bildirin.
Teşekkürler
Yazarlar Malim laboratuvar, Luis Apolonia, Jernej Ule ve Rebecca Oakey üyelerinden destek kabul etmiş oluyorsunuz. Yazarlar Matt Arno King's College London genomik merkezi ve Debbie Hughes University College London (UCL), teşekkür ederim, Enstitüsü Nöroloji sonraki nesil sıralama tesisi, MiSeq sıralama ile ilgili yardım için çalışır. İş Hibe Sözleşmesi kapsamında İngiltere'de tıbbi araştırma Konseyi (G1000196 ve Bay/M001199/1 mm), Wellcome Trust (106223/Z/14/Z mm), Avrupa Komisyonu'nun Yedinci Çerçeve Programı (FP7/2007-2013) tarafından desteklenmiştir yok. PIIF-GA-2012-329679 (için D.P.) ve King's College London ve Kral'ın ortaklığında güven Sağlık Bakanlığı ile ulusal kurumları adamın ve St. Thomas'NHS Vakfı Sağlık Araştırma kapsamlı Biyomedikal Araştırma Merkezi Ödülü Üniversite Hastanesi NHS vakıf güven.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 293T cells | ATCC | CRL-3216 | |
| Dulbecco's Modified Eagle's Medium | Gibco | 31966-021 | |
| Penicillin/Streptomycin | Gibco | 15150-122 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| HeraCell Vios 250i CO2 Incubator | Thermo Scientific | 51030966 | |
| Laminar flow hood - CAS BioMAT2 | Wolflabs | CAS001-C2R-1800 | |
| 10mm TC-treated culture dish | Corning | 430167 | |
| TrypLE™ Express (1x), Stable Trypsin Replacement Enzyme | Gibco | 12605-010 | |
| OptiMEM® (Minimal Essential Medium) | Gibco | 31985-047 | |
| HIV-1 NL4-3 Infectious Molecular Clone (pNL4-3) | NIH Aids reagent program | 114 | |
| Polyethylenimine (PEI) - MW:25000 | PolySciences Inc | 23966-2 | dissolved at 1mg/ml and adjusted to pH7 |
| RQ1- Rnase free Dnase | Promega | M6101 | |
| Filter 0.22 μm | Triple Red Limited | FPE404025 | |
| 15 mL polypropylene tubes | Corning | CLS430791 | |
| Sucrose | Calbiochem | 573113 | |
| Phosphate Buffered Saline (1x) | Gibco | 14190-094 | |
| Ultracentrifuge tubes | Beckman Coulter | 344060 | |
| Ultracentrifuge | Sorval | WX Ultra Series | Th-641 Rotor |
| Alliance HIV-1 p24 antigen ELISA kit | Perkin Elmer | NEK050001KT | |
| CEM-SS cells | NIH Aids reagent program | 776 | |
| Roswell Park Memorial Institute Medium | Gibco | 31870-025 | |
| CoStar® TC treated multiple well plates | Corning | CLS3513-50EA | |
| Benchtop centrifuge: Heraus™ Multifuge™ X3 FR | Thermo Scientific | 75004536 | |
| TX-1000 Swinging Bucket Rotor | Thermo Scientific | 75003017 | |
| Microcentrifuge: 5424R | Eppendorf | 5404000060 | |
| Total DNA extraction kit (DNeasy Blood and Tissue kit) | Qiagen | 69504 | |
| Nuclease free H2O | Ambion | AM9937 | |
| Cutsmart buffer | New England Biolabs (part of DpnI enzyme) | R0176S | |
| DpnI restriction enzyme | New England Biolabs | R0176S | |
| Oligonucleotides for qPCR | MWG Eurofins | N/A | HPSF purification |
| TaqMan PCR Universal Mastermix | Thermo | 4304437 | |
| LoBind Eppendorf® tubes | Eppendorf | 30108078 | |
| Axygen™ aerosol filter pipette tips, 1000 μL | Fisher Scientific | TF-000-R-S | |
| Axygen™ aerosol filter pipette tips, 200 μL | Fisher Scientific | TF-200-R-S | |
| Axygen™ aerosol filter pipette tips, 20 μL | Fisher Scientific | TF-20-R-S | |
| Axygen™ aerosol filter pipette tips, 10 μL | Fisher Scientific | TF-10-R-S | |
| PCR clean hood | LabCaire | Model PCR-62 | |
| DynaMag™2-magnet | Thermo | 12321D | |
| Streptavidin MagneSphere® paramagnetic particles | Promega | Z5481 | |
| Casein | Thermo Scientific | 37582 | |
| End over end rotator, Revolver™ 360° | Labnet | H5600 | |
| Tris-Base | Fisher Scientific | BP152-5 | |
| Hydrochloric Acid | Sigma | H1758-100ML | |
| EDTA disodium salt dihydrate | Electran (VWR) | 443885J | |
| Sodium Chloride | Sigma | S3014 | |
| Dri-Block® Analog Block Heater | Techne | UY-36620-13 | |
| PCR tubes and domed caps | Thermo Scientific | AB0266 | |
| PCR machine | Eppendorf | Mastercycler® series | |
| T4 DNA ligase | New England Biolabs | M0202M | |
| 40% Polyethylene glycol solution (PEG) in H2O, MW: 8000 | Sigma | P1458-25ML | |
| Betaine solution, 5M | Sigma | B0300-1VL | |
| Gel loading buffer II (formamide buffer) | Thermo Scientific | AM8546G | |
| Precast 6% TBE urea gels | Invitrogen | EC6865BOX | |
| Mini cell electrophoresis system | Invitrogen, Novex | XCell SureLock™ | |
| Tris/Borate/EDTA solution (10x) | Fisher Scientific | 10031223 | |
| Needle 21 G x1 1/2 | VWR | 613-2022 | |
| SYBR Gold nucleic acid stain (10000x) | Life Technologies | S11494 | |
| Dark Reader DR46B transilluminator | Fisher Scientific | NC9800797 | |
| Ammonium acetate | Merck | 101116 | |
| SDS solution 20% (w/v) | Biorad | 161-0418 | |
| Centrifuge tube filter | Appleton Woods | BC591 | |
| Filter Glass Fibre Gf/D 10mm | Whatman (VWR) | 512-0427 | |
| polyadenylic acid (polyA) RNA | Sigma | 10108626001 | |
| Glycogen, molecular biology grade | Thermo Scientific | R0561 | |
| Isopropanol (2-propanol) | Fisher Scientific | 15809665 | |
| Ethanol, molecular biology grade | Fisher Scientific | 10041814 | |
| Accuprime™ Supermix I (DNA polymerase premix) | Life Technologies | 12342-010 | |
| NEBNext® Multiplex Oligo for Illumina (Index Primer Set 1 and 2) | New England Biolabs | E7335S; E7500S | |
| Tapestation D1000 Screentape High sensitivity | Agilent Technologies | 5067- 5584 | |
| Tapestation D1000 Reagents | Agilent Technologies | 5067- 5585 | |
| 2200 Tapestation - automated gel electrophoresis system | Agilent Technologies | G2965AA | |
| Agencourt® AMPure® beads XP | Beckman Coulter | A63880 | |
| Qubit™ dsDNA HS Assay Kit | Invitrogen | Q32851 | |
| Qubit™ 2.0 Fluorometer | Invitrogen | Q32866 | |
| Topo™ TA cloning Kit | Invitrogen | 450071 | |
| Sequencing platform: MiSeq System | Illumina | ||
| Experiment Manager (Sample sheet software) | Illumina | Note: Use TruSeq LT as a template | |
| Miseq™ Reagent kit V3 (150 cycle) | Illumina | MS-102-3001 | |
| Sequencing hub: Basespace | Illumina | https://basespace.illumina.com | |
| Ligase A: Thermostable 5’ App DNA/RNA ligase | NEB | M0319S | Not used in this protocol, but tested in optimization process with results described in the discussion. |
| Ligase B: T4 RNA ligase 1 | NEB | M0204 | Not used in this protocol, but tested in optimization process with results described in the discussion. |
| Ligase C: CircLigase | Epicentre | CL4111K | Not used in this protocol, but tested in optimization process with results described in the discussion. |
Referanslar
- Herschhorn, A., Hizi, A. Retroviral reverse transcriptases. Cellular and Molecular Life Sciences. 67 (16), 2717-2747 (2010).
- Hu, W. S., Hughes, S. H. HIV-1 reverse transcription. Cold Spring Harbor Perspectives in Medicine. 2 (10), (2012).
- Levin, J. G., Mitra, M., Mascarenhas, A., Musier-Forsyth, K. Role of HIV-1 nucleocapsid protein in HIV-1 reverse transcription. RNA Biology. 7 (6), 754-774 (2010).
- Menendez-Arias, L., Sebastian-Martin, A., Alvarez, M. Viral reverse transcriptases. Virus Research. , (2016).
- Telesnitsky, A., Goff, S. P., Coffin, J. M., Hughes, S. H., Varmus, H. E. . Retroviruses. , (1997).
- Pollpeter, D., et al. Deep sequencing of HIV-1 reverse transcripts reveals the multifaceted antiviral functions of APOBEC3G. Nature Microbiology. 3 (2), 220-233 (2018).
- Frohman, M. A., Dush, M. K., Martin, G. R. Rapid production of full-length cDNAs from rare transcripts: amplification using a single gene-specific oligonucleotide primer. Proceedings of the National Academy of Sciences of the United States of America. 85 (23), 8998-9002 (1988).
- Liu, X., Gorovsky, M. A. Mapping the 5' and 3' ends of Tetrahymena thermophila mRNAs using RNA ligase mediated amplification of cDNA ends (RLM-RACE). Nucleic Acids Research. 21 (21), 4954-4960 (1993).
- Ince, I. A., Ozcan, K., Vlak, J. M., van Oers, M. M. Temporal classification and mapping of non-polyadenylated transcripts of an invertebrate iridovirus. Journal of General Virology. 94, 187-192 (2013).
- Hafner, M., et al. RNA-ligase-dependent biases in miRNA representation in deep-sequenced small RNA cDNA libraries. RNA. 17 (9), 1697-1712 (2011).
- Kwok, C. K., Ding, Y., Sherlock, M. E., Assmann, S. M., Bevilacqua, P. C. A hybridization-based approach for quantitative and low-bias single-stranded DNA ligation. Analytical Biochemistry. 435 (2), 181-186 (2013).
- Abram, M. E., Tsiang, M., White, K. L., Callebaut, C., Miller, M. D. A cell-based strategy to assess intrinsic inhibition efficiencies of HIV-1 reverse transcriptase inhibitors. Antimicrobial Agents and Chemotherapy. 59 (2), 838-848 (2015).
- Bishop, K. N., Verma, M., Kim, E. Y., Wolinsky, S. M., Malim, M. H. APOBEC3G inhibits elongation of HIV-1 reverse transcripts. PLoS Pathogens. 4 (12), 1000231 (2008).
- Zack, J. A., Haislip, A. M., Krogstad, P., Chen, I. S. Incompletely reverse-transcribed human immunodeficiency virus type 1 genomes in quiescent cells can function as intermediates in the retroviral life cycle. Journal of Virology. 66 (3), 1717-1725 (1992).
- Adachi, A., et al. Production of acquired immunodeficiency syndrome-associated retrovirus in human and nonhuman cells transfected with an infectious molecular clone. Journal of Virology. 59 (2), 284-291 (1986).
- Shah, V. B., Aiken, C. In vitro uncoating of HIV-1 cores. Journal of Visualized Experiments. (57), (2011).
- JoVE Science Education Database. Science Education Database: Basic Methods in Cellular and Molecular Biology: Passaging Cells. Journal of Visualized Experiments. , (2018).
- JoVE Science Education Database. JoVE Science Education Database: Basic Methods in Cellular and Molecular Biology: Using a Hemocytometer to Count Cells. Journal of Visualized Experiments. , (2018).
- Zhou, M. Y., Gomez-Sanchez, C. E. Universal TA cloning. Current Issues in Molecular Biology. 2 (1), 1-7 (2000).
- Zhang, S., Cahalan, M. D. Purifying plasmid DNA from bacterial colonies using the QIAGEN Miniprep Kit. Journal of Visualized Experiments. (6), 247 (2007).
- Mangeat, B., et al. Broad antiretroviral defence by human APOBEC3G through lethal editing of nascent reverse transcripts. Nature. 424 (6944), 99-103 (2003).
- Gillick, K., et al. Suppression of HIV-1 infection by APOBEC3 proteins in primary human CD4(+) T cells is associated with inhibition of processive reverse transcription as well as excessive cytidine deamination. Journal of Virology. 87 (3), 1508-1517 (2013).
- Harris, R. S., et al. DNA deamination mediates innate immunity to retroviral infection. Cell. 113 (6), 803-809 (2003).
- Zhang, H., et al. The cytidine deaminase CEM15 induces hypermutation in newly synthesized HIV-1 DNA. Nature. 424 (6944), 94-98 (2003).
- Konig, J., et al. iCLIP--transcriptome-wide mapping of protein-RNA interactions with individual nucleotide resolution. Journal of Visualized Experiments. (50), (2011).
- Troutt, A. B., McHeyzer-Williams, M. G., Pulendran, B., Nossal, G. J. Ligation-anchored PCR: a simple amplification technique with single-sided specificity. Proceedings of the National Academy of Sciences of the United States of America. 89 (20), 9823-9825 (1992).
- Zhelkovsky, A. M., McReynolds, L. A. Structure-function analysis of Methanobacterium thermoautotrophicum RNA ligase - engineering a thermostable ATP independent enzyme. BMC Molecular Biology. 13 (24), (2012).
- Li, T. W., Weeks, K. M. Structure-independent and quantitative ligation of single-stranded DNA. Analytical Biochemistry. 349 (2), 242-246 (2006).
- Gansauge, M. T., et al. Single-stranded DNA library preparation from highly degraded DNA using T4 DNA ligase. Nucleic Acids Research. 45 (10), 79 (2017).
- Ding, Y., Kwok, C. K., Tang, Y., Bevilacqua, P. C., Assmann, S. M. Genome-wide profiling of in vivo RNA structure at single-nucleotide resolution using structure-seq. Nature Protocols. 10 (7), 1050-1066 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır