Method Article
Определение последовательности зарождающейся вирусной ДНК одноцепочечной молекул во время ВИЧ-1 и 3'-Термини обратный транскрипции в инфицированных клетках
В этой статье
Резюме
Здесь мы представляем глубокую последовательности подхода, который обеспечивает объективное определение зарождающейся 3'-Термини, а также мутационного профили молекул одноцепочечной ДНК. Основное применение-характеристика зарождающейся ретровирусной взаимодополняющих ННО (cDNAs), промежуточных продуктов, созданных в процессе ретровирусной обратной транскрипции.
Аннотация
Мониторинг промежуточных нуклеиновой кислоты во время репликации вируса обеспечивает понимание эффекты и механизмы действия противовирусных соединений и принимающих клетки белки на синтез вирусной ДНК. Здесь мы решить проблему отсутствия на основе ячеек, высоким уровнем охвата и высоким разрешением assay, который способен определения ретровирусной обратной транскрипции интермедиатов в пределах физиологических контексте вирусной инфекции. Описан метод захватывает 3'-Термини зарождающейся дополнительных молекул ДНК — (cDNA кДНК) внутри клетки инфицированных ВИЧ-1 в единичных нуклеотидных резолюции. Протокол включает в себя сбор клеточных ДНК, целенаправленных обогащения вирусной ДНК через гибридные захвата, перешнуровки переходник, размер фракционирования, очищение геля, амплификации PCR, глубокие последовательности и анализа данных. Ключевым шагом является эффективной и беспристрастной лигирование адаптер молекул, чтобы открыть 3'-ДНК Термини. Применение метода описаны определяет обилие обратный стенограммы каждой конкретной длины в данной выборке. Он также предоставляет информацию о вариации (внутренней) последовательности в обратном стенограммы и тем самым любые потенциальные мутации. В общем assay подходит для любых вопросов, связанных с ДНК 3'-расширение, при том условии, что шаблон последовательность известна.
Введение
Для того чтобы рассечь и понять, что вирусной репликации полностью, все более уточнены методы, которые захватывают репликации требуются промежуточные. В частности, точное определение видов нуклеиновой кислоты вируса в контексте зараженных клеток может обеспечить новые идеи, так как многие механизмы репликации вируса к настоящему времени были изучены в изолированных в vitro реакциях. Ярким примером является процесс обратной транскрипции в ретровирусы, например вируса иммунодефицита человека 1 (HIV-1). Различные этапы обратной транскрипции ВИЧ-1, во время которого вирусный фермент обратной транскриптазы (RT) копирует одноцепочечной РНК генома в double-stranded дна, были изучены главным образом в грунт расширение анализов с очищенной белков и нуклеиновых кислоты1,2,3,4,5. Хотя были установлены основополагающие принципы, такие анализы не включают все вирусные и клеточных компонентов и могут не отражать биологически соответствующих stoichiometries вовлеченных факторов. Таким образом мы разработали это мощный метод для определения спектров интермедиатов обратной транскрипции с их точные cDNA 3'-Термини (т.е., определение их точные длины) и нуклеотидных последовательностей в контексте инфекций жизни 6клетки. Сбор данных от времени курс эксперименты могут быть использованы для сравнения профиль стенограммы в различных условиях, таких как наличие противовирусных молекул или белков, которые могут повлиять на эффективность и processivity синтеза ДНК и накопление. Это позволяет более детального понимания естественный возбудитель жизненного цикла, который часто является основой для разработки целенаправленных наркотиков и успешных терапевтического вмешательства.
Обратная транскрипция ВИЧ-1 включает в себя серию последовательных событий, инициированных отжига праймера tRNA в геномной РНК шаблон, который затем распространяется на RT производить короткие сингл мель cDNA стенограмма, называется минус стренги сильный стоп (-sss) (см. Рисунок 1). Впоследствии, cDNA - ССС передается от 5'-Лонг терминала повторить (LTR) 3'-LTR геномной РНК, где он anneals и служит как грунтовка для продолжения RT опосредованной удлинение минус нити ДНК (см. Отзывы на обратной транскрипции1 , 2 , 3 , 4). это первая прядь передача является одним из ограничения скорости шагов обратная транскрипция; Следовательно cDNA - ССС известен накапливаться. Основные рабочего процесса и библиотеки дизайн для захвата обратной транскрипции продуктов в инфицированных клетках, изложены в рисунке 2a. Конкретные грунты и анализа параметров, которые используются в протоколе и перечисленных в таблице 1 пристрелть все рано обратный транскрипции cDNA интермедиатов в диапазоне длины от 23 до ~ 650 nt, которая включает 180-182-nt - ССС ДНК. Однако соответствующие незначительные адаптации стратегии позволит приложения не только поздно обратной транскрипции продуктов, но также других вирусов и систем, где целью является обнаружить 3'-OH, содержащий ДНК заканчивается. Важные ограничения для рассмотрения включают диапазон длины конечного продукта ПЦР в библиотеке; в частности шаблоны, в которых расстояние между адаптер на открытых 3'-Отель terminus и вверх по течению грунтовка сайта превышает ~ 1000 nt будет скорее всего менее эффективно упорядочивать, потенциально представляя заблуждение технические смещения во время подготовки (библиотека смотрите обсуждение для более подробной информации и адаптации предложения).
Ранее сообщалось методы для систематического определения 3'-Термини нуклеиновых кислот пряди были сосредоточены на молекулы РНК, а не ДНК. Одним из примеров является 3' гонка (быстрое амплификация cDNA концы)7, которая опирается на сплайсингу мРНК. Кроме того были разработаны адаптер перевязка-стратегии на основе использования ligases РНК, которые включили RLM-раса (РНК лигаза опосредованной)8 или9КРУЖЕВА (на основе лигирование амплификация cDNA заканчивается). Важно подчеркнуть, что на основе лигирование амплификаций чувствительны к какой-либо предвзятости, представленный реакции перешнуровки сам. Например лигирование может быть более или менее эффективным в зависимости от конкретного нуклеотидной позиции 3', последовательность, длину всего молекулы или местные структуры. Такие предпочтения лигаза привести к неполной захвата молекул и искажение в индикации, которые мы и другие наблюдали9,10. Для сведения к минимуму лигирование предвзятости во время шаги сложения адаптер в протоколе, описанные здесь, мы проверили ряд стратегий перевязки и нашли применение T4 ДНК лигаза с трубчатыми одноцепочечной ДНК адаптер (как описано на Квок и др. 11) быть единственной процедурой с рядом количественных перевязки, которые не привели к значительным различиям в перевязки эффективность при оценке с специально выбранный набор управления олигонуклеотиды6. Выбор этой стратегии перевязки, поэтому, является ключевым элементом в обеспечении успеха этого протокола.
На сегодняшний день, мониторинг прогрессирования ВИЧ-1 RT в инфицированных клетках главным образом достигнуто путем измерения обратной транскрипции продуктов различной длины с количественного PCR (ПЦР) с использованием наборов праймер зонд, измеряющих уникально короче или длиннее (ранних и поздно, соответственно) cDNA продуктов12,,1314. Хотя этот подход ПЦР является целесообразным определить внутреннюю эффективность процесса обратной транскрипции в клеточных системах, выход имеет относительно низкое разрешение, без последовательности полученной. Наш новый подход, на основе оптимизированного адаптер перевязки, ПЦР опосредованной библиотека поколения и глубокой последовательности адреса технологического разрыва и дает возможность контролировать обратная транскрипция во время инфекции ВИЧ-1, количественно и в единичных нуклеотидных резолюции.
Мы продемонстрировали полезность этого метода в исследовании, которое проводится различие между двух предложенных моделей для способности фактором ограничения ВИЧ-1 APOBEC3G (аполипопротеина B мРНК редактирования фермент каталитического полипептид как 3G) вмешиваться с производство вирусных обратный стенограммы6.
протокол
Примечание: Пожалуйста, обратитесь к Таблице материалов для конкретных реагенты и оборудование, используемые в настоящем Протоколе.
1. вирус производство и инфекции клеток
Предупреждение: Инфекционные ВИЧ-1 следует обрабатывать только в утвержденных биобезопасности лабораторий сдерживания.
Примечание: Производство частиц ВИЧ-1 от переходных трансфекции человеческих эмбриональных почки (ГЭС) 293T клетки, как указано в шаг 1.1, является стандартной процедурой и был описан ранее15,16. Общие клеточной культуры, которые являются процедуры описано ранее17.
- Вирус ВИЧ-1 производства.
- Сохранить 293T клетки в Дульбекко изменение Eagle среднего (DMEM) дополнена плода бычьим сывороточным (ФБС) 10% и 1% пенициллина/стрептомицина (полный DMEM) в инкубатор культуры стандартной ячейки при 37 ° C и 5% CO2 как описано ранее,17.
- В стандартной Ламинарный шкаф культуры ткани удалить роста средств массовой информации и добавить 3 мл подогретым (37 ° C) трипсина в 10 см вблизи притока клетки культуры блюдо (~1.2 x 107 клеток) 293T клеток. Блюдо Положите обратно в инкубаторе для 2-3 мин.
- Забрать блюдо из инкубатора в культуре ткани капюшон и добавить 7 мл полной среды. Пипетка вверх и вниз в течение блюдо несколько раз чтобы Ресуспензируйте клетки. Разделение клетки 1:4, добавив 2,5 мл суспензии клеток новое блюдо 10 см и заполнить его с 7,5 мл полной среды.
- На следующий день, смешать с 1 мл сыворотки бесплатные минимальные основные среды 10 мкг proviral ВИЧ-1 плазмидной ДНК (например pNL4.3) и polyethylenimine (PEI) решение (25 000 МВт, 1 мг/мл pH 7) добавить в 4,5 мкл на 1 мкг ДНК. Проинкубируйте втечение 10 мин на RT и добавьте каплям 293T клеток.
- 24 ч после трансфекции, удалите среды и замените 6 мл полное DMEM, содержащих бесплатно РНКазы DNase на 20 средних ед/мл. После 6 часов замените 10 мл полное DMEM среды.
- 48 ч после трансфекции, урожай супернатант и процеживают через фильтр 0,22 мкм, использование шприц 10 мл, 15 мл полипропиленовые трубы.
- Добавьте 2 мл стерильного 20% сахарозы в 1 x-фосфатный буфер (PBS) трубки тонкостенные ультрацентрифуга открытым верхом. Медленно наложение сахарозы с отфильтрованной ячейки супернатант.
- Центрифуги для 1 ч 15 мин на 134 000 x g при 4 ° C, с помощью ультрацентрифугирования.
- Осторожно снимите трубки из ультрацентрифугирования. Медленно снимите супернатант и сахарозы, используя всасывания или пипетки. Использовать меньший пипетки и наклона трубки, когда вывоз последний раствора сахарозы. Оставьте гранулированных вирус в нижней части трубки.
Примечание: Гранулы не будет видна. - 200 мкл ПБС, оставьте в холодильнике для 4 на 12 ч, Ресуспензируйте и заморозить в 20 мкл аликвоты-80 ° c.
- Определить p24Gag контента с использованием ВИЧ-1 антиген p24 ELISA комплект (следующие изготовителя).
- Т-клеточная линия инфекции.
- Культура увековечен линии Т-клеток (например., CEM-SS клетки) в Розуэлле парк Мемориальный институт (RPMI) 1640 среде с 10% FBS и 1% пенициллина/стрептомицина (полный RPMI). Подсчет количества ячеек с помощью Горяева18 и семян 1 хорошо на сэмпл с 1 мл полное RPMI с 2 х 106 клеток/мл в пластине культуры 12-ну формат ячейки.
- Добавить частицы ВИЧ-1 эквивалентна 150 нг p24Gag и место пластину в качается центрифуга ведра с крышками биоизоляции спин-заразить центрифугированием в настольная центрифуга для 2 ч в 2000 x g при 30 ° C.
- Снять пластину из центрифуги и дайте ему отдохнуть в течение 1 ч в инкубаторе стандартной культуры ткани при 37 ° C и 5% CO2.
- Смыть ввода вирус, собрать клетки путем передачи клеточных суспензий microcentrifuge трубы и центрифугирование в microcentrifuge на RT (RT) на 500 x g на 2 мин. Взлет супернатант не нарушая Пелле ячейки.
- Ресуспензируйте гранулы клеток в 1 мл подогретым (37 ° C), стерильные ПБС. Повторите центрифугирования, супернатанта снятие и ресуспендирования шаги и еще два раза.
- Центрифуга снова, удалить супернатант и Ресуспензируйте гранулы клеток в 1 мл полное RPMI. Добавьте каждый подвески одной скважины в новой 12 хорошо пластины.
- В 6 ч после первоначального добавления вируса (4 ч после центрифугирования) урожай клетки центрифугированием, как это сделано в шаге 1.2.4. Снимите и выбросьте супернатант. Гранулы клетки может быть замороженные при температуре-80 ° C или обрабатываются непосредственно для экстракции ДНК.
2. ДНК добычи, количественного определения ДНК ВИЧ-1 и обогащение Hybrid Capture
- Извлечь клеточных ДНК с крови и тканей всего комплект экстракции ДНК, следуя руководству комплект для клетки культуры ткани. Единственным изменением является элюции в 200 мкл нуклеиназы свободный H2O вместо предоставленный Элюирующий буфер.
Примечание: После добавления chaotropic лизис буферу (комплект «Аль») и протеиназы, образцы можно быть удалены из лаборатории биобезопасности сдерживания и обрабатываются в стандарт безопасности уровня лаборатории для остальной части протокола. - Определите количество cDNA ВИЧ-1 копия, ПЦР.
- Возьмите 17 мкл элюата от шаг 2.1 и 2 мкл 10 x буфер энзима ограничения вместе с 1 мкл ДПНИ энзима ограничения. Инкубируйте 1 час при 37 ° C, чтобы удалить любые потенциальные остаточные ввода плазмидной ДНК из transfection.
- Выполнять ПЦР для минус стренги сильный стоп cDNA, используя следующий набор зонд грунтовка: oHC64 (5 ' taactagggaacccactgc-3′) и oHC65 (5 ' gctagagattttccacactg-3′) и зонд oHC66 (5′-FAM-acacaacagacgggcacacacta ТАМРА 3′). ПЦР установки и точные условия можно найти ссылки на6,13. Увлечь образцы с последовательным разрежения pNL4.3 proviral плазмиды как стандартной кривой для определения номеров копии cDNA молекул.
Примечание: Смотрите обсуждение для ожидаемого количества.
- Обогащение Захват гибридной ДНК ВИЧ-1.
Примечание: Этот шаг вперед, желательно использовать microcentrifuge трубы с низкой нуклеиновой кислоты свойства привязки, а также аэрозольный фильтр наконечники для всех образцов ДНК. Если это возможно работе в рабочей станции PCR. Все шаги и реагенты находятся на RT (RT), если не указано иное.- Подготовить мастер смесь магнитных стрептавидина бусы, Пипетка 100 мкл бусы на сэмпл в одном microcentrifuge трубку. Поместите трубку на магнит подходит для microcentrifuge трубы.
- После того, как бусы поселились в сторону магнит трубки (~ 1 мин), снять буфер хранения, извлеките трубку из магнита и Ресуспензируйте бусины в 500 мкл bind и выстирать буфера (BW буфера, 5 мм трис-HCL pH 7.5, 0.5 мм ЭДТА 1 М NaCl) мыть.
- Установите трубку обратно на магнит, удалить супернатант и добавьте 500 мкл раствора казеина. Магнита, Ресуспензируйте и проинкубируйте втечение 10 мин на RT, а затем вымыть с буфером BW.
Примечание: Мыть относится к размещение трубки на магните, снимая супернатанта, принимая трубку от магнита, добавив буфер и resuspending. - Положите трубку на магнит, снять супернатант и Ресуспензируйте бусины в 500 мкл буфера BW. Добавьте 50 пмоль каждого захвата биотинилированным олигонуклеотиды (см. таблицу 1, три oligos в этом случае) на сэмпл. (Например, если 5 образцов ДНК, чтобы быть обработаны, используйте 500 мкл магнитные бусы из шаг 2.3.1 и 250 пмоль каждого олигонуклеотида).
- Инкубируйте 30 мин на RT во время качания в микшер над конца.
- Вымойте бусины с иммобилизованными олигонуклеотиды два раза с 500 мкл 1 x 10 буфера (10 мм Tris-HCl рН 8,0, 1 мм ЭДТА, 100 NaCl).
- Ресуспензируйте бусины в 10 мкл 1 x 10 буфера на сэмпл.
- Для каждого образца, пометьте один microcentrifuge пробирку и добавить 10 мкл бусины подвеска, 170 мкл ДНК (из шага 2.1) и 90 мкл 3 x 10 буфера. Инкубируйте в блоке сухого тепла в 92 ° C на 2 мин денатурировать ДНК.
- Перемещение трубы различных сухим теплом блок, который установлен в 52 ° C, и инкубировать 1 ч. Инверсия смешивать регулярно (~ каждые 10 минут) во время этой инкубации.
- Раз промойте 500 мкл 1 x 10 буфера и Ресуспензируйте в 35 мкл свободной от нуклеиназы H2O.
- Для элюировать, Инкубируйте трубы на 92 ° C в блоке сухого тепла на 2 мин. Затем быстро переместить трубы на магнит (одна трубка в то время). После того, как бусы привязаны к стороне трубки, передачи супернатанта, содержащий ДНК ВИЧ-1 в свежий трубку.
- Дополнительно: Повторить ПЦР (как это сделано в шаге 2.2.2) для определения восстановленного cDNA ВИЧ-1.
Примечание: Смотрите обсуждение для ожидаемого количества.
3. адаптер лигирование
- Подготовка адаптер
- Ресуспензируйте лиофилизированные адаптер (см. Таблица 1 «полное Квок + MiSeq») на 100 мкм в свободной от нуклеиназы H2O.
- В образце плюс один контрольный образец, объединить 0,45 мкл 10 x T4 ДНК лигаза буфер, 4 мкл адаптер и 0,05 мкл нуклеиназы свободный H2O. тепла до 92 ° C в течение 2 минут и дайте остыть медленно.
Примечание: Если доступен параметр используйте машину ПЦР с регулируемой скорости охлаждения (использование ставка 2%). Это занимает около 30 минут от 92 ° C до 16 ° C. Альтернативно используйте блок сухого тепла на 92 ° C и выключить. Вынуть адаптер mastermix когда блок тепла обратно на RT. Это позволить сформировать структуру шпилька адаптер (см. Рисунок 2b).
- Подготовка элемента управления реакции с набором синтезированные олигонуклеотиды (см. таблицу 2) вместо ДНК, извлеченные из клеток.
- Сделайте запасы 100 мкм каждого олигонуклеотида. Смешайте 1 мкл каждого из 17 oligonucelotides и 8 мкл H2O эквимолярных соотношение в окончательный объем 25 мкл.
- Разбавьте смесь 1:2,500 в свободной от нуклеиназы H2O в серийный разрежения. Объединить 1 мкл смеси с 17,3 мкл нуклеиназы свободный H2O для использования в перевязки образца управления в шаге 3.3.1 так, чтобы каждый олигонуклеотида присутствует на 1.6 фмоль (эквивалентно 0,026 Нм в реакции 60 мкл).
- Настройка перешнуровок
- Для 60 мкл окончательный объем реакции в пробирках, ПЦР объединить 6 мкл 10 x T4 ДНК лигаза буфера, 24 мкл 40% PEG, 6 мкл 5м бетаин, 4.5 мкл (400 пмоль) адаптер (pre-annelead как шаг 3.1.2), 1.2 мкл T4 ДНК лигаза (2.000.000 единиц/мл) и 18,3 мкл ДНК (от Шаг 2.3.11)
Примечание: Будьте особенно внимательны с вязкой решений, таких как 40% PEG для поддержания точных томов. Не делать mastermix. - Настройте такую же реакцию, как выполняется на шаге 3.3.1 но смесью управления олигонуклеотида, подготовленную на этапе 3.2.2.
- Хорошо перемешайте реакции и инкубировать в машину ПЦР на 16 ° C на ночь.
- Для 60 мкл окончательный объем реакции в пробирках, ПЦР объединить 6 мкл 10 x T4 ДНК лигаза буфера, 24 мкл 40% PEG, 6 мкл 5м бетаин, 4.5 мкл (400 пмоль) адаптер (pre-annelead как шаг 3.1.2), 1.2 мкл T4 ДНК лигаза (2.000.000 единиц/мл) и 18,3 мкл ДНК (от Шаг 2.3.11)
4. адаптер удаления и размер разделение
- Денатурирующий гель-электрофорез
- 30 мкл формамид содержащих ДНК геля загрузки буфер для каждой реакции перешнуровки. Смешайте хорошо закупорить.
- Тепло в течение 2 мин на 94 ° C в ПЦР машины, а затем немедленно положить на льду.
- Место сборного 6% трис/Борат/ЭДТА (КЭ) денатурируя мочевины геля полиакриламида (10-Ну гребень) в соответствующие гель танк. Добавить 1 x TBE (89 мм трис база, 89 мм борной кислоты, 2 мм ЭДТА) идущий буфер и предварительно запустить гель для 20 мин 250 V/Макс постоянной.
- Промойте гель карманы с запуском буфера, используя шприц и игла 21G.
- Нагрузки каждый 90 мкл пример в три скважины (30 мкл на хорошо) и запустить за 20 мин (250 V/Макс.) до темно синий краситель фронт собирается на полпути через гель.
- Окрашивания и резки нуклеиновые кислоты от геля
- Подготовьте 3 небольших microcentrifuge трубок (0,5 мл) на сэмпл, тыча отверстия в дне, с помощью шприца игла 21 G (Возьмите осторожность во время работы с колюще-режущие предметы). Каждый подготовленный трубок Вставьте пробки microcentrifuge 2.0 мл и маркировать их с имя выборки плюс «низкое», «средний» или «высокий».
- Возьмите и откройте кассетный геля. Вырежьте гель вертикально с лезвием бритвы, чтобы щедро акцизных полосы с 3 скважины загруженных образцов. Добавьте в гель газа контейнер с 1 х кэ (около 30 мл) и 5 мкл цианиновые пятен нуклеиновой кислоты. Инкубируйте 3-5 мин.
Примечание: Шаг извлечения геля особенно чувствителен к перекрестного загрязнения. Рекомендуется запускать только 1 образец в гель и с помощью отдельного, чистый контейнер для каждого Пятнать геля. Перчатки должны быть изменены, если частицы геля контакт перчатках пальцы. - Очистить поверхность голубой свет transilluminator тщательно с ddH2O. Возьмите кусок гель из контейнера окрашивание и добавить его в поле света.
- Включите поле света и осмотрите окрашенных нуклеиновые кислоты через оранжевый фильтр.
Примечание: Адаптер обычно появляется перегруженных и работает как большой «капля» с перевязаны ДНК ВИЧ-1, запуск выше как полоса. - С помощью нового лезвия бритвы, срезаем по бокам гель, если есть области с не образца загружены еще присутствует. Далее вырежьте чуть выше адаптера, чтобы удалить адаптер и Нижняя гель частей. Наконец срезаем самом верху геля, в том числе около 1 мм геля карманы, которые часто имеют резкий интенсивной сигнал более высокой молекулярной массой ДНК.
- Разделить оставшихся кусок гель, содержащий образец, который обычно ~ 2 x 3 см в размер по горизонтали на три даже кусочки: «низкая», «середины» и «высокомолекулярный» районах.
Примечание: Каждый кусок будет теперь осуществляться отдельно [т.е., там будет три трубки (низкий, средний и высокий)] на исходный образец. - Cut каждый из трех гель фрагментов на более мелкие куски (~ 2 x 2 мм частицы) и перенести их в штуцере microcentrifuge prepped 0,5 мл (шаг 4.2.1).
- Спина на максимальной скорости с открытой крышки для 1 мин выжать гель штук через отверстие в 2-мл пробирку для создания геля слякоть. Если любой гель частицы остаются в нижней части трубки 0,5 мл, передавать их в 2-мл пробирку, вручную с помощью кончика иглы или пипетки.
- Экстракции ДНК
- Добавьте 1 мл раствора мочевины гель извлечения буфера (0,5 М NH4CH3CO2, 1 мм ЭДТА, 0,2% SDS) гель слякоть. Поворот трубы для минимум 3 часа (ночь приемлемо) на RT-над конца миксером.
- Используйте чистую набор пинцетов добавить один небольшие круглые стеклянные волокна фильтра центрифуги столбцы с ацетат целлюлозы мембранные фильтры (0,2 мкм), что позволяет избежать засорения мембран. Установите фильтр в место с наконечником Перевернутый пипеткой.
- Кратко спина 2 мл пробирок с гель слякоть и извлечения буфер в microcentrifuge и передачи 700 мкл супернатант подготовленный фильтр столбцов. Держите гель слякоть и оставшиеся супернатант.
- Центрифуга для фильтрации столбцов в microcentrifuge за 1 мин передачи проточные в новые пробки microcentrifuge 2.0 мл с максимальной скоростью.
- Перезагрузите столбцы с оставшихся супернатант. Постарайтесь получить как можно больше жидкости от добычи слякоть. Передача части гель не является проблемой. Спина снова и объединить flowthroughs же извлечения образцов.
- Высыпание дна
- 3 мкл поля РНК (1 мкг/мкл; как перевозчика), 1 мкл гликогена и 0,7 мл изопропанола проточные из шага 4.3.5. Вихревой кратко и замораживания при температуре-80 ° C ночь.
- Отбора проб из морозильника-80 ° C и пусть они кратко оттепель. Положите их в microcentrifuge охлаждением (4 ° C) и спина на 30 минут на максимальной скорости.
- Снимите и выбросьте супернатант. Будьте очень осторожны, чтобы не удалить гранулы. Если неясно, что гранулы будут удалены в противном случае оставьте 30-50 мкл жидкости.
Примечание: Обычно все «высокий» образцы показывают более заметными Пелле чем образцы «середины» и «низкий». - 800 мкл 80% этанола. Инвертируйте трубы и спин снова за 1 мин на максимальной скорости. Удалите часть этанола с пипеткой, кратко спин трубы снова и больше этанола с меньший объем пипетки.
- Пусть все оставшиеся этанола испаряются, поместив трубки с открытой крышкой в блок сухого тепла 55 ° C. Когда образцы, сухой (2-4 мин)-20 мкл от нуклеиназы свободный H2O и распространения вокруг нижней части трубки для обеспечения ДНК Пелле растворяется. Образец ДНК может храниться при температуре-20 ° C.
5. ПЦР-амплификации и подготовка библиотеки
- Настройка реакции PCR 40 мкл с 20 мкл предварительно смеси ДНК-полимеразы, 18 мкл ускорили и перерастворить ДНК из шага 4.4.5, 1 мкл вперед грунтовка «MP1.0 + 22HIV» (10µM) (см. таблицу 1) и 1 мкл мультиплекс oligo грунтовки (индекс грунтовки 1-24) (см. таблицу Ма ском).
Примечание: Запуск трех реакций (низкий, средний, высокий) каждого образца в отдельном реакциях PCR, но с тем же индексируются грунтовка. Используйте другой индекс для каждого из оригинальных образцов инфекции.- Запустите ПЦР-реакции при следующих условиях: 2 мин при денатурации 94 ° C, а затем 18 циклов PCR 3-шаг; 15 s на денатурации 94 ° C, 15 s отжига при 55 ° C и 30 s расширение на 68 ° C.
- Как вариант контроля качества анализа ПЦР-реакции с автоматизированный высокочувствительного системы электрофореза геля. Возьмите 2 мкл низкий, середине и высокий образец для запуска согласно инструкции производителя.
Примечание: Две грунтовки должны быть видны и часто выполнения вычисляемых длиной около 45 и 95 nt (фактическая длина отличается). Кроме того, должны быть обнаружены ДНК от 150 до 500 nt. Если сигнал не присутствует, это целесообразно для добавления дополнительных циклов PCR, между 2 и 10 дополнительных циклов. Не добавляйте дополнительные циклы для олигонуклеотида контрольных образцов, созданных в шаге 3.3.2. - Для удаления праймеры используют систему очистки парамагнитных шарик на основе ПЦР.
- Возьмите 20 мкл каждого реакции PCR и бассейн образцы вместе (смешать все образцы на данный момент). Заморозить остальные 20 мкл реакции как резервные копии при-20 ° C.
- Пусть парамагнитных бусины приходят к RT и смеси объединения реакций PCR с 1.8 x объем раствора из бисера. Смешать, закупорить и инкубировать в течение 5 мин.
Примечание: Как пример, если 4 образцы были подготовлены и каждый имеют низкий, в середине и высокой реакции, объем будет 4 x 3 x 20 мкл = 240 мкл ПЦР-реакции с раствором шарик 432 мкл. - Трубы на магнит пробки microcentrifuge, пусть бусы привязки для ~ 1 мин и снимать супернатант отказаться. Оставьте трубы на магните и 500 мкл 80% этанола.
- Оставьте этанол 30 сек, затем взлет тщательно и пусть бусы airdry за ~ 5 минут добавить 40 мкл нуклеиназы свободный H2O, возьмите трубы от магнита и Пипетка вверх и вниз несколько раз.
- Оставьте подвеска для 5 минут положить трубку обратно на магните, пусть бусы поселиться в сторону и передать новой трубки супернатант. Это библиотека. Возьмите 10 мкл аликвота для контроля качества и заморозить остальные-20 ° c.
6. Оценка библиотеки
- Определите качество Библиотека, концентрации и Молярность.
- Используйте метод флуориметрический количественной оценки. Мера 1 мкл и 3 мкл библиотеки с высокой чувствительностью dsDNA пробирного комплект в соответствии с инструкциями производителя.
Примечание: Типичные концентрации находятся между 1 и 10 нг/мкл. - Мера библиотеки ДНК молекулярной массой спектра, высокая чувствительность автоматизированных электрофорез геля, как описано выше (шаг 5.2).
- Использование автоматизированных гель электрофореза анализ, чтобы определить средний молекулярный вес библиотеки и вычисления для разбавления библиотеки в свободной от нуклеиназы H2O 4 Нм. Несколько библиотек могут быть объединены, пока все индексы являются уникальными.
- Используйте метод флуориметрический количественной оценки. Мера 1 мкл и 3 мкл библиотеки с высокой чувствительностью dsDNA пробирного комплект в соответствии с инструкциями производителя.
- Контроль качества Факультативный низкая пропускная способность
- Подвергайте библиотеки ДНК TA клонирования19 для вставки библиотека молекул в векторы для амплификации. Следуйте инструкциям комплекта, вырастают ~ 10-20 колоний и экстракт ДНК через алкалический протоколы, как описано здесь20.
- Последовательности вектор с использованием местных последовательности служб и проверьте, вставки, которые содержат нужный ВИЧ-1 полученные последовательности и библиотека конкретные адаптеры.
7. высокопроизводительного секвенирования Run
- Создайте лист образца последовательности с коммерческого программного обеспечения, поставляемого с платформой виртуализации.
- Укажите набор выбранной последовательности. Как правило, выбирают набор 150-цикла, но другие подходят в зависимости от желаемой длины чтения.
- Выберите «Только Fastq» в качестве приложения рабочего процесса. Выберите один из шаблонов, которые содержит 24 индексов в мультиплекс олигонуклеотида наборы (указано в руководстве комплект).
- Выберите «25 nt» для Read1 и «125 nt» для Read2. Держите 6 nt для единого индекса читать.
Примечание: В доме анализа только Read2 используется в анализе. Сохранить Read1 как минимум 25 nt для виртуализации платформы алгоритм целей.
- Следуйте инструкциям производителя именно для подготовки предварительного запуска библиотеки и установки. Выбрать максимум 20 pM концентрации и использование Спайк PhiX 15%, как библиотека является очень низкой сложности.
8. анализ данных
- Проверьте, если пропуск фильтра процент и средняя оценка качества Q30 являются приемлемыми согласно виртуализации платформы изготовителя.
Примечание: Фильтр обычно > 90% и Q30 оценки, как правило, > 80%. - Скачать. fastq.gz файлы от производителя последовательности хаб.
- Настройка сценария виртуализации
- Создайте новый каталог (папку) под названием «AnalysisXYZ» и перейдите к https://github.com/malimlab/seqparse для загрузки всех файлов исходного кода (parse_sam.pl, rc_extract.pl, parse.sh) в этот каталог.
- Скачайте короткое читать aligner Bowtie, версия 1.1.2, от http://bowtie-bio.sourceforge.net/index.shtml в ту же директорию.
- Скачать создает подкаталог в «AnalysisXYZ», названный «Боути-1.1.2». В этом каталоге откройте подкаталог «индексы» и скачать последовательности предоставленный шаблон, состоящий из 6 файлов с расширениями .ebwt.
- Скачайте FASTQ/A короткие читает предварительной обработки Инструментарий fastx-0.0.13 из http://hannonlab.cshl.edu/fastx_toolkit/download.html в папку «AnalysisXYZ».
- Скачайте Samtools (https://sourceforge.net/projects/samtools/files/) и bam-readcount (https://github.com/genome/bam-readcount) в папку «Документы».
- Переместить. fastq.gz файлы, загруженный на шаге 8.2, всех читать 2s (заканчивающийся в... _R2_001.fastq.gz) в папку «AnalysisXYZ».
- Откройте консоль/терминал команды. Перейти к «AnalysisXYZ» как текущий каталог с помощью команды cd. Тип «./parse.sh.» для запуска сценариев.
- Найти .csv файлы с резюме для всех образцов на всего чтения графов, отрегулировать длину читать отсчетов и нормализует чтения графов, а также файлы с базовый вариант для каждого образца в каталог с именем parse_results в каталоге «XYZ анализ».
Примечание: Смотрите обсуждение для получения дополнительной информации о процессе анализа. Скрипт возвращает CSV-файлов с всего читает для Каждый нуклеотид вдоль последовательности ВИЧ-1NL4.3 сильный стоп и первая передача прядь до нуклеотидов 635. Как руководство 50000 до 100000 уникальных читает обычно наблюдается в пробах инфекций с указанной ячейке чисел и вирусных инокуляты и без противовирусное белки или соединений. Пример элемента управления олигонуклеотида обычно производит читает 100 000 до 200 000.
Результаты
Метод, описанный в этой статье был применен к более широкого исследования для решения лежащих в основе ингибирования ВИЧ-1 обратной транскрипции по антиретровирусной человеческий белок APOBEC3G (A3G) механизмы6. Рисунок 3 показывает представитель результаты, полученные после применения протокола в пробах CEM-SS T-клетки, инфицированные с vif-дефицит ВИЧ-1 в отсутствие или наличие A3G. Общее количество уникальных читает, полученные от каждого образца после отфильтровывать дубликаты PCR которые имеют же 6 nt штрих и одинаковую длину (выполнены анализ программного обеспечения, предоставляемого) строятся на рисунке 3. Повышение уровня A3G сократить общее число чтения, отражающие тормозящий эффект A3G на синтез cDNA RT опосредованной рассказывал ранее и измеряется ПЦР-6,-13,-21,-22. В рисунке 3bпоказана часть молекул в каждой возможной длины в пределах первого 182 nt. Для инфекции ВИЧ-1 в отсутствие A3G, наиболее распространенных видов является основным 180 nt сильный стоп самой молекулы, с некоторым накоплением гласит в короткие диапазоне (23 до 40 nt) (Топ граф, синий гистограммы). Добавление A3G изменений, которые этот профиль, как резкое увеличение короче, отброшенный cDNA молекул в несколько очень конкретных, воспроизводимые позиций является обнаружено (среднего и нижнего графиков). Так как A3G Цитидин Аденозиндеминазный, цитозин уридина (определяемых как C-к Т) когда A3G присутствует в заражении вирионы21,,2324происходят мутации в cDNA. Используя полученные последовательности информации, процент мутаций C-к Т был заговор на одном графике (красная пунктирная линия). Следует отметить, что мутационного профиль является производным от всех уникальных комбинированных читает и освещение Каждый нуклеотид будет меняться. Однако если требуется информация о последовательности могут быть связаны обратно в каждой молекуле и коррелирует с конкретным 3'-Отель terminus. Представленные данные были взяты из Pollpeter и др. 6 и корреляция между мутационного и cDNA длина профилей был продемонстрирован быть из-за обнаружения и расщепление deaminated cDNA клетчатыми ДНК ремонт оборудования.
Положительный контроль для 3'-картирования подход легко может производиться путем обработки пул синтетические олигонуклеотиды известных последовательность, длину и концентрации. Этот элемент управления добавляется в адаптер перевязка в шаге 3.3.2 и советуют быть включены во всех библиотеках мультиплексированных. Данные, полученные из образца управления должны иметь все олигонуклеотиды ожидаемых входных коэффициенты, с только очень незначительные фон читает. Рисунок 4 показывает результаты положительный контроль набора 17 химически синтезированные олигонуклеотиды (для последовательностей, см. таблицу 2), которые были смешаны в эквимолярных соотношениях. Как и ожидалось, все молекулы появляются в почти равных изобилия с только небольшие вариации (Верхний график). Хотя большинство должностей в пределах последовательности ДНК - ССС, которые не были представлены олигонуклеотида возвращать нулевой чтения графов, мы наблюдали мелких видов, которые являются 1 или 2 nt, короче, чем фактическим контролем олигонуклеотидов. Мы далее не расследование этих незначительных видов, но предположим, что они представляют деградированных или неполной продуктов, потенциально присутствующих в предоставленный олигонуклеотида акции при покупке (олигонуклеотидов были заказаны как ВЭЖХ очищенный, для которого Производитель указывает чистоты > 80%). На нижней диаграмме пример элемента управления от другой библиотеки, запуска, где колебания немного выше между 17 олигонуклеотиды и коррелирует с общей длиной в том, что больше контроля молекул обнаруживаются более эффективно, а затем коротких. Это может быть из-за незначительных уклоном в реакциях PCR или в кластере при виртуализации MiSeq, который имеет оптимальный размер вставки и может произойти с библиотеками, перевозящих особенно широкий вставка диапазонов. Основной способ решения этой предвзятости является применение коэффициента нормализации, основываясь на склоне, что указывает на предвзятость, соотнося молекулы длины (розовая линия). Необходимые расчеты, включены в программы анализа (см. шаг 8.3 в протоколе).

Рисунок 1: Диаграмма, показывающая первые шаги ВИЧ-1 обратный транскрипции. Процесс начинается с отжиг tRNA(Lys,3) (оранжевый) на сайт связывания праймера (PBS) в геномной вирусной РНК (шаг 1), который позволяет посвящения и удлинение вирусных cDNA (синий, шаг 2). Сопутствующе обстоятельств шаблон геномной РНК разлагается на RNaseH активность RT (шаг 3). Первый полный промежуточного процесса обратной транскрипции это минус стренги сильный остановка (-) sss cDNA, который завершается, когда RT катализировано полимеризации достигает 5'-конечная регионе gRNA повторить (R) (шаг 3). Sss (-) промежуточные передается 3'-конечная шаблоне геномной РНК путем отжига в дополнительных терминала 3'-Лонг повторить (LTR) R регион. Отсюда полимеризация продолжается (шаг 4). В методе описанных обратной транскрипции прогрессии определяется путем сопоставления точную длину зарождающейся вирусный cDNA (синий). PPT, polypurine тракт; U5, уникальный 5'-последовательности; U3, уникальный 3'-последовательности. Эта цифра публикуется от предыдущей публикации6. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
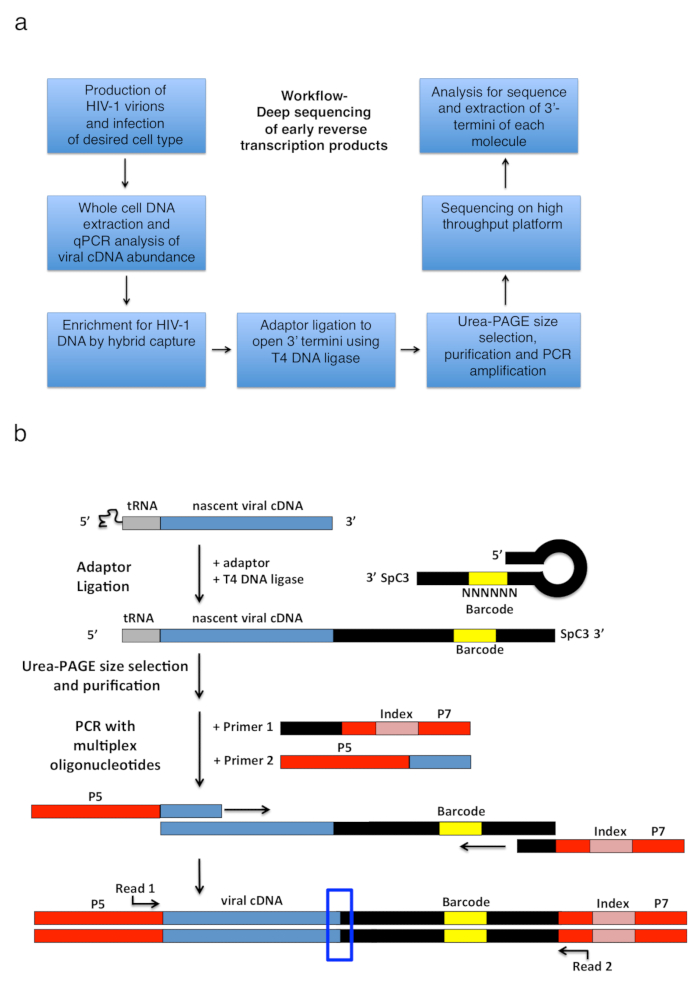
Рисунок 2 : Структура рабочего процесса и схемы адаптер перевязки и стратегии амплификации PCR. () рабочего процесса структурирования основные шаги описаны методики для определения 3'-Термини ВИЧ-1 обратный стенограммы в инфицированных клетках. Рисунок заимствован из предыдущей публикации6. (b) схемы перешнуровка переходник и стратегии амплификации PCR. Нарождающейся cDNA молекул различной длины, которые были очищены в предыдущих шагах лигируют одноцепочечной ДНК-адаптер с помощью T4 ДНК лигаза. Шпилька адаптер (именованные «полный Квок + MiSeq», см. таблицу 1) дизайн был вдохновлен Квок и др. 11. адаптер носит случайный 6 nt штрих последовательность, которая позволяет для спаривания базы для облегчения перевязки и одновременно служит в качестве идентификатора для уникальных операций чтения. 3'-Термини адаптера носит распорку (SpC3) для предотвращения самолигирование. Перевязаны продуктов отделены от избыточного адаптер денатурации электрофореза геля полиакриламида (страница). Нуклеиновые кислоты в геле витражи и нарезать три отдельных, одинаковых по размеру геля в районе сверху адаптер к колодцу, как это сделано в25. После элюции, осадков и ресуспендирования, продукция ПЦР, усиливается с праймерами, отжиг в известных последовательность адаптер (праймер 1 мультиплекс олигонуклеотида комплект, смотрите Таблицу материалы) и грунтовка, перевозящих первый 22 nt ВИЧ-1 5'-LTR последовательность сразу же после tRNA (грунтовка 2, MP1.0 + 22HIV). 5'-Термини праймеров выбранной нести адаптеров для выбранной последовательности платформы (P5 и P7) а также последовательность индексов различать отдельные образцы, работать в той же библиотеке. Отправной точки последовательности чтения указаны грунтовки. Синий ящик показывает региона интерес определить оригинальный 3'-Термини захваченных молекулы. Эта цифра адаптирована от предыдущего издания6. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
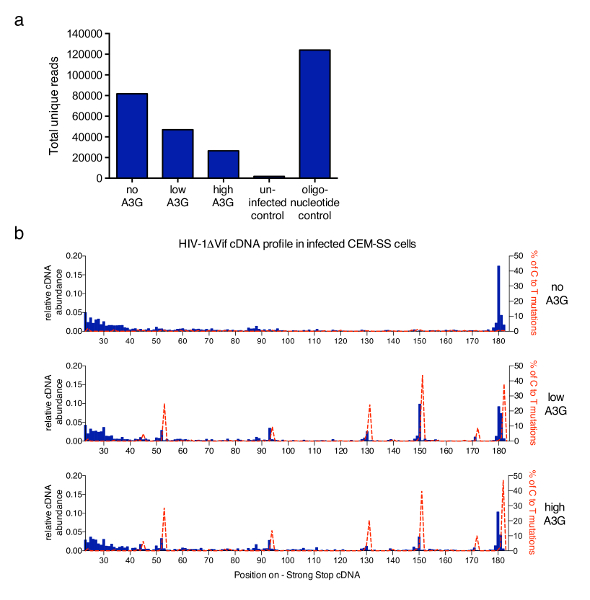
Рисунок 3 : Представитель результаты. (читать число репрезентативных выборок, обработанных с описанной протоколом. Это включает в себя все последовательности, которые были определены как уникальный читает ВИЧ-1 молекул с их 3'-Термини в течение первых 635 nt минус прядь cDNA (до PPT, см. Рисунок 1). Инфицирование ВИЧ-1, не перевозящих A3G дает наибольшее количество операций чтения, в то время как A3G угнетает синтез cDNA и тем самым уменьшает общее чтение всего. Неинфицированных клеток служил отрицательный контроль, в то время как набор синтетические олигонуклеотиды обеспечивает положительный контроль. b относительное обилие cDNAs для каждой длины между позициями nt 23 и 182 (полнометражный - ССС cDNA-180-182 nt) из ВИЧ-1NL4.3 последовательности (ось x) показано в синие гистограммы (шкала по левой оси y). Относительное обилие cDNA рассчитывалась из абсолютное количество последовательностей завершающий в данной нуклеотидов в пределах последовательности кДНК - ССС, делится на сумму всех гласит, измерения 182nt или меньше. Показано в красные пунктирные линии являются проценты читает, перевозящих C-T/U мутации в соответствующей позиции (шкалы на оси y правой–). Рисунок 3 b публикуется от предыдущей публикации6. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
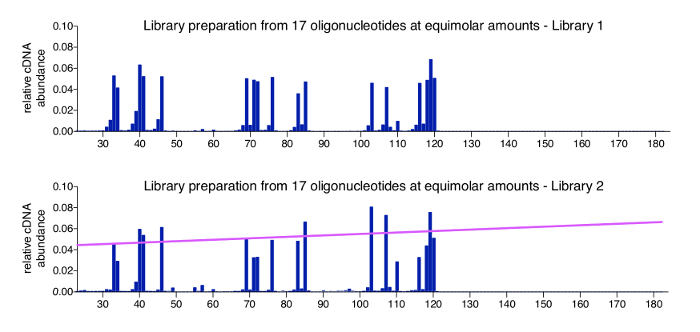
Рисунок 4 : Представитель результаты контрольных образцов. Изображены два профиля для бассейнов, содержащих эквимолярных количествах 17 разной длины синтетические олигонуклеотиды. Эти олигонуклеотиды, последовательности от ВИЧ-1NL4.3 и были отобраны для покрытия различных длин и представить все 4 базы как 3'-нуклеотидов (см. таблицу 2). Верхний график показывает пример позитивного управления из рис. Обнаружен не значительный уклон в сторону длина молекулы или открытых 3'-Термини. На нижней диаграмме различные библиотеки, запуска, которые произведены незначительные длина уклоном в последовательности. В этом случае целесообразно применить коэффициент нормализации, который является производным от склона (показано в розовом), представляющий размер смещения. Эта цифра публикуется от предыдущей публикации6. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Имя oligo | Длина в nt | Последовательность | Цель | Производитель (очистка) | ||||||||||||||
| полное Квок + MiSeq | 61 | 5'-ФО tgaagagcctagtcgctgttcannnnnnctgcccatagagagatcggaagagcacacgtct-SpC3-3' | Адаптер | IDT ДНК-технологий (HPLC) | ||||||||||||||
| 2xBiotin СС приманки | 40 | 5'-биотин cagtgtggaaaatctctagcagtggcgcccgaacagggac биотин-3' | Гибридные захват | MWG Eurofins (HPLC) | ||||||||||||||
| Ss биотин 1-16 | 22 | 5'-cagtgtggaaaatctctagcag-BiTEG-3' | Гибридные захват | MWG Eurofins (ВЭЖХ | ||||||||||||||
| Биотин тРНК + КТГ | 16 | 5'-cagtggcgcccgaaca-BITEG-3' | Гибридные захват | MWG Eurofins (HPLC) | ||||||||||||||
| MP1.0 + 22HIV | 82 | 5'-aatgatacggcgaccaccgagatctacactctttccctacacgacgctcttccgatctcactgctagagattttccacactg-3' | Амплификации PCR | MWG Eurofins (ВЭЖХ | ||||||||||||||
Таблица 1: таблица олигонуклеотиды, включая длину, последовательности и модификаций, которые используются в протоколе описаны. Таблица адаптирована от предыдущего издания6. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу в виде файла excel.
| Имя oligo | Длина в nt | Последовательность | Производитель (очистка) | |||||||||||||
| ПВТ кон длинные C | 120 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactttgagcactcaaggcaagctttattgaggcttaagc-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ кон длинные G | 119 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactttgagcactcaaggcaagctttattgaggcttaag-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ кон длинные T | 116 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactttgagcactcaaggcaagctttattgaggctt-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ con длинные A | 118 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactttgagcactcaaggcaagctttattgaggcttaa-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ con середины C | 76 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcac-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ con середине G () | 71 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacg-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ con середине G (b) | 72 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgg-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ con середине A | 69 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacaga-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ con середине T | 85 | 5'-ctgctagagattttccacactgactaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactt-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ короткие A con | 40 | 5'-ctgctagagattttccacactgactaaaagggtctgaggga-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ кон короткие T | 33 | 5'-ctgctagagattttccacactgactaaaagggt-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ кон короткие G | 41 | 5'-ctgctagagattttccacactgactaaaagggtctgaggg-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ кон короткие C | 34 | 5'-ctgctagagattttccacactgactaaaagggtc-3' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ Con 46 (T) | 46 | actaaaagggtctgagggatctct-3, 5'-ctgctagagattttccacactg' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ Con 83 (C) | 83 | actaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactac-3, 5'-ctgctagagattttccacactg' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ Con 103 (C) | 103 | actaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactttgagcactcaaggcaagc-3, 5'-ctgctagagattttccacactg' | MWG Eurofins (HPLC) | |||||||||||||
| ПВТ Con 107 (A) | 107 | actaaaagggtctgagggatctctagttaccagagtcacacaacagacgggcacacactactttgagcactcaaggcaagcttta-3, 5'-ctgctagagattttccacactg' | MWG Eurofins (HPLC) | |||||||||||||
Таблица 2: Таблица 17 синтетических управления олигонуклеотиды, используется в качестве образца позитивного управления. Топ 13 олигонуклеотиды были выбраны на основе размера [длинный (116 – 120 nt), середина (69-85 nt), короткие (33-41 nt)] а также их 3'-Термини. Таблица адаптирована от предыдущего издания6. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу в виде файла excel.
Обсуждение
Наличие быстрое, надежное и рентабельное секвенирования глубоко изменила многие аспекты в области наук о жизни, позволяя большую глубину в последовательности на основе анализа. Нерешенная проблема заключается в инновационный дизайн и создание представитель последовательности библиотеки. Здесь мы описываем протокол для захвата зарождающейся вирусный cDNA молекул, специально интермедиатов процесса обратной транскрипции ВИЧ-1.
Наиболее важным этапом в этой стратегии является перешнуровка переходник для открытых 3'-Термини в количественных и беспристрастной основе. Эффективность перешнуровок между двумя ssDNA Термини, оба Интер- и внутримолекулярного, расследованы и оптимизирована для различных приложений11,26,27,,2829. Выбор между использованием шпилька адаптер с T4 ДНК лигаза на условиях, описанных в шаге 3.3 является результатом эмпирических оптимизации, в которых мы оценивали разные ligases, адаптеров и реагенты для перевязки синтетические олигонуклеотиды представляющих Последовательности ВИЧ-1 (Таблица 2) (данные не показаны). В этих в vitro тест реакции, в мы подтвердили, что T4 ДНК лигаза опосредованной лигирование шпилька адаптер, как описано на Квок и др. 11, имеет очень низкий уклон и достигает около полной перевязки акцепторные молекулы, когда адаптер используется в избытке. Лигирование эффективность была независимость путем добавления нуклеотидной последовательности для отрисовки адаптер совместимый для системы уплотнения грунта (см. Рисунок 4). Для сравнения мы обнаружили, что термостабильные 5' ДНК/РНК лигаза («Лигаза A», см. Таблицу материалов для точного ligases, по сравнению здесь), который является инженерии лигаза РНК, была разработана отчасти улучшить эффективность перевязки с ssDNA как акцептор 27, был действительно более эффективным в безлигатурные две молекулы ssDNA чем РНК лигаза («лигаза B»), но был значительным уклоном, с сильным различия в эффективности лигирование даже олигонуклеотиды с одной базовой длины различия [в таблице 2 ; ПВТ con середине G (а) и (b)]. Кроме того, мы нашли только минимальный уклон в реакциях с «Лигаза C» в сочетании с адаптером проведение рандомизированных 5'-Термини (стратегия для компенсировать известные нуклеотидов смещения «Лигаза C»; см. например Дин и др. 30). Однако, «Лигаза C»-опосредованной межмолекулярных перешнуровок были неполными, рендеринга системе T4 ДНК лигаза наилучший выбор.
Несколько этапов контроля качества за курс протокола и включение положительной и отрицательной контроля позволяют для обнаружения потенциальных проблем до продолжения анализа и дать указания по устранению неполадок усилия. Количественной ПЦР в шагах 2.2.2 и 2.3.12 обеспечить достаточное количество исходного материала. Типичный cDNA копирования чисел в диапазоне элюции (от шага 2.1) 200 мкл от около 10 000 до 300 000 за мкл. Гибридные захвата шаг может привести к некоторой потере общей ВИЧ-1 количество cDNA, но должно привести к сильным обогащения конкретных cDNA ВИЧ-1 над клеточной ДНК, который может быть определен с помощью соответствующей грунтовки для количественного определения геномной ДНК до и после обогащения ПЦР или путем измерения общей концентрации ДНК. Восстановленные cDNA ВИЧ-1, после того, как гибрид захвата шаги должно быть по крайней мере 10% входных данных. Низкий исходный материал может иначе объяснить положительный контроль успешного олигонуклеотида (см. шаг 3.3.2), но только читает, достигнутые в образцах. Низкий читать числа общей также может быть объяснено завышению библиотека концентрации вследствие наличия не значения ДНК видов без MiSeq адаптеров. Это приведет к низкой кластера плотность и может быть улучшена путем определения концентрации ВИЧ-1 последовательностей в библиотеке по ПЦР в дополнение к общей суммы ДНК флуориметрический анализов. Из-за весьма деликатный характер метода особое внимание следует избегать даже низкого уровня загрязнения, оба от других образцов (в частности, с высокой концентрацией управления олигонуклеотида запасов) также, как от лабораторного оборудования. Работа в УФ стерилизации ПЦР станции является полезным в этом отношении. Автоматизированный гель-электрофорез окончательного библиотеки (шаг 6.1.2) является еще одной мерой контроля качества. Нуклеиновые кислоты размер обычно наблюдается составляет от 150 до 500 nt. грунты, которые могут быть обнаружены в пульт управления, после ПЦР и до очистки (см. Примечание в шаге 5.2) теперь должны отсутствовать. В результате представительного образца кривой интенсивности имеет пик около 160-170 nt и второй резкий пик около 320 до 350 nt. Это, вероятно, отражает часто видели выше изобилия в относительно короткий (1-20 nt Вставка длина) обратный стенограммы и полнометражных сильный стоп (180-182 nt Вставка длина) (Рисунок 3b).
Хотя представленные протокол и отдельных грунтовки являются специфическими для ранних конструкций обратной транскрипции ВИЧ-1, метод обычно применяется для любого исследования, стремясь определить открытые 3'-Термини ДНК. Основные изменения, необходимые в других контекстах будет методом для гибридных захвата и грунтовка разработки стратегии. Например если целью является быть адаптированы к конце стенограммы ВИЧ-1, большее количество различных захвата биотинилированным олигонуклеотиды, отжиг по всей длине cDNA будет целесообразно и вероятно снизит потери в гибридных шаг записи. Как уже упоминалось во введении, важно учитывать ограничения при проектировании диапазоне, над которой обнаружен чтобы избежать различных источников предвзятости 3'-Термини. Во-первых может быть уклоном в реакциях PCR если шаблоны с адаптером, значительно различной длины. Во-вторых платформа виртуализации используется здесь (например, MiSeq) имеет диапазон длины предпочтительным вставить для оптимального кластеризации, и значительно короче и более продуктов не могут быть виртуализации с той же эффективностью. Частично, это может быть решена вычислений, как это было сделано путем расчета поправочный коэффициент для линейной длины смещения (см. Рисунок 4, нижняя графа). Однако если регион где пожелана 3'-Термини сопоставления длинная (> 1000 nt), это более целесообразно разделить реакции с перевязаны стенограммы и использовать несколько вверх по течению Праймеры для оценки 3'-Термини в разделах.
Программа анализа была написана доме с конкретной целью анализа как последний нуклеотидной последовательности ВИЧ-1, прилегающих к последовательности фиксированных адаптер, а также базовые вариации всех баз для выявления каких-либо мутаций. Отдельные шаги включают следующее: во-первых, адаптер последовательности удаляются с помощью fastx-0.0.13 Инструментарий; затем удаляются любые последовательности, которые дублируются (т.е. идентичные последовательности, включая штрих-кода). Все остальные уникальные читает затем выравниваются до последовательности ВИЧ-1, с помощью Боути (http://bowtie-bio.sourceforge.net/index.shtml) с максимальной несоответствие в трех базах. Шаблон последовательность состоит из первых 635 nt cDNA ВИЧ-1 (штамм NL4.3), который включает в себя последовательность - ССС и первый продукт передачи прядь до polypurine трек (U5-R-U3-PPT; см. рис. 1). Таким образом предоставленного программного обеспечения и шаблоны только непосредственно подходит, если метод используется для того же приложения (обнаружение ранней обратной стенограммы ВИЧ-1NL4.3). Корректировки должны быть сделаны для других целевых последовательностей. Позиции 3'-Термини для каждого чтения определяется позицией в выравнивание. Базовый звонки для каждой позиции записываются и мутации ставки рассчитываются от общего освещения каждой базы, которая меняется, как гласит разной длины и длинные вставки не могут быть полностью охвачены последовательности 125-base в Read2.
В заключение, мы считаем, описан метод, чтобы быть ценным инструментом для многих видов исследований. Очевидные применения включают исследования механизмов, лежащих в основе обратной транскрипции ингибирование через антиретровирусные препараты или сотовой ограничение факторов. Однако лишь относительно незначительные корректировки должны быть необходимо адаптировать систему к 3'-Термини сопоставления в рамках других одноцепочечной ДНК вирусный промежуточных продуктов, которые присутствуют, например, в парвовирус репликации. Кроме того принцип метода, особенно его оптимизированной лигирование шаг, может предоставить основной частью библиотеки подготовка дизайн для описания любого расширения 3'-ДНК, включая растяжении, катализируемые двуцепочечной ДНК полимеразы.
Раскрытие информации
Авторы заявляют, что они не имеют ничего сообщать.
Благодарности
Авторы признают поддержки со стороны членов Лаборатория Malim, Луис Аполлония, Йерней Ule и Ребекка Oakey. Авторы благодарят Matt Arno короля колледж Лондона геномного центра и Дебби Хьюз в университете колледж Лондона (UCL), Институт неврологии следующего поколения последовательности фонда, за помощь в MiSeq последовательности выполняется. Работа была поддержана Великобритании Совета медицинских исследований (G1000196 и г-н/M001199/1-м.м.), Велком Траст (106223/Z/14/Z к м.м.), Европейской Комиссии, седьмой рамочной программы (FP7/2007-2013) под Грант соглашения нет. PIIF-GA-2012-329679 (для д.п.) и Министерство здравоохранения через национальные институты здравоохранения исследований комплексного центра биомедицинских исследований премии парня и Сент-Томас NHS Фонд доверия в партнерстве с King's College London и короля Колледж больницы NHS Фонд доверия.
Материалы
| Name | Company | Catalog Number | Comments |
| 293T cells | ATCC | CRL-3216 | |
| Dulbecco's Modified Eagle's Medium | Gibco | 31966-021 | |
| Penicillin/Streptomycin | Gibco | 15150-122 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| HeraCell Vios 250i CO2 Incubator | Thermo Scientific | 51030966 | |
| Laminar flow hood - CAS BioMAT2 | Wolflabs | CAS001-C2R-1800 | |
| 10mm TC-treated culture dish | Corning | 430167 | |
| TrypLE™ Express (1x), Stable Trypsin Replacement Enzyme | Gibco | 12605-010 | |
| OptiMEM® (Minimal Essential Medium) | Gibco | 31985-047 | |
| HIV-1 NL4-3 Infectious Molecular Clone (pNL4-3) | NIH Aids reagent program | 114 | |
| Polyethylenimine (PEI) - MW:25000 | PolySciences Inc | 23966-2 | dissolved at 1mg/ml and adjusted to pH7 |
| RQ1- Rnase free Dnase | Promega | M6101 | |
| Filter 0.22 μm | Triple Red Limited | FPE404025 | |
| 15 mL polypropylene tubes | Corning | CLS430791 | |
| Sucrose | Calbiochem | 573113 | |
| Phosphate Buffered Saline (1x) | Gibco | 14190-094 | |
| Ultracentrifuge tubes | Beckman Coulter | 344060 | |
| Ultracentrifuge | Sorval | WX Ultra Series | Th-641 Rotor |
| Alliance HIV-1 p24 antigen ELISA kit | Perkin Elmer | NEK050001KT | |
| CEM-SS cells | NIH Aids reagent program | 776 | |
| Roswell Park Memorial Institute Medium | Gibco | 31870-025 | |
| CoStar® TC treated multiple well plates | Corning | CLS3513-50EA | |
| Benchtop centrifuge: Heraus™ Multifuge™ X3 FR | Thermo Scientific | 75004536 | |
| TX-1000 Swinging Bucket Rotor | Thermo Scientific | 75003017 | |
| Microcentrifuge: 5424R | Eppendorf | 5404000060 | |
| Total DNA extraction kit (DNeasy Blood and Tissue kit) | Qiagen | 69504 | |
| Nuclease free H2O | Ambion | AM9937 | |
| Cutsmart buffer | New England Biolabs (part of DpnI enzyme) | R0176S | |
| DpnI restriction enzyme | New England Biolabs | R0176S | |
| Oligonucleotides for qPCR | MWG Eurofins | N/A | HPSF purification |
| TaqMan PCR Universal Mastermix | Thermo | 4304437 | |
| LoBind Eppendorf® tubes | Eppendorf | 30108078 | |
| Axygen™ aerosol filter pipette tips, 1000 μL | Fisher Scientific | TF-000-R-S | |
| Axygen™ aerosol filter pipette tips, 200 μL | Fisher Scientific | TF-200-R-S | |
| Axygen™ aerosol filter pipette tips, 20 μL | Fisher Scientific | TF-20-R-S | |
| Axygen™ aerosol filter pipette tips, 10 μL | Fisher Scientific | TF-10-R-S | |
| PCR clean hood | LabCaire | Model PCR-62 | |
| DynaMag™2-magnet | Thermo | 12321D | |
| Streptavidin MagneSphere® paramagnetic particles | Promega | Z5481 | |
| Casein | Thermo Scientific | 37582 | |
| End over end rotator, Revolver™ 360° | Labnet | H5600 | |
| Tris-Base | Fisher Scientific | BP152-5 | |
| Hydrochloric Acid | Sigma | H1758-100ML | |
| EDTA disodium salt dihydrate | Electran (VWR) | 443885J | |
| Sodium Chloride | Sigma | S3014 | |
| Dri-Block® Analog Block Heater | Techne | UY-36620-13 | |
| PCR tubes and domed caps | Thermo Scientific | AB0266 | |
| PCR machine | Eppendorf | Mastercycler® series | |
| T4 DNA ligase | New England Biolabs | M0202M | |
| 40% Polyethylene glycol solution (PEG) in H2O, MW: 8000 | Sigma | P1458-25ML | |
| Betaine solution, 5M | Sigma | B0300-1VL | |
| Gel loading buffer II (formamide buffer) | Thermo Scientific | AM8546G | |
| Precast 6% TBE urea gels | Invitrogen | EC6865BOX | |
| Mini cell electrophoresis system | Invitrogen, Novex | XCell SureLock™ | |
| Tris/Borate/EDTA solution (10x) | Fisher Scientific | 10031223 | |
| Needle 21 G x1 1/2 | VWR | 613-2022 | |
| SYBR Gold nucleic acid stain (10000x) | Life Technologies | S11494 | |
| Dark Reader DR46B transilluminator | Fisher Scientific | NC9800797 | |
| Ammonium acetate | Merck | 101116 | |
| SDS solution 20% (w/v) | Biorad | 161-0418 | |
| Centrifuge tube filter | Appleton Woods | BC591 | |
| Filter Glass Fibre Gf/D 10mm | Whatman (VWR) | 512-0427 | |
| polyadenylic acid (polyA) RNA | Sigma | 10108626001 | |
| Glycogen, molecular biology grade | Thermo Scientific | R0561 | |
| Isopropanol (2-propanol) | Fisher Scientific | 15809665 | |
| Ethanol, molecular biology grade | Fisher Scientific | 10041814 | |
| Accuprime™ Supermix I (DNA polymerase premix) | Life Technologies | 12342-010 | |
| NEBNext® Multiplex Oligo for Illumina (Index Primer Set 1 and 2) | New England Biolabs | E7335S; E7500S | |
| Tapestation D1000 Screentape High sensitivity | Agilent Technologies | 5067- 5584 | |
| Tapestation D1000 Reagents | Agilent Technologies | 5067- 5585 | |
| 2200 Tapestation - automated gel electrophoresis system | Agilent Technologies | G2965AA | |
| Agencourt® AMPure® beads XP | Beckman Coulter | A63880 | |
| Qubit™ dsDNA HS Assay Kit | Invitrogen | Q32851 | |
| Qubit™ 2.0 Fluorometer | Invitrogen | Q32866 | |
| Topo™ TA cloning Kit | Invitrogen | 450071 | |
| Sequencing platform: MiSeq System | Illumina | ||
| Experiment Manager (Sample sheet software) | Illumina | Note: Use TruSeq LT as a template | |
| Miseq™ Reagent kit V3 (150 cycle) | Illumina | MS-102-3001 | |
| Sequencing hub: Basespace | Illumina | https://basespace.illumina.com | |
| Ligase A: Thermostable 5’ App DNA/RNA ligase | NEB | M0319S | Not used in this protocol, but tested in optimization process with results described in the discussion. |
| Ligase B: T4 RNA ligase 1 | NEB | M0204 | Not used in this protocol, but tested in optimization process with results described in the discussion. |
| Ligase C: CircLigase | Epicentre | CL4111K | Not used in this protocol, but tested in optimization process with results described in the discussion. |
Ссылки
- Herschhorn, A., Hizi, A. Retroviral reverse transcriptases. Cellular and Molecular Life Sciences. 67 (16), 2717-2747 (2010).
- Hu, W. S., Hughes, S. H. HIV-1 reverse transcription. Cold Spring Harbor Perspectives in Medicine. 2 (10), (2012).
- Levin, J. G., Mitra, M., Mascarenhas, A., Musier-Forsyth, K. Role of HIV-1 nucleocapsid protein in HIV-1 reverse transcription. RNA Biology. 7 (6), 754-774 (2010).
- Menendez-Arias, L., Sebastian-Martin, A., Alvarez, M. Viral reverse transcriptases. Virus Research. , (2016).
- Telesnitsky, A., Goff, S. P., Coffin, J. M., Hughes, S. H., Varmus, H. E. . Retroviruses. , (1997).
- Pollpeter, D., et al. Deep sequencing of HIV-1 reverse transcripts reveals the multifaceted antiviral functions of APOBEC3G. Nature Microbiology. 3 (2), 220-233 (2018).
- Frohman, M. A., Dush, M. K., Martin, G. R. Rapid production of full-length cDNAs from rare transcripts: amplification using a single gene-specific oligonucleotide primer. Proceedings of the National Academy of Sciences of the United States of America. 85 (23), 8998-9002 (1988).
- Liu, X., Gorovsky, M. A. Mapping the 5' and 3' ends of Tetrahymena thermophila mRNAs using RNA ligase mediated amplification of cDNA ends (RLM-RACE). Nucleic Acids Research. 21 (21), 4954-4960 (1993).
- Ince, I. A., Ozcan, K., Vlak, J. M., van Oers, M. M. Temporal classification and mapping of non-polyadenylated transcripts of an invertebrate iridovirus. Journal of General Virology. 94, 187-192 (2013).
- Hafner, M., et al. RNA-ligase-dependent biases in miRNA representation in deep-sequenced small RNA cDNA libraries. RNA. 17 (9), 1697-1712 (2011).
- Kwok, C. K., Ding, Y., Sherlock, M. E., Assmann, S. M., Bevilacqua, P. C. A hybridization-based approach for quantitative and low-bias single-stranded DNA ligation. Analytical Biochemistry. 435 (2), 181-186 (2013).
- Abram, M. E., Tsiang, M., White, K. L., Callebaut, C., Miller, M. D. A cell-based strategy to assess intrinsic inhibition efficiencies of HIV-1 reverse transcriptase inhibitors. Antimicrobial Agents and Chemotherapy. 59 (2), 838-848 (2015).
- Bishop, K. N., Verma, M., Kim, E. Y., Wolinsky, S. M., Malim, M. H. APOBEC3G inhibits elongation of HIV-1 reverse transcripts. PLoS Pathogens. 4 (12), 1000231 (2008).
- Zack, J. A., Haislip, A. M., Krogstad, P., Chen, I. S. Incompletely reverse-transcribed human immunodeficiency virus type 1 genomes in quiescent cells can function as intermediates in the retroviral life cycle. Journal of Virology. 66 (3), 1717-1725 (1992).
- Adachi, A., et al. Production of acquired immunodeficiency syndrome-associated retrovirus in human and nonhuman cells transfected with an infectious molecular clone. Journal of Virology. 59 (2), 284-291 (1986).
- Shah, V. B., Aiken, C. In vitro uncoating of HIV-1 cores. Journal of Visualized Experiments. (57), (2011).
- JoVE Science Education Database. Science Education Database: Basic Methods in Cellular and Molecular Biology: Passaging Cells. Journal of Visualized Experiments. , (2018).
- JoVE Science Education Database. JoVE Science Education Database: Basic Methods in Cellular and Molecular Biology: Using a Hemocytometer to Count Cells. Journal of Visualized Experiments. , (2018).
- Zhou, M. Y., Gomez-Sanchez, C. E. Universal TA cloning. Current Issues in Molecular Biology. 2 (1), 1-7 (2000).
- Zhang, S., Cahalan, M. D. Purifying plasmid DNA from bacterial colonies using the QIAGEN Miniprep Kit. Journal of Visualized Experiments. (6), 247 (2007).
- Mangeat, B., et al. Broad antiretroviral defence by human APOBEC3G through lethal editing of nascent reverse transcripts. Nature. 424 (6944), 99-103 (2003).
- Gillick, K., et al. Suppression of HIV-1 infection by APOBEC3 proteins in primary human CD4(+) T cells is associated with inhibition of processive reverse transcription as well as excessive cytidine deamination. Journal of Virology. 87 (3), 1508-1517 (2013).
- Harris, R. S., et al. DNA deamination mediates innate immunity to retroviral infection. Cell. 113 (6), 803-809 (2003).
- Zhang, H., et al. The cytidine deaminase CEM15 induces hypermutation in newly synthesized HIV-1 DNA. Nature. 424 (6944), 94-98 (2003).
- Konig, J., et al. iCLIP--transcriptome-wide mapping of protein-RNA interactions with individual nucleotide resolution. Journal of Visualized Experiments. (50), (2011).
- Troutt, A. B., McHeyzer-Williams, M. G., Pulendran, B., Nossal, G. J. Ligation-anchored PCR: a simple amplification technique with single-sided specificity. Proceedings of the National Academy of Sciences of the United States of America. 89 (20), 9823-9825 (1992).
- Zhelkovsky, A. M., McReynolds, L. A. Structure-function analysis of Methanobacterium thermoautotrophicum RNA ligase - engineering a thermostable ATP independent enzyme. BMC Molecular Biology. 13 (24), (2012).
- Li, T. W., Weeks, K. M. Structure-independent and quantitative ligation of single-stranded DNA. Analytical Biochemistry. 349 (2), 242-246 (2006).
- Gansauge, M. T., et al. Single-stranded DNA library preparation from highly degraded DNA using T4 DNA ligase. Nucleic Acids Research. 45 (10), 79 (2017).
- Ding, Y., Kwok, C. K., Tang, Y., Bevilacqua, P. C., Assmann, S. M. Genome-wide profiling of in vivo RNA structure at single-nucleotide resolution using structure-seq. Nature Protocols. 10 (7), 1050-1066 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены