Method Article
Omics Yaklaşımlar için Drosophila melanogaster Uçuş Kasları Diseksiyon
Bu Makalede
Özet
Drosophila uçuş kası transkripsiyonel düzenleme, alternatif birleştirme, metabolizma ve mekanobiyoloji çalışma güçlü bir modeldir. Biz proteomics ve derin sıralama için ideal son derece zenginleştirilmiş örnekler oluşturmak için canlı pupa floresan etiketli uçuş kası diseksiyon için bir protokol salıyoruz. Bu örnekler kas gelişiminin çeşitli yönleri ne önemli mekanistik anlayışlar sunabilir.
Özet
Drosophila uçuş kası transkripsiyonel düzenleme, alternatif birleştirme, metabolizma ve mekanobiyoloji gibi çeşitli süreçleri incelemek için güçlü bir modeldir, tüm etkisi kas gelişimi ve miofibrillogenesis. Kütle spektrometresi veya derin sıralama ile üretilenler gibi Omics verileri, bu biyolojik süreçlere önemli mekanik bilgiler sağlayabilir. Bu tür yaklaşımlar için, omik parmak izlerinin hem seçiciliğini hem de özgüllüğünü artırmak için dokuya özgü numunelerin analiz inde faydalıdır. Burada canlı pupa dan floresan etiketli uçuş kası diseksiyon uiçin bir protokol sunmak omik uygulamaları için son derece zenginleştirilmiş kas örnekleri oluşturmak için. İlk olarak erken pupal evrelerde uçuş kaslarının nasıl diseksiyon unu (<48 h sonra puparium oluşumu [APF]), kaslar yeşil floresan protein (GFP) etiketleme ile ayırt edilebilir olduğunda açıklar. Daha sonra geç pupa (>48 h APF) veya yetişkinlerden kasların nasıl kesiştiğini, kasların bir diseksiyon mikroskobu altında ayırt edilebilir olduğunu açıklarız. Eşlik eden video protokolü bu teknik olarak talep edilen diseksiyonları kas ve Drosophila araştırma toplulukları için daha yaygın olarak erişilebilir hale getirecektir. RNA uygulamaları için, farklı zaman noktalarında ve farklı yaklaşımlarla izole edilebilen RNA'nın miktarını ve kalitesini tarıyoruz. Ayrıca Bruno1 (Bru1) miyozin ağır zincir(Mhc)birleştirme bir zamansal değişim için gerekli olduğunu göstermek, diseksiyon kasları mRNA-Seq için kullanılabilir gösteren, kütle spektrometresi, ve ters transkripsiyon polimeraz zincir reaksiyonu (RT-PCR) Uygulama. Bu diseksiyon protokolü dokuya özgü omik analizlerinin desteklenmesine yardımcı olacaktır ve genellikle miyogenezin birden fazla biyolojik yönünü incelemek için uygulanabilir.
Giriş
Modern omics teknolojileri kas gelişimi ve insan kas bozuklukları nın altında yatan mekanizmalar hakkında önemli bilgiler sağlar. Örneğin, hayvan modellerinde genetik ve biyokimyasal doğrulama ile birlikte transkripsiyon verilerinin analizi, rbm20 birleştirme faktörü kaybının 30'dan fazla sarcomere hedef ağı düzenlemesi nedeniyle dilate kardiyomiyopatiye neden olduğunu ortaya koymuştur. daha önce kalp hastalığı ile ilişkili genler, titindahil 1,2,3.
İkinci bir örnekte, hücre kültürü, hayvan modelleri ve insan hastalardan yapılan çalışmalar, kas körünün (MBNL) ve CELF14,5'inyükseltisini nedeniyle RNA regülasyonunda bir bozulmadan miyotonik distrofi olduğunu göstermiştir. MBNL ve CELF1 arasındaki çapraz düzenleyici ve zamansal dinamikler (CUGBP1 veya Bruno Benzeri 2 olarak da adlandırılır) miyotonik distrofi hastalarında kalıcı embriyonik birleştirme paternlerini açıklamaya yardımcı olur. Ayrıca, yanlış düzenlenmiş hedeflerin büyük ağ hastalığın karmaşık doğasını açıklamak için yardımcı olur4,6,7,8. Bu çalışmaların çoğu insan kas hastalığının altında yatan mekanizmaları anlamak için genetik model organizmalarda omik yaklaşımlar kullanır. Ayrıca, hastalıklı veya yaşlanan kas değişiklikleri anlamak için sağlıklı kas temporal ve doku tipi özel gen ekspresyonu, protein modifikasyonu ve metabolik desenler ilk anlamanın önemini vurgulamak.
Drosophila melanogaster başka köklü genetik model organizmadır. Sarcomere yapısı yanı sıra bireysel sarcomere bileşenleri yüksek omurgalılar4,9,10sinekler korunmuş ve dolaylı uçuş kasları (IFM) çalışma için güçlü bir model haline gelmiştir kas gelişiminin birden fazla yönü11,12. İlk olarak, fibriller uçuş kasları fonksiyonel ve morfolojik olarak tübüler vücut kaslarından farklıdır11,13, kas tipi spesifik gelişimsel mekanizmaların araştırılmasına izin. Spalt majör (Salm)14,Ekstradentisle (Exd) ve Homotoraks (Hth)15 gibi transkripsiyon faktörleri fibriller kader düzenleyicileri olarak tanımlanmıştır. Ayrıca, Salm downstream, CELF1 homolog Bruno1 (Bru1, Aret) bir fibrillar özgü yapıştırma programı16,17yönlendirir.
İkinci olarak, IFM'ler miyoblast füzyonu ve miyotube eki miofibrillogenez ve sarcomere olgunlaşma9,18,19miyobez kendisi sürecini anlamak için önemli bir modeldir. Üçüncü olarak, Drosophila genetik bireysel proteinler, protein etki alanları ve protein izoformlar sarcomere oluşumu, fonksiyon ve biyofiziksel özellikleri20,21,22 katkıları nın araştırılmasına izin verir ,23. Son olarak, IFM modelleri miyotonik distrofi, miyofibriller miyopatiler, kas dejeneratif bozuklukları, aktinopatiler, vb24,25,26 gibi birden fazla insan kas bozuklukları, çalışma için geliştirilmiştir ,27, ve hastalık mekanizmaları ve potansiyel tedaviler28,29,30 içine önemli bilgilersağlamıştır. Böylece, Drosophila kas tipi spesifik transkripsiyon mekanizmaları da dahil olmak üzere miyogenez alanında birçok açık soruları ele almak için yararlı bir modeldir, splicing, ve kromatin düzenleme, kas gelişiminde metabolizmarolü gibi. Modern omics teknolojilerinin uygulanması, drosophilamevcut genetik, biyokimyasal ve hücre biyolojik tahliller geniş bir yelpazede özellikle birlikte , önemli ölçüde kas anlayışını ilerletmek için potansiyele sahiptir gelişme, yaşlanma ve hastalık.
IFM'ler sinekteki en büyük kaslardır, yetişkinlerde toraksın tüm uzunluğu boyunca yaklaşık 1 mm'ye yayılan31,32. Ancak, bu küçük boyut doku tipi özel bir şekilde Drosophila omics teknolojileri uygulamak için yeterli örnek elde etme zorluğu oluşturur. Ayrıca, IFM'ler pupal evrelerinde oluşan erişkin kasların bir parçasıdır. Miyoblastlar, puparium oluşumundan (APF) sonra 24 saat civarında tendlere bağlanan ve 30 h APF(Şekil 1A-D)18,33civarında miyofibrillogenezi başlatmak için gerekli bir sıkıştırma adımından geçilen miyotüpler oluşturmak için birleşirler, 34'e kadar.
Miyofiberler daha sonra toraksın tüm uzunluğuna kadar uzanır, miyofibriller yaklaşık 48 saat APF'ye kadar sarcomere ilavesine odaklanmış bir başlangıç büyüme evresinden geçer ve daha sonra sarcomerelerin uzunluk ve genişlikte uzadığı bir olgunlaşma aşamasına geçerler ve 72 h APF (Şekil 1A-D)32,35tarafından streç aktivasyon kurmak için remodeled . Lif olgunlaşmabaşlangıcı en azından kısmen Salm ve E2F32,36,37tarafından kontrol edilir ve birden fazla IFM özgü sarcomere protein izoformları olan birleştirme Bru1 tarafından kontrol edilir bu sırasında dahil edilir faz16,17. Olgun uçar 90-100 h APF eclose. Bu kas gelişimi çalışma için, IFM yeterli miktarda izole edilmesi gerektiği anlamına gelir, kalite, ve birden fazla pupal zaman noktalarından saflık omik yaklaşımlar kullanarak analizi kolaylaştırmak için.
IFM diseksiyonu için çeşitli protokoller yayınlanmıştır. Bu protokoller amaçlanan uygulamalar için iyi çalışır, ancak hiçbiri omics yaklaşımlar için idealdir. Pupal ve erişkin IFM'lerin immünorfülolojisi için IFM morfolojisini koruyan protokoller19, mekanik değerlendirme için IFM liflerini izole31, veya kriyokesilerden pupal IFM mikrodisyonu kullanan38 çok özel ve zaman ve omik uygulamaları için yeterli miktarda IFM dokusu elde etmek için emek yoğun. Diğer protokoller özellikle yetişkin IFM38hızlı diseksiyon için geliştirilmiştir,39, bu nedenle pupal aşamaları için geçerli değildir, ve ideal olmayan veya uyumsuz olabilir tamponlar kullanın, örneğin, RNA izolasyon. Bu nedenle, biyokimya veya omik uygulamaları için pupal IFM izole etmek için yeni yaklaşımlar geliştirmek için bir ihtiyaç vardır.
Burada 16 h APF'den yetişkin evrelerine kadar mRNA-Seq analizinde başarıyla kullanılan pupal evrelerinde IFM diseksiyonu için bir protokol salıyoruz16,32. Protokol, pupal ve yetişkin gelişiminin tüm aşamalarında IFM'leri tanımlamak için yeşil floresan protein (GFP) etiketi kullanır ve floresan diseksiyon mikroskobu altında canlı diseksiyonun alabını sağlar. Bu yaklaşım, mevcut IFM diseksiyon protokollerinden daha yüksek bir iş gücüyle daha az emek yoğundur. Bu, numunelerin hızlı izolasyonve kriyopreservation sağlar, omics yaklaşımlar yanı sıra standart ters transkripsiyon polimeraz zincir reaksiyonu için birkaç tur diseksiyon sonra yeterli malzeme üreten (RT-PCR) veya batı lekeleme.
Protokolü, 48 saat APF'den önce (IFM ekleri daha ince olduğunda) ve 48 saat APF'den sonra (pupal vücut planı ve IFM ekleri iyi tanımlandığında) ifmlerin nasıl hızla kesiştiğini gösteren iki bölümhalinde sıyoruz. Yüksek kaliteli RNA'yı tüm zaman noktalarında parçalanmış IFM'lerden izole edebileceğimizi ve RNA yalıtımı ve ters transkripsiyona yönelik farklı yaklaşımlar hakkında veri sunabileceğimizi gösteriyoruz. Son olarak, celf1 homolog Bruno1'i kullanarak mRNA-Seq, kütle spektrometresi ve RT-PCR'ye diseksiyon protokolünün uygulanmasını örnek olarak gösteriyoruz. Biz Bruno1 mutant IFM proteomics verilerinde sarcomere protein izoformlarının yanlış ekspresyonu göstermek ve Myosin ağır zincir C-terminal splice olay Bruno1 düzenleme incelemek(Mhc). Bu sonuçlar, omik verilerin genetik ve biyokimyasal deneyleri tamamlayarak biyolojik fenomenlerin daha derin bir şekilde anlaşılmasını nasıl sağlayabileceğini göstermektedir.
Protokol
1. Pupa evreleme
- Şişelerde istenilen genotipin uçlarını yükseltmek(Şekil 1E). Ya diseksiyon stok taze bir flip yapmak ya da en az 20 kadın bakire sinekler ile bir haç ayarlayın. Sinekler pupate başlayana kadar şişe leri koruyun.
- Isledilmiş bir fırça ile pre-pupa toplayın ve 60 mm Petri kabında ıslak filtre kağıdına aktarın(Şekil 1F).
- Seks pupa, deney için uygun cinsiyet toplama (Şekil 1G). Erkekler, aksi takdirde opak pupa yarı saydam topları olarak görünür testisler, varlığı ile tanımlanır.
- Petri kabını saat, tarih ve genotip ile etiketleyin, ardından pupayı istenilen aşamaya kadar yaşlayın(Şekil 1H).
NOT: Daha yüksek sıcaklıklarda artan Gal4 aktivitesi devir verimi40artırdığı için, haçları/stokları ve yaş pupalarını sıcaklık kontrollü bir kuluçka makinesinde muhafaza edin (örneğin, RNAi haçlar için 25 °C veya 27 °C). Birkaç gün yaşlanırken pupaların kurumaması için nem oranının yeterince yüksek olduğundan emin olun.
2. IFM Diseksiyon Önce 48 h APF
- İki #5 biyoloji sınıf forsepsi, pipet, pipet uçları, kuru buz ve (RNA örnekleri için) izolasyon reaktifi dahil olmak üzere gerekli ekipmanı bir araya getirin (Bkz. Malzeme Tablosu). Buna ek olarak, soğuk siyah diseksiyon yemekleri (Malzeme Tablosubakınız), 1x fosfat-tamponlu salin (PBS) tampon, ve buz üzerinde 1.5 mL mikrosantrifüj tüpleri.
- Islak bir fırça kullanarak, sahnelenmiş pupayı soğuk 1x PBS ile yaklaşık üçte ikisi dolu siyah bir kesişen tabağa aktarın(Şekil 2A,B). Floresan diseksiyon mikroskobuna geçin.
NOT: 30 dk'lık bir zaman dilimi içinde kesilebildiği kadar pupa kullanın. Deneyime bağlı olarak, bu 3-15 pupa arasında değişmektedir. Siyah diseksiyon yemekleri alternatifleri tartışmak için Ek Yöntemler bakın. - #5 forceps kullanarak, siyah bir diseksiyon çanak altına pupa birini itin ve açıkça pupa görmek için mikroskop zoom ve odak ayarlayın(Şekil 2C).
- Bir forceps ile pupa ön kavramak(Şekil 2D),sonra diğer forceps tek bir ucu ile pupa dürtmek biraz karın içinde merkezi kapalı, toraks hemen arkasında. Bu, pupayı yerinde tutar ve IFM'lerin karın içine girmesini önler(Şekil 2E).
NOT: Pupal bütünlüğü bozulur bozulmaz, bu noktadan itibaren diseksiyon uzunluğunu zamanlamaya başlayın. Kas ölümünü ve buna bağlı transkripsiyon ve proteomik değişiklikleri en aza indirmek için tanımlanmış bir diseksiyon uzunluğu (örneğin 20-30 dakika) kullanın. Bu süre içinde mümkün olduğunca çok sayıda sinek inceleyin. - İlk çömleçleri kullanarak, pupal kılıfın ön yarısını çıkarın (Şekil 2F).
- Thorax'ın hemen arkasında maruz kalan pupayı çimdiklemek ve karnı torakstan ayırmak için aynı çömetüleri kullanın (Şekil 2G).
- Forsepsleri kullanarak, toraksın ön kısmını hafifçe sıkın (<35 h APF için) veya floresan olarak etiketlenmiş IFM'leri ortaya çıkarmak için toraksı açın (Şekil 2H). IFM'ler epidermisten kolayca uzaklaşacaktır, çünkü erken zaman noktalarındaki tendon ekleri kırılgandır. Kalan karkas çanak karşı tarafına itmek için forceps kullanarak atın.
- Yinelenen adımları 2.3-2.7, ek pupa incelemek.
- IFM liflerini forceps ile toplayın ve siyah kesme kabının altındaki bir yığın halinde düzenleyin(Şekil 2I,J). Forceps kullanarak görüş alanı dışına iterek herhangi bir enkaz kaldırın.
NOT: Uygulama ile, forceps ipuçları birbirine dokunmadan yakın bir yakına getirilebilir. Bu teknik gevşek onları yok etmeden IFMs kapmak için kullanılabilir. Alternatif yöntemler, IFM'leri tek bir ucu veya tamamen kapalı forsepsle hafifçe itme veya kaldırmayı veya IFM ile yağ veya başka bir doku almayı ve 2.10 adımda açıklandığı gibi yağın çıkarılmasını içerir. - IFM olmayan kasları, yağ, miğfiz, vb. çıkarmak için çerkesleri kullanarak IFM kas örneğini kalite kontrolü(Şekil 2K,L).
NOT: Mef2-Gal4 ile IFM, floresan yoğunluğu na ve kas şekline göre atlama kası ve larva kaslarının çıkarılmasına olanak sağlayan erken zaman noktalarındaki diğer kas tiplerine göre daha güçlü bir şekilde etiketlenir (Şekil 2K,K' Yağ ve miğfer dokusu farklı görünür ve kasa özgü floresan etiketi ile etiketlenmez (Şekil 2K,K'). IFM etiketini alan diğer Gal4 satırlarının tartışma bölümüne bakın. - Kırpılmış pipet ucu kullanarak IFM yığınını 250 μL soğutulmuş 1x PBS(Şekil 2M-O)ile dolu 1,5 mL mikrosantrifüj tüpe aktarın. Hemen bölüm 4'e gidin.
NOT: IFM örnekleri sadece pipet ucunun yan tarafına yapışarak kaybedilebilir. IFM'leri toplamadan önce tamponu birkaç kez yukarı ve aşağı pipetleme standart ipuçlarını daha az yapışkan hale getirebilir ve silikonlu veya perfluoroalkoxy (PFA) uçları (Bkz. Malzeme Tablosu)ile daha düşük yüzey gerilimleri numune kaybını önlemeye yardımcı olabilir.
3. IFM Diseksiyon 48 h APF sonra
- İki #5 biyoloji sınıf forseps, ince makas, standart cam mikroskop slaytlar, çift sopa bant, pipet, pipet uçları, kuru buz ve (RNA uygulamaları için) izolasyon reaktifi dahil olmak üzere gerekli ekipmanları bir araya getirin (Bkz. Malzeme Tablosu). Buz üzerinde 1x PBS ve mikrosantrifüj tüpler chill.
- Hafifçe ıslak bir fırça kullanarak, sahnelenen pupayı mikroskop kaydıranınüzerine monte edilmiş çift taraflı yapışkan bantşeridine aktarın(Şekil 3A). Pupayı aynı yönde (ventral aşağı ve ön salığın altına doğru) yönlendirilmiş bir çizgiye yerleştirin.
NOT: Boya fırçası veya filtre üzerinde çok fazla su kullanmamaya dikkat edin, yoksa pupa iyi yapışmaz. Pupa yapışmaz, ilk kuru filtre veya doku kağıt aktararak kuru. 30 dk'lık bir zaman dilimi içinde, ideal olarak ~10 pupa olarak birçok pupa monte edilebildiği gibi. - Pupal kılıfından pupa çıkarın. Ayrı kızdırmak ve ön spiracles üzerinde pupal durumda açmak için forceps kullanın(Şekil 3B).
- Bir çift forceps'ü arka ya doğru yavaşça kaydırArak, püreler hareket ettikçe pupal kılıfı keserek(Şekil 3B'). Altta yatan pupa yırtılmamaya dikkat edin. Pupayı açılan kasadan kurtarın ve hemen ikinci bir mikroskop slaytında 1x PBS'ye aktarın(Şekil 3B",C).
- Satırdaki tüm pupalar için 3.3 ve 3.4 adımlarını tekrarlayın, ardından çift yapışkanlı bant kaydırasını bir kenara koyun.
- İnce makas kullanarak, pupanın karnını torakstan kesip ayrı bir yığına itin(Şekil 3D,D'). Kalan pupa için tekrarlayın.
NOT: Pupal bütünlüğü bozulur bozulmaz, 3.6 adımla diseksiyon un uzunluğunu zamanlamaya başlayın. Hücre ölümünü ve buna bağlı transkripsiyonve proteomik değişiklikleri önlemek için 20-30 dakika içinde mümkün olduğunca çok sayıda sinek inceleyin. 1 d yetişkin veya >90 h pupa diseksiyon yaparken, daha sonraki adımların başını ince makasla çıkarmak genellikle uygundur. - Bir kağıt parçası kullanarak, 1x PBS çoğunluğu kaldırmak (genellikle askıda yağ ile bulutlu) yanı sıra karın yığını(Şekil 3E). Kalan torakslar taze, soğutulmuş 1x PBS bir damla ekleyin.
- Tek bir hareketle uzunlamasına vücut ekseninden aşağı yaslayarak toraksı ikiye(Şekil 3F,F') kesmek için makası kullanın. Alternatif olarak, kafa çıkarılmışsa, önce başın bağlı olduğu makası takın ve IFM'ler arasında toraksın üst yarısını uzunlamasına kesin. Sonra, aynı yönde ikinci bir kesim ile toraks ventral tarafı kesti.
- Tüm pupaların kesilmesi için 3.7 ve 3.8 adımlarını tekrarlayın ve kaydıraktan merkezine yakın toraks hemisleri yığını oluşturur. Hemisections kurumasın böylece slayt üzerinde yeterli soğutulmuş 1x PBS olduğundan emin olun.
NOT: 48 saat APF'den sonra IFM'ler, eğitimli göze standart bir kesme mikroskobu altında görülebilecek kadar büyüktür. Protokolün bu noktasında, floresan etiketli kaslar IFM tanımlamasına veya eğitim amaçlarına yardımcı olmak için floresan diseksiyon kapsamına taşınabilir, ancak bu gerekli değildir. - IFM'leri göğüs kafesinde niçin parçalara ayırın. #5 forceps kullanarak hemikesitlerden birini izole edin (Şekil 3G,H). IFM'lerin ortasına ve altına bir çözgünün uçlarını yavaşça yerleştirin (Şekil 3G',H'). İlk çifenleri hareketsiz tutarken, IFM'nin bir ucunu mite ve tendondan kesmek için ince makas kullanın. Daha sonra IFM'in diğer ucunu kesip teptiz edin (Şekil 3G'',H'').
NOT: İlk IFM kesildikten sonra toraksın oryantasyonuna bağlı olarak, ikinci IFM kesiminin daha kolay olması için toraks180° döndürmek yararlıdır. - IFM demetini torakstan forceplarla çıkarın (Şekil 3G''',H'''), su gerilimini yerinde tutmak için PBS kabarcığının kenarına aktarır (Şekil 3I). Karkas'ı kaydıranın karşı tarafına doğru itin. Kalan toraks hemisleri için tekrarlayın, diseksiyon lu IFM'ler koleksiyonu oluşturur.
NOT: IFM'ler düzgün bir yığında kalmazsa, 1x PBS'nin bir kısmını bir dokuyla çıkarın. Tüm PBS'nin buharlaşmasına izin vermemeye ve parçalanmış IFM'lerin ve hemithoraxe'lerin tampon la kaplı kalmasını sağlamaya dikkat edin. - Tüm IFM'leri inceledikten sonra, incelenmiş kas üzerinde hızlı bir kalite kontrolü yapın. #5 forceps kullanarak, örnek içine kendi yolunu bulmuş olabilir herhangi bir atlama kas veya mitirkül parçaları kaldırmak(Şekil 3J-K'').
NOT: Atlama kası IFM'den farklı görünür. Floresan altında Mef2-Gal4 etiketli kas diseksiyon varsa, atlama kas zayıf bir floresan ve farklı bir şekil ve doku vardır. Normal ışık altında, IFM'ler opak, sütlü sarı iken neredeyse yarı saydam görünür(Şekil 3J-J'',K). - Su gerilimi kullanarak, bir çift forceps(Şekil 3L)arasında parçalanmış IFM'leri yakalayın (ancak ezmeyin). IFM'leri önceden 250 μL soğutulmuş 1x PBS(Şekil 3M)ile doldurulmuş 1,5 mL mikrosantrifüj tüpe aktarın. Bölüm 4 ile hemen devam edin.
NOT: Forseps uçları birbirine yakın bir yere getirildiğinde ve bir tampon çözeltisi dışına kaldırıldığında, su gerilimi forseps uçları arasında bir tampon kabarcığı yakalanmasına neden olur. IFM'ler de bu baloncukta mevcutsa, çözeltiden çıkarılabilir ve kolayca başka bir tampon dolu hazneye aktarılabilir. Tampon baloncuktan yakalanan dokunun bükülmesini önlemek için, uçları birbirine dokunmadan birbirine yaklaştırmak için püreleri sıkmak önemlidir.
4. Pelet ve IFM Örneğini Koruyun
- 1.5 mL mikrosantrifüj tüpünü 3-5 dk 2.000 x g'de bir masa üstü santrifüjde santrifüj ederek IFM'leri peletleyin(Şekil 4A,B).
- Pipet ucu(Şekil 4C) kullanarak arabelleğiçıkarın.
- RNA uygulamaları için, IFM peletini istenilen RNA izolasyon tamponunun 50-100 μL'inde yeniden askıya alın (bkz. Malzeme Tablosu, Şekil 4D). Aksi takdirde, adım 4.4'e geçin.
NOT: IFM'ler kütle spektrometresi preparatları veya RNA'nın ticari kitlerle izole edilmesi için 4.2. RNA uygulamaları için, IFM peletinin izolasyon tamponu içinde derhal yeniden dondurulması ve dondurulması ile daha iyi sonuçlar elde edilir. - Numuneyi kuru buzda dondurma veya sıvı nitrojende çabuk dondurma(Şekil 4E). -80 °C'de, aşağı akım analizi için numune hazırlığıiçin sonraki adımlara hazır olana kadar saklayın.
NOT: Kriyopreservation sonra, örnekler downstream soruşturma için işleme önce birkaç ay saklanabilir.
Sonuçlar
Yukarıda sunulan diseksiyon protokolleri, yetişkin evresine kadar puparium oluşumundan (APF) sonra 16 saat arasında IFM ile zenginleştirilmiş numuneler oluşturmak için yararlıdır. Diseksiyonlu uçuş kas örnekleri birden fazla uygulama için kullanılabilir, ve şimdiye kadar başarıyla RT-PCR4,17, RNA-Seq16,32, ChIP36,37, Batı için uygulanmıştır 14,41 ve kütle spektrometresi deneyleri (aşağıya bakınız). Potansiyel kullanıcıların RNA tabanlı uygulamaları incelemelerine yardımcı olmak için, öncelikle Sonuçlarımızı özellikle IFM'lerden RNA'ların yalıtımı için önemli hususları vurgulayan sonuçlar sayılacağız. Diseksiyon protokollerimizin yararını daha geniş göstermek için, RNA bağlayıcı protein Bruno1 hakkındaki verilerimizi kullanarak olası -omics uygulamalarından bazılarını gösteriyoruz.
IFM diseksiyon protokolü yüksek kaliteli RNA sağlar
Kodlama mRNA'sının toplam RNA42'ninsadece %1-5'ini oluşturduğu tahmin edildiğinden, önceden kesilecek sinek sayısını belirlemek önemlidir. IFM'den sinek başına ortalama 24 ± 9 ng rNA elde ettik ve 1 d yetişkinden(Şekil 4F ve Ek Şekil 1A)elde edildive verim genellikle deneyimle birlikte artmaktadır. Sinek başına toplam RNA verimi nispeten sabittir, IFM için 25 ng civarında dalgalanan 16 h APF, 24 h APF, 30 h APF, 48 h APF, 72 h APF ve 90 h APF(Şekil 4F ve Ek Şekil 1B,D,E). Bu gözlemler aynı zamanda daha önceki zaman noktalarından izole edilen örneklerde daha yüksek olabilecek yağ, tendon, trakea veya diğer hücre tiplerinden izole edilmiş herhangi bir RNA'yı yansıtır. Böylece, 50 sinekten IFM'den toplam RNA'nın >1 μg'sini elde ettik ve tipik olarak IFM'i 100−150'den inceleyerek RNA-Seq örnekleri için toplam RNA'nın >3 μg'sini oluşturduk.
RNA yalıtım yöntemi kurtarılan RNA'nın miktarını ve kalitesini etkiler ve kullanıcıları yalıtım yaklaşımlarını doğrulamaya teşvik ediyoruz. Örneğin, 1 no'lu yöntemle izolasyon, IFM'den 50 1 d yetişkin sineklerden toplam RNA'nın ortalama 1143 ± 465 ng'sini üretirken, çeşitli ticari kitlerle izolasyon 186 ± 8 ng ile 1261 ± 355 ng arasında toplam RNA(Şekil 4G ve Ek Şekil 1C). Ticari kitlerden izole edilen RNA genellikle kalitelidir(Şekil 4H ve Ek Şekil 1F),ancak düşük geri kazanımlar RNA'nın sütunlardan verimli bir şekilde çıkarılmayabileceğini düşündürmektedir. RNA bütünlüğü de yöntem 2(Şekil 4H, ikinci arsa), tampon anayasa ve ısı tedavileri nedeniyle, downstream deneyleri etkileyebilir şiddetli parçalanma yol yapılan bir kit kullanımı ile tehlikeye olabilir.
RNA örneklerini yalıtma ve işleme sırasında uygun RNase-free tekniğini gözlemlemek de önemlidir. Donma-çözülme döngüleri ve 4 saatlik oda sıcaklığında kuluçka, RNA bütünlük profillerini önemli ölçüde etkilemese de, az miktarda rna bile hızlı RNA bozulmasına yol açar (Şekil 4I ve Tamamlayıcı Yöntemler). Kullanıcılar hala RNA hidroliz ve parçalanma önlemek için buz üzerinde çalışmak ve donma-çözülme sınırlamak için teşvik edilmektedir. Bu burada tespit edilmedi ancak filtre uçları ve DEPC ile işlenmiş tamponlar kullanılarak RNase kontaminasyonunu önlemek kesinlikle gereklidir.
Ters transkripsiyon verimliliği de downstream uygulamaların başarısını etkiler. Test ettiğimiz üç ticari RT kitinden ikisi ile güvenilir sonuçlar elde ettik ve bu bantlar ribozomal gen rp49 (Şekil 4J)için güçlü RT-PCR bantlarını güçlendirdiler. Ancak, RT Kiti #2 düşük ifadeli transkriptlerin tespiti için daha duyarlı olabilir, çünkü her üç biyolojik kopya için De RNA bağlayıcı protein bru1 için daha güçlü bantlar elde ettik(Şekil 4J). Birlikte ele alındığında, bu sonuçlar yüksek kaliteli RNA ifm'lerden bu yordam ile diseksiyon izole edilebilir göstermektedir.
Diseksiyonlu IFM'ler yüksek kaliteli mRNA-Seq ve proteomik veri üretir
Yukarıdaki protokole göre 30 h APF, 72 h APF ve 1 d yetişkin sineklerinden alınan IFM kullanılarak, daha önce RNA bağlayıcı protein ve CELF1-homolog Bruno1 'in (Bru1, Arrest, Aret) ifm'e özgü bir splicing yolunu kontrol ettiğini transkripsiyon faktörü Spalt majör (Salm)16. Null mutants yanı sıra kas özgü bruno1 RNAi(bru1-IR)ile sinekler IFM'ler sarcomere büyüme kusurları, miyozin aktivitesinin yanlış regülasyon ve sonuçta hiperkontraksiyon ve kas liflerinin kaybı16,17 ekran . Aşağıda tüm proteom kütle spektrometresi için parçalanmış IFM'lerin faydasını göstermekte ve RNA düzeyinde gözlemlediğimiz bazı ekspresyon değişikliklerinin protein düzeyinde de belirgin olduğunu göstermişolacağız. Mhc'de Bruno1 tarafından düzenlendiği tespit edilen belirli bir gelişimsel splice olayını vurgulayarak, parçalanmış IFM'lerden mRNA-Seq ve RT-PCR'nin alternatif splice olaylarının düzenlenmesini göstermek için kullanılabileceğini gösteriyoruz.
Kütüphane kalitesine ve derinliğine bağlı olarak, mRNA-Seq verileri gen birimlerinin (bir genin tüm ekonlarında ortalama okuma sayıları), bireysel eksonlar veya splice kavşakları düzeyinde analiz edilebilir. bru1-IR IFM'lerden alınan mRNA-Seq verileri, yabani tipe göre gen birimi düzeyi16'da ekspresyonda zayıf değişiklikler gösterir (Şekil 5A). 72 h APF'de, 60A [Mlp60A], actin 57B [Act57B], kas spesifik protein 300 kDa [Msp300], veya Stretchin-Mlck [Strn-Mlck]) gibi sarcomere genleri için uygun kas gelişimi için önemli olan bir eğilim var. bru1-IR kas (Şekil 5A ve Ek Tablo 1). Ancak, daha önce bireysel eksyon düzeyinde, belirli sarcomere gen izoforms16çok daha güçlü bir downregulationasyon olduğunu göstermiştir , Bruno1 önemli işlevi alternatif birleştirme kontrol etmek olduğunu düşündürmektedir (Ek Tablo 1 ).
Diseksiyonlu IFM'lerde tam proteom kütle spektrometresi kullanılarak protein düzeyinde benzer bir düzenleme gösterebiliriz(Şekil 5B ve Ek Tablo 2). Saptanan 1.895 peptid grubundan 524'ü (%28) bunların 1 d erişkinlerde Bru1M2 mutant IFM'de yanlış düzenlenmiştir(Ek Tablo 2). Strn-Mlck ve Mlp60A proteininin aşağıregülasyonu da gözlemlenir ve mRNA-Seq verilerimizde transkript düzeyinde eşleşen gözlemler görülür. Belirli protein izoformlarına (analiz detayları için Ek Yöntemler) haritaoluşturan veritabanı peptidlerinin sınırlı sayıdasına rağmen, sarcomere proteinleri Tropomyosin 1 (Tm1), destek (up/TnT), Mhc, bent (bt/projectin) ve Paramiyozin (Prm) için biz bir izoform ve başka bir downregulation gelen peptidlerin upregulation gözlemlemek(Şekil 5B), RNA düzeyi benzer düzenleme bizim önceki gözlemler doğrulayan16. Bu, diseksiyonlu IFM'lerin hem mRNA-Seq hem de proteomik uygulamalariçin yararlı olduğunu göstermektedir.
Omik verilerin biyolojik içgörüyü geliştirmek ve genişletmek için geleneksel yaklaşımları nasıl tamamlayabildiğini niçin bir başka örnek olarak, Mhc'ninC terminusuna odaklanmayı seçtik. WeeP26 adı verilen daha önce karakterize edilmiş bir protein traphattı Mhc43,44'ün son intronuna eklenir (tam konum için Ek Yöntemlere bakınız). weeP26 güçlü bir splice acceptor içerir ve muhtemelen tüm Mhc transkript(Şekil 5C)dahil edilmiştir. Ancak IFM'de GFP etiketli protein, M-line'ın her iki tarafında iki "nokta" içine dahil edilirken, bacak kasında, M-line boyunca düzgün ve kalın iplikler arasında zayıf bir şekilde birleştirir (Şekil 5E). Orfanos ve Sparrow bu "nokta"ları gelişimsel Mhc izoform anahtarı nedeniyle IFM formunda gösterdiler: 48 h APF'den önce ifade edilen Mhc izoform, açık okuma çerçevesinde weeP26 ekson ekler olarak GFP olarak etiketlenirken, Mhc weeP26 ekson 3'-UTR44dur kodonun aşağı dahil olduğu gibi, 48 h APF sonra ifade edilen izoform, etiketsiz.
mRNA-Seq verilerimiz C-terminal Mhc izoform ekspresyonunu daha ayrıntılı olarak karakterize etmemizi sağladı. İki farklı Mhc sonlandırma43,44, bizim mRNA-Seq veri ve mevcut Flybase ek açıklama (FB2019_02) rapor edilmiş olsa da aslında Mhc üç olası alternatif splice olaylar olduğunu göstermektedir C-terminus (Exon 34-35, 34-36 veya 34-37) (Şekil 5C), RT-PCR (Şekil 5D) tarafından doğrulanır. weeP26 GFP Exon 36 ve 37 arasında intron eklenir; böylece, hem Exon 34-35 hem de Exon 34-36 izoformları dur kodonları içerdiğinden, GFP sadece Exon 34-37 izoform (Exon 34-GFP-37 ile sonuçlanan) olarak tercüme edilebilir. Ayrıca tüm Mhc izoformlarının hem zamansal hem de mekansal regülasyonlarını görebiliriz. IFM'de, Exon 34-37'den Exon 34-35'e 30 h APF ile 48 h APF(Şekil 5C,D,F)arasında 27 °C'de bir Mhc izoform anahtarı gözlemliyoruz, ancak bu durum 48 h APF 'de immünfloresans tarafından henüz görülemese de(Şekil 5E). Bacaklar zaten Exon 34-37 ve Exon 34-35 30 h APF bir karışımını ifade ve 72 h APF ifade üç Mhc isoforms(Şekil 5D,F). Yetişkin atlama kas (TDT) da üç Mhc izoformları ifade eder(Şekil 5F),Bu genellikle tübüler somatik kaslar için doğru olduğunu düşündürmektedir. Bu nedenle, mRNA-Seq verilerimiz IFM'de Mhc izoform anahtarının zaman dilimini daraltarak ve tübüler kaslarda Mhc izoform kullanımını karakterize ederek önceki bulguların uzatılmasına olanak sağlar.
Daha sonra salm ve bru1 mutant IFM'de Mhc isoform regülasyonu incelendi. Her iki durumda da, weeP26yanlış düzenleme gördüm. Salm mutant IFM'ler Exon 34-36 olayının kazanımı da dahil olmak üzere daha sonraki aşamalarda Mhc izoform ekspresyon ve fenokopbacak birleştirme desenleri gelişim anahtarı tamamlamak için başarısız(Şekil 5F). Bu önceki bulgular ile kabul eder salm kaybı tübüler kas16IFM yakın tam bir kader dönüşümü ile sonuçlanır . Bru1-IR ve bru1 mutant IFM, salm benzer -/- IFM, yetişkin aşamalarında Exon 34-37 splice olay korur(Şekil 5E,F), bacak kası benzeyen bir weeP26 GFP etiketleme desen sonuçlanan, ama Exon 34-36 olay kazanmaz. Bu, Bruno1'in IFM'de Mhc alternatif birleştirmedeki gelişim anahtarını en azından kısmen kontrol etmek için gerekli olduğunu gösterir, ancak salm-/-bağlamında ek birleştirme faktörlerinin de yanlış düzenlendiğini gösterir. Ayrıca, bu örnek, parçalanmış IFM'den elde edilen RT-PCR ve mRNA-Seq verilerinin gelişimsel birleştirme mekanizmaları ve gözlenen morfolojik bozukluklar hakkında daha derin bir anlayış elde etmede nasıl değerli olabileceğini göstermektedir.
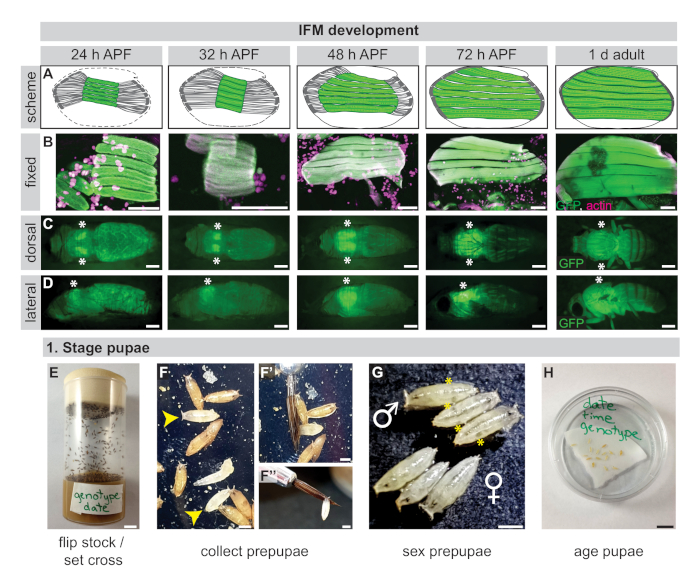
Şekil 1: IFM gelişimi ve pupa evreleme. (A) 24 h APF, 32 h APF, 48 h APF, 72 h APF ve 1 d yetişkin ~ 32 h APF uçuş kasları (yeşil) ve toraks doldurmak için sonraki lif büyüme sıkıştırma gösteren IFM gelişimi şeması. Tendonlar koyu gri renkte. (B) Açık kitap diseksiyondan sabit IFM'lerin konfokal görüntüleri (24 h, 32 h, 48 h)19 veya toraks hemisections (72 saat, 1 gün) aktin (rhodamine phalloidin, macenta) ve GFP (yeşil) için boyanmış. (C,D) Dorsal (C) veya lateral (D) düzleminde diseksiyon sinek hattının sağlam IFM morfolojisini gösteren canlı pupada GFP floresan görüntüleri. Yıldız işaretleri IFM konumunu işaretler. (E) Diseksiyon lara hazırlanmak için sinek stokları çevrilmeli veya 3-4 gün önceden ayarlanmalıdır. (F) Prepupae beyaz renk (sarı ok başları) tarafından seçilir ve ıslak bir fırça (F',F'') kullanılarak izole edilir. (G) Prepupae, arkadan yarı saydam toplar (sarı yıldız) olarak görünen testislerin varlığına göre dişileri erkeklerden ayırmak için cinsiyetlendirilmelidir. (H) Pupa 60 mm tabaklarda ıslak filtre kağıdı üzerinde yaşlanır. Ölçek çubukları = 100 μm (B), 1 cm (C,D,E,H), 1 mm (F,F'',G). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
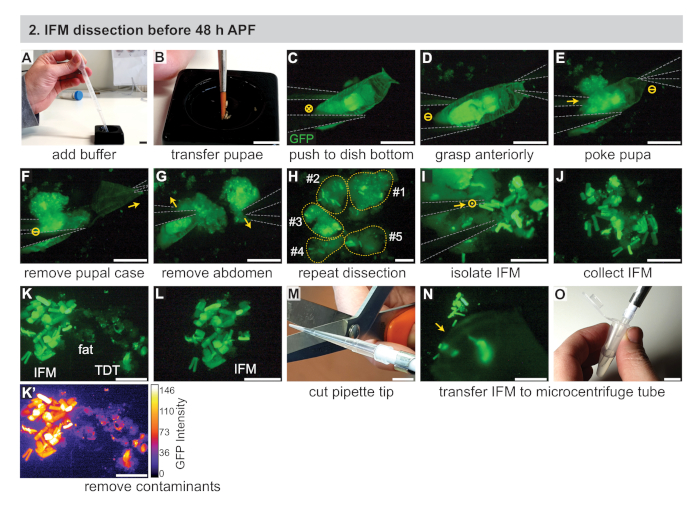
Şekil 2: 48 h APF'den önce IFM'lerin diseksiyonu. (A) Transfer pipeti ile siyah bir kesme kabına 1x PBS tampon ilavesi. (B) Sahnelenmiş pupanın bir boya fırçası kullanılarak aktarılması. (C) GFP'yi görselleştirmek için floresan bir diseksiyon mikroskobu altında, pupanın #5 forceps kullanarak bir diseksiyon kabının altına hafifçe itmesi (gri olarak özetlenmiştir). Dairedeki "X" görüntüye hareketi gösterir. (D,E) Pupaan anteriorly kavrama (D), sonra toraks (E) hemen arkasında pupa dürtme. Daire içinde Çizgi hiçbir hareket gösterir. (F,G) Pupal durumda (F) kaldırmak için ön forceps (ok) ile çekme, sonra karın kaldırılması (G). (H) Birkaç pupa için C-G tekrarı. Sarı noktalı çizgiler pupa katkıda gösteren numaralandırılır. (I, J) IFM'leri çevreleyen dokudan (J) izole etmek için forceps (I) kullanımı. Dairedeki nokta, sayfanın dışına çıkan hareketi gösterir. (K,L) Temiz bir IFM örneği (L) oluşturmak için yağ ve atlama (TDT) kasları (K) dahil olmak üzere kirleticimaddelerin uzaklaştırılması. TDT, GFP ifadesini daha düşük ve IFM liflerinden(K') farklı bir şekle sahiptir. (M,N,O) Kesilen IFM'leri (N) toplamak için kırpılmış pipet ucu (M) kullanımı ve mikrosantrifüj tüpüne (O) aktarılması. Ölçek çubukları = 1 cm (A,B,M,O), 1 mm (C-G), 500 μm (H-L,N). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
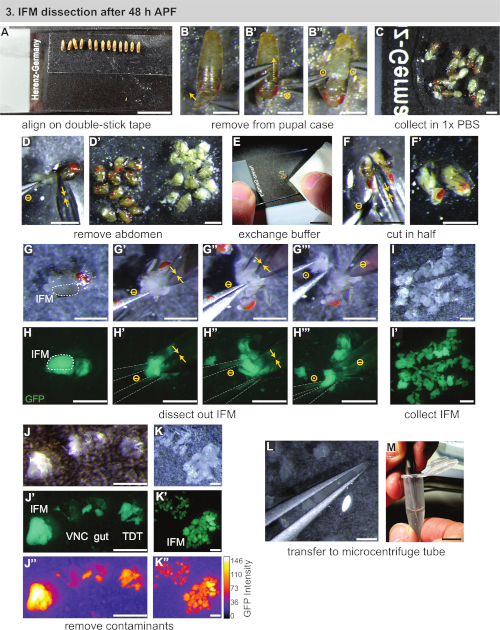
Şekil 3: 48 h APF sonrası IFM'lerin diseksiyonu. (A) Pupanın çift yapışkan bant üzerinde hizalanması. (B) Pupanın pupal kasadan çıkarılması anteriorly (B) açılarak, kılıfı dorsally(B') keserek ve pupayı kaldırarak(B''). Daire sembolleri Şekil 2ile aynı temsil edilir. (C) Pupanın tampona transferi. (D) Karın makasla kesilerek çıkarılması (sarı çift oklar) ve torakstan ayrılma(D'). (E, F) Temiz tampon (E) eklenmesi, daha sonra yarım uzunlamasına toraks kesme(F,F'). (G,H) Diseksiyonlar GFP (H) görselleştirmek için beyaz ışık (G) veya floresan altında yapılabilir; bir tarafta IFM'lerin kesilmesi (G', sonra diğer tarafta (G''); forseps (gri) (G''''' ile toraks dışarı kaldırma). (I,J,K) Tampon (I) ve kontamine ventral sinir kordonu (VNC), bağırsak ve atlama kas (TDT) (J) temiz bir IFM örneği (K) oluşturmak için kaldırılması IFM'ler toplanması. TDT daha düşük GFP ifadesine ve IFM liflerinden (J''', K') farklı bir şekle sahiptir. (L,M) IFM'leri (L) mikrosantrifüj tüpüne (M) aktarmak için forceps kullanımı. Ölçek çubukları = 1 cm (A,E,M), 1 mm (B-D',F-L). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
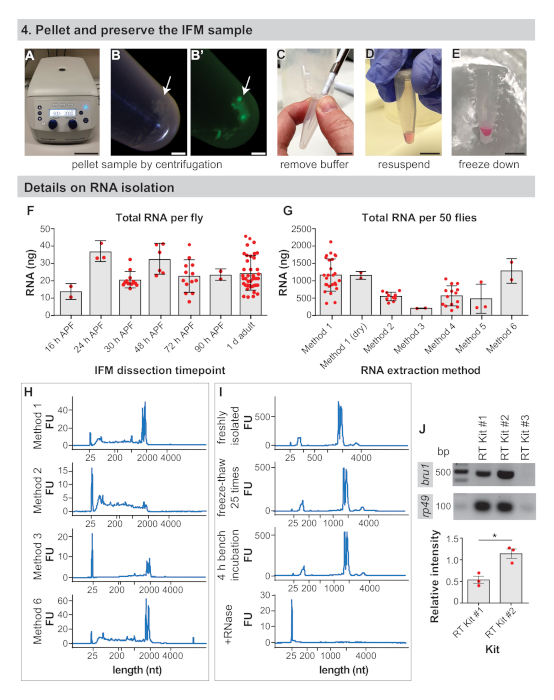
Şekil 4: IFM koruma ve RNA izolasyon detayları. (A) IFM'ler 2000 x g'da5 dk santrifüj ile peletlenir. ( B ) FLORESAN(B)altında IFM pelet (ok) ve pelet. (C) Bir pipet ucu ile tüm tampon kaldırılması. (D) RNA ekstraksiyonu için, izolasyon tamponundaki peletin yeniden askıya alınması. Bu adım, parçalanmış IFM'leri kuru dondurmak için atlanabilir. (E) Numunenin sıvı azot veya kuru buz üzerinde dondurulması ve -80 °C'de depolanması. Ölçek çubukları = 10 cm (A), 1 mm (B,B'), 1 cm (C,D,E). (F) 16 h APF, 24 h APF, 30 h APF, 48 h APF, 72 h APF, 90 h APF ve 1 d yetişkin de sinek başına elde edilen diseksiyonIFM toplam RNA nanogramlar (ng). Hata çubukları = SD. (G) IFM'den izole edilen toplam RNA 50 1 d yetişkin farklı ekstraksiyon yöntemleri kullanılarak kesilir. Hata çubukları = SD. (H) Temsilci farklı çıkarma yöntemlerinden sonra RNA bütünlüğünü teşpede izler. Ribozomal bantlar 2000 nükleotit (nt) ve marker bandının hemen altında 25 nt. Ek Şekil 1'debulunan ek izler çalışır. (I) Yeni izole edilmiş bir RNA örneğinin (üstte), kuru buzda 25 kat çözülmüş bir numunenin (ikinci arsa), tezgahta 4 saat (üçüncü arsa) bırakılan bir numunenin ve RNase A (alt çizim) ile işlenmiş bir numunenin temsilcisi izleri. RNa'nın bru1 ve rp49için etiketlenmiş kitlerinden RNa (J) RT-PCR jel eklenmesi üzerine tam bozulmanotu . RP49'a karşı normalleştirilen bru1 bandının göreceli yoğunluğu aşağıda çizilmiştir. Hata çubukları = SEM (eşleşmemiş t-test, p = 0,0119). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
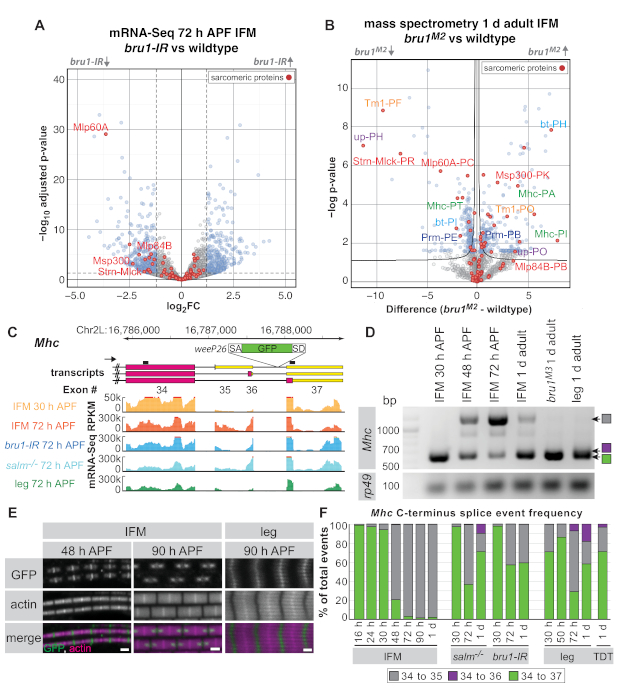
Şekil 5: Bruno1 fonksiyonunu alternatif birleştirmede araştırmak için IFM diseksiyonları uygulaması. (A) IFM'lerden mRNA-Seq verilerinin (gen birimi) yanardağ çizimi 72 h APF'de incelenmiştir. Bru1-IR ve wildtype IFM (padj < 0.05, abs(log2FC) >1.5) arasında önemli ölçüde farklı olarak düzenlenmiş genler mavi, önemli olmayan genler gri olarak gösterilir. Sarcomere proteinleri kırmızı ile vurgulanır ve belirli genler etiketlenir. (B) Tüm proteom kütle spektrometresi volkan arsa 1 d yetişkin IFMs sonuçları. BruM2mutantları ile yabani tip (FDR < 0.05) arasında anlamlı olarak farklı olan proteinler mavi, önemsiz olmayan gri proteinlerle gösterilir. Sarkoerik proteinler kırmızı ile vurgulanır. (A)'daki genlere karşılık gelen peptidler kırmızı ile etiketlenir. Aynı proteinin farklı isoformlarına haritalanan peptid kümeleri aynı renkte etiketlenir. (C) WeeP26 gen kapanının farklı transkript izoformlarını ve ekleme yerini gösteren Mhc'nin C-terminusunun şeması (ekleme noktası için Ek Yöntemler'e bakınız). RT-PCR astarları transkriptlerin üzerinde siyah çizgiler olarak gösterilir. MRNA-Seq'den milyon baz başına kilobaz başına okuma sayıları (RPKM), yabani tipten 30 saat APF (turuncu) ve 72 h APF (kırmızı), bru1-IR (mavi) ve salm-/- (zil) 72 h APF'de ve 72 saat APF'de tüm bacaktan (yeşil) parçalar için gösterilir . (D) RT-PCR mhc karşı astar ile 30 h APF ve daha sonraki zaman noktaları arasında IFM izoform anahtarı gösteren. Exon 34-35 splice olayı sadece zayıf bruM3mutant IFM veya yetişkin bacak gözlenir. (E) Yabani tip IFM sarcomeres weeP26 GFP lokalizasyonu konfokal görüntüleri 48 h APF ve 90 h APF 90 h APF bacak kası ile karşılaştırıldığında. Ölçek çubukları = 1 μm. (F) Genotipler ve zaman noktaları için mRNA-Seq verilerinden splice junction quantification olarak etiketlenmiştir. Kavşak okumaları, ekson 34 splice donörünün paylaşılması olan toplam sayı etkinliklerine belirli bir splice olayının (Exon 34-35 gri, 34-36'sı mor ve 34-37 yeşil) oranı olarak sunulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
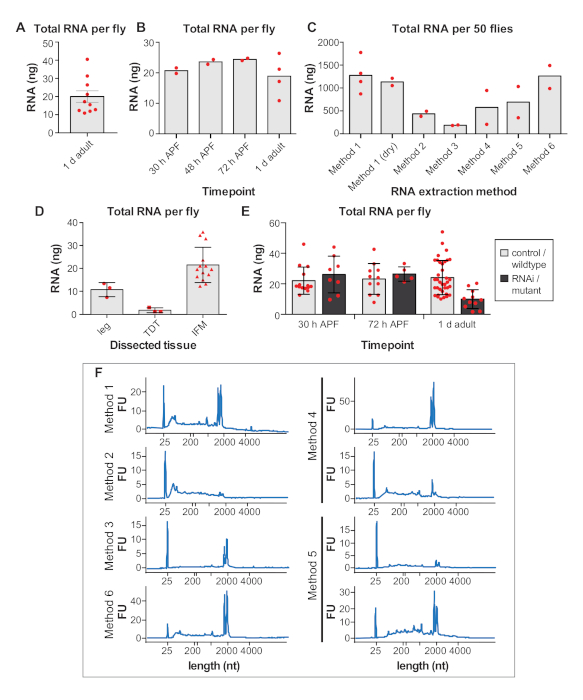
Ek Şekil 1: (A,B,C) RNA aynı araştırmacı tarafından aynı hafta içinde diseksiyon lanan aynı genotipten örneklerden elde edilir. Tüm numuneler kesildikten sonra RNA izole edildi ve aynı gün ölçüldü. (A) 1 d yetişkin sinek başına IFM diseksiyondan elde edilen toplam RNA nanogramları (ng). Hata çubukları = SEM. (B) 30 h APF, 48 h APF, 72 h APF ve 1 d yetişkin de sinek başına parçalanmış IFM elde edilen toplam RNA. (C) IFM'den izole edilen toplam RNA, farklı ekstraksiyon yöntemleri kullanılarak 50 1 d yetişkin sineklerden kesilir. (D) Parçalara, atlama kaslarından (TDT) ve IFM'den sinek başına toplam RNA konsantrasyonları. Daha büyük IFM'lerden daha fazla RNA elde edilir. Hata çubukları = SD. (E) IFM'nin sinek başına toplam RNA konsantrasyonları kontrollerden 30 saat APF, 72 h APF ve 1 d yetişkin de RNAi veya mutant numunelere göre kesilir. Mutantlar için, w1118 wildtype kontrol olarak kullanılmıştır. Mutant verileri bru1-IR, salm-/- ve başka bir RNA bağlayıcı protein mutantından derlenmiştir. Bu manipülasyonlar için, RNA verimleri 1 d yetişkin kas atrofisi ve kaybı nedeniyle azalır, bu nedenle daha fazla sinek omik yaklaşımlar için yeterli miktarda elde etmek için diseksiyon gerekir unutmayın. Hata çubukları = SD. (F) Şekil 4G'de ve Ek Şekil 1C'degösterilen RNA yalıtım yöntemleri için RNA bütünlüğünü gösteren ek izler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Ek Yöntemler: Metin boyunca kullanılan yöntem ve reaktiflerin ayrıntılı bir açıklaması ve özellikle Şekil 1A-D, Şekil 4F-K, Şekil 5, Ek Tablo1' de gösterilen verileri oluşturmak ve Ek Tablo 2. Bu veriler diseksiyon protokolünü motive eder ve RNA yalıtımı, mRNA-Seq, RT-PCR ve proteomik için yardımcı programını gösterir. Bu dosyayı indirmek için lütfen buraya tıklayınız.
| Ana metindeki Şekil 5 ve ilişkili paragraflarla ilgili | |
| Sekme Adı | Veri Özeti |
| Sarcomere Proteinleri | Spletter et al. Elife 2018'den sarcomere genleri listesi; Burada mevcut FBgn ve gen adını listeliyoruz. |
| SP gen birimleri_DESeq2_72h | Spletter ve ark. EMBO Rep 2015 verilerini kullanarak, özellikle mRNA-Seq verilerindeki sarcomere genlerine 72 saat APF'de baktık. Bu kontrol arasındaki gen birimi düzeyinde diferansiyel ekspresyon tespit DESeq2 analizi (Mef2-Gal4, UAS-GFM-Gma w1118 geçti) ve Mef2-Gal4, UAS-GFM-Gma x Bruno1-IR. Sarı renkte vurgulanan satırlar, ispanatla yukarı veya aşağı düzenlenmiş genlerdir (log2FC=abs(1.5)'in bir eşiğinin üstünde/altında). Bu veriler Şekil 5A'daki kırmızı nokta kaplamasIdır. Her sarcomere geni için tanımlayıcı bilgileri, DESeq2'den log2FC, P değeri ve ayarlanmış P değeri ile DESeq2 normalleştirilmiş ifade sayıları sağlarız. |
| SP exon_DEXSeq_72h | Spletter ve ark. EMBO Rep 2015 verilerini kullanarak, özellikle 72 h APF'de mRNA-Seq verilerinde sarcomere gen ekson kullanımına baktık. Bu dexseq analizi kontrol (Mef2-Gal4, UAS-GFM-Gma w1118 geçti) ve Mef2-Gal4, UAS-GFM-Gma x Bruno1-IR arasında diferansiyel ekson kullanımı tespit. Sarı renkte vurgulanan satırlar, işaretçi bir şekilde yukarı veya aşağı düzenlenmiş ekonlardır (log2FC=abs(1.5)'in bir eşiğinin üstünde/altında). Ekson ve gen tanımlayıcı bilgileri, DEXSeq'tan log2FC, P değeri ve ayarlanmış P değeri ile ilişkili transkriptlerin listesini salıyoruz. |
| Birçok genin DEXSeq analizinde genellikle yüksek log2FC değerleri ve düşük P değeri/p değerlerini ayarlama ile bir veya daha fazla eksonun düzenlenmesini gösterdiğini, sınırlı bir gen listesinin ise 72 saat APF'de değişiklikler gösterdiğini unutmayın. Bu alternatif birleştirme düzenlenmesi bruno kaybının güçlü bir etkisini destekler. | |
Ek Tablo 1: Bru1-IR vs. wildtype IFM'lerde farklı ifade edilmiş genleri(DESeq2 ile) ve eksexleri (DEXSeq üzerinden) tanımlayan sarcomere proteinleri için 72 h APF mRNA-Seq veri tablosu.
| Ana metindeki Şekil 5B ve ilişkili paragraflarla ilgili | |
| Sekme Adı | Veri Özeti |
| Perseus çıkışı | Bu, Şekil 5B oluşturmak için kullanılan kütle spektrometresi verilerini sunan işlenmiş bir veri tablosudur. IFM örnekleri 1 d yetişkin kontrolü (w1118) ve mutant (bruno1-M2) sineklerinden dir. Önemli sütunlar, her bir örnek için 4 çoğaltmanın her biri için dönüştürülmüş yoğunluk değerleri, t-testi istatistiği ve önemi, peptit istatistleri ve ilgili gen adları ve Flybase D'leridir. İşaret, Perseus'taki standart ayarlar kullanılarak hesaplanmıştır (FDR<.05). Tespit edilen 1859 protein/peptid vardır ve bunların 524'ü (%28) örnekler arasında önemli ölçüde farklıdır. |
| Aşağı regüle | Bunlar Bruno1-M2 mutant IFM'de indirgenmiş Perseus çıkışından elde edilen 252 protein/peptiddir. Flybase kimlikleri ve gen adları güncel olduğundan, ayrıca mevcut Flybase gen kimliği ve gen adını da salıyoruz. |
| Güncel | Bunlar Bruno1-M2 mutant IFM'de denetlenen Perseus çıkışından elde edilen 272 protein/peptiddir. Flybase kimlikleri ve gen adları güncel olduğundan, ayrıca mevcut Flybase gen kimliği ve gen adını da salıyoruz. |
| Şekil 5B'de kırmızı ile vurgulanan sarcomere proteinleri yukarıdaki listelerde yer alıyor. Sarcomere'nin bir parçası olarak kabul edilen genlerin listesi Ek Tablo 1'deki sekmelerden birinde mevcuttur. | |
Ek Tablo 2: Bru M2mutant vs'defarklı ifade edilen proteinleri ve protein isoformlarını tanımlayan 1 d erişkin tüm proteom kütle spektrometresi verilerinin tablosu. wildtype IFM'ler.
Tartışmalar
Bu protokolde, Drosophila IFM'leri erken ve geç evre pupalardan protein, DNA, RNA veya diğer makromoleküllerin aşağı izole edilmesi için incelemek için temel tekniği sıyoruz. Protokol, YETIŞKIN sineklerden IFM'i incelemek için kolayca uyarlanabilir. MRNA-Seq, proteomik ve RT-PCR uygulamaları için diseksiyon protokolümüzün yardımcı programını gösteriyoruz. Daha az başlangıç malzemesi ve daha düşük girdi konsantrasyonlarına sahip numunelerin analizine olanak sağlayacak omik teknolojilerinsürekli iyileştirilmesi ile bu diseksiyonlar büyük olasılıkla birçok ek uygulama için değerli hale gelecektir. IFM'ler insan miyopatileri için kurulmuş bir model olduğundan4,24 ve kas tipi spesifik gelişim9,12, örneğin, IFM ile zenginleştirilmiş metabolomikler, kromatin konformasyonu araştırmaları 3C veya 4C ile, CLiP etkileşimleri veya miofibrillogenez fosfo-proteomik yoluyla ağ değerlendirmesi birleştirme.
Bu diseksiyonlarsaf ifm numunesi yerine IFM için zenginleştirilmiş bir numune ürettiği göz önünde bulundurulması önemlidir. Bu motor nöron innervasyonu nedeniyle kaçınılmazdır, tendon ekleri ve kas liflerinin trakeal invazyonu. Biyoinformatik analizi IFM zenginleştirilmiş gen veya proteinleri tanımlamak için kullanılabilir, ancak daha fazla deney aslında IFM özgü olduğunu göstermek için gereklidir. Örnek saflık Stripe45 (tendon), Act79B4,44 (tübüler kas), Act88F15 (IFM) veya syb46 (nöronal spesifik) gibi yayınlanmış dokuya özgü belirteçler kullanılarak test edilebilir. Veri kümelerini IFM'ye özgü içeriğe normalleştirmek için bu tür belirteçleri kullanmak mümkün olabilir, ancak kullanıcılar, normalleşme için kullanılan genlerin ekspresyonundaki zamansal değişikliklerin , örneğin IFM'ye özgü genler veya tubulin gibi, böyle bir yaklaşımı saptırabileceği konusunda uyarılır.
Genetik olarak kodlanmış dokuya özgü etiketleme yöntemleri, örneğin EC etiketleme47,48 veya PABP etiketleme49,RNA izole etmek için50 son yıllarda geliştirilmiştir, hangi gerçekten elde yardımcı olabilir dokuya özgü RNA örneği. Ancak, EC-etiketlemesinekler sürekli besleme gerektirir 47 ve bu nedenle pupal aşamalarında geçerli değildir. PABP etiketli transkripsiyonların duyarlılığı ve bütünlüğü51sınırlaması olabilir. Bireysel kas liflerini izole etmek için FACS yaklaşımları IFM'lerin büyük boyutu ve sinital doğası ile karmaşık. INTACT52,53 tarzı yaklaşımlar IFM'lerden belirli hücre altı bölmeleri izole etmek için uygulanabilir, ifm çekirdekleri veya mitokondri saf popülasyonları izole etmek için yararlı olabilir. Manuel diseksiyonlar, çoğu aşağı uygulama için sağlam IFM dokusu elde etmek için hala geçerli standarttır.
Numune kalitesi, diseksiyon işlemindeki birkaç kritik adıma bağlıdır. Diseksiyonlar teknik olarak zorludur, diseksiyon hızı ve numune saflığı deneyimle artmaktadır. Deterjansız soğutulmuş tamponda kısa süreler (20-30 dk) diseksiyon ve hemen donma, fare tendon izolasyonu için daha önce de görüldüğü gibi numune bütünlüğünükorumaya yardımcı olur54. IFM'ler peletteki tüm arabelleği çıkardıktan sonra başarılı bir şekilde kurumaya biçilebilir, ancak özellikle RNA izolasyonu için, izolasyon arabelleğindeki dondurucu numuneler daha iyi sonuçlar verme eğilimindedir. 20 ayrı diseksiyondan ifm'ler RNA veya protein izolasyonundan önce birleştirilir, bu da ölçeklendirmeye ve yeterli malzemenin toplanmasına izin verir, hatta erken zaman noktalarından veya mutantlardan16,32, downstream analizi için.
RNA uygulamaları için en kritik adım RNA'nın kendisinin yalıtımı olabilir. Guanidinium tiyosiyanat-fenol-kloroform izolasyon (yukarıdaki yöntem 1) en ticari kitleri test daha iyi performans ve, daha önce belirtildiği gibi, önemli ölçüde daha az pahalı55. Ticari kitleri ile RNA izolasyon verimleri gözlenen değişkenlik önceki gözlemler ilerle aynı fikirde56,57. Biz daha fazla tüm RNA kurtarmak için izopropanol yağış sırasında glikojen ekleyin. RNA veriminin ötesinde, numunenin diseksiyon ve izolasyon işlemleri sırasında parçalanmadığından veya bozulmadığından emin olmak için RNA bütünlüğünü doğrulamak önemlidir. Ayrıca RNase-free çalışmak esastır. Son olarak, RT-kit seçimi ters transkripsiyon sürecinin hassasiyetini etkileyebilir. Sık sık ayrıntılı olarak tartışılmamakla birlikte, tüm bu noktalar IFM örneğinin kalitesini ve akış aşağı uygulamalarından elde edilen verileri etkiler.
Birçok önemli değişiklik protokolü mevcut IFM diseksiyon protokollerinden ayırıyor. IFM immünoresans için ayrıntılı bir diseksiyon protokolü19mevcut olmasına rağmen, bu protokol IFM dokusunun daha hızlı izolasyonsağlayan pupal diseksiyonlar için farklı bir yaklaşım sunar. Bu proteom veya transkripsiyon değişiklikleri önlemek için sınırlı diseksiyon süreleri ile IFM doku (nispeten konuşma) büyük miktarlarda toplanması sağlar. Diğer protokoller bireysel miyofibrils39 GFP boyama görselleştirmek için yetişkin IFM diseksiyon veya larva vücut duvarı kasları nın boyanması için58, ama pupal aşamalarında diseksiyon adresi veya RNA veya protein izolasyonu için. Bu yaklaşım aynı zamanda pupal IFM'lerin kriyos38'den mikrodisseksi için mevcut protokolden farklıdır , bu daha saf bir IFM örneği oluşturabilir, ancak daha fazla emek yoğundur ve daha az malzeme üretir. Diğer hızlı yetişkin IFM diseksiyon protokolleri ile karşılaştırıldığında38,39, IFM'ler stres indüksiyonve diğer önemli ifade değişiklikleri sınırlamak için deterjan olmadan PBS tampon izole edilir.
Bu protokoldeki en önemli ilerleme, ifm'lerin erken pupal aşamalarında izole edilmesine olanak sağlayan canlı, floresan bir muhabirin dahil edilmesidir. Biz standart olarak Mef2-GAL459 sürüş ya UAS-CD8:::GFP veya UAS-GFP::Gma60kullanın. Bu, IFM'nin diferansiyel etiketlemesini (uçuş kasları diğer pupal kaslara göre daha güçlü bir şekilde etiketlenmiş ve farklı biçimlidir) ve örneğin kurtarma veya RNAi deneyleri gibi GAL4-UAS tabanlı manipülasyonların performansına olanak tanır. RNAi ile ilişkili erken öldürücülüğü önlemek için mef2-GAL4'ü küvet-GAL80ts ile veya RNAi verimliliğini40artırmak için UAS-Dcr2 ile birleştirmek de mümkündür.
Ek GAL4 sürücüleri veya GFP-hatları kas tipi özgüllük, zamansal ifade deseni değişir ve sürücü gücü19,61 yerine Mef2-GAL4 kullanılabilir kullanılabilir. Örneğin, Act88F-GAL4 ilk olarak 24 saat APF civarında ifade edilir, bu nedenle önceki zaman dilimleri için kullanılamaz; ancak IFM'yi güçlü bir şekilde etiketler ve RNAi ile ilişkili erken öldürücülüğü önlemek yararlı olabilir. Onu-GFP veya Act88F-GFP etiket IFM, yine zamansal kısıtlamalar ile, ama marker ifade GAL4 bağımlılığı önlemek ve ilgi bir mutant arka plan ile birlikte yararlı olabilir. Diğer olası işaret satırlarının listeleri mevcuttur19. Ayrıca transgenlerin ve GAL4/UAS sisteminin kullanımının gen ekspresyonu eserlerine neden olabileceği de unutulmamalıdır, bu nedenle uygun kontrollerin kullanılması önemlidir, örneğin sürücü çizgisi vahşi tip arka plan gerilimine geçilir, böylece bu tür yapılar muhtemelen tüm örneklerde aynı.
Eşlik eden video ile, Bu ayrıntılı protokol pupal IFM diseksiyonu daha erişilebilir hale getirmek ve kas gelişimi çalışma omik yaklaşımların kullanımını teşvik amaçlamaktadır. Drosophila genetiğinin ve hücre biyolojisinin gücünü, parçalanmış IFM ile erişilebilen biyokimya ve omik tahlillerle biriktirmek miyogenez ve kas fonksiyonunun mekanistik anlayışını ilerletme potansiyeline sahiptir. Transkripsiyon ve proteom regülasyonunun sistem düzeyindeki gözlemlerini metabolik ve fonksiyonel çıktılara bağlayan gelecekteki çalışmalar, kas tipi spesifik gelişim ve kas bozukluklarının patogenezi hakkında daha derin bir anlayış sağlayacaktır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Andreas Ladurner ve Frank Schnorrer'a cömert destekleri için minnettarız. Sandra Esser'e mükemmel teknik yardım için ve Akanksha Roy'a kütle spektrometresi verilerini ürettiği için teşekkür ederiz. Biz sinek sağlamak için Bloomington ve Viyana stok merkezleri kabul ediyoruz. Her ikisi de LMU Biyomedikal Merkezi'nde (Martinsried, DE) kütle spektrometresi örneklerinin analizi için konfokal görüntüleme ve Zentrallabor für Proteinanalytik ile ilgili yardımları için Core Facility Bioimaging'e teşekkür ederiz. Çalışmalarımız Deutsche Forschungs Gemeinschaft (MLS, SP 1662/3-1), Ludwig-Maximilians-University München (MLS), Frederich-Bauer Stiftung (MLS) ve International Max entegre protein bilimi merkezi (CIPSM) tarafından desteklendi. Planck Araştırma Okulu (EN).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 5x High Fidelity (HF) buffer | Thermo Fisher | F518L | |
| 60 mm culture dishes | Sigma-Aldrich | Z643084-600EA | Greiner dishes, 60 mm x 15 mM, vented |
| Black dissecting dish (glass) | Augusta Laborbedarf | 42021010 | Lymphbecken, black glass, 4 cm x 4 cm |
| Black silicon dissecting dishes: activated charcoal powder | Sigma-Aldrich | C9157 | Also available from most pharmacies |
| Black silicon dissecting dishes: Sylgard 184 | Sigma-Aldrich | 761036 | Dishes are made by mixing the Sylgard (~50g) with activated charcoal powder (200 mg) and curing it in Petri dishes (~4 60 mm dishes). |
| Blue pestle | Sigma-Aldrich | Z359947-100EA | Any pellet pestle that can sterilized, also can be used with a motor-driven grinder |
| Cell phone camera, Samsung Galaxy S9 | Samsung | SM-G960F/DS | used for photos not taken under a microscope |
| Chloroform | PanReac AppliChem | A3691,0500 | |
| Confocal microscope, Leica SP8X upright confocal | Leica | www.leica-microsystems.com | |
| Confocal microscope, Zeiss LSM 780 inverted confocal | Zeiss | www.zeiss.com | |
| Double stick tape | Scotch/3M | 3M ID 70005108587 | Double-sided tape, available at most office supply handlers |
| Dumont #5 Forceps | Fine Science Tools | 11252-20 | Inox straight tip 11 cm forceps, Biology grade with 0.05 mm x 0.02 mm tip |
| EtOH (100%, RNase free) | Sigma-Aldrich | 32205-M | |
| fluorescent dissecting microscope camera, Leica DFC310 FX camera | Leica | www.leica-microsystems.com | |
| Fluorescent dissecting microscope software, Leica Application Suite (LAS) version 4.0.0 | Leica | www.leica-microsystems.com | |
| Fluorescent dissecting microscope, Leica M165 FC | Leica | www.leica-microsystems.com | |
| Fly: Bru1[M2] | Fly stock; This paper | ||
| Fly: Bru1[M3] | Fly stock; This paper | ||
| Fly: Mef2-GAL4 | Bloomington Stock Center | BDSC:27390 | Fly stock |
| Fly: salm[1] | Bloomington Stock Center | 3274 | Fly stock |
| Fly: salm[FRT] | Fly stock; see Spletter et al., Elife, 2018 | ||
| Fly: UAS-Bru1IR | Vienna Drosophila Research Center | GD41568 | Fly stock, RNAi hairpin |
| Fly: UAS-GFP::Gma | Bloomington Stock Center | BDSC:31776 | Fly stock |
| Fly: UAS-mCD8a::GFP | Bloomington Stock Center | BDSC:5130 | Fly stock |
| Fly: w[1118] | Bloomington Stock Center | 3605 | Fly stock |
| Fly: weeP26 | Fly stock; see Clyne et al., Genetics, 2003 | ||
| GFP detection reagent, GFP-Booster | ChromoTek | gba488-100 | |
| Glycogen | Invitrogen | 10814-010 | |
| Image processing software, Photoshop CS6 | Adobe | www.adobe.com | |
| Isopropanol | Sigma-Aldrich | I9516-25ML | 2-propanol |
| Method 1 (RNA isolation): TRIzol | Life Technologies | 15596018 | Guanidinium isothiocyanate and phenol monophasic solution |
| Method 2 (RNA isolation): Method 1 + TURBO DNA-free Kit | Invitrogen | AM1907 | TRIzol isolation followed by treatment with a kit to remove DNA |
| Method 3 (RNA isolation): Direct-zol RNA Miniprep Plus Kit | Zymo Research | R2070S | RNA isolation in TRIzol, but over commercial columns instead of using phase separation. Recommended DNase treatment performed with Monarch Dnase I in Monarch DNase I Reaction buffer. |
| Method 4 (RNA isolation): RNeasy Plus Mini Kit | Qiagen | 74134 | We used the provided DNase treatment. IFM pellets were homogenized in RTL buffer as suggested for animal tissues. |
| Method 5 (RNA isolation): ReliaPrep RNA Tissue Miniprep System | Promega | Z6110 | We applied the protocol for ‘Purification of RNA from Fibrous Tissues’. |
| Method 6 (RNA isolation): Monarch Total RNA Miniprep Kit | New England Biolabs | T2010G | We applied the protocol for tissues/leukocytes and lysed in 300 μL of RNA Protection Reagent. |
| Microcentrifuge tubes | Thermo Fisher | AM12400 | RNase-free Microfuge Tubes, 1.5 mL |
| Microscope slides | Thermo Fisher | 12342108 | Standard slides, uncharged, 1 mm |
| Microtome blades | PFM Medical | 207500003 | C35 feather 80 mm |
| Monarch DNase I | New England Biolabs | T2004-21 | |
| Monarch DNase I Reaction Buffer | New England Biolabs | T2005-21 | |
| Normal goat serum | Thermo Fisher | 16210072 | |
| OneTaq Polymerase | New England Biolabs | M0480X | |
| Paintbrush | Marabu | 1910000000 | Marabu Fino Round No. 0, or similar brush from any art supply |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| PBS buffer (1x) | Sigma-Aldrich | P4417 | Phosphate buffered saline tablets for 1 L solutions, pH 7.4 |
| PFA PureTip Pipette Tips | Elemental Scientific | ES-7000-0101 | Optional substitute for standard pipette tips to reduce sample loss; 100 mL, 0.8 mm orifice |
| Phusion High Fidelity Polymerase | Thermo Fisher | F-530XL | |
| Pipette tips | Sigma-Aldrich | P5161 | Universal 200 mL pipette tips |
| Preomics iST 8x Kit | Preomics | P.O.00001 | peptide preparation kit for mass spectrometry |
| Q Exactive mass spectrometer | Thermo Fisher | 725500 | mass spectrometry was performed at the Protein Analysis Unit of the LMU Biomedical Center |
| Qubit RNA Assay Kit | Life Technologies | Q32855 | |
| Rhodamine-phalloidin | Invitrogen, Molecular Probes | 10063052 | |
| RNA concentration Approach 1 & RNA integrity traces, Bioanalyzer | Agilent Technologies | G2939BA | |
| RNA concentration Approach 2, Nanodrop | Thermo Fisher | ND-2000 | |
| RNA concentration Approach 3, Qubit 4 Fluorometer | Invitrogen | Q33238 | |
| RNA Pico Chips | Agilent Technologies | 5067-1513 | |
| RNase A | Promega | A7937 | |
| RNase-free water, Diethyl pyrocarbonate (DEPC) | Sigma-Aldrich | D5758 | DEPC treat water overnight and then autoclave, to remove all RNase. |
| RT Kit #1: Super Script III Reverse Transcriptase Kit | Invitrogen | 18080-044 | reverse transcription kit |
| RT Kit #2: LunaScript | New England Biolabs | E3010S | reverse transcription kit |
| RT Kit #3: QuantiNova Reverse Transcription Kit | Qiagen | 205410 | reverse transcription kit |
| Slide mounting buffer, Vectashield | Vector Laboratories | H-1200 | containing DAPI |
| Statistical software: GraphPad Prism | GraphPad Prism | www.graphpad.com | |
| Statistical software: Microscoft Excel | Microsoft | Purchased as part of the bundle: Office Home & Student 2019 | |
| Table-top centrifuge | Eppendorf | 5405000760 | Eppendorf Centrifuge 5425 or equivalent |
| Tissue/ Kimwipes | Sigma-Aldrich | Z188956 | Standard tissue wipes |
| Transfer pipette | Sigma-Aldrich | Z350796 | Plastic pipette |
| Triton-X100 | Sigma-Aldrich | T9284-500ML | |
| Vannas spring scissors | Fine Science Tools | 15000-00 | 3 mm cutting edge, tip diameter 0.05 mm, length 8 cm |
| Whatman paper | Sigma-Aldrich | 1004-070 | Filter paper circles, Grade 4, 70 mm |
Referanslar
- Rexiati, M., Sun, M., Guo, W. Muscle-Specific Mis-Splicing and Heart Disease Exemplified by RBM20. Genes. 9 (1), 18 (2018).
- Guo, W., et al. RBM20, a gene for hereditary cardiomyopathy, regulates titin splicing. Nature Medicine. 18 (5), 766-773 (2012).
- Guo, W., et al. Splicing Factor RBM20 Regulates Transcriptional Network of Titin Associated and Calcium Handling Genes in The Heart. International Journal of Biological Sciences. 14 (4), 369-380 (2018).
- Nikonova, E., Kao, S. -. Y., Ravichandran, K., Wittner, A., Spletter, M. L. Conserved functions of RNA-binding proteins in muscle. The International Journal of Biochemistry & Cell Biology. 110, 29-49 (2019).
- Wang, E. T., et al. Dysregulation of mRNA Localization and Translation in Genetic Disease. The Journal of Neuroscience. 36 (45), 11418-11426 (2016).
- Wang, E. T., et al. Antagonistic regulation of mRNA expression and splicing by CELF and MBNL proteins. Genome Research. 25 (6), 858-871 (2015).
- Kalsotra, A., et al. A postnatal switch of CELF and MBNL proteins reprograms alternative splicing in the developing heart. Proceedings of the National Academy of Sciences of the United States of America. 105 (51), 20333-20338 (2008).
- Ho, T. H., et al. Muscleblind proteins regulate alternative splicing. The EMBO Journal. 23 (15), 3103-3112 (2004).
- Lemke, S. B., Schnorrer, F. Mechanical forces during muscle development. Mechanisms of Development. 144, 92-101 (2017).
- Iwamoto, H. Structure, function and evolution of insect flight muscle. Biophysics. 7, 21-28 (2011).
- Schnorrer, F., Dickson, B. J. Muscle building; mechanisms of myotube guidance and attachment site selection. Developmental Cell. 7 (1), 9-20 (2004).
- Spletter, M. L., Schnorrer, F. Transcriptional regulation and alternative splicing cooperate in muscle fiber-type specification in flies and mammals. Experimental Cell Research. 321 (1), 90-98 (2014).
- Benoist, P., Mas, J. A., Marco, R., Cervera, M. Differential muscle-type expression of the Drosophila troponin T gene. A 3-base pair microexon is involved in visceral and adult hypodermic muscle specification. Journal of Biological Chemistry. 273 (13), 7538-7546 (1998).
- Schönbauer, C., et al. Spalt mediates an evolutionarily conserved switch to fibrillar muscle fate in insects. Nature. 479 (7373), 406-409 (2011).
- Bryantsev, A. L., et al. Extradenticle and Homothorax Control Adult Muscle Fiber Identity in Drosophila. Developmental Cell. 23 (3), 664-673 (2012).
- Spletter, M. L., et al. The RNA-binding protein Arrest (Bruno) regulates alternative splicing to enable myofibril maturation in Drosophila flight muscle. EMBO Reports. 16 (2), 178-191 (2015).
- Oas, S. T., Bryantsev, A. L., Cripps, R. M. Arrest is a regulator of fiber-specific alternative splicing in the indirect flight muscles of Drosophila. The Journal of Cell Biology. 206 (7), 895-908 (2014).
- Kim, J. H., Jin, P., Duan, R., Chen, E. H. ScienceDirect Mechanisms of myoblast fusion during muscle development. Current Opinion in Genetics & Development. 32, 162-170 (2015).
- Weitkunat, M., Schnorrer, F. A guide to study Drosophila muscle biology. Methods. 68 (1), 2-14 (2014).
- Rai, M., Nongthomba, U., Grounds, M. D. Skeletal Muscle Degeneration and Regeneration in Mice and Flies. Mechanisms of Regeneration. 108, 247-281 (2014).
- Swank, D. M., Wells, L., Kronert, W. A., Morrill, G. E., Bernstein, S. I. Determining structure/function relationships for sarcomeric myosin heavy chain by genetic and transgenic manipulation of Drosophila. Microscopy Research and Technique. 50 (6), 430-442 (2000).
- de Joussineau, C., Bataillé, L., Jagla, T., Jagla, K. Diversification of muscle types in Drosophila: upstream and downstream of identity genes. Current Topics in Developmental Biology. 98, 277-301 (2012).
- Maqbool, T., Jagla, K. Genetic control of muscle development: learning from Drosophila. Journal of Muscle Research and Cell Motility. 28 (7-8), 397-407 (2008).
- Jagla, K., Kalman, B., Boudou, T., Hénon, S., Batonnet-Pichon, S. Beyond mice: Emerging and transdisciplinary models for the study of early-onset myopathies. Seminars in Cell & Developmental Biology. 64, 171-180 (2017).
- Haigh, S. E., et al. Drosophila indirect flight muscle specific Act88F actin mutants as a model system for studying congenital myopathies of the human ACTA1 skeletal muscle actin gene. Neuromuscular Disorders. 20 (6), 363-374 (2010).
- Batonnet-Pichon, S., et al. Myofibrillar Myopathies: New Perspectives from Animal Models to Potential Therapeutic Approaches. Journal of Neuromuscular Diseases. 4 (1), 1-15 (2017).
- Kreipke, R. E., Kwon, Y. V., Shcherbata, H. R., Ruohola-Baker, H. Drosophila melanogaster as a Model of Muscle Degeneration Disorders. Current Topics in Developmental Biology. 121, 83-109 (2017).
- Souidi, A., Zmojdzian, M., Jagla, K. Dissecting Pathogenetic Mechanisms and Therapeutic Strategies in Drosophila Models of Myotonic Dystrophy Type 1. International Journal of Molecular Sciences. 19 (12), 4104 (2018).
- Sparrow, J., Hughes, S. M., Segalat, L. Other Model Organisms for Sarcomeric Muscle Diseases. Advances in Experimental Medicine and Biology. 642, 192-206 (2008).
- Lloyd, T. E., Taylor, J. P. Flightless flies: Drosophila models of neuromuscular disease. Annals of the New York Academy of Sciences. 1184, 1-20 (2010).
- Swank, D. M. Mechanical analysis of Drosophila indirect flight and jump muscles. Methods. 56 (1), 69-77 (2012).
- Spletter, M. L., et al. A transcriptomics resource reveals a transcriptional transition during ordered sarcomere morphogenesis in flight muscle. eLife. 7, 1361 (2018).
- Weitkunat, M., Kaya-Çopur, A., Grill, S. W., Schnorrer, F. Tension and force-resistant attachment are essential for myofibrillogenesis in Drosophila flight muscle. Current Biology. 24 (7), 705-716 (2014).
- Gunage, R. D., Dhanyasi, N., Reichert, H., VijayRaghavan, K. Drosophila adult muscle development and regeneration. Seminars in Cell & Developmental Biology. 72, 56-66 (2017).
- Weitkunat, M., Brasse, M., Bausch, A. R., Schnorrer, F. Mechanical tension and spontaneous muscle twitching precede the formation of cross-striated muscle in vivo. Development. 144 (7), 1261-1272 (2017).
- Zappia, M. P., Rogers, A., Islam, A. B. M. M. K., Frolov, M. V. Rbf Activates the Myogenic Transcriptional Program to Promote Skeletal Muscle Differentiation. Cell Reports. 26 (3), 702-719 (2019).
- Zappia, M. P., Frolov, M. V. E2F function in muscle growth is necessary and sufficient for viability in Drosophila. Nature Communications. 7 (1), 10509 (2016).
- Bryantsev, A. L., et al. Myogenesis in Drosophila melanogaster: Dissection of Distinct Muscle Types for Molecular Analysis. Methods in Molecular Biology. 1889 (5), 267-281 (2019).
- Xiao, Y. S., Schöck, F., González-Morales, N. Rapid IFM Dissection for Visualizing Fluorescently Tagged Sarcomeric Proteins. Bio-Protocol. 7 (22), (2017).
- Kaya-Çopur, A., Schnorrer, F. RNA Interference Screening for Genes Regulating Drosophila Muscle Morphogenesis. Myogenesis. 1889, 331-348 (2019).
- Chechenova, M. B., et al. Functional redundancy and non-redundancy between two Troponin C isoforms in Drosophila adult muscles. Molecular Biology of the Cell. 28 (6), 760-770 (2017).
- Alberts, B. . Molecular Biology of the Cell. , (2017).
- Clyne, P. J., Brotman, J. S., Sweeney, S. T., Davis, G. Green fluorescent protein tagging Drosophila proteins at their native genomic loci with small P elements. Genetics. 165 (3), 1433-1441 (2003).
- Orfanos, Z., Sparrow, J. C. Myosin isoform switching during assembly of the Drosophila flight muscle thick filament lattice. Journal of Cell Science. 126 (1), 139-148 (2013).
- Volohonsky, G., Edenfeld, G., Klambt, C., Volk, T. Muscle-dependent maturation of tendon cells is induced by post-transcriptional regulation of stripeA. Development. 134 (2), 347-356 (2007).
- Estes, P. S., Ho, G. L., Narayanan, R., Ramaswami, M. Synaptic localization and restricted diffusion of a Drosophila neuronal synaptobrevin--green fluorescent protein chimera in vivo. Journal of Neurogenetics. 13 (4), 233-255 (2000).
- Hida, N., et al. EC-tagging allows cell type-specific RNA analysis. Nucleic Acids Research. 45 (15), 138 (2017).
- Thomas, A., et al. A versatile method for cell-specific profiling of translated mRNAs in Drosophila. PLoS ONE. 7 (7), 40276 (2012).
- Yang, Z. Isolation of mRNA from specific tissues of Drosophila by mRNA tagging. Nucleic Acids Research. 33 (17), 148 (2005).
- Jiao, Y., Moon, S. J., Montell, C. A Drosophila gustatory receptor required for the responses to sucrose, glucose, and maltose identified by mRNA tagging. Proceedings of the National Academy of Sciences of the United States of America. 104 (35), 14110-14115 (2007).
- Blazie, S. M., et al. Comparative RNA-Seq analysis reveals pervasive tissue-specific alternative polyadenylation in Caenorhabditis elegans intestine and muscles. BMC Biology. 13 (1), 1775-1821 (2015).
- Henry, G. L., Davis, F. P., Picard, S., Eddy, S. R. Cell type-specific genomics of Drosophila neurons. Nucleic Acids Research. 40 (19), 9691-9704 (2012).
- Deal, R. B., Henikoff, S. The INTACT method for cell type-specific gene expression and chromatin profiling in Arabidopsis thaliana. Nature Protocols. 6 (1), 56-68 (2011).
- Grinstein, M., Dingwall, H. L., Shah, R. R., Capellini, T. D., Galloway, J. L. A robust method for RNA extraction and purification from a single adult mouse tendon. PeerJ. 6 (8), 4664 (2018).
- Green, M. R., Sambrook, J. . Molecular Cloning. , (2012).
- Brown, R. A. M., et al. Total RNA extraction from tissues for microRNA and target gene expression analysis: not all kits are created equal. BMC Biotechnology. 18 (1), 16 (2018).
- Ford, K. L., et al. Optimisation of laboratory methods for whole transcriptomic RNA analyses in human left ventricular biopsies and blood samples of clinical relevance. PLoS ONE. 14 (3), 02136855 (2019).
- Ramachandran, P., Budnik, V. Dissection of Drosophila larval body-wall muscles. Cold Spring Harbor Protocols. (8), 5469 (2010).
- Ranganayakulu, G., Schulz, R. A., Olson, E. N. Wingless signaling induces nautilus expression in the ventral mesoderm of the Drosophila embryo. Developmental Biology. 176 (1), 143-148 (1996).
- Dutta, D., Bloor, J. W., Ruiz-Gómez, M., VijayRaghavan, K., Kiehart, D. P. Real-time imaging of morphogenetic movements in Drosophila using Gal4-UAS-driven expression of GFP fused to the actin-binding domain of moesin. Genesis. 34 (1-2), 146-151 (2002).
- Lemke, S. B., Schnorrer, F. In Vivo Imaging of Muscle-tendon Morphogenesis in Drosophila Pupae. Journal of Visualized Experiments. (132), e57312 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır