Method Article
Deneysel Evrim Yaklaşımında Plazmid Aracılı Antibiyotik Direncinin Ölçülmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Deneysel yaklaşımımız, bakteri popülasyonlarında plazmid bolluğu ve antibiyotik direncini zaman içinde takip etmek için bir strateji sağlar.
Özet
Plazmidler mikrobiyal ekoloji ve evrimde lateral gen transferi araçları ve mikrobiyal popülasyonlarda aksesuar gen fonksiyonlarının rezervuarları olarak önemli bir rol oynamaktadır. Bu özellikle antibiyotiklerin maruz kalma dalgalı gibi hızla değişen ortamlarda altında durumdur. Yakın zamanda plazmidlerin Escherichia coli'de plazmid varlığı için pozitif seçim olmaksızın antibiyotik direnci genlerini koruduğunu gösterdik. Burada, uzun süreli evrim deneylerinde hem plazmid genotipini hem de fenotipi takip eden deneysel bir sistemi tanımlıyoruz. Moleküler teknikleri, daha sonra bir E. coli konakta deneysel evrim toplu sistem yaklaşımına tanıtılan bir model plazmid tasarlamak için kullanırız. Antibiyotik direnci kalıcılığını ölçerken E. coli popülasyonlarının replika kaplamasını uygulayarak plazmid sıklığını zaman içinde takip ediyoruz. Ayrıca plazmid nicking ve agarose jel elektroforezi ile plazmid multimer oluşumunun derecesini analiz ederek konak hücrelerdeki plazmidlerin konformasyonu gözlemliyoruz. Böyle bir yaklaşım bize sadece gelişen plazmidlerin genom boyutunu değil, aynı zamanda plazmid kalıtım için son derece önemli bir faktör olan topolojik konformasyonu da görselleştirmemizi sağlar. Sistemimiz moleküler stratejileri geleneksel mikrobiyoloji yaklaşımları ile birleştirir ve uzun süre boyunca bakteri popülasyonlarında plazmidleri takip etmek için bir set-up sağlar. Sunulan yaklaşım gelecekte mobil genetik unsurların geniş bir yelpazede çalışma için uygulanabilir.
Giriş
Plazmidler prokaryotlarda her yerde bulunan dairesel, kendi kendini kopyalayan genetik elementlerdir. Onlar lateral gen transferi ajanları, onlar mikrobiyal popülasyonlar arasında özellikleri aktarabilirsiniz gibi, ve böylece mikrobiyal evrim önemli bir rol oynadığı kabul edilir. Plazmidler kısa bir süre içinde büyümeyi sınırlayan koşullara hızlı adaptasyonun itici nedenleridir (örneğin, antibiyotik veya pestisit lerin varlığında1)ve diğer yaşam tarzı modlarına uzun süreli geçişten sorumludurlar (örn. patojenitenin ortaya çıkışı2). Plazmidlerin gen transferi üzerindeki etkisine ilişkin en çarpıcı örnekler, tıbbi klinikler veya endüstriyel çiftlikler gibi dalgalı antibiyotik seviyelerine maruz kalan ekosistemlerde belgelenmiştir3. Güçlü pozitif seçilim nedeniyle, birçok plazmidantiantibiyal direnç genleri için kod ve genellikle kendi bakteriyel konak multiresistance vermek için bulunmuştur. Plazmidler popülasyonlar veya bakteri türleri arasında göçü sağlar ve bu da çoklu antimikrobiyal direncin hızlı bir şekilde yayılmasına neden olabilir. Nonselektif koşullar altında plazmidler hücre için gerekli değildir ve hatta genellikle parazitik elementler olarak adlandırılır. Yine de plazmidler doğada her yerde dir ve evrimleri bakteri kromozomları ile son derece iç içedir. Doğal ortamlarda plazmid kalıcılığı (dalgalanan ve nonselektif olmayan) kötü anlaşılmış kalır, henüz doğada antibiyotik direnci genlerinin kalıcılığı anlayışımız için yüksek önem taşımaktadır.
Deneysel evrim mikrobiyal popülasyonların incelenmesi için güçlü bir araçtır4. Deneysel evrim plazmid bakım için güçlü bir seçim heybetli olduğunu gösterdi kompansus (yani, adaptif) plazmid fitness maliyetini azaltır plazmid veya konak kromozom evrimi ve, sırayla, plazmid bolluğu kolaylaştırır (yani, plazmid kalıcılık)5,6,7. Böylece, plazmid-host etkileşimini zaman içinde takip etmek her iki elementin de adaptasyonunun önemli mekanizmalarını ortaya çıkarabilir. Ayrıca, deneysel evrim çeşitli koşullar altında plazmid taşıyan hücrelerin bolluğunu ölçmek için bir sağlar8,9,10.
Evrim deneylerinde plazmid kalıcılığı floresan aktif hücre sıralama (FACS)11, kantitatif PCR (qPCR)11, veya ekimtabanlı yöntemlerle akış sitometri sitometri sitometri sitometri sitometri sitometri sitometri sitometri sitometri sitometri sitometri sitometri sitometri sitometri sitometri sitometri sitometri sitometri sitometri situsisi ile izlenebilir. Akış sitometrisi bir FACS makinesi ve plazmid üzerinde yeşil floresan protein (GFP) gibi saptanabilir (floresan) marker geninin tanıtılmasını gerektirir. Ancak, GFP ekspresyonu çeşitli hücresel özellikleri değiştirebilir ve ayrıca hücre bölünmesi sırasında plazmid kalıtım etkileyebilir hücre12plazmid konumunu etkileyebilir. Plazmid bolluğunu ölçmek için bir qPCR yaklaşımı son derece bakteriyel büyüme fazı boyunca büyük ölçüde değişebilir plazmid kopya numarası ile önyargılı olabilir ve zaman içinde13. Son olarak, kültür tabanlı ve kaplama yaklaşımı seçilebilir bir marker geninin tanıtılmasını gerektirir. Bu genellikle doğal plazmidler üzerinde kodlanmış bir antibiyotik direnç geni olabilir; bu nedenle, hiçbir genetik manipülasyon gereklidir. Antibiyotik direnci geleneksel bir çoğaltma kaplama yaklaşımı takip edilebilir. Böylece, doğal plazmid dinamikleri çalışma, çoğaltma kaplama plazmid kodlanmış antibiyotik resisitance izlemek için uygundur14.
Plazmid moleküllerini görselleştirmek için (örn. plazmid boyutunu değerlendirmek için) çeşitli yöntemler uygulanabilir. Tüm plazmidler PCR tabanlı bir yaklaşım la güçlendirilebilir. Ancak, plazmid dizisi zaman içinde değişebilir, çünkü bu, bir evrim deneyi sırasında zor olabilir belirli astarlar, tasarımı gerektirir. Buna ek olarak, PCR astarlar için birden fazla bağlama siteleri nedeniyle PCR tabanlı bir yaklaşım plazmid multimerleri yükseltmek zordur. Multimerik plazmid molekülleri plazmid replikasyon sonlandırılması veya plazmid moleküllerinin rekombinasyonu ile aşağıdaki ortaya çıkabilir ve çoğunlukla baş-to-kuyruk15yönlendirilir. Plazmid görselleştirmenin bir diğer yaklaşımı, plazmid moleküllerinin enzimatik sindirimini, plazmid DNA iplikçiğini cleave veya nick agabroz jel elektroforez analizi ile oluşturan DNA ensonükleazları ile birleştirir. Farklı boyutlarda aynı plazmid (örneğin, monomerler vs multimers) plazmid molekülleri görselleştirirken gözlenebilir farklı jel mobiliteleri ile sonuçlanır. Bu yaklaşım, farklı plazmid konformasyonlarının (yani çok merizasyon durumlarının) görselleştirilmesini ve ölçülmesini sağlar. Plazmid konformasyonu plazmid stabilitesinin bir göstergesi olarak kullanılabilir, çünkü plazmid multimerleri hücre bölünmesi sırasında sıklıkla kaybolur16.
Yakın zamanda yaptığımız bir çalışmada, plazmid bolluğu için seçici olmayan koşullarda (antibiyotik seçimi olmadan) plazmid kalıcılığını takip ettik. Plazmid kalıcılığını iki farklı sıcaklıkta (20 °C ve 37 °C) ve üç popülasyon boyutunda (yani seyreltme oranları) karşılaştırdık. Çeşitli seyreltme oranları, ya da nüfus darboğazları uygulanması, bakteriyel ve plazmid evrimi üzerinde nüfus büyüklüğünün etkisinin araştırılması için izin verir. Sonuçlarımıza dayanarak, plazmidlerin bakteriyel konaklarına karşı nötr olabileceğini ve herhangi bir seçim basıncı olmadan stabiliteyi geliştirebileceğini öneriyoruz8. Gelişmiş plazmid stabilitesi plazmid multimer formasyonunun azaltılması ile verilir8.
Burada, plazmid kalıcılığının ölçülmesi ve plazmid evriminin antibiyotik direnci genlerinin bakımı ile ilgili olarak araştırılması için bir protokol sıyoruz. Yöntem, bir model plazmid bir antibiyotik direnç geninin eklenmesi de dahil olmak üzere çeşitli adımlar vardır (doğal bir direnç plazmid kullanırken atlanabilir), plazmid potansiyelini değerlendirmek için deneysel evrim kullanımı takip devam etmek replika kaplama kullanarak zaman içinde plazmid frekans dinamikleri belirlenirken nonselektif koşullar altında, ve görselleştirme ile plazmid genom analizi. Burada açıklanan protokol plazmidlerin evrimini ve kalıcılığını araştırmak için tasarlanmıştır, ancak zaman içinde kromozomal direnç genlerinin (veya diğer marker genlerin) evrimini takip etmek için de uygulanabilir.
Protokol
1. Antibiyotik direnç geni taşıyan bir model plazmidin yapımı
NOT: Escherichia coli K-12 MG1655 türü tüm deneylerde model organizma olarak kullanılmıştır (DSM No. 18039, Alman Mikroorganizmalar ve Hücre Kültürleri Koleksiyonu, DSMZ). E. coli DH5α17 suşplazmid yapımı sırasında kullanılmıştır.
- PCR seçtiğiniz plazmid omurgasını yükseltmek ve PCR tarafından organizatör bölge de dahil olmak üzere direnç geni yükseltmek(Şekil 1).
- PCR plazmid kalıbı pLC (GenBank acc. no) üzerinde plazmid omurgasını yüksek sadakatli polimeraz ve oligonükleotidpBBR1_for (5'-GCGGCCACCGGCTGGCTCT-3') ve pBBR1_rev (5'-TACCGGCGCCAGCGTGACCC-3') kullanarak güçlendirin. MH238456)18.
- PCR direnç gen nptII yerli Tn5 promotör19 yüksek sadakat polimeraz ve oligonükleotidler nptII_gib_for kullanarak dahil direnç gen nptII yükseltmek (5'-GCGCCCCGGATCTCTCTCTCTGTTGAAGCTGGGGGGCA-3') ve nptII_gib_rev (5'-CGGTGGCCCCCCCCAAAAAAAAAACCCCCCCCCAGGGGGGGGGGGGGGGGGGGGGGAGAAGAACTGT-3' kullanarak. NptII geni neomisin fosfotransferaz için kodlar ve kanamisin direnci ni verir.
NOT: Direnç geni için astarları, erimiş olacağı plazmid omurgasına yaklaşık 20 bp tamamlayıcı sıra ile tasarlayın.
- Seçtiğiniz bir kiti kullanarak her iki PCR parçasını da temizleyin.
- Saflaştırılmış antibiyotik direnci geni PCR ürününe (organizatörü bölge dahil) saflaştırılmış plazmid omurgasına katılın ve 50 °C'de 60 dakika boyunca isothermal montaj20kullanarak homolog bölgeleri birleştirin.
- Erimiş ürünü E. coli DH5α gerilimine elektroporate edin.
- 4 °C ve 2,5 kV'da 2 mm'lik kürlerde 1,3'ten 40°L'lik elektrobeceriksiz hücrelere kadar ürünün 2 μL'sini tanıtın. Hücreleri 1 mL'lik lysogeny suyu (LB) ortasında yeniden askıya alın.
- Plazmid üzerindeki direnç belirtecinin ekspresyonuna izin vermek için toplam hacmi bir mikrofuge tüpüne aktarın ve 37 °C'de 250 rpm'de orbital çalkalayıcıyla 1 saat kuluçkaya yatırın.
- Uygun antibiyotik içeren LB agar plakaları (kanamisin 25 μg/mL) içeren hücrelerin Plaka 100 μL antibiyotik direnci geni için seçin ve böylece plazmid taşıyan hücreler için seçin. Geri kalanını aşağı çevirin, süpernatant'ı çıkarın, 100°L LB'deki hücreleri ve seçici bir agar plakaüzerindeki plakayı yeniden askıya alın. Plakaları 37 °C'de 24 saat kuluçkaya yatırın.
- Klonları doğrulamak için, ticari bir mini hazırlık kiti kullanarak alkali lysis ile inşa plazmidler ayıklayın.
- Oda sıcaklığında 12.000 x g'de santrifüj ederek sabit bir gecede 5 mL hasat. Resuspension çözeltisi hücreleri resuspend, sonra lyse ve hücre çözeltisi nötralize. 12.000 x g5 dakika santrifüj .
- Süpernatant'ı kitte sağlanan DNA bağlama sütununa aktarın ve kolon membranını elüsasyon tamponuyla eluting yapmadan önce 500 μL yıkama çözeltisi santrifüjü yle iki kez yıkayın.
- Dizinin doğru olduğunu doğrulamak için plazmidin Sanger sıralamasını gerçekleştirin.
- Plazmid geçerliliği doğrulandıktan sonra, yukarıda açıklandığı gibi plazmidi (şimdi pCON) e. coli MG1655 gerilimine elektroporate. Bu gerilme E. coli MG1655 pCON verimleri.
2. Plazmid taşıyan bakterilerin zaman içinde çeşitli koşullar altında izlenmesi
NOT: Evrim deneyi, selektif olmayan koşullarda (LB media) iki sıcaklıkta (37 °C ve 20 °C) ve üç popülasyon darboğaz boyutunda plazmid taşıyan suşlarla gerçekleştirilmiştir. Deneysel tasarım çeşitli koşullar altında plazmid kalıcılığı incelemek için kullanılır.
- Zaman içinde plazmid frekansını takip etmek için bir evrim deneyinin tasarımı (Şekil 2)
- Lb agar plakalarında antibiyotiklerle takviye edilmiş (kanamisin 25 μg/mL) ve bir gecede 37 °C'de kuluçkaya yatırılan plazmid taşıyan suşu(E. coli MG1655 pCON) plakalayın.
- Her kuyuda 1 mL LB orta ile 96 derin kuyu plakası hazırlayın. Bakteri ataları olarak, bağımsız kuyularda agar plaka sekiz rasgele izole koloniler seçin. Plakaları 37 °C ve 450 rpm'de 24 saat boyunca bir tabak çalkalayıcıüzerinde kuluçkaya yatırın.
- Ertesi gün sekiz çoğaltma popülasyonları deneysel tasarıma göre yeni derin kuyu plakalarına aktarır(Şekil 2). Kültürler seyreltme için PBS kullanılarak 1 mL LB toplam hacmi 1:100 (büyük darboğaz, L), 1:1.000 (orta darboğaz, M) veya 1:10.000 (küçük darboğaz, S) seyreltilmiş. Seyreltilmiş kültürlerin her ikisi de 37 °C ve 20 °C'de kuluçkaya yatırılır.
NOT: 96-derin kuyu plakasında çapraz kontaminasyonun kontrol edilmesi son derece önemlidir. Böylece, bakteri içermeyen LB orta ile aşılanmış kuyular intercalating tarafından bir dama plaka tasarımı kullanın. Tüm evrim deneyi boyunca bu deseni kullanın. - 37 °C'de kuluçkaya yatan kültürler her 12 saatte bir, 20 °C'deki kültürler ise her 24 saatte bir aktarılır.
NOT: Her aktarım olayı sırasında darboğaz boyutu tedavisi uygulanır ve seri aktarım toplam 98 aktarım üzerinden tekrarlanır. Transfer sayısı okuyucuların deneysel tasarımına bağlıdır. - Düzenli olarak tüm popülasyonların dondurulmuş gliserol stok hazırlayın, 2x bir hafta.
- Plazmid frekansını çoğaltma kaplaması ile izleme (Şekil 3)
NOT: Evrim deneyi sırasında, popülasyonda plazmid taşıyan hücrelerin sıklığı konakların oranından tahmin edilmektedir. Çoğaltma kaplama protokolü Şekil 3'tegösterilmiştir.- Evrim deneyi sırasında popülasyondaki plazmid sıklığını belirlemek için, sabit kültürler seri olarak seyreltilir ve seçici olmayan LB agar plakaları üzerine kaplanır. Plaka başına 250-500 kolonilerin bir verim göre seyreltme ayarlayın.
NOT: Kaplamadan önce kalın LB agar plakaları hazırlayın (~30 mL agar). - Kaplama popülasyonları, deneydeki büyüme sıcaklıklarına göre bir gecede büyüme için kuluçkaya yatırılır.
NOT: Kolonilerin küçük olması gerekir, bu nedenle 37 °C'de kuluçka <24 saat. - Bir gecede büyümeden sonra, manuel veya otomatik koloni sayma istasyonu kullanarak tüm kolonileri sayın ve kültürlerdeki toplam bakteri popülasyon uyrcadını hesaplayın.
NOT: Agar plakasının kenarındaki koloniler toplam bakteri hücre sayısına dahil edilmemelidir. - Otoklavlama kare parçaları (~ 20 x 20 cm) pamuk kadife sterilize.
NOT: Kadife kumaşın otoklavlanabilmesi için %100 pamuk olması gerekir. Sterilizasyondan sonra bezin kurutulması önemlidir. - Kadife bez sterilizasyon sonra, yuvarlak bir blok üzerine bez yerleştirin ve metal bir halka ile düzeltmek. Kırışıklıkları önlemek için çok önemlidir. Dikkatle sabit kadife bez yüzeyinde büyümüş koloniler (agar aşağı bakan) ile plaka yerleştirin. Tüm kolonilerin Petri kabına dairesel bir şekilde dikkatlice dokunarak kadife yüzeye dokunduğundan emin olun.
- LB agar plakasını dikkatlice çıkarın ve kadife bezin üzerine antibiyotiklerle (kanamisin 25 μg/mL) takviye edilmiş seçici bir plaka yerleştirin. Plakanın daha önce açıklandığı gibi Petri kabına dikkatlice dokunarak tüm kadifeye dokunduğundan emin olun. Daha sonra, plakayı çıkarın. Gece büyüme için oda sıcaklığında plakaları bırakın.
- Ertesi gün, hem LB agar plaka ve seçici plaka değerlendirmek. Seçici ortamda yetişen koloniler plazmid konakları olarak sayılır (örn. antibiyotiğe dirençli), koloniiçermeyen noktalar plazmidiçermeyen kolonilerdir ve bu nedenle antibiyotiğe dirençli değildir (yani plazmidi kaybetmiştir). Bu, plakaları birbirinin üzerine koyarak ve büyümeyi karşılaştırarak (yani, eksik kolonileri işaretleyerek) ve her iki plakadaki koloni numarasını sayarak yapılır. Bu evrim deneyi sırasında plazmid kaybetti hücrelerin sayısını verir.
- Bu yordamı tüm evrim deneyi boyunca düzenli bir şekilde tekrarlayın (örn. her 14 transfer).
- Evrim deneyi sırasında popülasyondaki plazmid sıklığını belirlemek için, sabit kültürler seri olarak seyreltilir ve seçici olmayan LB agar plakaları üzerine kaplanır. Plaka başına 250-500 kolonilerin bir verim göre seyreltme ayarlayın.
3. Jel elektroforezkullanılarak plazmid multimerlerinin görüntülenmesi
NOT: Düşük kopya plazmidlerin plazmid ekstraksiyonu genellikle görüntülemeden önce enzimatik olarak sindirilmesi gereken konak kromozomal DNA ile kontaminasyona yol açar.
- Adım 1.5'te açıklandığı gibi alkali lysis kullanarak 5 mL sabit bir gece hücre kültüründen plazmid DNA ayıklayın.
- Daha sonra, çıkarılan plazmid DNA'sını sadece kromozom alınını ortadan kaldırmak için kromozom almını kesen ATP'ye bağımlı bir DNase ile tedavi edin(bkz. 37 °C'de 30 dk. Daha sonra seçtiğiniz bir kit kullanarak DNA'yı temizleyin.
- Tüm plazmid konformasyonlarının (monomerler veya multimerler) açık daire molekülleri oluşturmak için, plazmid DNA örneklerini bir çentik enzimi (Nb.BsrDI) ile kuluçkaya yatırın ve 65 °C'de 30 dakika kuluçkaya yatırın.
- Buna paralel olarak, lineer plazmid molekülleri oluşturmak için (yani, plazmid boyutu karşılaştırması için), plazmidi bir kez cleaves seçtiğiniz bir kısıtlama enzimi kullanın (örneğin, HindIII).
NOT: Bu lineer DNA plazmid monomerler ile sonuçlanır. Açık daire molekülleri doğrusal bir şekilde göç etmezler. - Plazmid boyutunu ve konformasyonu görselleştirmek için, 120 dk için 120 dk 4,3 V/cm'de %1 (w/v) agarose jel ve 1× TAE tamponu için çentikli ve lineer plazmid DNA örneklerini elektrofore edin. Örnekler Midori yeşili ile boyanmış ve jel bir jel görüntüleme sistemi üzerinde görselleştirilmiştir (Malzeme Tablosubakınız). 1 kbp merdiven kullanın.
Sonuçlar
Burada, plazmid evrimini bir popülasyonda plazmid kalıcılığını ölçerek incelemek için bir yaklaşım sayılacağız. İlk olarak, daha sonra bir evrim deneyi tanıtıldı E. coli suşu MG1655 pCON taşıyan plazmid oluşturmak için nasıl göstereceğimiz. İkinci olarak, gelişen bakteri popülasyonlarında plazmid bolluğunu takip etmek için basit bir yöntem salıyoruz. Son olarak, plazmid molekül übdeki boyutu ve konformasyonu nasıl görselleştirebileceğimizi gösteriyoruz.
Daha önceki çalışmamızda8' de sunulan yaklaşımı kullanarak, Antibiyotik yokluğunda E. coli'de antibiyotik direnci plazmidlerinin kalıcılığını takiben bir evrim deneyi gerçekleştirilmiştir(Şekil 4). Temsili sonuçlarımız 37 °C'deki popülasyonların evrimini ve seyreltme oranını 10-4olarak göstermektedir. Plazmid taşıyan hücrelerin bolluğunu takiben, zaman içinde plazmid taşıyan konak hücrelerinin sıklığında bir azalma gözlemledik(Şekil 4). Yaklaşımımız, plazmid kaybının yoğunlaştırılmış plazmid genom mimarisinin bir sonucu olduğunu keşfetmemizi sağladı, bu da direnç geninin transkripsiyonu ve plazmidin kendisinin replikasyonu ile ortaya çıkan çatışmaların neden olduğu plazmid dengesizliğine yol açtı. Plazmid moleküllerinin görselleştirilmesi, bu çatışmaların kararsız bir plazmid konformasyonuna yol açtığını keşfetmemizi sağladı (örn. plazmid çok meroluşumu, Şekil 5). Bununla birlikte, antibiyotiklere maruz kalmadan plazmid stabilite evrimini gözlemledik(Şekil 4). Evrimleşen istikrar, transkripsiyon-çoğaltma çatışmalarını ortadan kaldıran ve kalıtsal plazmidlerin oluşmasına yol açan plazmid içsel bir yineleme ile verildi. Böylece elde edilen sonuçlar, genetik elementlerin adaptif evriminde rekombinasyon ve genom amplifikasyonunun önemini göstermektedir.
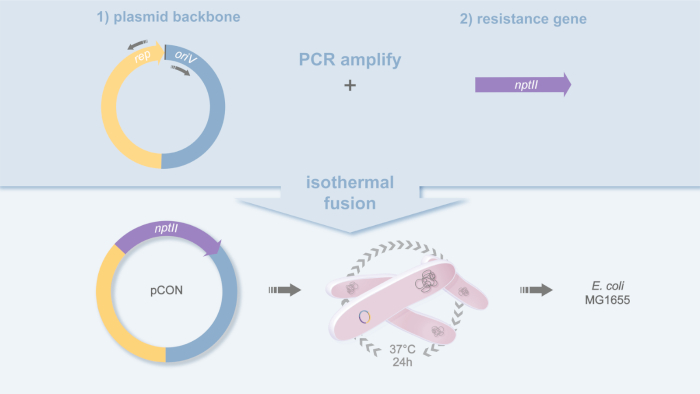
Şekil 1: pCON plazmid tasarımı. Plazmid pCON oluşturmak için kullanılan klonlama stratejisinin şematik temsili. Plazmid omurgası (pBBR1) ve antibiyotik direnci geni(nptII)PCR amplifikatörlü ve isotermal füzyon20ile erimiş. Bu plazmid pCON ve gerinim MG1655 pCON verir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
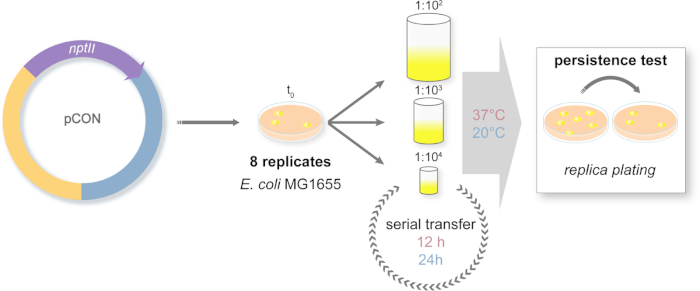
Şekil 2: Uzun vadeli evrim deneyinin tasarımı. Seri aktarım deneyinin şematik gösterimi. Plazmid taşıyan (pCON) popülasyonlar seçici ortama göre kaplanır. Atakolonileri plakadan rastgele seçilir ve seri transfer sistemine getirilir. Transferler, farklı boyutlardaki popülasyon darboğazlarını simüle etmek için üç farklı seyreltme yaklaşımıyla gerçekleştirilir. Seyreltmeler seri olarak tekrarlanır. Deney iki sıcaklık rejiminde gerçekleştirilir. Plazmid-host frekansı kopya kaplama ile deney boyunca ölçülür. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
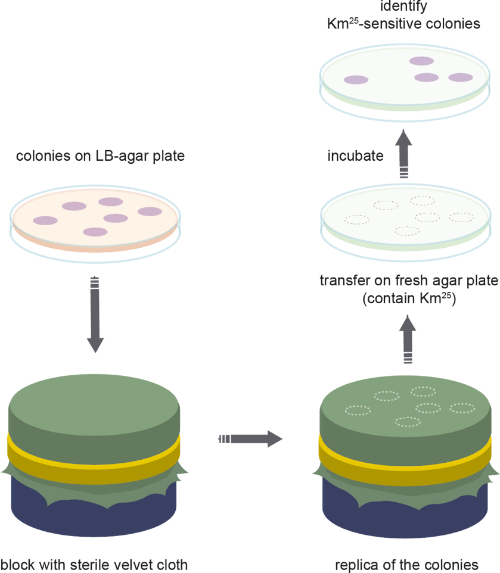
Şekil 3: Çoğaltma kaplama. Bakteri popülasyonlarının kopya kaplamasında kullanılan adımların şematik gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
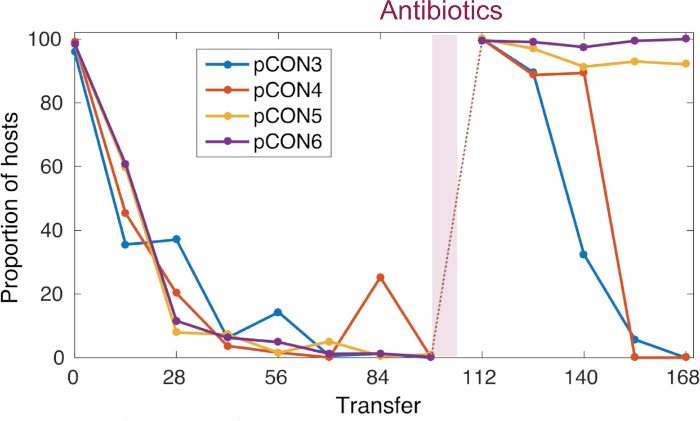
Şekil 4: Zaman içinde temsili pCON frekansı. pCON kalıcılığı, evrim deneyi sırasında ana bilgisayarların (temsili çoğalan popülasyonlar) oranı olarak gösterilir. 98 transferiçin, pCON plazmid popülasyonları 10-4seyreltme faktörü ile seçici olmayan koşullar altında gelişti. Plazmid pCON taşıyan tüm çoğaltmalar popülasyonda azalmıştır. Daha sonra popülasyonlar bir gecede kuluçka için antibiyotiklere maruz kalmış ve plazmid stabilite evrimini test etmek için selektif olmayan koşullar altında tekrar ekili olarak eklenmiştir. Bu rakam Wein ve ark.8'dendeğiştirilmiştir.
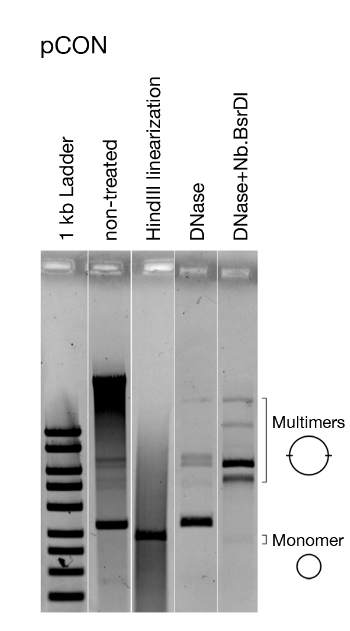
Şekil 5: Plazmid konformasyonunun temsili analizi. Plazmid pCON modelinin görselleştirilmesi. Görselleştirilmiş doğrudan ayıklama sonra işlenmemiş plazmid DNA, doğrusallaştırılmış plazmid DNA, ve dNase ile tedavi sadece kromozomal DNA keser yanı sıra enzimatik olarak nickli DNA (yani, açık daire plazmid DNA). Plazmiddoğrusallaştırma tüm plazmidlerin aynı boyutta olduğunu gösterir. Kromozom DNA'sının çıkarılması ve pCON'un çalınması dimer ve diğer multimerlerin varlığını ortaya çıkarır. Bu rakam Wein ve ark.8'dendeğiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolde, bakterilerde antibiyotik direncinin kalıcılığı için plazmid evriminin rolünü araştırmak için moleküler biyoloji, deneysel evrim ve DNA görselleştirme tekniklerini birleştiren bir yaklaşım sayılmaktadır. Sunulan yaklaşım farklı araştırma alanlarından gelen yöntemleri bir araya getirse de, uygulanan tüm teknikler basittir ve standart bir mikrobiyoloji laboratuvarında uygulanabilir.
Protokoldeki en kritik adımlar plazmid taşıyan genotipgenetik doğrulama içeren model sistem zorlanma inşaat içerir. Özellikle, birçok plazmidler doğal antibiyotik direnci genleri kodlamak. Böylece, okuyucu protokolün 1. Daha sonra, evrim deneyleri, sonuçların derin kuyu plakasındaki çoğaltma popülasyonlarının konumuna göre önyargılı olmaması için, çoğaltma popülasyonlarının rasgele bir tasarımını içermelidir. Buna ek olarak, kontaminasyon sonuçları tahrif edeceği için evrim deneyindeki seri aktarım ve seyreltme adımlarını dikkatli bir şekilde yürütmek özellikle önemlidir. Son olarak, çoğaltma kaplama büyük bir özenle yapılmalıdır. Büyük koloni boyutu bir sorun olabilir, ancak daha az 24 saat için plakalar kuluçka ile önlenebilir. Benzer şekilde, bir plaka üzerinde kolonilerin sayısı önyargı çoğaltma kaplama sonuçları olabilir. Bu nedenle, popülasyonların kaplama ve çoğaltma dan önce seyreltilmesi gerekir.
Yaklaşımımızın en büyük avantajlarından biri, ağır ekipmana ihtiyaç duymadan kolayca çoğaltılabilmedir. Buna ek olarak, çoğaltıcı kaplamanın marker genlerini takip etmesinin bir diğer avantajı da, ölü hücrelerin canlı olarak değerlendirilebileceği akış sitometrisi veya qPCR'nin aksine sadece canlı hücrelerin değerlendirilmesidir. Böylece, çoğaltma kaplama plazmid taşıyan hücrelerin sayma daha az önyargı tanıttı. Bununla birlikte, çoğaltma kaplama bir sınırlama popülasyon boyutu (yani, hücre numarası) bir deneysel çalışmada değerlendirmek mümkündür olabilir.
Yaklaşımımızı kullanarak, plazmid stabilite evriminin bakterilerdeki antibiyotik direnci genlerinin kalıcılığını güçlü kdığını gösterdik. Böylece, özellikle antibiyotik varlığı olmayan koşullarda zaman içinde direnci takip etmek için yüksek öneme sahip plazmid aracılı direnç kalıcılığını takip etmek için bir araç olarak bir yaklaşım geliştirdik.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Gor Margaryan'a yaratıcı destek ve teknik destek için teşekkür ederiz. Bu çalışma ZMB Genç Bilim Adamı Grant 2017/2018 (TW'ye verilmiştir) ve 1819 DFG odak programı (Grant No. DA1202/2-1 TD'ye verilir).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 96-deep-well plates | Starlab | ||
| 96-deep-well plates | Roth | EN07.1 | 2 ml, square |
| 96-deep-well plates (cryo) | Starlab | E1702-8400 | Micro-Dilution Tube System |
| Colony counter | Stuart | SC6+ | |
| Cotton velvet | drapery shop | 100 % cotton required | |
| Electrophoresis chamber | BioRad | Agarose gel electrophoresis | |
| Electrophoresis power supply | BioRad | 1645070 | Agarose gel electrophoresis |
| Electroporation cuvettes | BioRad | 1652089 | 0.1 cm |
| Electroporator | BioRad | 1652660 | |
| GeneJet Gel Extraction kit | Thermo Fisher Scientific | K0832 | PCR fragment clean-up |
| GeneJet Plasmid Miniprep kit | Thermo Fisher Scientific | K0503 | Plasmid extraction kit |
| Gibson Assembly | New England Biolabs | E2611S | |
| Incubator | Thermo Fisher Scientific | 50125852 | |
| Incubator (plate shaker) | Heidolph | 1000 | |
| Incubator (shaker) | New Brunswick Scientific | Innova 44 | |
| Inoculating loops | Sigma-Aldrich | ||
| Multi-channel pippetes | Eppendorf | 3125000052, 3125000028 | |
| Multi-channel pippetes | Capp | ME8-1250R | |
| NanoDrop 2000/2000c | Thermo Fisher Scientific | ND2000 | |
| Oligonucleotides | Eurofines | ||
| Petri dishes | Sigma-Aldrich | ||
| Phusion Polymerase | Thermo Fisher Scientific | F533S | |
| Pipettes | Eppendorf | 3123000012, 3123000098, 3123000055, 3123000063, | |
| PlasmidSafe enzyme | Epicentre | 10059400 | |
| Reaction tubes | Eppendorf | 30125150 | |
| Replica block & metal ring | VWR | 601-3401 | PVC cylinder 69 mm; ring 102cm |
| Resctriction enzymes | New England Biolabs | ||
| Thermocycler | BioRad | T100 |
Referanslar
- San Millan, A. Evolution of plasmid-mediated antibiotic resistance in the clinical context. Trends in Microbiology. 26 (12), 978-985 (2018).
- Bruto, M., James, A., et al. Vibrio crassostreae, a benign oyster colonizer turned into a pathogen after plasmid acquisition. The ISME Journal. 11 (4), 1043-1052 (2017).
- von Wintersdorff, C. J. H., et al. Dissemination of antimicrobial resistance in microbial ecosystems through horizontal gene transfer. Frontiers in Microbiology. 7 (110), 305-310 (2016).
- Lenski, R. E. Experimental evolution and the dynamics of adaptation and genome evolution in microbial populations. ISME Journal. 11 (10), 2181-2194 (2017).
- De Gelder, L., Williams, J. J., Ponciano, J. E. M., Sota, M., Top, E. M. Adaptive plasmid evolution results in host-range expansion of a broad-host-range plasmid. Genetics. 178 (4), 2179-2190 (2008).
- Harrison, E., Guymer, D., Spiers, A. J., Paterson, S., Brockhurst, M. A. Parallel compensatory evolution stabilizes plasmids across the parasitism-mutualism continuum. Current Biology. 25 (15), 2034-2039 (2015).
- Bouma, J. E., Lenski, R. E. Evolution of a bacteria/plasmid association. Nature. 335 (6188), 351-352 (1988).
- Wein, T., Hülter, N. F., Mizrahi, I., Dagan, T. Emergence of plasmid stability under nonselective conditions maintains antibiotic resistance. Nature Communications. 10 (1), 2595(2019).
- Loftie-Eaton, W., et al. Compensatory mutations improve general permissiveness to antibiotic resistance plasmids. Nature Ecology & Evolution. 1 (9), 1354-1363 (2017).
- Millan, A. S., et al. Positive selection and compensatory adaptation interact to stabilize non-transmissible plasmids. Nature Communications. 5 (1), 1-11 (2014).
- Loftie-Eaton, W., Tucker, A., Norton, A., Top, E. M. Flow cytometry and real-time quantitative PCR as tools for assessing plasmid persistence. Applied and Environmental Microbiology. 80 (17), 5439-5446 (2014).
- Münch, K. M., et al. Polar fixation of plasmids during recombinant protein production in Bacillus megaterium results in population heterogeneity. Applied and Environmental Microbiology. 81 (17), 5976-5986 (2015).
- Jahn, M., Vorpahl, C., Hübschmann, T., Harms, H., Müller, S. Copy number variability of expression plasmids determined by cell sorting and Droplet Digital PCR. Microbial Cell Factories. 15 (1), 211(2016).
- Lederberg, J., Lederberg, M. E. Replica plating and indirect selection of bacterial mutants. Journal of Bacteriology. 63, 399-406 (1952).
- Summers, D. K., Sherratt, D. J. Multimerization of high copy number plasmids causes instability: ColE1 encodes a determinant essential for plasmid monomerization and stability. Cell. 36 (4), 1097-1103 (1984).
- Summers, D. K., Beton, C. W., Withers, H. L. Multicopy plasmid instability: the dimer catastrophe hypothesis. Molecular Microbiology. 8 (6), 1031-1038 (1993).
- Hanahan, D. Studies on transformation of Escherichia coli with plasmids. Journal of Molecular Biology. 166 (4), 557-580 (1983).
- Ilhan, J., et al. Segregational drift and the interplay between plasmid copy number and evolvability. Molecular Biology and Evolution. 36 (3), 472-486 (2019).
- Beck, E., Ludwig, G., Auerswald, E. A., Reiss, B., Schaller, H. Nucleotide sequence and exact localization of the neomycin phosphotransferase gene from transposon Tn5. Gene. 19 (3), 327-336 (1982).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır