Method Article
실험적 진화 접근법에서 플라스미드 매개 항생제 내성의 정량화
요약
우리의 실험적인 접근은 세균성 인구에 있는 plasmid 풍부하고 항생 저항을 시간이 지남에 따라 전략을 제공합니다.
초록
플라스미드는 미생물 집단에서 부속 유전자 기능의 측면 유전자 전달 및 저수지의 차량으로서 미생물 생태학 및 진화에 중요한 역할을 합니다. 이것은 특히 변화하는 항생제 노출과 같은 급변하는 환경에서 그렇습니다. 우리는 최근에 플라스미드가 플라스미드 존재에 대한 긍정적 인 선택없이 대장균에서 항생 저항 유전자를 유지하는 것으로 나타났습니다. 여기에서 우리는 장기 적인 진화 실험에 있는 plasmid 유전자형 및 표현형을 둘 다 따르는 것을 허용하는 실험 시스템을 기술합니다. 우리는 분자 기술을 사용하여 대장균 숙주에서 실험적 진화 배치 시스템 접근법에 도입되는 모델 플라스미드를 설계합니다. 우리는 항생 저항 지속성을 정량화하는 동안 대장균 인구의 복제 도금을 적용하여 시간이 지남에 따라 플라스미드 주파수를 따릅니다. 또한, 우리는 플라스미드 니킹 및 아가로즈 겔 전기 영동에 의한 플라스미드 다중체 형성의 정도를 분석하여 숙주 세포에서 플라스미드의 형태를 모니터링합니다. 이러한 접근법을 통해 우리는 진화하는 플라스미드의 게놈 크기뿐만 아니라 플라스미드 상속에 매우 중요한 위상적 형태인 위상을 시각화할 수 있습니다. 우리의 시스템은 전통적인 미생물학 접근과 분자 전략을 결합하고 오랜 시간 동안 세균 성 인구에 있는 plasmids를 따르기 위하여 설치를 제공합니다. 제시된 접근법은 미래에 광범위한 모바일 유전 적 요소를 연구하기 위해 적용될 수 있다.
서문
플라스미드는 원핵생물에서 유비쿼터스인 원형의 자가 복제 유전 적 요소입니다. 그(것)들은 미생물 인구 사이 특료를 전송할 수 있기 때문에, 측량 유전자 전송의 에이전트이고, 따라서 미생물 진화에 있는 중요한 역할을 하기 위하여 여겨져 있습니다. 플라스미드는 단시간에 걸쳐 성장을 제한하는 조건에 대한 신속한 적응의 동인(예를 들어, 항생제 또는 살충제1의존재) 및 다른 라이프스타일 모드로의 장기적인 전환(예를 들어, 병원성2의출현)에 대한 책임이 있다. 유전자의 전송에 플라스미드의 충격에 대한 가장 눈에 띄는 예는 의료 진료소 또는 산업 농장에서 와 같은 항생제의 변동 수준에 노출된 생태계에서 문서화됩니다3. 강한 긍정적인 선택 때문에, 많은 플라스미드는 항균 저항 유전자를 위한 인코딩하고 수시로 그들의 세균성 호스트에 다중 저항을 부여하는 것을 발견됩니다. 플라스미드는 인구 또는 세균 종 간의 이동을 가능하게 하여 다중 항균 저항성의 급속한 전파를 초래합니다. 비선택적 조건하에서 플라스미드는 세포에 필수적이지 않으며 종종 기생 요소라고도 합니다. 그럼에도 불구하고, 플라스미드는 본질적으로 유비쿼터스이며 그 진화는 세균 성 염색체의 그것과 매우 얽혀 있습니다. 자연 환경 (변동 및 비 선택적)에서 플라스미드 지속성은 제대로 이해되지 않지만, 본질적으로 항생제 내성 유전자의 지속성에 대한 우리의 이해를 위해 매우 중요합니다.
실험적 진화는 미생물 집단의 연구를 위한 강력한도구입니다 4. 실험적 진화는 플라스미드 유지보수에 대한 강력한 선택을 부과하면 플라스미드 적당 비용을 감소시키는 플라스미드 또는 숙주 염색체의 보상(즉, 적응형) 진화로 이어지며, 차례로 플라스미드 풍부(즉, 플라스미드 지속성)를 용이하게 한다는 것을입증했다5,6,7. 따라서, 시간이 지남에 따라 플라스미드-숙주 상호작용을 따르는 것은 두 원소의 적응의 중요한 메커니즘을 드러낼 수 있다. 더욱이, 실험적 진화는 다양한 조건 하에서 시간이 지남에 따라 플라스미드 운반 세포의 풍부를 정량화할 수 있게 한다8,9,10.
진화 실험에서 플라스미드 지속성은 형광 활성화 세포 선별(FACS)11,정량적 PCR(qPCR)11,또는 재배 기반 방법에 의한 유세포분석법을 포함한 여러 전략에 의해 모니터링될 수 있다. 유세포측정법은 FACS 기계를 필요로 하며, 플라스미드상에서 녹색 형광 단백질(GFP)과 같은 검출 가능한(형광) 마커 유전자의 도입을 요구한다. 그러나, GFP 발현은 몇몇 세포 속성을 변경하고 또한 세포 분열 도중 플라스미드 상속에 영향을 미칠 수 있는 세포(12)에있는 플라스미드 위치에 영향을 미칠 수 있습니다. 플라스미드 풍부도를 측정하는 qPCR 접근법은 플라스미드 카피 수에 의해 매우 편향될 수 있으며, 이는 세균 성장 단계및 시간이 지남에 따라 크게 달라질 수있다 13. 마지막으로, 배양 기반 및 도금 접근법은 선택 가능한 마커 유전자의 도입을 요구한다. 이것은 종종 자연 플라스미드에 인코딩되는 항생제 내성 유전자일 수 있습니다. 따라서 유전 적 조작이 필요하지 않습니다. 항생 저항은 전통적인 복제 도금 접근에 선행될 수 있습니다. 따라서, 천연 플라스미드 역학을 연구하기 위해, 복제 도금은 플라스미드 인코딩된 항생제 반응성14를모니터링하는데 적합하다.
플라스미드 분자(예를 들어, 플라스미드 크기를 평가하기 위해)를 시각화하기 위해 여러 가지 방법이 적용될 수 있다. 전체 플라스미드는 PCR 기반 접근법을 사용하여 증폭될 수 있습니다. 그러나, 이것은 플라스미드 서열이 시간이 지남에 따라 변경될 수 있기 때문에 진화 실험 중에 어려울 수 있는 특정 프라이머의 설계를 필요로 한다. 또한, PCR 프라이머에 대한 다중 결합 부위로 인해 PCR 기반 접근법에서 플라스미드 멀티머를 증폭시키기가 어렵다. 다중 플라스미드 분자는 플라스미드 복제 종단 또는 플라스미드 분자의 재조합을 통해 나타날 수 있으며 대부분 머리에서꼬리까지 15를지향한다. 플라스미드 시각화의 또 다른 접근법은 아가로스 겔 전기 동공 분석과 플라스미드 DNA 가닥을 갈라지거나 닉하는 DNA endonucleases에 의해 플라스미드 분자의 효소 소화를 결합합니다. 상이한 크기의 동일한 플라스미드(예를 들어, 단량체 대 멀티머)는 플라스미드 분자를 시각화할 때 관찰될 수 있는 상이한 겔 동원을 초래한다. 이 접근 방식을 사용하면 다양한 플라스미드 적합성(즉, 다중화 상태)을 시각화하고 정량화할 수 있습니다. 플라스미드 형태는 플라스미드 멀티머가 세포분열(16)동안 자주 손실되기 때문에 플라스미드 안정성의 지표로서 사용될 수 있다.
최근 작업에서, 우리는 플라스미드 풍부를 위해 선택적이지 않은 조건에서 플라스미드 지속성을 따랐습니다 (즉, 항생제 선택없이). 우리는 두 개의 서로 다른 온도 (20 ° C 와 37 ° C)와 세 가지 인구 크기 (즉, 희석 속도)에서 플라스미드 지속성을 비교했습니다. 다양한 희석율 또는 인구 병목 현상을 적용하면 박테리아 및 플라스미드 진화에 대한 인구 규모의 영향을 조사할 수 있습니다. 우리의 결과에 따라, 우리는 플라스미드가 세균 성 숙주에게 중립적 일 수 있으며 선택 압력8없이안정성을 진화 시킬 수 있음을 제안합니다. 진화된 플라스미드 안정성은 플라스미드 멀티머 형성8의감소에 의해 부여된다.
여기서, 우리는 항생 저항 유전자의 유지에 관하여 플라스미드 진화의 plasmid 지속성 및 조사의 정량화를 위한 프로토콜을 제시한다. 이 방법은 모델 플라스미드에 항생제 내성 유전자의 삽입을 포함하여 여러 단계를 가지고 있습니다 (자연 저항 플라스미드를 사용할 때 생략 될 수 있음), 플라스미드의 잠재력을 평가하기 위한 실험적 진화의 사용이 뒤따릅니다. 비선택적 조건하에서 복제 도금을 이용하여 시간이 지남에 따라 플라스미드 주파수 역학을 결정하고, 시각화에 의한 플라스미드 게놈의 분석을 수행한다. 여기에서 기술된 프로토콜은 플라스미드의 진화 와 지속성을 조사하기 위하여 디자인되었습니다, 그러나 또한 염색체 저항 유전자의 진화를 따르기 위하여 적용될 수 있습니다 (또는 그밖 마커 유전자) 시간이 지남에 따라.
프로토콜
1. 항생제 내성 유전자를 운반하는 모델 플라스미드의 건설
참고: 균주 대장균 K-12 MG1655는 모든 실험에서 모델 유기체로 사용하였다(DSM No. 18039, 독일 미생물 및 세포 배양, DSMZ). 균주 대장균 DH5α17을 플라스미드 시공 시 사용하였다.
- PCR은 선택한 플라스미드 백본을 증폭시키고 PCR에 의해 프로모터 영역을 포함하는 내성 유전자를 증폭시다(도1).
- PCR은 플라스미드 템플릿 pLC(GenBank acc.no.) 상에서 고충실성 폴리머라제 및 올리고뉴클레오티드 pBBR1_for(5'-GCGGCCCCGGCTCT-3')와 pBBR1_rev(5'-TACCGGCGCGCGCGCGGCCC-3')를 사용하여 플라스미드 백본을 증폭시다. MH238456)18.
- PCR은 고충실도 폴리머라제 및 올리고뉴클레오티드 nptII_gib_for 사용하여 네이티브 Tn5 프로모터19를 포함하는 내성 유전자 nptII를 증폭(5'-GCGCCGGAGCTCTTGCGCGCCGCCC-3')와 nptII_gib_rev(5'-CGGTGGGGGCGCGCCGCCGCCGCAAAAAAGCCCGCCAGTGA)를 사용한다. nptII 유전자는 네오마이신 포스포트랜스퍼라제에 대해 인코딩하고 카나마이신에 대한 내성을 부여한다.
참고: 플라스미드 백본에 약 20 bp의 상보서열을 가진 저항성 유전자에 대한 프라이머를 설계하여 융합될 것이다.
- 선택한 키트를 사용하여 두 PCR 조각을 청소합니다.
- 정제된 항생 저항 유전자 PCR 생성물(이 의 프로모터 영역 포함)을 정제된 플라스미드 백본에 결합하고 등등조립체 20을사용하여 상동 영역을 융합시키고, 50°C에서 60분 동안.
- 융합된 생성물인 균주 대장균 DH5α를 전기화한다.
- 4°C 및 2.5 kV에서 2 mm 큐벳에 전기 유능한 세포의 40 μL에 단계 1.3에서 제품의 2 μL을 소개합니다. 리소제니 국물 (LB) 배지의 1 mL에서 세포를 다시 중단하십시오.
- 총 부피를 마이크로퍼지 튜브로 이송하고 37°C에서 250 rpm에서 교배하여 플라스미드 상에서 저항 마커의 발현을 허용한다.
- 플레이트 100 μL은 적절한 항생제(카나마이신 25 μg/mL)를 함유하는 LB 한천 플레이트 상에서 항생제 내성 유전자를 선택하고 따라서 플라스미드 운반 세포를 선택한다. 나머지를 스핀 다운, 상판을 제거, 100 μL LB에서 세포를 다시 중단하고 선택적 한천 접시에 플레이트. 플레이트를 37°C에서 24시간 동안 배양합니다.
- 클론을 확인하기 위해 상업용 미니 프렙 키트를 사용하여 알칼리성 용해를 통해 구성된 플라스미드를 추출합니다.
- 실온에서 12,000 x g에서 원심분리하여 고정된 하룻밤 배양물 5 mL을 수확한다. 재서스펜션 용액에서 세포를 다시 일시 중단한 다음 세포 용액을 용해시키고 중화시다. 12,000 x g에서5 분 동안 원심 분리기 .
- 키트에 제공된 DNA 결합 컬럼에 상온액을 전달하고 용출 완충액으로 컬럼 멤브레인을 용출하기 전에 2x 원심분리하여 500 μL 세척 용액으로 컬럼을 두 번 세척한다.
- 플라스미드의 Sanger 시퀀싱을 수행하여 서열이 올바른지 확인합니다.
- 플라스미드 타당성이 확인되면, 전술한 바와 같이 플라스미드(현재 pCON)를 균주 대장균 MG1655로 전기화한다. 이것은 변형 대장균 MG1655 pCON을 산출한다.
2. 시간이 지남에 따라 다양한 조건에서 플라스미드 운반 박테리아 모니터링
참고: 진화 실험은 2개의 온도(37°C 및 20°C)와 3개의 인구 병목 현상 크기에서 비선택적 조건(LB 매체)하에서 플라스미드 운반 균주를 가지고 진행됩니다. 실험 설계는 다양한 조건하에서 플라스미드 지속성을 연구하는 데 사용됩니다.
- 시간이 지남에 따라 플라스미드 주파수를 따르는 진화 실험의 설계(그림 2)
- 항생제(카나마이신 25 μg/mL)로 보충된 LB 한천 플레이트상에 구성된 플라스미드 운반균주(E. coli MG1655 pCON)를 플레이트하고 37°C에서 밤새 배양한다.
- 각 우물에 1 mL의 LB 배지로 96 개의 딥 웰 플레이트를 준비하십시오. 세균 조상으로, 독립적 인 우물에서 한천 접시에서 여덟 무작위 고립 된 식민지를 선택합니다. 플레이트 쉐이커에서 37°C 및 450 rpm에서 플레이트를 24시간 동안 배양합니다.
- 다음날 실험 설계에 따라 8개의 복제 인구를 새로운 딥 웰 플레이트로 옮김(그림2). 배양은 희석을 위해 PBS를 사용하여 총 부피 1mL LB에서 1:100(큰 병목 현상, L), 1:1,000(중간 병목 현상, M) 또는 1:10,000(작은 병목 현상, S)을 희석한다. 희석된 배양액은 모두 37°C 및 20°C에서 배양된다.
참고: 96-deep-well 플레이트의 교차 오염을 제어하는 것이 매우 중요합니다. 따라서, 박테리아가없는 LB 배지와 접종 웰을 상호 하여 바둑판 플레이트 디자인을 사용합니다. 전체 진화 실험을 통해이 패턴을 사용합니다. - 37°C에서 배양된 배양배양은 12시간마다 이송되고 20°C에서 배양하는 동안 24시간마다 이송된다.
참고: 모든 전송 이벤트 동안 병목 현상 크기 처리가 적용되고 총 98전송에 걸쳐 직렬 전송이 반복됩니다. 전송 수는 독자의 실험적 디자인에 따라 달라집니다. - 모든 인구의 냉동 글리세롤 주식을 정기적으로 준비, 일주일에 2 배.
- 복제 도금에 의한 플라스미드 주파수 모니터링(그림 3)
참고 : 진화 실험 동안, 집단에서 플라스미드 운반 세포의 빈도는 숙주의 비율에서 추정된다. 복제 도금 프로토콜은 그림 3에도시되어 있습니다.- 진화 실험 동안 인구의 플라스미드 주파수를 결정하기 위해 고정 배양은 비선택적 LB 한천 플레이트에서 연속적으로 희석되고 도금됩니다. 플레이트 당 250-500 콜로니의 수율에 따라 희석을 조정합니다.
참고 : 도금 전에 두꺼운 LB 한천 접시를 준비하십시오 (~ 30 mL 한천). - 도금 된 인구는 실험에서 그들의 성장 온도에 따라 하룻밤 성장을 위해 배양된다.
참고 : 식민지는 작아야하므로 37 ° C에서 배양 및 24 시간. - 하룻밤 성장 후, 수동 또는 자동화 된 식민지 카운트 스테이션을 사용하여 모든 식민지를 계산하고 배양에서 총 세균 인구 크기를 계산합니다.
참고: 한천 판 의 가장자리에 있는 콜로니는 총 세균 세포 수에 포함되지 않아야 합니다. - 토클레이브에 의한 면 벨벳의 사각 조각(~20 x 20cm)을 살균합니다.
참고: 벨벳 천은 오토클레이브가 가능하려면 면 100%이어야 합니다. 살균 후 천을 말리는 것이 중요합니다. - 벨벳 천을 살균 한 후 둥근 블록에 천을 놓고 금속 고리로 고정하십시오. 주름을 피하는 것이 중요합니다. 조심스럽게 고정 벨벳 천 표면에 성장 식민지 (한천 아래로 향하게)와 접시를 배치합니다. 모든 식민지가 조심스럽게 원형 방식으로 페트리 접시를 눌러 벨벳 표면에 닿는지 확인하십시오.
- LB 한천 접시를 조심스럽게 제거하고 항생제 (카나마이신 25 μg / mL)로 보충 된 선택적 접시를 벨벳 천에 놓습니다. 접시가 앞에서 설명한 대로 페트리 접시를 조심스럽게 눌러 모든 벨벳을 만지고 있는지 확인하십시오. 그 후 접시를 제거합니다. 하룻밤 성장을 위해 접시를 실온에서 둡니다.
- 다음날, LB 한천 플레이트와 선택적 플레이트를 모두 평가한다. 선택적 매체에 성장하는 식민지는 플라스미드 숙주 (즉, 항생제 내성)로 계산되며, 식민지가없는 반점은 플라스미드가없는 콜로니이며 따라서 항생제에 내성이없는 식민지입니다 (즉, 플라스미드를 잃었습니다). 이것은 서로 위에 판을 배치하고 성장을 비교 (즉, 누락 된 식민지를 표시) 두 판에 식민지 번호를 계산하여 수행됩니다. 이것은 진화 실험 도중 플라스미드를 분실한 세포의 수를 산출합니다.
- 전체 진화 실험을 따라 이 절차를 정기적으로 반복합니다(예: 14회 전송할 때마다).
- 진화 실험 동안 인구의 플라스미드 주파수를 결정하기 위해 고정 배양은 비선택적 LB 한천 플레이트에서 연속적으로 희석되고 도금됩니다. 플레이트 당 250-500 콜로니의 수율에 따라 희석을 조정합니다.
3. 젤 전기 동동을 사용하여 플라스미드 멀티머의 시각화
참고: 저카피 플라스미드의 플라스미드 추출은 종종 시각화 전에 효소적으로 소화되어야 하는 숙주 염색체 DNA로 오염을 유발합니다.
- 1.5단계에서 기재된 바와 같이 알칼리성 용해를 이용한 5 mL 고정된 하룻밤 세포 배양으로부터 플라스미드 DNA를 추출한다.
- 그 후, 염색체 DNA 오염을 제거하기 위해 염색체 DNA만 절단하는 ATP 의존적 DNase로 추출된 플라스미드 DNA를 치료합니다(재료 표참조). 37°C에서 30분 동안 배양한 후, 선택한 키트를 사용하여 DNA를 청소합니다.
- 모든 플라스미드 적합성(단량체 또는 멀티머)의 열린 원 분자를 생성하려면, 플라스미드 DNA 샘플을 닉킹 효소(Nb.BsrDI)로 배양하고 65°C에서 30분 동안 배양합니다.
- 병렬로, 선형 플라스미드 분자(즉, 플라스미드 크기 비교를 위해)를 생성하기 위해, 플라스미드를 한 번 절단하는 당신의 선택의 제한 효소(예를 들어, HindIII)를 사용한다.
참고 : 이것은 선형 DNA 플라스미드 단량체가 발생합니다. 열린 원 분자는 선형 방식으로 마이그레이션되지 않습니다. - 플라스미드 크기와 형태를 시각화하기 위해, 전기조는 아가로즈 겔 1% (w/v) 및 1× TAE 완충액에서 4.3 V/cm에서 120 분 동안 닉 및 선형 플라스미드 DNA 샘플을. 샘플은 Midori 녹색으로 염색되고 젤은 젤 이미징 시스템에서 시각화됩니다 (재료 표참조). 1kbp 사다리를 사용합니다.
결과
여기에서, 우리는 인구에 있는 plasmid 지속성을 정량화하여 플라스미드 진화를 공부하는 접근을 제시합니다. 첫째, 우리는 이후에 진화 실험에 도입되는 대장균 균주 MG1655 pCON을 운반하는 플라스미드를 구축하는 방법을 보여준다. 둘째, 우리는 진화하는 세균 집단에 있는 plasmid 풍부를 따르는 간단한 방법을 제시합니다. 마지막으로, 우리는 플라스미드 분자의 크기와 형태를 시각화하는 방법을 보여줍니다.
제시된접근법을 사용하여 8의 전작에서 우리는 항생제가 없는 대장균에서 항생제 내성 플라스미드의 지속성에 따른 진화 실험을 수행하였다(도4). 우리의 대표적인 결과는 37 °C에서 인구의 진화와10-4의희석 비율을 보여줍니다. 플라스미드 운반 세포의 풍부에 따라, 우리는 시간이 지남에 따라 주파수 플라스미드 운반 숙주 세포의 감소를 관찰하였다(그림4). 우리의 접근은 플라스미드 손실이 응축된 플라스미드 게놈 건축의 결과였다는 것을 것을을 발견하기 위하여 가능하게 했습니다, 저항 유전자의 전사 및 플라스미드 자체의 복제에 의해 소개된 충돌에 기인한 플라스미드 불안정성으로 이끌어 냈습니다. 플라스미드 분자를 시각화함으로써 이러한 충돌이 불안정한 플라스미드 형태(즉, 플라스미드 다중체 형성, 그림 5)로이어졌다는 것을 발견할 수 있었습니다. 그럼에도 불구하고, 우리는 항생제에 노출되지 않고 플라스미드 안정성 진화를 관찰하였다(그림4). 진화된 안정성은 전사-복제 충돌을 폐지하고 안정적으로 상속된 플라스미드의 형성으로 이어진 플라스미드 본질복제에 의해 부여되었다. 우리의 결과는 이렇게 유전 요소의 적응 진화에 있는 재결합 그리고 게놈 증폭의 중요성을 보여줍니다.
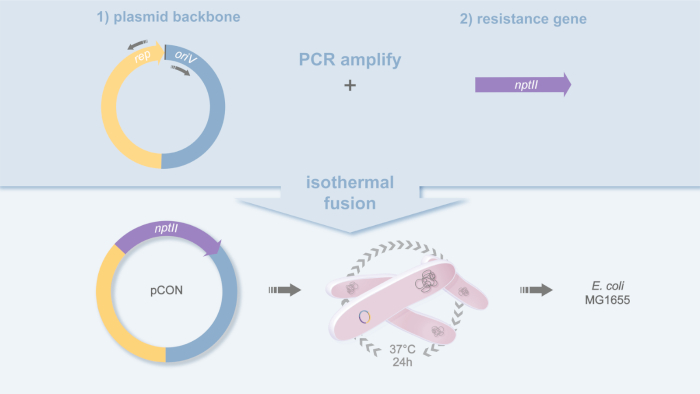
그림 1: pCON의 플라스미드 디자인. 플라스미드 pCON을 구축하는 데 사용되는 복제 전략의 개략적 표현. 플라스미드 백본(pBBR1) 및 항생제 내성유전자(nptII)는등등융합(20)에의해 PCR 증폭 및 융합된다. 이것은 플라스미드 pCON 및 스트레인 MG1655 pCON을 산출한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
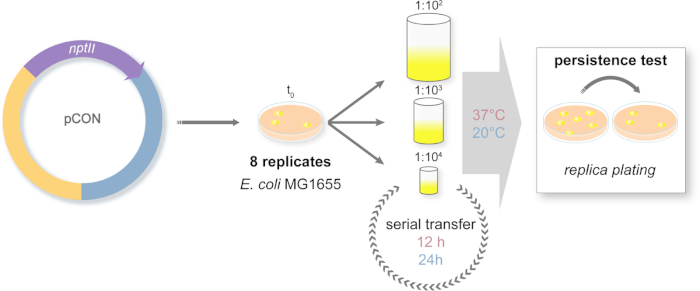
그림 2: 장기 진화 실험의 설계. 직렬 전송 실험의 개략적 표현입니다. 플라스미드 운반(pCON) 모집단은 선택적 매체에 도금된다. 조상 식민지는 무작위로 접시에서 선택되어 직렬 전송 시스템에 도입됩니다. 전송은 서로 다른 크기의 인구 병목 현상을 시뮬레이션하기 위해 세 가지 희석 접근법으로 수행됩니다. 희석은 연속적으로 반복됩니다. 실험은 2개의 온도 정권에서 수행된다. 플라스미드 숙주 주파수는 복제 도금을 통해 실험을 따라 측정된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
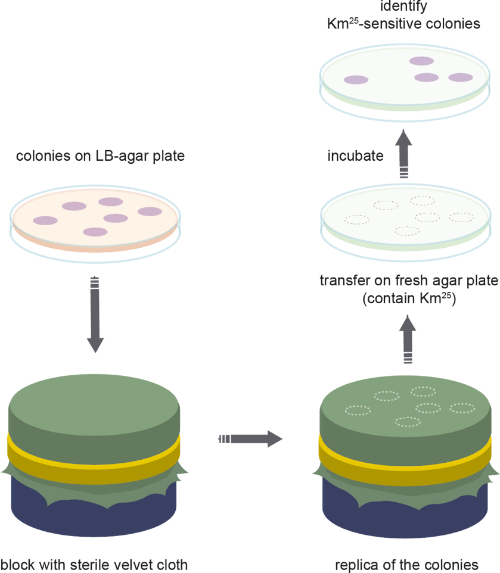
그림 3: 복제 도금. 세균 집단의 복제 도금에 사용되는 단계의 개략적 표현. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
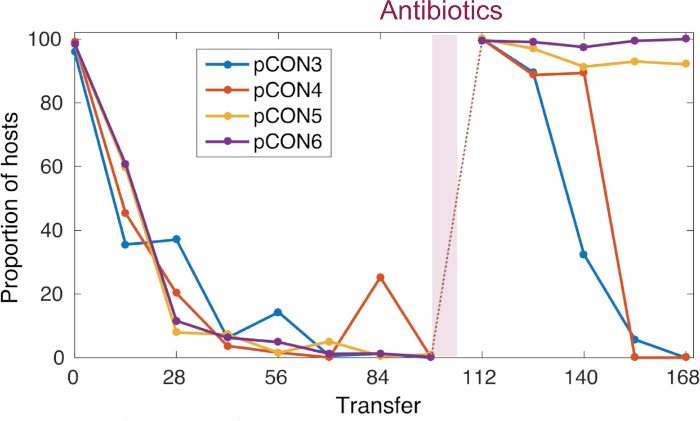
그림 4: 시간에 따라 대표pCON 주파수. pCON 지속성은 진화 실험 동안 호스트(대표 복제 모집단)의 비율로 나타난다. 98 전송을 위해, pCON 플라스미드 인구는10-4의희석 계수와 비선택적 조건 하에서 발전했습니다. 플라스미드 pCON을 운반하는 모든 복제는 인구에서 감소하였다. 그 후, 인구는 하룻밤 배양을 위한 항생제에 드러내고 플라스미드 안정성 진화를 위해 시험하기 위하여 비선택적 조건 하에서 다시 경배되었습니다. 이 그림은 Wein 등에서수정되었습니다. 8이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
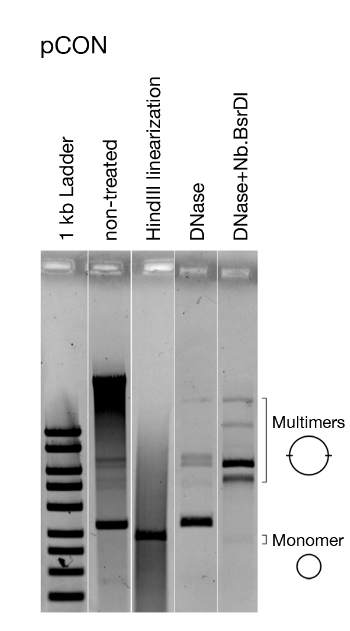
그림 5: 플라스미드 형태에 대한 대표적인 분석. 모델 플라스미드 pCON의 시각화. 가시화는 추출 후 직접 치료되지 않은 플라스미드 DNA, 선형화 플라스미드 DNA, 그리고 효소적으로 닉닉된 DNA(즉, 오픈 서클 플라스미드 DNA)만 절단하는 DNase로 처리됩니다. 플라스미드를 선형화하면 모든 플라스미드의 크기가 동일하다는 것을 알 수 있습니다. 염색체 DNA를 제거하고 닉핑 pCON은 이dimers 및 그밖 multimers의 존재를 제시합니다. 이 그림은 Wein 등 에서수정되었습니다. 8. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜에서는, 우리는 박테리아에 있는 항생 저항의 지속성을 위한 plasmid 진화의 역할을 조사하기 위하여 분자 생물학, 실험적인 진화 및 DNA 시각화에 있는 기술을 결합하는 접근을 제시합니다. 제시된 접근은 다른 연구 분야의 방법을 결합하더라도, 모든 적용된 기술은 간단하고 표준 미생물학 실험실에서 수행될 수 있습니다.
프로토콜에서 가장 중요한 단계는 플라스미드 운반 유전자형의 유전적 검증을 포함하는 모델 시스템 균주의 구성을 포함한다. 특히, 많은 플라스미드는 항생제 내성 유전자를 자연적으로 인코딩합니다. 따라서, 판독기는 프로토콜의 1단계를 생략하고 2단계로 직접 진행할 수 있다. 다음으로, 진화 실험은 결과가 깊은 우물 판에 복제 인구의 위치에 의해 편향되지 않도록 복제 인구의 무작위 디자인을 포함해야한다. 또한, 오염이 결과를 위조할 수 있으므로 진화 실험에서 직렬 전달 및 희석 단계를 신중하게 수행하는 것이 특히 중요하다. 마지막으로, 복제 도금은 세심한 주의를 기울여 수행되어야 합니다. 큰 콜로니 크기는 문제가 될 수 있지만, 24 시간 미만에 대한 플레이트를 인큐베이팅하여 피할 수 있습니다. 마찬가지로, 한 플레이트에 있는 콜로니의 수는 복제 도금 결과를 편향시킬 수 있습니다. 따라서 도금 및 복제 전에 인구를 희석해야 합니다.
당사의 접근 방식의 가장 큰 장점 중 하나는 중장비 없이도 쉽게 재현할 수 있다는 것입니다. 또한, 마커 유전자를 따르는 복제 도금의 또 다른 장점은 살아있는 세포만이 평가된다는 것입니다, 죽은 세포가 살아있는 것으로 평가될 수 있는 유세포 측정 또는 qPCR과는 대조적으로. 따라서, 복제 도금은 플라스미드 운반 세포의 계수에 대한 편향을 덜 도입한다. 그럼에도 불구하고, 복제 도금의 한 가지 제한은 하나의 실험 실행에서 평가할 수 있는 집단 크기(즉, 셀 수)일 수 있다.
우리의 접근을 사용하여, 우리는 최근에 플라스미드 안정성 진화가 박테리아에 있는 항생 저항 유전자의 지속성을 약하게 한다는 것을 보여주었습니다. 따라서, 우리는 특히 항생제의 존재없이 조건에서 시간이 지남에 따라 저항을 따르는 것이 매우 중요하다 플라스미드 매개 저항 지속성을 따르는 도구로 접근을 개발했다.
공개
저자는 공개 할 것이 없다.
감사의 말
창의적인 지원과 기술 지원을 해주신 고르 마가리안에게 감사드립니다. 이 작품은 ZMB 젊은 과학자 교부금 에 의해 지원되었다 2017/2018 (TW에 수여) 및 DFG 초점 프로그램 1819 (그랜트 번호. DA1202/2-1은 TD에 수여됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 96-deep-well plates | Starlab | ||
| 96-deep-well plates | Roth | EN07.1 | 2 ml, square |
| 96-deep-well plates (cryo) | Starlab | E1702-8400 | Micro-Dilution Tube System |
| Colony counter | Stuart | SC6+ | |
| Cotton velvet | drapery shop | 100 % cotton required | |
| Electrophoresis chamber | BioRad | Agarose gel electrophoresis | |
| Electrophoresis power supply | BioRad | 1645070 | Agarose gel electrophoresis |
| Electroporation cuvettes | BioRad | 1652089 | 0.1 cm |
| Electroporator | BioRad | 1652660 | |
| GeneJet Gel Extraction kit | Thermo Fisher Scientific | K0832 | PCR fragment clean-up |
| GeneJet Plasmid Miniprep kit | Thermo Fisher Scientific | K0503 | Plasmid extraction kit |
| Gibson Assembly | New England Biolabs | E2611S | |
| Incubator | Thermo Fisher Scientific | 50125852 | |
| Incubator (plate shaker) | Heidolph | 1000 | |
| Incubator (shaker) | New Brunswick Scientific | Innova 44 | |
| Inoculating loops | Sigma-Aldrich | ||
| Multi-channel pippetes | Eppendorf | 3125000052, 3125000028 | |
| Multi-channel pippetes | Capp | ME8-1250R | |
| NanoDrop 2000/2000c | Thermo Fisher Scientific | ND2000 | |
| Oligonucleotides | Eurofines | ||
| Petri dishes | Sigma-Aldrich | ||
| Phusion Polymerase | Thermo Fisher Scientific | F533S | |
| Pipettes | Eppendorf | 3123000012, 3123000098, 3123000055, 3123000063, | |
| PlasmidSafe enzyme | Epicentre | 10059400 | |
| Reaction tubes | Eppendorf | 30125150 | |
| Replica block & metal ring | VWR | 601-3401 | PVC cylinder 69 mm; ring 102cm |
| Resctriction enzymes | New England Biolabs | ||
| Thermocycler | BioRad | T100 |
참고문헌
- San Millan, A. Evolution of plasmid-mediated antibiotic resistance in the clinical context. Trends in Microbiology. 26 (12), 978-985 (2018).
- Bruto, M., James, A., et al. Vibrio crassostreae, a benign oyster colonizer turned into a pathogen after plasmid acquisition. The ISME Journal. 11 (4), 1043-1052 (2017).
- von Wintersdorff, C. J. H., et al. Dissemination of antimicrobial resistance in microbial ecosystems through horizontal gene transfer. Frontiers in Microbiology. 7 (110), 305-310 (2016).
- Lenski, R. E. Experimental evolution and the dynamics of adaptation and genome evolution in microbial populations. ISME Journal. 11 (10), 2181-2194 (2017).
- De Gelder, L., Williams, J. J., Ponciano, J. E. M., Sota, M., Top, E. M. Adaptive plasmid evolution results in host-range expansion of a broad-host-range plasmid. Genetics. 178 (4), 2179-2190 (2008).
- Harrison, E., Guymer, D., Spiers, A. J., Paterson, S., Brockhurst, M. A. Parallel compensatory evolution stabilizes plasmids across the parasitism-mutualism continuum. Current Biology. 25 (15), 2034-2039 (2015).
- Bouma, J. E., Lenski, R. E. Evolution of a bacteria/plasmid association. Nature. 335 (6188), 351-352 (1988).
- Wein, T., Hülter, N. F., Mizrahi, I., Dagan, T. Emergence of plasmid stability under nonselective conditions maintains antibiotic resistance. Nature Communications. 10 (1), 2595(2019).
- Loftie-Eaton, W., et al. Compensatory mutations improve general permissiveness to antibiotic resistance plasmids. Nature Ecology & Evolution. 1 (9), 1354-1363 (2017).
- Millan, A. S., et al. Positive selection and compensatory adaptation interact to stabilize non-transmissible plasmids. Nature Communications. 5 (1), 1-11 (2014).
- Loftie-Eaton, W., Tucker, A., Norton, A., Top, E. M. Flow cytometry and real-time quantitative PCR as tools for assessing plasmid persistence. Applied and Environmental Microbiology. 80 (17), 5439-5446 (2014).
- Münch, K. M., et al. Polar fixation of plasmids during recombinant protein production in Bacillus megaterium results in population heterogeneity. Applied and Environmental Microbiology. 81 (17), 5976-5986 (2015).
- Jahn, M., Vorpahl, C., Hübschmann, T., Harms, H., Müller, S. Copy number variability of expression plasmids determined by cell sorting and Droplet Digital PCR. Microbial Cell Factories. 15 (1), 211(2016).
- Lederberg, J., Lederberg, M. E. Replica plating and indirect selection of bacterial mutants. Journal of Bacteriology. 63, 399-406 (1952).
- Summers, D. K., Sherratt, D. J. Multimerization of high copy number plasmids causes instability: ColE1 encodes a determinant essential for plasmid monomerization and stability. Cell. 36 (4), 1097-1103 (1984).
- Summers, D. K., Beton, C. W., Withers, H. L. Multicopy plasmid instability: the dimer catastrophe hypothesis. Molecular Microbiology. 8 (6), 1031-1038 (1993).
- Hanahan, D. Studies on transformation of Escherichia coli with plasmids. Journal of Molecular Biology. 166 (4), 557-580 (1983).
- Ilhan, J., et al. Segregational drift and the interplay between plasmid copy number and evolvability. Molecular Biology and Evolution. 36 (3), 472-486 (2019).
- Beck, E., Ludwig, G., Auerswald, E. A., Reiss, B., Schaller, H. Nucleotide sequence and exact localization of the neomycin phosphotransferase gene from transposon Tn5. Gene. 19 (3), 327-336 (1982).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유