Method Article
Caenorhabditis elegans'tan Protein Özü Hazırlama ve Eş-immün premobpriktiasyon
Bu Makalede
Özet
Bu yöntem, Caenorhabditis elegans örneklerinden ve daha sonra eş-immünoselipitasyondan yüksek verimli protein özü hazırlanması için bir protokol açıklar.
Özet
Protein-protein etkileşimlerini incelemek için sıklıkla ko-immünoselipitasyon yöntemleri kullanılmaktadır. Hipotezlenmiş protein-protein etkileşimlerinin onaylanması veya yenilerinin tanımlanması, ilgi çekici bir proteinin işlevi hakkında paha biçilmez bilgiler sağlayabilir. Ekstrakt hazırlama için geleneksel yöntemlerden bazıları sıklıkla emek yoğun ve zaman alıcı teknikler gerektirir. Burada, boncuk değirmeni homojenizatörü ve metal boncuklar kullanılarak değiştirilmiş bir ekstrakt hazırlama protokolü, geleneksel protein hazırlama yöntemlerine hızlı bir alternatif olarak tanımlanmaktadır. Bu ekstrakt hazırlama yöntemi aşağı akış eş-immüno-immün önksepitasyon çalışmaları ile uyumludur. Örnek olarak, yöntem C. elegans mikroRNA Argonaute ALG-1 ve bilinen iki ALG-1 interactor'u başarıyla eş-immünprecipitate etmek için kullanıldı: AIN-1 ve HRPK-1. Bu protokol, hayvan örneği toplama, ekstrakt hazırlama, ekstrakt açıklama ve protein immün önseçiminin açıklamalarını içerir. Açıklanan protokol, çeşitli genetik geçmişlerde iki veya daha fazla endojen, endojen olarak etiketlenmiş veya aşırı ifade edilmiş C. elegans proteinleri arasındaki etkileşimleri test etmek için uyarlanabilir.
Giriş
İlgi çekici bir proteinin makromoleküler etkileşimlerini tanımlamak, işlevi hakkında daha fazla bilgi edinmenin anahtarı olabilir. İmmün prempripitasyon ve eş-immünovipitasyon deneyleri, büyük ölçekli proteomik yaklaşımlar1 yoluyla bir proteinin tüm etkileşimini tanımlamak veya bir proteinin hipotezlenmiş bir interactor ile işbirliği yapma yeteneğini özellikle test etmek için kullanılabilir. C. elegans'da, gen ekspresyonunu düzenlemek için mikroRNA'larla yakından çalışan proteinler de dahil olmak üzere çeşitli proteinlerin aktivitesi hakkında daha fazla bilgi edinmek için her iki yöntem de başarıyla 2,3,4. Ortak immün premünipitasyon deneyleri, protein-protein etkileşimlerini kendi doğal hücresel ortamlarında test etme avantajına sahiptir, ancak ekstrakt hazırlama zor ve zaman alıcı olabilir. Numunenin verimli lizisi gereklidir, ancak protein-protein etkileşimlerinin bozulmasını en aza indirmek için dikkatli olunmalıdır. C. elegans toplam protein özlerini başarıyla hazırlamak için5,sonication6, Balch homojenizasyon7ve zirkonya boncukları-homojenizasyon8,9 gibi yöntemler kullanılmıştır. Bu yöntemler, zirkonya boncuk homojenizasyonu dışında, aynı anda işlenebilen numune sayısı açısından sınırlamalara sahiptir. Sunulan, C. elegans örneklerinden yüksek verimli, hızlı protein özü hazırlanmasına izin vermek için kolayca ölçeklendirilebilen alternatif biryöntemdir. Özellikle, yöntem aynı anda 24 numune hazırlayabilir ve ekstrakt hazırlığı için gereken süreyi büyük ölçüde azaltabilir. Bunun aksine, örneğin, douncing genellikle aynı anda yalnızca bir örnek hazırlamaya izin verir. Bu ekstrakt yöntemi, C. elegans'ınherhangi bir gelişim aşamasından özler hazırlamak için kullanılabilir.
Açıklanan, başarılı protein çekme ve ortak immün önseçimli proteinin tespitini doğrulamak için hayvan örneği toplama, ekstrakt hazırlama, immün önseçimleme ve Batı şişkinlik verilerinin sunumu için adım adım bir prosedürdür. Protokolün etkinliğini göstermek için, 1) microRNA Argonaute ALG-1 ve GW182 homolog olan AIN-1 arasında iki ortak immün önseçim deneyi yapıldı; ve 2) ALG-1 ve HRPK-1, yeni tanımlanmış bir ALG-1 interactor2. ALG-1 ve AIN-1, mikroRNA kaynaklı susturma kompleksini (miRISC) oluşturan temel proteinlerdir ve bu iki protein arasındaki etkileşim iyi belirlenmiştir10,11. Ekstrakt hazırlama protokolü ALG-1-AIN-1 eş-immünoselipitasyon deneyinde etkili oldu. Bu protokol ayrıca ALG-1 ve yeni tanımlanan etkileşimcisi HRPK-12arasındaki etkileşimi başarıyla doğruladı.
Özetle, makale, proteinler arasındaki yeni veya hipotez etkileşimleri tanımlamak veya doğrulamak için kullanılabilecek bir eş-immün özürlülük protokolü ile birlikte 24 örneği aynı anda işlemek için ölçeklendirilebilen bir C. elegans özü hazırlama protokolünü tanımlamaktadır. Ekstrakt hazırlama protokolü, protein immün önkeksasyonu2 ve mikroRNA çekmeleri12dahil olmak üzere bir dizi aşağı akış deneyi ile uyumludur. Ayrıca, immün önksezi protokolü, çeşitli genetik geçmişlerde iki veya daha fazla endojen, endojen olarak etiketlenmiş veya aşırı ifade edilmiş C. elegans proteinleri arasındaki etkileşimleri test etmek için uyarlanabilir.
Protokol
1. Solucan numunesi toplama
- Ngm katı plakalarında gerekli sıcaklıkta tohum karışık aşaması veya senkronizeedilmiş 13 solucan ve solucanların istenen aşamaya kadar büyümesini sağlar. Temel C. elegans büyüme ve bakım için, stiernagle ve ark. ve Porta-de-la-Riva ve ark.14,13bakınız.
- Solucan plakalarını M9 tamponu ile yıkayarak solucanları 15 mL konik santrifüj tüpünde toplayın.
- Solucanları oda sıcaklığında (RT) 2 dakika boyunca 400 x g'da santrifüjleme yaparak peletlayın ve süpernatantı atın.
NOT: Ekstrakt hazırlama için solucan pelet boyutu 100 μL ile 500 μL arasındadır. Aşağı akış immün önkupitasyon deneyleri için 300 μL'lik bir solucan peleti önerilir ve tipik olarak toplam proteinin ~4,5 mg'ını, 500 μL'lik bir pelet ise ~7,5 mg toplam protein verir. - M9 tamponu ile ek 3-5 yıkama gerçekleştirin (bkz. Tablo 1) veya süpernatant artık bulutlu olana kadar.
- DDH2O ile son bir yıkama gerçekleştirin.
- Gevşek solucan peletini 1,5 mL mikrosantrifüj tüpüne taşıyın ve 2 dakika boyunca RT'de 400 x g'da aşağı doğru döndürün. Paketlenmiş bir solucan peleli elde etmek için kalan süpernatant atın ve hazırlığı çıkarmaya devam edin.
NOT: Protokol burada duraklatılabilir. Solucan topakları hemen sıvı nitrojende dondurulabilir ve -80 °C'de veya sıvı nitrojende saklanabilir. Solucan peletlerinin sadece bir kez çözülebileceğini ve yeniden çözüleemeyeceğini lütfen unutmayın.
2. Solucan peletinin hazırlanması
NOT: Ekstrakt hazırlığı buz üzerinde veya 4 °C'de yapılmalıdır.
- Donmuşsa, solucan peletlerini buzda çözün.
NOT: Numune toplama sırasında istenen 300 μL'lik paketlenmiş solucan pelet boyutu elde edilemezse, daha fazla ekstraksiyon için yeterli malzeme bulunana kadar birden fazla küçük pelet birleştirilebilir. - Eşit hacimde buz gibi 2x lizis tamponu ekleyin (60 mM HEPES, pH = 7.4, 100 mM potasyum klorür, %0.1 Triton X, 4 mM magnezyum klorür, %10 gliserol, RNase inhibitörü, proteaz inhibitörü ve fosfataz inhibitörleri ile 2 mM DTT; bkz. Tüpün altındaki karışımı toplamak için tüpleri aşağı çevirin.
- Karışımı metal boncuk içeren 1,5 mL RNase içermeyen bir tüpe taşıyın (bkz. Malzeme Tablosu)ve numuneyi boncuk değirmeni homojenizatörüne koyun (bkz. Malzeme Tablosu)4 °C'de. Tüp kapaklarının sıkılsın ve numuneler homojenizatör içinde dengelendirilsin.
- Numuneyi 4 dakika boyunca en yüksek hızda (ayar 12) homojenize edin.
- Numuneyi boncuklardan çıkarın ve yeni bir 1,5 mL mikrosantrifüj tüpüne yerleştirin. Alternatif olarak, boncukları numuneden çıkarmak için homojenizatör ile birlikte verilen bir mıknatıs kullanılabilir.
- Protein ekstresini netleştirmek için özü 4 °C'de 20 dakika boyunca 19.000 x g'da döndürün.
- Üst kısmı buz üzerinde taze bir 1,5 mL tüpe aktarın, bu arada numunenin üstünde oluşan beyaz, bulutlu çökeltmenin taşınmasından kaçının. Süpernatant artık netleştirilmiş özüdür.
NOT: Toplam protein konsantrasyonu belirlemek için netleştirilmiş ekstrakt 10 μL tasarruf edin. - Aşağıdaki deneyler için özü hemen kullanın veya özü sıvı nitrojende flaşla dondurun ve -80 °C'de saklayın.
NOT: Protokol burada duraklatılabilir. Ekstraktlar ultra düşük sıcaklıkta saklanabilir (-80 °C dondurucu veya sıvı azot ~6 ay). Dondurulmuş özler bir kez çözülebilir ve yeniden dondurulamaz. - Üreticinin talimatlarına göre deterjanlarla uyumlu bir protein konsantrasyonu test kiti kullanarak özün toplam protein konsantrasyonunun belirlenmesi (bkz. Malzeme Tablosu).
3. İmmün önseçme
NOT: Ekstrakt hazırlama için tüm immün önseçim adımları buz üzerinde veya 4 °C'de yapılmalıdır. Her immün önksepitasyon için 2 mg toplam protein kullanılması önerilir. Bununla birlikte, 0.8-1 mg toplam protein ile başarılı immün prempripitasyonlar gerçeklenmiştir. Her zaman taze veya taze çözülmüş protein özleri kullanın. Aşağıdaki protokol, 2 mg toplam proteinden veya tek bir immün önksepitasyon deneyinden immün önksepitasyon yapmak için özetlenmiştir. Boncuk ve antikor miktarı birden fazla örnek için veya farklı miktarda protein özü kullanılırsa arttırılabilir veya azaltılabilir.
- Protein özünü buza yerleştirin veya çözün. Numune buz gibi 1x lizis tamponu ile 10 mg/mL veya 5 mg/mL'ye seyreltilebilir (bkz. Tablo 1).
- Manyetik boncukları ters çevirme ile yeniden diriltin ve %50 boncuk süspansiyonunun 150 μL'sini 1,5 mL'lik bir tüpe aktarın. Boncukları 1 dakika boyunca veya çözelti netleşene kadar manyetik bir standa karşı buz üzerinde mıknatıslandırın. Üstnatant atın.
- Tüpü manyetik standdan çıkarın ve boncuk bulamacının 2 hacmini (yani 300 μL) kullanarak boncukları 1x lizis tamponunda yıkayın. Toplam üç yıkama için yıkamayı 2x tekrarlayın.
- Boncukları 150 μL buz gibi lizis tamponunda yeniden depola.
- Boncuk bulamacının 75 μL'sini 2 mg protein özüne aktarın ve nazik ajitasyonla 1 saat boyunca 4 °C'de kuluçkaya yatırın. Kalan boncuk süspansiyonu daha sonra kullanmak üzere buz üzerinde sakla.
NOT: Bu adım, immün önseçme adımı sırasında boncuklara spesifik olmayan protein bağlanmasını azaltmak için gerçekleştirilir. - Numuneli tüpü 1 dakika boyunca veya boncuklar tamamen mıknatıslanana ve numune temizlenene kadar buz üzerindeki manyetik standa yerleştirin. Süpernatant yeni bir 1.5 mL tüpe aktarın; boncukları rahatsız etmeyin. Bu önceden tanımlanmış protein lysate. Batı leke analizi için numunenin %10'unu sakla.
- Önceden tanımlanmış lysate 20 μg benzeşim saflaştırılmış antikor ekleyin ve nazik ajitasyon ile 1 saat boyunca 4 °C'de kuluçkaya yatırın.
NOT: İmmün prempripitasyon için kullanılan antikor miktarı antikor ve proteine özgüdür ve hedef proteinin etkili immün önksezisini sağlamak için ampirik olarak belirlenmelidir. - Önceden yıkanmış boncuk süspansiyonunun kalan 75 μL'lik kısmını (adım 3,5) antikor/lisat karışımına ekleyin ve hafif ajitasyonla 4 °C'de 1 saat kuluçkaya yatırın.
- Tüpü manyetik standa 1 dakika boyunca veya boncuklar tamamen mıknatıslanana ve numune temizlenene kadar buz üzerinde yerleştirin. Batı blot analizi için süpernatantı kaydedin (isteğe bağlı).
- İmmünprecipitate 3x içeren boncukları 450 μL yıkama tamponunda (30 mM HEPES, pH = 7,4, 100 mM potasyum klorür, %0,1 Triton X, 2 mM magnezyum klorür, %10 gliserol, 1 mM DTT; bkz. Tablo 1)buz üzerinde yıkayın.
NOT: Daha sıkı yıkama koşulları tercih edilirse ek yıkamalar yapılabilir. - Boncuk peletini 20 μL 2x SDS/BME protein jeli yükleme tamponuna (bkz. Malzeme Tablosu)ve denatüreyi bir SDS-PAGE jeline yüklenmeden önce 95 °C'de 5 dakika kaynatarak yeniden kullanın. Alternatif olarak, denatüre numuneler birkaç ay boyunca -20 ° C'de saklanabilir.
NOT: İstenirse, boncuk immünödeksilatın bir kısmı aşağı akış RNA izolasyonu için kaydedilebilir.
4. IP örneklerinin Batı lekesi tespiti
- IP örneklerini SDS-PAGE jeline yükleyin (bkz. Malzeme Tablosu). IP tüplerini numunenin aspirasyonundan önce 1 dakika boyunca manyetik standa yerleştirerek boncukları aktarmaktan kaçının.
- Batı şişkinliğini15,16 ve antikor boyama16'yı aşağıdaki değişikliklerle gerçekleştirin: ALG-1 antikorunu% 5 yağsız kuru sütte (NFDM)17 1:500 seyreltin; HRPK-1 antikor 2 1:1.000%5 NFDM'de seyreltin; ve AIN-1 antikor 18 1:10.000%NFDM'de seyreltin. İkincil antikorlar (bkz. Malzeme Tablosu)üreticinin talimatlarına göre kullanılmıştır.
- Hrp bazlı kemimuminesans ile bantları tespit edin (bkz. Malzeme Tablosu).
Sonuçlar
Bu protokol (Şekil 1'deşematize edilmiş) birkaç proteinin aşağı akış immün önkupitasyonu için C. elegans toplam protein özlerini (Şekil 2) elde etmek için başarıyla kullanılmıştır2 (Şekil 3 ve Şekil 4). Sunulan boncuk değirmeni homojenizatör protokolü, toplam protein ekstraksiyonunda dounce bazlı yöntemlerle (Şekil 2) ve verimli bir şekilde çıkarılan nükleer (COL-19::GFP(NLS) (Şekil 2) ve sitoplazmik proteinlerle karşılaştırılabilirdi (Şekil 3 ve Şekil 4). Çeşitli boyutlarda birden fazla örnek aynı anda çıkarılmıştır(Şekil 2). Argonaute proteinleri GW182 protein ailesinin üyeleriyle etkileşime girerek hedef haberci RNA'lara bağlanan ve ifadelerini bastıran miRISC'leri oluşturur10. Şekil 3, öncekiraporlar11,17ile tutarlı olarak çekirdek miRISC bileşenleri ALG-1 ve AIN-1'in başarılı bir şekilde eş-immün önseçimini göstermektedir. Daha yakın zamanda, mikroRNA biyogenez ve aktivitenin yardımcı faktörler tarafından nasıl düzenlenebileceği hakkında daha fazla bilgi edinmek için ArgonauteALG-1 3'ün ek protein etkileşimcilerini belirlemeye yönelik çalışmalar yapılmıştır. RNA bağlayıcı protein HRPK-1, ALG-1 immünoprecipitates3'tetanımlanmıştır. Bu etkileşim yakın zamanda karşılıklı bir HRPK-1 immün önksepitasyon deneyi2'de doğrulandı. Sunulan ekstrakt ve immün premünipitasyon protokolleri HRPK-1'e özgü ko-immünoselipitaitlerde ALG-1'i başarıyla geri kazanmıştır (Şekil 4). Buna ek olarak, ALG-1-AIN-1 etkileşimi çeşitli genetik arka planlarda test edildi ve HRPK-1'in ALG-1/AIN-1 miRISCderlemesi 2 (Şekil 3)için gereksiz olduğu gösterildi. Ek rakamlar, tam membran problanmış olarak göstermek için sağlanmıştır(Ek Şekil 1).
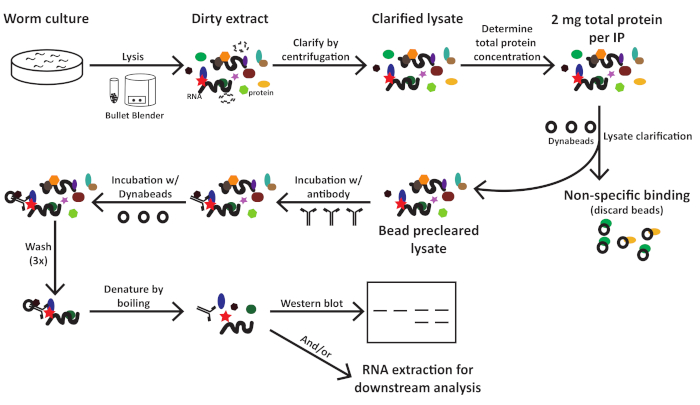
Şekil 1: C. elegans özü hazırlama ve immün önkupseleme için iş akışı şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
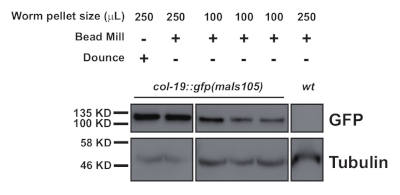
Şekil 2: Nükleer lokalize GFP, COL-19::GFP (NLS), 250 μL ve 100 μL solucan peletlerinden dounce hazırlanmış ve homojenize numunelerdeki seviyelerin Batı blot karşılaştırması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
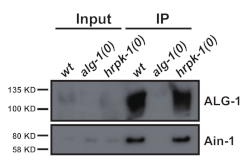
Şekil 3: GW182 homolog AIN-1 ALG-1 ile birlikte immünoselipitatlar. ALG-1 immünöteritlerinde ALG-1 ve AIN-1 proteinleri için batı şişkinliği. ALG-1/AIN-1 ko-immünopipitasyonu hrpk-1'in yokluğundan etkilenmedi. Giriş = IP'nin %10'unu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: ALG-1 HRPK-1 ile eş-immünoprecipitates. HRPK-1'de HRPK-1 ve ALG-1 için Batı blottingi gösterilmiştir. Giriş = IP'nin %10'unu. * antikor ağır zincirini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| M9 arabelleği (1 L) | |
| KH2PO4 | 3 g |
| Na2HPO4 | 6 g |
| NaCl | 5 g |
| 1 M MgSO4 | 1 mL |
| ddH2O | 1 L'ye kadar |
| 2x Lizis tamponu (5 mL) | |
| HEPES (pH 7.4) | 200 μL |
| 2 M KCl | 250 μL |
| %10 TritonX | 100 μL |
| 1 M MgCl2 | 20 μL |
| %100 gliserol | 1 mL |
| ddH2O | 5 mL'ye kadar |
| Taze ekleyin: | |
| 1 M DTT | 20 μL |
| EDTA içermeyen proteaz inhibitörü | 1 tablet |
| fosfataz inhibitörü kokteyl 2 | 100 μL |
| fosfataz inhibitörü kokteyl 3 | 100 μL |
| 1x Lizis arabelleği | |
| 2x Lizis tamponu eşit hacimde ddH20 ile seyreltin. | |
| 1x Yıkama tamponu 10 mL) | |
| HEPES (pH 7.4) | 300 μL |
| 2 M KCl | 500 μL |
| %10 TritonX | 100 μL |
| 1 M MgCl2 | 20 μL |
| %100 gliserol | 1 mL |
| ddH2O | 10 mL'ye kadar |
| 1 M DTT | 20 μL (taze ekleyin) |
Tablo 1: Tarifler
Ek Şekil 1. Şekil 2-4 oluşturmak için kullanılan tam problu Batı leke zarları gösterilmiştir. (A) Şekil 2 için problanmış membran. Membran, GFP ve Tubulin için eşzamanlı problama için kesildiğini ve genel leke boyutunu azalttığını unutmayın. (B) Şekil 3 için problanmış membran. (C) Şekil 3 için problanmış membran. *antikor ağır zincirini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
C. elegans hücre, moleküler ve gelişim biyolojislerindeki temel soruları incelemek için mükemmel bir modeldir19. Genetik bir model sistemi olarak gücüne ek olarak, C. elegans protein immüno-immün önseçim ve eş-immünoselipitasyon dahil ancak bunlarla sınırlı olmamak üzere biyokimyasal yaklaşımlara açıktır. İmmün prempripitasyon deneyleri yaparken olası bir engel, ilgi proteinlerine özgü antikorların eksikliğidir. Antikor yoksa özel poliklonal veya monoklonal antikorlar üretilebilir. Bununla birlikte, genom düzenleme teknolojisindeki son yenilikler, araştırmacıların mutasyonları hızla tanıtmasına veya endojen C. elegans genlerini etiketlemesine izinvermiştir 20,21, genler ve kodlanmış proteinler arasındaki genetik, fonksiyonel ve fiziksel etkileşimleri çözen çalışmaları kolaylaştırmaktadır. Özellikle, CRISPR/Cas9 aracılı sonojen loci'deki C. elegans genlerinin etiketlenmesi, immün önseçim deneylerinin antikor kullanılabilirliği üzerindeki bağımlılığını azaltarak, eş-immün özürlülüğü deneylerini çok daha uygulanabilir hale getirdi. C. elegans genleri, GFP veya mCherry gibi floresan etiketlerden FLAG ve HA gibi küçük etiketlere kadar çeşitli etiketlerle etiketlenebilir. Bu etiketleri tanıyan antikorlar ticari olarak kolayca kullanılabilir ve immün önkupseleme yaklaşımları yoluyla protein-protein etkileşimlerinin çalışmalarını kolaylaştırır.
Şekil 1'deözetlenen sunulan protokol, az sayıda numune için gerçekleştirilebilir veya ölçeklendirilebilir ve aynı anda 24 numune hazırlığına izin verir. İmmün önseçme yoluyla protein-protein etkileşimlerinin ilk nitelemeleri tipik olarak normal büyüme koşulları altında vahşi tip arka planlarda yapılırken, takip çalışmaları genellikle protein-protein etkileşimlerinin çeşitli genetik arka planlarda veya farklı büyüme koşullarında test edilmesini gerektirir. Aynı anda birden fazla ekstrakt hazırlama yeteneği zaman kazandırır ve daha da önemlisi, farklı numuneler arasında ekstrakt hazırlama tutarlılığı sağlar. Negatif bir kontrol her zaman gereklidir, ideal kontrol, immün önkoşüle edilmiş ilgi proteini için gen kodlamasında boş bir mutasyondur (bkz. Şekil 3 ve Şekil 4 örnek olarak).
Bu ekstrakt protokolü, C. elegans örneklerinden hızlı protein özü hazırlanmasına izin verir ve zirkonyum boncuk bazlı homojenizasyon8ile karşılaştırılabilir. Genel olarak boncuk homojenizasyonu, çeşitli boncuk değirmeni homojenizatörleri veya benzeri ekipmanlar kullanılarak birden fazla eşzamanlı numune preparatlarına kadar ölçeklendirilebilir. Bununla birlikte, bazı daha ekonomik boncuk değirmeni homojenizatörleri aynı anda işlenebilen numune sayısını azaltabilir. Alternatif olarak, sunulan ekstrakt protokolü, ekonomik bir alternatifi temsil eden dounce bazlı ekstrakt hazırlığı ile uyumludur. Farklı boncuk değirmeni homojenizatörleri test edilmede de, C. elegans örneklerinin tamamen bozulması sağlandığınız sürece, çoğu bu protein özü protokolü ile uyumlu olabilir.
Sunulduğu gibi, bu ekstrakt hazırlama protokolü, protein immünoselipitasyon2 ve microRNA aşağı çekme12 dahil olmak üzere birden fazla aşağı akış deneyi ile uyumludur ve hem protein hem de RNA bileşenlerinin aşağı akış toplanmasına izin verir. Ayrıca hem nükleer hem de sitoplazmik proteinleri verimli bir şekilde çıkarır (Şekil 2, Şekil 3ve Şekil 4). Benzer şekilde, sunulan immünoprecipitasyon protokolü protein ilişkili immünödepitaitlerden RNA izolasyonuna izin eder. İmmün önkekseleme protokolü başlangıçta ALG-1 protein etkileşimcilerini tanımlamak için geliştirilmiş olsa da, yöntem ilgi çekici proteinler arasındaki etkileşimleri test etmek için uyarlanabilir. Aslında, kullanılan immün prempripipitasyon koşulları ALG-1 (Şekil 3) ve HRPK-1 (Şekil 4)immünoprecipitasyon için eşit derecede iyi çalıştı. Bu protokol, RNA bağlayıcı proteinlerin immünpurifikasyonu için mükemmel bir başlangıç noktasıdır. Bununla birlikte, diğer ilgi proteinleri için tampon bileşiminde bazı değişikliklerin gerekli olabileceği belirtilmelidir. Değişiklikler, ilgi çekici proteinin fiziksel ve biyokimyasal özelliklerine bağlı olabilir ve duruma göre uygulanmalıdır.
Hedef protein (burada, ALG-1 veya HRPK-1) immün premünipit hale geldikten sonra, Batı şişkinliği belirli protein etkileşimcileri için ko-immünoprecipitate'i test etmek için kullanılabilir.
Alternatif olarak, kopurified immünprecipitate tüm putatif etkileşim proteinlerini tanımlamak için kütle spektrometresi analizine tabi tutulabilir. Doğrulanmış eş-immün özürlü etkileşimler daha sonra belirli etkileşimin potansiyel düzenlemesini belirlemek için çeşitli genetik geçmişlerde veya koşullarda incelenebilir. Örneğin, HRPK-1'in ALG-1/AIN-1 miRISC derlemesinde rol oynayıp oynamadığını belirlemek için, ALG-1-AIN-1 coprecipitation hem vahşi tip arka planda hem de HRPK-1 yokluğunda değerlendirildi (Şekil 3). hrpk-1'in ALG-1/AIN-1etkileşimi 2 (Şekil 3)için dağıtılabilir olduğu bulunmuştur. Ek olarak, CRISPR/Cas9 genom düzenleme teknolojisi, ilgi çekici proteinlerde tek nokta veya alan adı silme mutasyonları oluşturmak için kullanılabilir. Üretilen mutantların protein etkileşimcileriyle işbirliği yapma yeteneğini yeniden test etmek, hangi etki alanlarının veya kalıntıların fiziksel etkileşime aracılık ettiğini ortaya açabilir. Bu tür gelecekteki çalışmalar, protein fonksiyonu ve regülasyon mekanizması hakkında paha biçilmez bilgiler verebilir. Bu yaklaşımlar, C. elegans genetiğinin gücü ile birlikte, hayvan gelişimini ve hücresel işlevi yöneten temel moleküler süreçler hakkında önemli içgörüler sağlayabilir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu çalışma kısmen Kansas INBRE, Li ve Zinovyeva'ya P20GM103418 ve Zinovyeva'ya R35GM124828 tarafından desteklendi. Min Han'a anti-AIN-1 antikorlarını cömertçe paylaştığı için teşekkür ederiz. Bu çalışma boyunca kullanılan suşların bir kısmı NIH Araştırma Altyapı Programları Ofisi (P40 OD010440) tarafından finanse edilen Caenorhabditis Genetik Merkezi (CGC) tarafından sağlanmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL tube | VWR | 89039-664 | STEP 1.2 |
| 2x Laemmli Sample Buffer | BioRed | 1610737 | STEP 3.11 |
| 4–20% Mini-PROTEAN TGX Precast Protein Gels | BioRed | 4561096 | STEP 4.1 |
| anti-AIN-1 monoclonal antibody | custom generated | n/a | STEP 4.2, see ref. Zhang et al. 2007 |
| anti-ALG-1 monoclonal antibody | custom generated by PRF&L | n/a | STEP 4.2 |
| anti-HRPK-1 monoclonal antibody | custom generated by PRF&L | n/a | STEP 4.2 |
| Bullet Blender Storm Homogenizer | MidSci | BBY24M | STEP 2.3 |
| DL-Dithiothreitol (DTT) | Sigma | D9779-5G | Table 1 |
| Dynabeads Protein A for Immunoprecipitation | Thermo Fisher | 10002D | STEP 3.2 |
| DynaMag-2 Magnet | Thermo Fisher | 12321D | STEP 3.2 |
| EDTA-free protease inhibitors | Roche | 11836170001 | Table 1 |
| GFP antibody (FL) | Santa Cruz Biotechnology | sc-8334 | Figure 2 |
| Glycerol | Thermo Fisher | G33-500 | Table 1 |
| Goat Anti-Rabbit Secondary Antibody, HRP | BioRed | 1662408 | STEP 4.2 |
| Goat anti-Rat IgG (H+L) Secondary Antibody, HRP | Thermo Fisher | 31470 | STEP 4.2 |
| HEPES | Sigma | H4034-500G | Table 1 |
| LICOR WesternSure PREMIUM Chemiluminescent Substrate, 100 mL Kit | LI-COR | 926-95000 | STEP 4.3 |
| Magnesium chloride hexahydrate ACS | VWR | VWRV0288-500G | Table 1 |
| Magnesium Sulfate Anhydrous | Thermo Fisher | M65-500 | Table 1 |
| Microcentrifuge Tubes, 1.5 mL | VWR | 20170-333 | STEP 1.6 |
| N2 wild type | CGC | ||
| Navy RINO RNA Lysis Kit 50 pack (1.5 mL) | MidSci | NAVYR1-RNA | STEP 2.3 |
| Phosphatase inhibitor cocktail 2 | Sigma | P5726-1ML | Table 1 |
| Phosphatase inhibitor cocktail 3 | Sigma | P0044-1ML | Table 1 |
| Potassium Chloride | Thermo Fisher | P217-500 | Table 1 |
| Potassium phosphate monobasic | Thermo Fisher | P285-3 | Table 1 |
| RC DC Protein Assay Kit I | BioRed | 5000121 | STEP 2.9 |
| RNaseOUT Recombinant Ribonuclease Inhibitor | Thermo Fisher | 10777019 | Table 1 |
| Sodium Chloride | Thermo Fisher | S271-500 | Table 1 |
| Sodium Phosphate Dibasic Anhydrous | Thermo Fisher | S374-500 | Table 1 |
| TritionX-100 | Sigma | X100-500ML | Table 1 |
| UY38 hrpk-1(zen17) | available upon request | ||
| VT1367 col-19::gfp(maIS105) | available upon request | ||
| VT3841 alg-1(tm492) | available upon request |
Referanslar
- Liu, X., et al. An AP-MS- and BioID-compatible MAC-tag enables comprehensive mapping of protein interactions and subcellular localizations. Nature Communications. 9 (1), 1188-1216 (2018).
- Li, L., Veksler-Lublinsky, I., Zinovyeva, A. HRPK-1, a conserved KH-domain protein, modulates microRNA activity during Caenorhabditis elegans development. PLoS Genetics. 15 (10), 1008067(2019).
- Zinovyeva, A. Y., Veksler-Lublinsky, I., Vashisht, A. A., Wohlschlegel, J. A., Ambros, V. R. Caenorhabditis elegans ALG-1 antimorphic mutations uncover functions for Argonaute in microRNA guide strand selection and passenger strand disposal. Proceedings of the National Academy of Sciences of the United States of America. 112 (38), 5271-5280 (2015).
- Hammell, C. M., Lubin, I., Boag, P. R., Blackwell, T. K., Ambros, V. nhl-2 Modulates microRNA activity in Caenorhabditis elegans. Cell. 136 (5), 926-938 (2009).
- Zou, Y., et al. Developmental decline in neuronal regeneration by the progressive change of two intrinsic timers. Science. 340 (6130), 372-376 (2013).
- Zanin, E., Dumont, J., et al. Affinity purification of protein complexes in C. elegans. Methods in Cell Biology. 106, 289-322 (2011).
- Bhaskaran, S., et al. Breaking Caenorhabditis elegans the easy way using the Balch homogenizer: an old tool for a new application. Analytical Biochemistry. 413 (2), 123-132 (2011).
- Kohl, K., et al. Plate-based Large-scale Cultivation of Caenorhabditis elegans: Sample Preparation for the Study of Metabolic Alterations in Diabetes. Journal of Visualized Experiments. (138), e58117(2018).
- Larance, M., Bailly, A. P., et al. Stable-isotope labeling with amino acids in nematodes. Nature Methods. 8 (10), 849-851 (2011).
- Ding, L., Han, M. GW182 family proteins are crucial for microRNA-mediated gene silencing. Trends in Cell Biology. 17 (8), 411-416 (2007).
- Ding, L., Spencer, A., Morita, K., Han, M. The Developmental Timing Regulator AIN-1 Interacts with miRISCs and May Target the Argonaute Protein ALG-1 to Cytoplasmic P Bodies in C. elegans. Molecular Cell. 19 (4), 437-447 (2005).
- Jannot, G., Vasquez-Rifo, A., Simard, M. J. Argonaute Pull-Down and RISC Analysis Using 2’-O-Methylated Oligonucleotides Affinity Matrices. Methods in Molecular Biology. 725, Chapter 16 233-249 (2011).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019(2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook: the Online Review of C. elegans Biology. , 1-11 (2006).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. Journal of Visualized Experiments. (16), e759(2008).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. Journal of Visualized Experiments. (44), e2359(2010).
- Zinovyeva, A. Y., Bouasker, S., Simard, M. J., Hammell, C. M., Ambros, V. Mutations in conserved residues of the C. elegans microRNA Argonaute ALG-1 identify separable functions in ALG-1 miRISC loading and target repression. PLoS Genetics. 10 (4), 1004286(2014).
- Zhang, L., et al. Systematic Identification of C. miRISC Proteins, miRNAs, and mRNA Targets by Their Interactions with GW182 Proteins AIN-1 and AIN-2. Molecular Cell. 28 (4), 598-613 (2007).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent Window into Biology: A Primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Farboud, B., et al. Enhanced Genome Editing with Cas9 Ribonucleoprotein in Diverse Cells and Organisms. Journal of Visualized Experiments. (135), e57350(2018).
- Dickinson, D. J., Goldstein, B. CRISPR-Based Methods for Caenorhabditis elegans Genome Engineering. Genetics. 202 (3), 885-901 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır