Method Article
카노르하비티스 예르간에서 단백질 추출물 제제 및 공동 면역 침전
요약
이 방법은 Caenorhabditis elegans 샘플 및 후속 공동 면역 침전에서 고처리량 단백질 추출물 제조를 위한 프로토콜을 설명합니다.
초록
공동 면역 침전 방법은 단백질 단백질 상호 작용을 연구하기 위해 자주 사용됩니다. 가설 단백질-단백질 상호 작용 또는 새로운 단백질의 식별확인은 관심 있는 단백질의 기능에 대한 귀중한 정보를 제공할 수 있습니다. 추출 준비를 위한 전통적인 방법 중 일부는 노동 집약적이고 시간이 많이 소요되는 기술이 자주 필요합니다. 여기서, 비드 밀 균질화제 및 금속 비드를 이용한 변형된 추출물 제제 프로토콜은 전통적인 단백질 제제 방법에 대한 신속한 대안으로 설명된다. 이 추출 준비 방법은 다운스트림 공존침전 연구와 호환됩니다. 예를 들어, 이 방법은 C. 예르간 마이크로RNA 아르고나테 ALG-1 및 알려진 ALG-1 인터액터 인 AIN-1 및 HRPK-1을 성공적으로 공동 면역전성염하는 데 사용되었다. 이 프로토콜에는 동물 샘플 수집, 추출물 제제, 추출물 설명 및 단백질 면역 침전에 대한 설명이 포함됩니다. 설명된 프로토콜은 다양한 유전 적 배경에서 어떤 둘 이상의 내인성, 내인성 태그, 또는 과발현 C. elegans 단백질 사이의 상호 작용을 위해 테스트하도록 적응될 수 있다.
서문
관심 있는 단백질의 거시분자 상호 작용을 식별하는 것이 그 기능에 대해 더 많이 배우는 데 핵심이 될 수 있습니다. 면역 침전 및 공동 면역 침전 실험은 대규모 프로테오믹 접근법1을 통해 단백질의 전체 상호 작용을 식별하거나 가설 상호 작용자와 결합하는 단백질의 능력을 구체적으로 테스트하는 데 사용될 수 있습니다. C. elegans에서,두 가지 방법은 유전자 발현2,3,4를조절하기 위해 microRNA와 밀접하게 기능하는 단백질의 다양한 활성에 대해 자세히 알아보기 위해 성공적으로 채택되었다. 공동 면역 침전 실험은 그들의 모국적인 세포 환경에서 단백질 단백질 상호 작용을 시험하는 이점이 있습니다, 그러나 추출 준비는 도전적이고 시간이 많이 소요될 수 있습니다. 시료의 효율적인 용해가 필요하지만 단백질-단백질 상호 작용의 중단을 최소화하기 위해 주의를 기울여야 합니다. douncing5,초음파6,발치 균질화7,및 지르코니아 구슬 균질화8,9와 같은 방법은 성공적으로 C. elegans 총 단백질 추출물을 준비하는 데 사용되었습니다. 이러한 방법은 지르코니아 비드 균질화를 제외하고 동시에 처리될 수 있는 시료 수에 제한이 있습니다. 제시된 대안방법은 C. elegans 샘플로부터 높은 처리량, 신속한 단백질 추출물 제제를 허용하고 공동 면역 침전을 가능하게 하기 위해 쉽게 확장할 수 있는대안이다. 구체적으로, 이 방법은 한 번에 최대 24개의 샘플을 제조할 수 있으며, 추출 준비에 필요한 시간을 크게 줄일 수 있다. 대조적으로, 예를 들어, douncing은 일반적으로 한 번에 하나의 샘플 준비를 허용합니다. 이 추출 방법은 C. elegans의모든 발달 단계에서 추출물을 준비하는 데 사용할 수 있습니다.
설명된 것은 동물 샘플 수집, 추출물 제제, 면역 침전, 및 서양 블로팅 데이터의 프리젠테이션을 위한 단계별 절차로서 성공적인 단백질 풀다운 및 관심 있는 단백질의 검출을 확인한다. 프로토콜의 효과를 입증하기 위해, 2개의 공동 면역 침전 실험은 1) microRNA Argonaute ALG-1 및 AIN-1, GW182 상동성론 사이에서 수행되었다; 및 2) ALG-1 및 HRPK-1, 새로 확인된 ALG-1 상호작용기2. ALG-1 및 AIN-1은 마이크로RNA 유도 침묵 복합체(miRISC)를 포함하는 핵심 단백질이며 이들 두 단백질 간의 상호작용은10,11로잘 확립된다. 상기 추출물 제제 프로토콜은 ALG-1-AIN-1 공동 면역침전 실험에서 효과적이었다. 이 프로토콜은 또한 ALG-1과 새로 확인된 상호 작용자 HRPK-1 2 간의 상호 작용을 성공적으로확인했습니다.
요약하자면, 원고는 새로운 것을 식별하거나 단백질 간의 가설 상호 작용을 확인하는 데 사용할 수 있는 공동 면역 강수화 프로토콜과 함께 24개의 샘플을 동시에 처리할 수 있는 C. elegans 추출 준비 프로토콜을 설명합니다. 상기 추출물 제제 프로토콜은 단백질 면역침전2 및 마이크로RNA풀다운(12)을포함하는 다수의 다운스트림 실험과 호환된다. 더욱이, 면역 침전 프로토콜은 다양한 유전적 배경에서 어떤 둘 이상의 내인성, 내인성 태그, 또는 과발현C. elegans 단백질 사이의 상호 작용을 테스트하기 위해 적응될 수 있다.
프로토콜
1. 웜 샘플 수집
- 시드 혼합 단계 또는 동기화된 13 NGM 고형 플레이트에 필요한 온도에서 웜과 원하는 단계까지 웜이 성장할 수 있습니다. 기초 C. elegans 성장 및 유지 보수를 위해, Stiernagle 외와 포르타 드 라 -Riva 외.14,13을참조하십시오.
- M9 버퍼로 웜 플레이트를 세척하여 15mL 원심분리기 튜브에서 웜을 수집합니다.
- 실온(RT)에서 400xg에서 원심분리하여 2분 동안 벌레를 펠렛하고 상퍼를 폐기합니다.
참고: 추출 준비를 위한 벌레 펠릿 크기는 100 μL과 500 μL 사이입니다. 포장된 벌레의 300 μL 펠릿은 다운스트림 면역 침전 실험에 권장되며 일반적으로 총 단백질의 ~4.5 mg을 산출하고 500 μL 펠릿은 총 단백질의 ~7.5 mg을 산출합니다. - M9 버퍼(표 1참조)로 또는 상퍼가 더 이상 흐리지 않은 때까지 3-5 세차스를 추가로 수행합니다.
- DdH2O로 마지막 세척을 수행합니다.
- 느슨한 벌레 펠릿을 1.5mL 마이크로센심분리기 튜브로 이동하고 2분 동안 RT에서 400 x g로 회전합니다. 남은 상체를 버리고 포장된 벌레 펠릿을 구하고 준비를 진행한다.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다. 웜 펠릿은 액체 질소에서 즉시 동결되어 -80°C 또는 액체 질소에 저장될 수 있다. 웜 펠릿은 한 번만 해동할 수 있으며 재냉동할 수 없습니다.
2. 벌레 펠릿의 추출물 준비
참고: 추출 준비는 얼음이나 4°C에서 수행해야 합니다.
- 얼어 붙으면 얼음 위에 벌레 펠릿을 해동하십시오.
참고: 300 μL의 원하는 포장 된 벌레 펠릿 크기가 샘플 수집 중에 얻어지지 않은 경우, 추가 추출을 위해 충분한 재료가 존재 할 때까지 여러 개의 작은 펠릿을 결합 할 수 있습니다. - 얼음 차가운 2배 용해 버퍼(60mM HEPES)의 동일한 볼륨을 추가합니다. pH = 7.4, 100 mM 염화칼륨, 0.1% 트리톤 X, 염화 마그네슘 4m, 글리세롤 10% 글리세롤, RNase 억제제, 프로테아제 억제제 및 인산염 억제제가 있는 2mM DTT; 표 1)및 소용돌이 또는 파이프를 위아래로 참조하십시오. 튜브의 바닥에 혼합물을 수집하기 위해 튜브를 아래로 회전.
- 혼합물을 금속 구슬이 들어 있는 1.5mL RNase-프리 튜브로 이동하고(재료표참조) 샘플을 4°C에서 비드 밀 균질화제(재료표 참조)에 넣습니다. 튜브 캡을 조이고 샘플이 균질화 내부에 균형을 이루도록 하십시오.
- 샘플을 최고 속도(설정 12)에서 4분 동안 균질화합니다.
- 구슬에서 샘플을 제거하고 새로운 1.5 mL 미세 원심 분리기 튜브에 배치합니다. 대안적으로, 균질화제와 함께 제공된 자석은 샘플에서 구슬을 제거하는 데 사용될 수 있다.
- 4°C에서 20분 동안 19,000 x g에서 추출물을 스핀다운하여 단백질 추출물을 명확히 합니다.
- 상체를 얼음 위에 있는 신선한 1.5mL 튜브로 옮기면서 샘플 위에 형성되는 흰색의 흐린 침전물의 이월을 피하십시오. 상체는 이제 명확한 추출물입니다.
참고: 정제된 추출물의 10μL을 저장하여 총 단백질 농도를 결정합니다. - 다음 실험에 즉시 추출물을 사용하거나 액체 질소에 추출물을 동결하고 -80°C에 저장한다.
참고: 프로토콜은 여기에서 일시 중지될 수 있습니다. 추출물은 초저온(-80°C 냉동고 또는 액체 질소~6개월)에 보관될 수 있다. 냉동 추출물은 한 번 해동될 수 있으며 재냉동할 수 없습니다. - 제조 업체의 지시에 따라 세제와 호환 되는 단백질 농도 분석 키트를 사용 하 여 추출 물의 총 단백질 농도를 결정 합니다(재료의 표참조) 제조 업체의 지침에 따라.
3. 면역 침전
참고: 추출 준비를 위한 모든 면역 침전 단계는 얼음 또는 4°C에서 수행해야 합니다. 각 면역 강수량에 대해 총 단백질 2 mg을 사용하는 것이 좋습니다. 그러나, 총 단백질의 0.8-1 mg을 가진 성공적인 면역 침전이 수행되었습니다. 항상 신선하거나 갓 해동된 단백질 추출물을 사용하십시오. 다음 프로토콜은 총 단백질 2 mg 또는 단일 면역 침전 실험으로부터 면역 침전을 수행하도록 설명된다. 구슬과 항체의 양은 여러 시료에 대해 또는 다른 양의 단백질 추출물이 사용되는 경우에 그에 따라 증가또는 감소될 수 있다.
- 얼음 위에 단백질 추출물을 놓거나 해동합니다. 샘플은 10 mg/mL 또는 얼음 차가운 1x 용해 완충액으로 5 mg/mL로 희석될 수 있습니다(표 1참조).
- 자기 구슬을 반전하여 재중지하고 50% 구슬 서스펜션의 150 μL을 1.5mL 튜브로 옮기십시오. 얼음 위에 구슬을 자석으로 1분 동안 자석 스탠드에 매화하거나 용액이 명확해질 때까지 자화합니다. 상부체를 폐기합니다.
- 마그네틱 스탠드에서 튜브를 제거하고 비드 슬러리의 2부부(즉, 300 μL)를 사용하여 1배 의 용액 버퍼로 구슬을 세척합니다. 워시 2x를 총 3개의 세척으로 반복합니다.
- 얼음 차가운 용해 버퍼의 150 μL에서 구슬을 다시 중단합니다.
- 비드 슬러리의 75 μL을 단백질 추출물 2mg으로 옮기고 4°C에서 부드러운 동요로 1h로 배양합니다. 나중에 사용할 수 있는 나머지 비드 서스펜션을 얼음위에 저장합니다.
참고: 이 단계는 면역 침전 단계 동안 구슬에 대한 비특이적 단백질 결합을 감소시키기 위해 수행됩니다. - 1 분 동안 얼음에 자기 스탠드에 샘플튜브를 배치하거나 구슬이 완전히 자화되고 샘플이 명확 할 때까지 튜브를 놓습니다. 새로운 1.5 mL 튜브로 상체를 전송; 구슬을 방해하지 마십시오. 이것은 미리 정리된 단백질 리자입니다. 웨스턴 블롯 분석을 위해 샘플의 10%를 저장합니다.
- 20 μg의 친화성 정제 항체를 미리 클리어된 lysate에 넣고 4°C에서 부드러운 교반으로 1h에 인큐베이션합니다.
참고: 면역 침전을 위해 사용되는 항체의 양은 항체 및 단백질에 특이하며 표적 단백질의 효과적인 면역 침전을 보장하기 위해 경험적으로 결정되어야 합니다. - 미리 세척된 비드 서스펜션(Step 3.5)의 나머지 75μL을 항체/용액 혼합물에 넣고 부드러운 교반으로 4°C에서 1시간 동안 배양한다.
- 튜브를 1분 동안 얼음 위에 놓거나 구슬이 완전히 자화되고 샘플이 명확해질 때까지 튜브를 얼음 위에 놓습니다. 웨스턴 블롯 분석(선택 사항)에 대한 상체를 저장합니다.
- 세척 버퍼의 450 μL에서 면역 침전염 3 배를 포함하는 구슬을 세척 (30 mM HEPES, pH = 7.4, 100 mM 칼륨 염화, 0.1 % 트리톤 X, 2 mM MM 마그네슘 염화, 10 % 글리세롤, 1 mM M DTT; 표 1)얼음에 참조)
참고: 보다 엄격한 세척 조건이 바람직한 경우 추가 세척이 수행될 수 있습니다. - 비드 펠릿을 20 μL의 20 μL에서 재연하여 SDS-PAGE 젤에 적재하기 전에 5분 동안 95°C에서 끓여서 변성(재료 표참조) 및 변성. 대안적으로, 변성 된 샘플은 몇 달 동안 -20 °C에서 저장 될 수있다.
참고: 비드 면역 침전염의 일부가 원하는 경우 다운스트림 RNA 절연을 위해 저장할 수 있습니다.
4. IP 샘플의 서양 얼룩 감지
- IP 샘플을 SDS-PAGE 젤에 로드합니다(재료 표참조). 시료의 포부 전에 1분 동안 자기 스탠드에 IP 튜브를 배치하여 구슬을 옮기지 마십시오.
- 다음과 같은 수정으로 서양 블로팅15,16 및 항체 염색16을 수행하십시오: ALG-1항체를 희석17 1:500 에 5% 비지방 건조 우유 (NFDM); HRPK-1 항체2 1:1,000을 5% NFDM에서 희석; AIN-1항체를 희석18 1:10,000 에서 5% NFDM. 이차 항체(재료표참조)는 제조업체의 지침에 따라 사용하였다.
- HRP 기반 화학 발광으로 대역을 감지합니다(재료 표참조).
결과
이러한 프로토콜(도 1에서 스키마화)은 여러 단백질2(도 3 및 도 4)의다운스트림 면역 침전을 위해 C. elegans 총 단백질 추출물(도2)을성공적으로 획득하는 데 사용되었다. 제시된 비드 밀 균질화 프로토콜은 총 단백질 추출에서비교하여-2)및 효율적으로 추출된 핵(COL-19:GFP(NLS)(도2)및 세포질단백질(도 3 및 도 4). 다양한 크기의 여러 샘플을 동시에 추출하였다(도2). 아르고나테 단백질은 GW182 단백질 제품군의 구성원과 상호 작용하여 표적 메신저 RNA에 결합하고발현(10)을억압하는 miRISC를 형성한다. 도 3은 코어 miRISC 성분 ALG-1 및 AIN-1의 성공적인 공동 면역 침전을 나타내며, 이전보고서(11,17)와일치한다. 최근에는 Argonaute ALG-13의 추가 단백질 인터랙터를 식별하여 미생물 생체 발생 및 활동이 보조 요인에 의해 어떻게 조절되는지에 대해 자세히 알아보려면 노력했습니다. RNA 결합 단백질 HRPK-1은 ALG-1 면역 침전염3에서확인되었다. 이러한 상호작용은 최근 상호 HRPK-1 면역침전 실험2에서확인되었다. 제시된 추출물 및 면역침전 프로토콜은 HRPK-1-1-co-specific 면역침전염(도4)에서ALG-1을 성공적으로 회수하였다. 또한, ALG-1-1 상호작용은 다양한 유전적 배경에서 시험되었고 HRPK-1은 ALG-1/AIN-1 miRISC 어셈블리2(도 3)에불필요하다고 나타났다. 보충 수치는 전체 멤브레인프로브(보충 도 1)를나타내기 위해 제공됩니다.
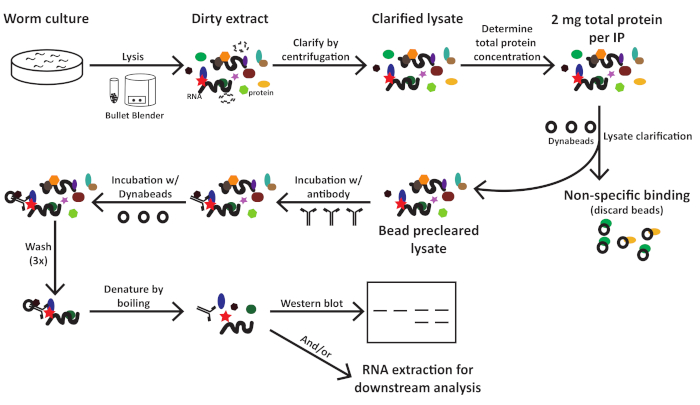
그림 1: C. elegans에 대한 워크플로식 회로도 추출 준비 및 면역 침전. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
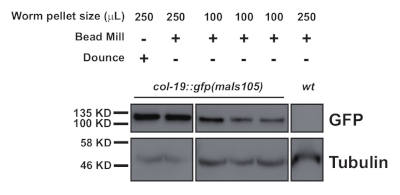
그림 2: 핵국산화된 GFP, COL-19:GFP(NLS)의 서양 얼룩 비교, 250 μL 및 100 μL 웜 펠릿에서 드온스 준비 및 균질화 된 샘플의 수준. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
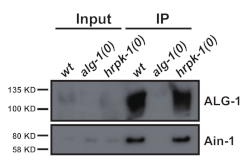
도 3: GW182 상동성AIN-1은 ALG-1과 공존한다. ALG-1 및 AIN-1 단백질을 위한 서양 블로팅은 ALG-1 면역 절전물염에 있습니다. ALG-1/AIN-1 공동 면역 침전은 hrpk-1의 부재에 의해 영향을 받지 않았다. 입력 = IP의 10%. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: HRPK-1을 결합한 ALG-1 공동 면역전수산. HRPK-1 면역절전염에서 HRPK-1 및 ALG-1을 위한 서부 블로팅이 도시된다. 입력 = IP의 10%. * 항체 무거운 사슬을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| M9 버퍼 (1 L) | |
| KH2PO4 | 3 g |
| 나2HPO4 | 6 g |
| 나Cl | 5 g |
| 1 M MgSO4 | 1 mL |
| ddH2O | 최대 1L |
| 2x 리시스 버퍼 (5 mL) | |
| 헤페스 (pH 7.4) | 200 μL |
| 2 M KCl | 250 μL |
| 10% 트리톤X | 100 μL |
| 1 M MgCl2 | 20 μL |
| 글리세롤 100% | 1 mL |
| ddH2O | 최대 5mL |
| 신선한 추가: | |
| 1 M DTT | 20 μL |
| EDTA 프리 프로테아제 억제제 | 1 정수 |
| 인스파타제 억제제 칵테일 2 | 100 μL |
| 포스파아제 억제제 칵테일 3 | 100 μL |
| 1x 리시스 버퍼 | |
| 동일한 볼륨의 ddH20으로 2배 Lysis 버퍼를 희석합니다. | |
| 1x 워시 버퍼 10 mL) | |
| 헤페스 (pH 7.4) | 300 μL |
| 2 M KCl | 500 μL |
| 10% 트리톤X | 100 μL |
| 1 M MgCl2 | 20 μL |
| 글리세롤 100% | 1 mL |
| ddH2O | 최대 10mL |
| 1 M DTT | 20 μL (신선한 추가) |
표 1: 레시피
보충 도 1. 그림 2-4를 생성하는 데 사용되는 전체 프로브 웨스턴 블롯 멤브레인이 표시됩니다. (A) 도 2용 프로브 멤브레인. 멤브레인은 GFP와 Tubulin에 대한 동시 프로빙을 허용하기 위해 절단되어 전체 얼룩 크기를 줄였습니다. (B) 도 3에 대한 프로브 멤브레인. (C) 도 3에 대한 프로브 멤브레인. *항체 헤비 체인을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
C. elegans는 세포, 분자 및 발달 생물학19에서근본적인 질문을 공부하기위한 훌륭한 모델입니다. 유전 적 모델 시스템으로서의 힘 외에도 C. elegans는 단백질 면역 침전 및 공동 면역 침전을 포함하되 이에 국한되지 않는 생화학적 접근법에 적합합니다. 면역 강수량 실험을 실시할 때 한 가지 잠재적인 장애물은 관심 있는 단백질에 특이적인 항체의 부족입니다. 항체가 없는 경우, 맞춤형 폴리클로날 또는 단일 클론 항체가 생성될 수 있다. 그러나, 게놈 편집 기술의 최근 혁신은 연구원이 유전자와 인코딩된 단백질 사이에서 유전, 기능 적, 물리적 상호 작용을 해명하는 연구 결과를 용이하게 하는 돌연변이 또는 꼬리표 내생 C. elegans 유전자20,21을급속하게 소개하는 것을 허용했습니다. 구체적으로, 내인성 loci에서 C. elegans 유전자의 CRISPR/Cas9 매개 태깅은 항체 가용성에 대한 면역 침전 실험의 의존도를 감소시켜 공동 면역 침전 실험을 훨씬 더 실현가능하게 만듭니다. C. elegans 유전자는 GFP 또는 mCherry와 같은 형광 태그에서 플래그 및 HA와 같은 작은 태그에 이르기까지 다양한 태그로 태그될 수 있습니다. 이러한 태그를 인식하는 항체는 면역 침전 접근법을 통해 단백질 단백질 상호 작용의 연구를 용이하게, 시판적으로 쉽게 사용할 수 있습니다.
그림 1에설명된 제시된 프로토콜은 소수의 샘플에 대해 수행되거나 확장하여 한 번에 최대 24개의 샘플 준비를 허용합니다. 면역 침전을 통한 단백질 단백질 상호 작용의 초기 특성은 일반적으로 정상적인 성장 조건하에서 야생 유형 배경에서 수행되지만, 후속 연구는 다양한 유전 적 배경이나 다른 성장 조건 하에서 단백질 단백질 상호 작용을 테스트해야합니다. 여러 추출물을 동시에 준비하는 기능은 시간을 절약하고, 중요한 것은 다른 샘플 들 사이에서 추출 준비 일관성을 보장합니다. 음성 조절은 항상 필요하며, 이상적인 제어는 관심있는 면역 침전 단백질에 대한 유전자 인코딩의 null 돌연변이입니다 (예례로 도 3 및 도 4 참조).
이 추출물 프로토콜은 C. elegans 샘플에서 신속한 단백질 추출물 을 제조할 수 있게 해주며 지르코늄 비드 계균화8과비교할 수 있다. 비드 균질화는 일반적으로 다양한 비드 밀 균질화 또는 이와 유사한 장비를 사용하여 다중 동시 시료 제제까지 확장될 수 있다. 일부 더 경제적인 비드 밀 균질화는 동시에 처리 될 수있는 샘플의 수를 줄일 수 있습니다, 그러나. 대안적으로, 제시된 추출 프로토콜은 경제적인 대안을 나타내는 음주 계 추출물 준비와 호환된다. 다른 비드 밀 균질화는 테스트되지 않았지만, 대부분은 C. elegans 샘플의 완전한 중단이 달성되는 한,이 단백질 추출물 프로토콜과 호환 될 가능성이 높습니다.
제시된 바와 같이, 본 추출물 제제 프로토콜은 단백질 면역침전2 및 마이크로RNA풀다운(12)을 포함한 여러 다운스트림 실험과 호환되며 단백질과 RNA 성분 모두의 다운스트림 수집을 가능하게 한다. 또한 핵 및 세포질 단백질을 효율적으로 추출합니다(도2, 도 3및 도 4). 유사하게, 제시된 면역침전 프로토콜은 단백질 관련 면역 침전염으로부터 RNA 절연을 허용한다. 면역 침전 프로토콜은 원래 ALG-1 단백질 인터액터를 식별하기 위해 개발되었지만, 이 방법은 관심있는 단백질 간의 상호 작용을 테스트하기 위해 적응될 수 있습니다. 실제로, 사용된 면역침전 조건은 ALG-1(도3)및 HRPK-1(도4)을면역침전시키는 데 동등하게 잘 작용하였다. 이 프로토콜은 RNA 결합 단백질의 면역 정화를 위한 우수한 출발점입니다. 그러나 완충 조성에 있는 몇몇 변경은 관심있는 그밖 단백질을 위해 요구될 수 있다는 것을 주의해야 합니다. 변경은 관심있는 단백질의 물리적 및 생화학적 특성에 따라 달라질 수 있으며 사례별로 구현되어야합니다.
표적 단백질(여기, ALG-1 또는 HRPK-1)이 면역침전이되면, 서양 블로팅은 특정 단백질 인터액터에 대한 공동 면역 전현전을 테스트하는 데 사용될 수 있다.
대안적으로, 코퓨화된 면역침전이는 모든 퍼티링 상호작용 단백질을 식별하기 위해 질량 분석 분석을 실시할 수 있다. 확인된 공동 면역 침전 상호 작용은 특정 상호 작용의 잠재적인 조절을 확인하기 위하여 유전 배경 또는 조건의 다양한에서 검토될 수 있습니다. 예를 들어, hrpk-1이 ALG-1/AIN-1 miRISC 어셈블리에서 역할을 하는지 여부를 결정하기 위해, ALG-1-AIN-1 회두는 야생형 배경과 HRPK-1의 부재 에서 모두 평가하였다(도3). hrpk-1은 ALG-1/AIN-1상호작용2(도 3)에대해 분배할 수 있는 것으로 나타났다. 또한, CRISPR/Cas9 게놈 편집 기술은 관심 있는 단백질에서 단일 점 또는 도메인 삭제 돌연변이를 생성하기 위하여 이용될 수 있다. 생성된 돌연변이체가 단백질 인터액터와 결합하는 능력을 재테스트하면 물리적 상호 작용을 중재하는 도메인 또는 잔류물이 드러낼 수 있습니다. 이러한 미래 연구는 단백질 기능 및 조절의 메커니즘에 대 한 귀중 한 정보를 얻을 수 있습니다. C. elegans 유전학의 힘과 결합된 이 접근은, 동물 발달 및 세포 기능을 통제하는 기본적인 분자 프로세스에 중요한 통찰력을 제공할 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 부분적으로 캔자스 INBRE에 의해 지원되었다, P20GM103418 리와 지노비에바와 R35GM124828 지노비에바에. 한민한이 항아인-1 항체를 아낌없이 공유해 주셔서 감사합니다. 이 작업의 과정에서 사용되는 균주 중 일부는 연구 인프라 프로그램의 NIH 사무실에 의해 투자 Caenorhabditis 유전학 센터 (CGC)에 의해 제공되었다 (P40 OD010440).
자료
| Name | Company | Catalog Number | Comments |
| 15 mL tube | VWR | 89039-664 | STEP 1.2 |
| 2x Laemmli Sample Buffer | BioRed | 1610737 | STEP 3.11 |
| 4–20% Mini-PROTEAN TGX Precast Protein Gels | BioRed | 4561096 | STEP 4.1 |
| anti-AIN-1 monoclonal antibody | custom generated | n/a | STEP 4.2, see ref. Zhang et al. 2007 |
| anti-ALG-1 monoclonal antibody | custom generated by PRF&L | n/a | STEP 4.2 |
| anti-HRPK-1 monoclonal antibody | custom generated by PRF&L | n/a | STEP 4.2 |
| Bullet Blender Storm Homogenizer | MidSci | BBY24M | STEP 2.3 |
| DL-Dithiothreitol (DTT) | Sigma | D9779-5G | Table 1 |
| Dynabeads Protein A for Immunoprecipitation | Thermo Fisher | 10002D | STEP 3.2 |
| DynaMag-2 Magnet | Thermo Fisher | 12321D | STEP 3.2 |
| EDTA-free protease inhibitors | Roche | 11836170001 | Table 1 |
| GFP antibody (FL) | Santa Cruz Biotechnology | sc-8334 | Figure 2 |
| Glycerol | Thermo Fisher | G33-500 | Table 1 |
| Goat Anti-Rabbit Secondary Antibody, HRP | BioRed | 1662408 | STEP 4.2 |
| Goat anti-Rat IgG (H+L) Secondary Antibody, HRP | Thermo Fisher | 31470 | STEP 4.2 |
| HEPES | Sigma | H4034-500G | Table 1 |
| LICOR WesternSure PREMIUM Chemiluminescent Substrate, 100 mL Kit | LI-COR | 926-95000 | STEP 4.3 |
| Magnesium chloride hexahydrate ACS | VWR | VWRV0288-500G | Table 1 |
| Magnesium Sulfate Anhydrous | Thermo Fisher | M65-500 | Table 1 |
| Microcentrifuge Tubes, 1.5 mL | VWR | 20170-333 | STEP 1.6 |
| N2 wild type | CGC | ||
| Navy RINO RNA Lysis Kit 50 pack (1.5 mL) | MidSci | NAVYR1-RNA | STEP 2.3 |
| Phosphatase inhibitor cocktail 2 | Sigma | P5726-1ML | Table 1 |
| Phosphatase inhibitor cocktail 3 | Sigma | P0044-1ML | Table 1 |
| Potassium Chloride | Thermo Fisher | P217-500 | Table 1 |
| Potassium phosphate monobasic | Thermo Fisher | P285-3 | Table 1 |
| RC DC Protein Assay Kit I | BioRed | 5000121 | STEP 2.9 |
| RNaseOUT Recombinant Ribonuclease Inhibitor | Thermo Fisher | 10777019 | Table 1 |
| Sodium Chloride | Thermo Fisher | S271-500 | Table 1 |
| Sodium Phosphate Dibasic Anhydrous | Thermo Fisher | S374-500 | Table 1 |
| TritionX-100 | Sigma | X100-500ML | Table 1 |
| UY38 hrpk-1(zen17) | available upon request | ||
| VT1367 col-19::gfp(maIS105) | available upon request | ||
| VT3841 alg-1(tm492) | available upon request |
참고문헌
- Liu, X., et al. An AP-MS- and BioID-compatible MAC-tag enables comprehensive mapping of protein interactions and subcellular localizations. Nature Communications. 9 (1), 1188-1216 (2018).
- Li, L., Veksler-Lublinsky, I., Zinovyeva, A. HRPK-1, a conserved KH-domain protein, modulates microRNA activity during Caenorhabditis elegans development. PLoS Genetics. 15 (10), 1008067 (2019).
- Zinovyeva, A. Y., Veksler-Lublinsky, I., Vashisht, A. A., Wohlschlegel, J. A., Ambros, V. R. Caenorhabditis elegans ALG-1 antimorphic mutations uncover functions for Argonaute in microRNA guide strand selection and passenger strand disposal. Proceedings of the National Academy of Sciences of the United States of America. 112 (38), 5271-5280 (2015).
- Hammell, C. M., Lubin, I., Boag, P. R., Blackwell, T. K., Ambros, V. nhl-2 Modulates microRNA activity in Caenorhabditis elegans. Cell. 136 (5), 926-938 (2009).
- Zou, Y., et al. Developmental decline in neuronal regeneration by the progressive change of two intrinsic timers. Science. 340 (6130), 372-376 (2013).
- Zanin, E., Dumont, J., et al. Affinity purification of protein complexes in C. elegans. Methods in Cell Biology. 106, 289-322 (2011).
- Bhaskaran, S., et al. Breaking Caenorhabditis elegans the easy way using the Balch homogenizer: an old tool for a new application. Analytical Biochemistry. 413 (2), 123-132 (2011).
- Kohl, K., et al. Plate-based Large-scale Cultivation of Caenorhabditis elegans: Sample Preparation for the Study of Metabolic Alterations in Diabetes. Journal of Visualized Experiments. (138), e58117 (2018).
- Larance, M., Bailly, A. P., et al. Stable-isotope labeling with amino acids in nematodes. Nature Methods. 8 (10), 849-851 (2011).
- Ding, L., Han, M. GW182 family proteins are crucial for microRNA-mediated gene silencing. Trends in Cell Biology. 17 (8), 411-416 (2007).
- Ding, L., Spencer, A., Morita, K., Han, M. The Developmental Timing Regulator AIN-1 Interacts with miRISCs and May Target the Argonaute Protein ALG-1 to Cytoplasmic P Bodies in C. elegans. Molecular Cell. 19 (4), 437-447 (2005).
- Jannot, G., Vasquez-Rifo, A., Simard, M. J. Argonaute Pull-Down and RISC Analysis Using 2’-O-Methylated Oligonucleotides Affinity Matrices. Methods in Molecular Biology. 725, 233-249 (2011).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook: the Online Review of C. elegans Biology. , 1-11 (2006).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. Journal of Visualized Experiments. (16), e759 (2008).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. Journal of Visualized Experiments. (44), e2359 (2010).
- Zinovyeva, A. Y., Bouasker, S., Simard, M. J., Hammell, C. M., Ambros, V. Mutations in conserved residues of the C. elegans microRNA Argonaute ALG-1 identify separable functions in ALG-1 miRISC loading and target repression. PLoS Genetics. 10 (4), 1004286 (2014).
- Zhang, L., et al. Systematic Identification of C. miRISC Proteins, miRNAs, and mRNA Targets by Their Interactions with GW182 Proteins AIN-1 and AIN-2. Molecular Cell. 28 (4), 598-613 (2007).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent Window into Biology: A Primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Farboud, B., et al. Enhanced Genome Editing with Cas9 Ribonucleoprotein in Diverse Cells and Organisms. Journal of Visualized Experiments. (135), e57350 (2018).
- Dickinson, D. J., Goldstein, B. CRISPR-Based Methods for Caenorhabditis elegans Genome Engineering. Genetics. 202 (3), 885-901 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유