Method Article
Preparação e Co-imunoprecipitação de Caenorhabditis elegans
Neste Artigo
Resumo
Este método descreve um protocolo para a preparação de extratos de proteína de alto rendimento de amostras de elegans de Caenorhabditis e posterior co-imunoprecipitação.
Resumo
Métodos de co-imunoprecipitação são frequentemente usados para estudar interações proteína-proteína. A confirmação de interações proteína-proteínas hipotéticas ou a identificação de novas podem fornecer informações inestimáveis sobre a função de uma proteína de interesse. Alguns dos métodos tradicionais de preparação de extratos frequentemente requerem técnicas intensivas em mão-de-obra e demoradas. Aqui, um protocolo de preparação de extratos modificados usando um homogeneizador de moinho de contas e contas metálicas é descrito como uma alternativa rápida aos métodos tradicionais de preparação de proteínas. Este método de preparação do extrato é compatível com estudos de co-imunoprecipitação a jusante. Como exemplo, o método foi usado para co-imunoprecipitar com sucesso C. elegans microRNA Argonaute ALG-1 e dois interagidores alg-1 conhecidos: AIN-1 e HRPK-1. Este protocolo inclui descrições da coleta de amostras de animais, preparação de extratos, esclarecimento de extratos e imunoprecipitação proteica. O protocolo descrito pode ser adaptado para testar interações entre quaisquer duas ou mais proteínas endógenas, marcadas endógenamente ou superexpressas em uma variedade de origens genéticas.
Introdução
Identificar as interações macromoleculares de uma proteína de interesse pode ser a chave para aprender mais sobre sua função. Experimentos de imunoprecipitação e co-imunoprecipitação podem ser usados para identificar todo o interactome de uma proteína através de abordagens proteômicas em larga escala1 ou para testar especificamente a capacidade de uma proteína de coprecipitar com um interagidor hipotético. Em C. elegans,ambos os métodos foram empregados com sucesso para aprender mais sobre a atividade de uma variedade de proteínas, incluindo aquelas que funcionam de perto com microRNAs para regular a expressão genética2,3,4. Experimentos de co-imunoprecipitação têm a vantagem de testar as interações proteína-proteína em seu ambiente celular nativo, mas a preparação do extrato pode ser desafiadora e demorada. A lise eficiente da amostra é necessária, mas deve-se tomar cuidado para minimizar a interrupção das interações proteína-proteína. Métodos como douncing5, sonication6, Balch homogenization7, e zircônia beads-homogeneization8,9 têm sido usados para preparar com sucesso extratos totais de proteínas C. elegans. Esses métodos, com exceção da homogeneização da conta de zircônia, têm limitações em termos do número de amostras que podem ser processadas simultaneamente. Apresentado é um método alternativo que pode ser facilmente dimensionado para permitir a preparação de extratos de proteínas rápidas e de alta produtividade de C. elegans seguidos de co-imunoprecipitação. Especificamente, o método pode preparar até 24 amostras por vez, reduzindo consideravelmente o tempo necessário para a preparação do extrato. Em contraste, por exemplo, douncing normalmente permite apenas uma preparação amostral por vez. Este método extrato pode ser usado para preparar extratos de qualquer estágio de desenvolvimento de C. elegans.
Descrito é um procedimento passo-a-passo para coleta de amostras de animais, preparação de extratos, imunoprecipitação e apresentação de dados de manchas ocidentais para confirmar a retirada e detecção bem sucedida da proteína co-imunoprecipitante de interesse. Para demonstrar a eficácia do protocolo, foram realizados dois experimentos de co-imunoprecipitação entre 1) microRNA Argonaute ALG-1 e AIN-1, um homólogo GW182; e 2) ALG-1 e HRPK-1, um recém-identificado interagedor ALG-12. ALG-1 e AIN-1 são proteínas centrais que compõem o complexo de silenciamento induzido pelo microRNA (miRISC) e a interação entre essas duas proteínas é bem estabelecida10,11. O protocolo de preparação do extrato foi eficaz no experimento de co-imunoprecipitação ALG-1-AIN-1. Este protocolo também confirmou com sucesso a interação entre a ALG-1e seu recém-identificado interager, HRPK-12 .
Em resumo, o manuscrito descreve um protocolo de preparação de extrato de C. elegans que pode ser dimensionado para processar simultaneamente 24 amostras, juntamente com um protocolo de co-imunoprecipitação que pode ser usado para identificar novas ou confirmar interações hipotéticas entre proteínas. O protocolo de preparação do extrato é compatível com uma série de experimentos a jusante, incluindo imunoprecipitaçãoproteica 2 e pulldowns microRNA12. Além disso, o protocolo de imunoprecipitação pode ser adaptado para testar interações entre quaisquer duas ou mais proteínas endógenas, marcadas ou superexpressas em uma variedade de origens genéticas.
Protocolo
1. Coleta de amostras de vermes
- Fase mista de sementes ousincronizado 13 vermes em placas sólidas NGM na temperatura necessária e permitem que os vermes cresçam até o estágio desejado. Para o crescimento e manutenção básicos de C. elegans, consulte Stiernagle et al. e Porta-de-la-Riva et al.14,13.
- Colete vermes em um tubo de centrífuga cônica de 15 mL lavando as placas de vermes com tampão M9.
- Pellule os vermes por centrifugação a 400 x g à temperatura ambiente (RT) por 2 min e descarte o supernasce.
NOTA: O tamanho da pelota de verme para a preparação do extrato está entre 100 μL e 500 μL. Uma pelota de 300 μL de vermes embalados é recomendada para experimentos de imunoprecipitação a jusante e normalmente produz ~4,5 mg de proteína total, enquanto uma pelota de 500 μL produzirá ~7,5 mg de proteína total. - Realize lavagens adicionais de 3 a 5 com tampão M9 (ver Tabela 1) ou até que o sobrenatante não esteja mais nublado.
- Realize uma última lavagem com ddH2O.
- Mova a pelota de verme solto para um tubo de microcentrifuuge de 1,5 mL e gire a 400 x g no RT por 2 min. Descarte o restante do supernante para obter uma pelota de verme embalada e prossiga para extrair a preparação.
NOTA: O protocolo pode ser pausado aqui. As pelotas de verme podem ser congeladas em nitrogênio líquido imediatamente e armazenadas a -80 °C ou em nitrogênio líquido. Por favor, note que as pelotas de verme só podem ser descongeladas uma vez e não podem ser refrozenas.
2. Extrair preparação da pelota de verme
NOTA: A preparação do extrato deve ser realizada no gelo ou a 4 °C.
- Se congelado, descongele a pelota de verme no gelo.
NOTA: Se o tamanho da pelota de verme embalado desejado de 300 μL não foi obtido durante a coleta de amostras, várias pelotas menores podem ser combinadas até que o material suficiente esteja presente para posterior extração. - Adicione um volume igual de tampão de lise 2x lysis gelada (60 mM HEPES, pH = 7,4, 100 mM de cloreto de potássio, 0,1% Triton X, 4 mM de cloreto de magnésio, 10% glicerol, 2 mM DTT com inibidor de RNase, inibidor de protease e inibidores de fosfatase; ver Tabela 1) e vórtice ou pipeta para cima e para baixo para misturar. Gire o tubo para baixo para coletar a mistura na parte inferior do tubo.
- Mova a mistura para um tubo sem RNase de 1,5 mL contendo contas metálicas (ver Tabela de Materiais) e coloque a amostra no homogeneizador do moinho de contas (ver Tabela de Materiais) a 4 °C. Certifique-se de que as tampas do tubo estão apertadas e as amostras são equilibradas dentro do homogeneizador.
- Homogeneize a amostra na velocidade mais alta (ajuste 12) por 4 min.
- Remova a amostra das contas e coloque-a em um novo tubo de microcentrifuuge de 1,5 mL. Alternativamente, um ímã fornecido com o homogeneizador pode ser usado para remover as contas da amostra.
- Gire o extrato a 19.000 x g por 20 min a 4 °C para esclarecer o extrato de proteína.
- Transfira o supernante para um tubo fresco de 1,5 mL no gelo, evitando o transporte do precipitado branco e nublado que se forma em cima da amostra. O supernante é agora o extrato esclarecido.
NOTA: Economize 10 μL do extrato esclarecido para determinar a concentração total da proteína. - Use o extrato imediatamente para os seguintes experimentos ou congele o extrato em nitrogênio líquido e armazene a -80 °C.
NOTA: O protocolo pode ser pausado aqui. Os extratos podem ser armazenados à temperatura ultrabaixo (-80 °C congelador ou nitrogênio líquido por ~6 meses). Extratos congelados podem ser descongelados uma vez e não podem ser refrozenados. - Determine a concentração total de proteínas do extrato utilizando um kit de ensaio de concentração de proteína compatível com detergentes (ver Tabela de Materiais) de acordo com as instruções do fabricante.
3. Imunoprecipitação
NOTA: Todas as etapas de imunoprecipitação para a preparação do extrato devem ser realizadas no gelo ou a 4 °C. Recomenda-se o uso de 2 mg de proteína total para cada imunoprecipitação. No entanto, foram realizadas imunoprecipitações bem sucedidas com 0,8-1 mg de proteína total. Use sempre extratos de proteínas frescos ou descongelados. O protocolo a seguir é delineado para realizar imunoprecipitação a partir de 2 mg de proteína total, ou um único experimento de imunoprecipitação. A quantidade de contas e anticorpos pode ser aumentada ou diminuída em conformidade para múltiplas amostras ou se uma quantidade diferente de extrato de proteína for usada.
- Coloque ou descongele o extrato de proteína no gelo. A amostra pode ser diluída a 10 mg/mL ou 5 mg/mL com tampão de 1x de lise gelada (ver Tabela 1).
- Resuspenda as contas magnéticas por inversão e transfira 150 μL da suspensão de contas de 50% em um tubo de 1,5 mL. Magnetize as contas no gelo contra uma posição magnética por 1 min ou até que a solução esteja clara. Descarte o supernaspeso.
- Remova o tubo do suporte magnético e lave as contas em 1x tampão de lise usando 2 volumes (ou seja, 300 μL) de chorume de contas. Repita a lavagem 2x para um total de três lavagens.
- Resuspenda as contas em 150 μL de tampão de lise gelada.
- Transfira 75 μL do chorume de contas para 2 mg de extrato de proteína e incubar a 4 °C por 1h com agitação suave. Guarde a suspensão restante do cordão um pouco no gelo para uso posterior.
NOTA: Esta etapa é realizada para reduzir a ligação proteica inespecífica às contas durante a etapa de imunoprecipitação. - Coloque o tubo com amostra no suporte magnético no gelo por 1 minuto ou até que as contas estejam totalmente magnetizadas e a amostra esteja clara. Transfira o supernante para um novo tubo de 1,5 mL; não perturbe as contas. Este é o lise de proteína pré-esclaro. Guarde 10% da amostra para análise de manchas ocidentais.
- Adicione 20 μg de anticorpo purificado de afinidade ao lise pré-esclara e incubar a 4 °C por 1h com agitação suave.
NOTA: A quantidade de anticorpos utilizados para a imunoprecipitação é específica para o anticorpo e proteína e deve ser empiricamente determinada para garantir uma imunoprecipitação eficaz da proteína alvo. - Adicione os 75 μL restantes da suspensão pré-lavada das contas (etapa 3.5) à mistura de anticorpos/lisesato e incubar por 1h a 4 °C com agitação suave.
- Coloque o tubo no suporte magnético no gelo por 1 minuto ou até que as contas estejam totalmente magnetizadas e a amostra esteja clara. Guarde o supernatante para análise de manchas ocidentais (opcional).
- Lave as contas contendo o imunoprecipitato 3x em 450 μL de tampão de lavagem (30 mM HEPES, pH = 7,4, 100 mM cloreto de potássio, 0,1% Triton X, 2 mM cloreto de magnésio, 10% glicerol, 1 mM DTT; ver Tabela 1) no gelo.
NOTA: Podem ser realizadas lavagens adicionais se forem preferidas condições de lavagem mais rigorosas. - Resuspenha a pelota de contas em 20 μL de 2x tampão de carregamento de gel de proteína SDS/BME (ver Tabela de Materiais) e desnaturar a 95 °C por 5 minutos antes de carregar em um gel SDS-PAGE. Alternativamente, as amostras desnaturadas podem ser armazenadas a -20 °C por vários meses.
NOTA: Uma parte do imunoprecipitato de contas pode ser salva para o isolamento do RNA a jusante, se desejar.
4. Detecção de manchas ocidentais de amostras de IP
- Carregue as amostras IP no gel SDS-PAGE (ver Tabela de Materiais). Evite transferir as contas colocando os tubos IP no suporte magnético por 1 minuto antes da aspiração da amostra.
- Realizar a mancha ocidental15,16 e mancha deanticorpos 16 com as seguintes modificações: diluir o anticorpo ALG-117 1:500 em 5% de leite seco não gordo (NFDM); diluir o anticorpo HRPK-12 1:1.000 em 5% NFDM; e diluir o anticorpo AIN-118 1:10.000 em 5% NFDM. Anticorpos secundários (ver Tabela de Materiais) foram utilizados de acordo com as instruções do fabricante.
- Detecte as bandas com chemiluminescência baseada em HRP (ver Tabela de Materiais).
Resultados
Este protocolo (esquematizado na Figura 1) foi utilizado com sucesso para obter extratos totais de proteínas C. elegans (Figura 2) para imunoprecipitação a jusante de várias proteínas2 (Figura 3 e Figura 4). O protocolo de homogeneizador da fábrica de contas apresentado foi comparável na extração total de proteínas aos métodos à base de dounce(Figura 2) e eficientemente extraído nuclear (COL-19::GFP(NLS) (Figura 2) e proteínas citoplasmáticas(Figura 3 e Figura 4). Várias amostras de vários tamanhos foram extraídas simultaneamente(Figura 2). As proteínas argonautas interagem com membros da família de proteínas GW182, formando os miRISCs que se ligam ao mensageiro alvo RNAs e reprimem sua expressão10. A Figura 3 mostra uma co-imunoprecipitação bem-sucedida dos componentes núcleo miRISC ALG-1 e AIN-1, consistentes com os relatórios anteriores11,17. Mais recentemente, foram feitos esforços para identificar interagidores proteicos adicionais do Argonaute ALG-13, a fim de saber mais sobre como a biogênese e a atividade do microRNA podem ser reguladas por fatores auxiliares. A proteína de ligação de RNA HRPK-1 foi identificada em imunoprecipitatos ALG-13. Esta interação foi recentemente confirmada em um experimento recíproco de imunoprecipitação HRPK-12. Os protocolos de extração e imunoprecipitação apresentados recuperaram com sucesso a ALG-1 em co-imunoprecipitatos específicos hrpk-1(Figura 4). Além disso, a interação ALG-1 -AIN-1 foi testada em uma variedade de origens genéticas e o HRPK-1 mostrou-se desnecessário para o conjunto ALG-1/AIN-1 miRISC2 (Figura 3). Figuras suplementares são fornecidas para mostrar a membrana completa sondada(Figura Suplementar 1).
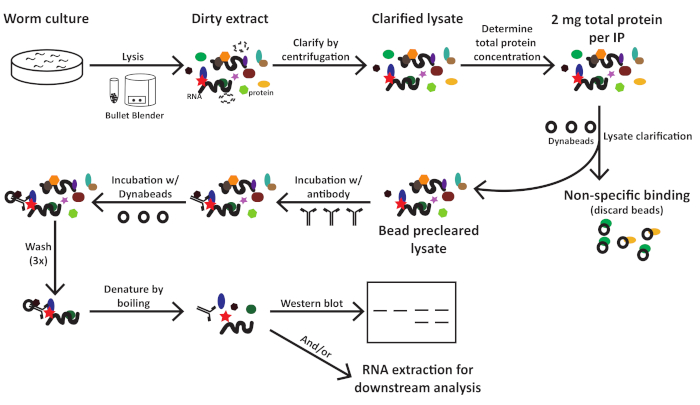
Figura 1: Esquema de fluxo de trabalho para C. elegans extraem preparação e imunoprecipitação. Clique aqui para ver uma versão maior desta figura.
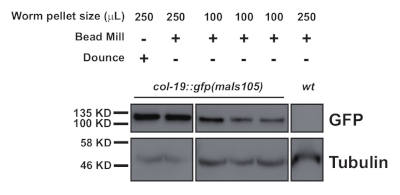
Figura 2: Comparação de manchas ocidentais de um GFP localizado nuclear, COL-19::GFP(NLS), níveis em amostras preparadas e homogeneizadas de 250 μL e 100 μL de pelotas de vermes. Clique aqui para ver uma versão maior desta figura.
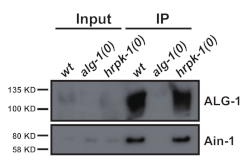
Figura 3: GW182 homólogo AIN-1 co-imunoprecipitates com ALG-1. Manchas ocidentais para proteínas ALG-1 e AIN-1 em imunoprecipitatos ALG-1. A co-imunoprecipitação ALG-1/AIN-1 não foi afetada pela ausência de hrpk-1. Entrada = 10% de IP. Clique aqui para ver uma versão maior desta figura.

Figura 4: ALG-1 co-imunoprecipitatos com HRPK-1. Mancha ocidental para HRPK-1 e ALG-1 em imunoprecipitatos HRPK-1 é mostrado. Entrada = 10% de IP. * indica corrente pesada de anticorpos. Clique aqui para ver uma versão maior desta figura.
| Tampão M9 (1 L) | |
| KH2PO4 | 3 g |
| Na2HPO4 | 6 g |
| NaCl | 5 g |
| 1 M MgSO4 | 1 mL |
| ddH2O | até 1 L |
| Tampão de lysis 2x (5 mL) | |
| HEPES (pH 7.4) | 200 μL |
| 2 M KCl | 250 μL |
| TritonX 10% | 100 μL |
| 1 M MgCl2 | 20 μL |
| 100% glicerol | 1 mL |
| ddH2O | até 5 mL |
| Adicione fresco: | |
| 1 M DTT | 20 μL |
| Inibidor de protease sem EDTA | 1 comprimido |
| coquetel inibidor de fosfatase 2 | 100 μL |
| coquetel inibidor de fosfatase 3 | 100 μL |
| 1x Tampão de lysis | |
| Diluir 2x tampão de lise com um volume igual de ddH20. | |
| 1x Tampão de lavagem 10 mL) | |
| HEPES (pH 7.4) | 300 μL |
| 2 M KCl | 500 μL |
| TritonX 10% | 100 μL |
| 1 M MgCl2 | 20 μL |
| 100% glicerol | 1 mL |
| ddH2O | até 10 mL |
| 1 M DTT | 20 μL (adicionar fresco) |
Tabela 1: Receitas
Figura Suplementar 1. As membranas ocidentais investigadas completas usadas para gerar figuras 2-4 são mostradas. (A) Membrana sondada para a Figura 2. Note que a membrana foi cortada para permitir a sondagem simultânea para GFP e Tubulin, reduzindo o tamanho geral da mancha. (B) Membrana sondada para a Figura 3. (C) Membrana sondada para a Figura 3. *denota a corrente pesada de anticorpos. Clique aqui para ver uma versão maior desta figura.
Discussão
C. elegans é um excelente modelo para estudar questões fundamentais em biologia celular, molecular e de desenvolvimento19. Além de seu poder como um sistema de modelo genético, C. elegans é favorável a abordagens bioquímicas, incluindo, mas não se limitando a, imunoprecipitação proteica e co-imunoprecipitação. Um obstáculo potencial na realização de experimentos de imunoprecipitação é a falta de anticorpos específicos às proteínas de interesse. Se nenhum anticorpo estiver disponível, podem ser gerados anticorpos policlonais ou monoclonais personalizados. No entanto, as recentes inovações na tecnologia de edição de genomas permitiram aos pesquisadores introduzir rapidamente mutações ou marcar genes endógenos C. elegans 20,21, facilitando estudos que desvendam as interações genéticas, funcionais e físicas entre os genes e as proteínas codificadas. Especificamente, a marcação mediada por CRISPR/Cas9 de genes C. elegans no loci endógeno reduziu a dependência de experimentos de imunoprecipitação na disponibilidade de anticorpos, tornando os experimentos de co-imunoprecipitação muito mais viáveis. C. elegans genes podem ser marcados com uma variedade de tags que vão desde tags fluorescentes como GFP ou mCherry até pequenas tags como FLAG e HA. Os anticorpos que reconhecem essas etiquetas estão prontamente disponíveis comercialmente, facilitando os estudos de interações proteína-proteína através de abordagens de imunoprecipitação.
O protocolo apresentado, delineado na Figura 1,pode ser realizado para um pequeno número de amostras ou ampliado, permitindo até 24 preparações amostrais por vez. Embora as caracterizações iniciais de interações proteína-proteína via imunoprecipitação sejam tipicamente feitas em origens do tipo selvagem em condições normais de crescimento, estudos de acompanhamento frequentemente exigem testar as interações proteína-proteína em uma variedade de origens genéticas ou em diferentes condições de crescimento. A capacidade de preparar simultaneamente vários extratos economiza tempo e, importante, garante a consistência de preparação do extrato entre as diferentes amostras. Um controle negativo é sempre necessário, com o controle ideal sendo uma mutação nula na codificação genética para a proteína imunoprecipitada de interesse (Ver Figura 3 e Figura 4, por exemplo).
Este protocolo de extrato permite a preparação rápida do extrato de proteínas a partir de amostras de C. elegans e é comparável à homogeneização à base de contas de zircônio8. A homogeneização das contas em geral pode ser dimensionada até múltiplas preparações simultâneas de amostras usando uma variedade de homogeneizadores de moinhos de contas ou equipamentos similares. Alguns homogeneizadores mais econômicos da fábrica de contas podem reduzir o número de amostras que podem ser processadas simultaneamente, no entanto. Alternativamente, o protocolo de extrato apresentado é compatível com a preparação do extrato à base de dounce, que representa uma alternativa econômica. Embora diferentes homogeneizadores de moinhos de contas não tenham sido testados, a maioria provavelmente será compatível com este protocolo de extrato de proteína, desde que a interrupção completa das amostras de C. elegans seja alcançada.
Como apresentado, este protocolo de preparação de extratos é compatível com múltiplos experimentos a jusante, incluindo imunoprecipitação proteica2 e microRNA pull-down12 e permite a coleta a jusante de componentes de proteína e RNA. Também extrai eficientemente proteínas nucleares e citoplasmáticas(Figura 2, Figura 3e Figura 4). Da mesma forma, o protocolo de imunoprecipitação apresentado permite o isolamento do RNA de imunoprecipitatos associados à proteína. Embora o protocolo de imunoprecipitação tenha sido originalmente desenvolvido para identificar os interagedores de proteínas ALG-1, o método pode ser adaptado para testar interações entre quaisquer proteínas de interesse. De fato, as condições de imunoprecipitação utilizadas funcionaram igualmente bem para imunoprecipitação ALG-1 (Figura 3) e HRPK-1 (Figura 4). Este protocolo é um excelente ponto de partida para a imunopurização de proteínas de ligação de RNA. Deve-se notar, no entanto, que algumas mudanças na composição do buffer podem ser necessárias para outras proteínas de interesse. As alterações podem depender das propriedades físicas e bioquímicas da proteína de interesse e devem ser implementadas caso a caso.
Uma vez que a proteína alvo (aqui, ALG-1 ou HRPK-1) é imunoprecipitada, a mancha ocidental pode ser usada para testar o co-imunoprecipitato para interagidores específicos de proteínas.
Alternativamente, o imunoprecipitato copurificado pode ser submetido à análise de espectrometria de massa para identificar todas as proteínas interativas putativas. Interações confirmadas de co-imunoprecipitação podem então ser examinadas em uma variedade de origens genéticas ou condições para identificar a possível regulação da interação específica. Por exemplo, para determinar se o HRPK-1 desempenha um papel na montagem ALG-1/AIN-1 miRISC, a coprecipitação ALG-1-AIN-1 foi avaliada tanto em um fundo tipo selvagem quanto na ausência de HRPK-1 (Figura 3). hrpk-1 foi considerado dispensável para interação ALG-1/AIN-12 (Figura 3). Além disso, a tecnologia de edição de genomas CRISPR/Cas9 pode ser empregada para gerar mutações de exclusão de ponto único ou domínio nas proteínas de interesse. Retestar a capacidade dos mutantes gerados de coprecipitar com seus interajadores de proteínas pode revelar quais domínios ou resíduos mediam a interação física. Tais estudos futuros podem produzir informações inestimáveis sobre o mecanismo da função e regulação da proteína. Essas abordagens, combinadas com o poder da genética C. elegans, podem fornecer insights importantes sobre os processos moleculares fundamentais que regem o desenvolvimento animal e a função celular.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi em parte apoiado por Kansas INBRE, P20GM103418 para Li e Zinovyeva e R35GM124828 para Zinovyeva. Agradecemos a Min Han por compartilhar generosamente o anticorpo anti-AIN-1. Algumas das cepas utilizadas no decorrer deste trabalho foram fornecidas pelo Centro de Genética de Caenorhabditis (CGC), financiado pelo NIH Office of Research Infrastructure Programs (P40 OD010440).
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL tube | VWR | 89039-664 | STEP 1.2 |
| 2x Laemmli Sample Buffer | BioRed | 1610737 | STEP 3.11 |
| 4–20% Mini-PROTEAN TGX Precast Protein Gels | BioRed | 4561096 | STEP 4.1 |
| anti-AIN-1 monoclonal antibody | custom generated | n/a | STEP 4.2, see ref. Zhang et al. 2007 |
| anti-ALG-1 monoclonal antibody | custom generated by PRF&L | n/a | STEP 4.2 |
| anti-HRPK-1 monoclonal antibody | custom generated by PRF&L | n/a | STEP 4.2 |
| Bullet Blender Storm Homogenizer | MidSci | BBY24M | STEP 2.3 |
| DL-Dithiothreitol (DTT) | Sigma | D9779-5G | Table 1 |
| Dynabeads Protein A for Immunoprecipitation | Thermo Fisher | 10002D | STEP 3.2 |
| DynaMag-2 Magnet | Thermo Fisher | 12321D | STEP 3.2 |
| EDTA-free protease inhibitors | Roche | 11836170001 | Table 1 |
| GFP antibody (FL) | Santa Cruz Biotechnology | sc-8334 | Figure 2 |
| Glycerol | Thermo Fisher | G33-500 | Table 1 |
| Goat Anti-Rabbit Secondary Antibody, HRP | BioRed | 1662408 | STEP 4.2 |
| Goat anti-Rat IgG (H+L) Secondary Antibody, HRP | Thermo Fisher | 31470 | STEP 4.2 |
| HEPES | Sigma | H4034-500G | Table 1 |
| LICOR WesternSure PREMIUM Chemiluminescent Substrate, 100 mL Kit | LI-COR | 926-95000 | STEP 4.3 |
| Magnesium chloride hexahydrate ACS | VWR | VWRV0288-500G | Table 1 |
| Magnesium Sulfate Anhydrous | Thermo Fisher | M65-500 | Table 1 |
| Microcentrifuge Tubes, 1.5 mL | VWR | 20170-333 | STEP 1.6 |
| N2 wild type | CGC | ||
| Navy RINO RNA Lysis Kit 50 pack (1.5 mL) | MidSci | NAVYR1-RNA | STEP 2.3 |
| Phosphatase inhibitor cocktail 2 | Sigma | P5726-1ML | Table 1 |
| Phosphatase inhibitor cocktail 3 | Sigma | P0044-1ML | Table 1 |
| Potassium Chloride | Thermo Fisher | P217-500 | Table 1 |
| Potassium phosphate monobasic | Thermo Fisher | P285-3 | Table 1 |
| RC DC Protein Assay Kit I | BioRed | 5000121 | STEP 2.9 |
| RNaseOUT Recombinant Ribonuclease Inhibitor | Thermo Fisher | 10777019 | Table 1 |
| Sodium Chloride | Thermo Fisher | S271-500 | Table 1 |
| Sodium Phosphate Dibasic Anhydrous | Thermo Fisher | S374-500 | Table 1 |
| TritionX-100 | Sigma | X100-500ML | Table 1 |
| UY38 hrpk-1(zen17) | available upon request | ||
| VT1367 col-19::gfp(maIS105) | available upon request | ||
| VT3841 alg-1(tm492) | available upon request |
Referências
- Liu, X., et al. An AP-MS- and BioID-compatible MAC-tag enables comprehensive mapping of protein interactions and subcellular localizations. Nature Communications. 9 (1), 1188-1216 (2018).
- Li, L., Veksler-Lublinsky, I., Zinovyeva, A. HRPK-1, a conserved KH-domain protein, modulates microRNA activity during Caenorhabditis elegans development. PLoS Genetics. 15 (10), 1008067 (2019).
- Zinovyeva, A. Y., Veksler-Lublinsky, I., Vashisht, A. A., Wohlschlegel, J. A., Ambros, V. R. Caenorhabditis elegans ALG-1 antimorphic mutations uncover functions for Argonaute in microRNA guide strand selection and passenger strand disposal. Proceedings of the National Academy of Sciences of the United States of America. 112 (38), 5271-5280 (2015).
- Hammell, C. M., Lubin, I., Boag, P. R., Blackwell, T. K., Ambros, V. nhl-2 Modulates microRNA activity in Caenorhabditis elegans. Cell. 136 (5), 926-938 (2009).
- Zou, Y., et al. Developmental decline in neuronal regeneration by the progressive change of two intrinsic timers. Science. 340 (6130), 372-376 (2013).
- Zanin, E., Dumont, J., et al. Affinity purification of protein complexes in C. elegans. Methods in Cell Biology. 106, 289-322 (2011).
- Bhaskaran, S., et al. Breaking Caenorhabditis elegans the easy way using the Balch homogenizer: an old tool for a new application. Analytical Biochemistry. 413 (2), 123-132 (2011).
- Kohl, K., et al. Plate-based Large-scale Cultivation of Caenorhabditis elegans: Sample Preparation for the Study of Metabolic Alterations in Diabetes. Journal of Visualized Experiments. (138), e58117 (2018).
- Larance, M., Bailly, A. P., et al. Stable-isotope labeling with amino acids in nematodes. Nature Methods. 8 (10), 849-851 (2011).
- Ding, L., Han, M. GW182 family proteins are crucial for microRNA-mediated gene silencing. Trends in Cell Biology. 17 (8), 411-416 (2007).
- Ding, L., Spencer, A., Morita, K., Han, M. The Developmental Timing Regulator AIN-1 Interacts with miRISCs and May Target the Argonaute Protein ALG-1 to Cytoplasmic P Bodies in C. elegans. Molecular Cell. 19 (4), 437-447 (2005).
- Jannot, G., Vasquez-Rifo, A., Simard, M. J. Argonaute Pull-Down and RISC Analysis Using 2’-O-Methylated Oligonucleotides Affinity Matrices. Methods in Molecular Biology. 725, 233-249 (2011).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook: the Online Review of C. elegans Biology. , 1-11 (2006).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. Journal of Visualized Experiments. (16), e759 (2008).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. Journal of Visualized Experiments. (44), e2359 (2010).
- Zinovyeva, A. Y., Bouasker, S., Simard, M. J., Hammell, C. M., Ambros, V. Mutations in conserved residues of the C. elegans microRNA Argonaute ALG-1 identify separable functions in ALG-1 miRISC loading and target repression. PLoS Genetics. 10 (4), 1004286 (2014).
- Zhang, L., et al. Systematic Identification of C. miRISC Proteins, miRNAs, and mRNA Targets by Their Interactions with GW182 Proteins AIN-1 and AIN-2. Molecular Cell. 28 (4), 598-613 (2007).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent Window into Biology: A Primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Farboud, B., et al. Enhanced Genome Editing with Cas9 Ribonucleoprotein in Diverse Cells and Organisms. Journal of Visualized Experiments. (135), e57350 (2018).
- Dickinson, D. J., Goldstein, B. CRISPR-Based Methods for Caenorhabditis elegans Genome Engineering. Genetics. 202 (3), 885-901 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados