Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sitotoksisiteye Erişim ve Biyomateryallere Hücre Yanıtı
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu metodoloji, akış sitometrisi, RT-PCR, immünositokimya ve diğer hücresel ve moleküler biyoloji teknikleri dahil olmak üzere canlılık testleri ve fenotipik analizler kullanarak, çözünür ekstraktların hazırlanması yoluyla biyomateryal sitotoksisitesini değerlendirmeyi amaçlamaktadır.
Özet
Biyomateryaller insan dokularıyla doğrudan veya dolaylı olarak temas eder ve bu da sitotoksisitesini değerlendirmeyi önemli kılar. Bu değerlendirme birkaç yöntemle yapılabilir, ancak kullanılan yaklaşımlar arasında yüksek bir tutarsızlık vardır, bu da tekrarlanabilirliği ve elde edilen sonuçlar arasındaki karşılaştırmayı tehlikeye atar. Bu yazıda, dental biyomateryaller için kullandığımız çözünür ekstraktları kullanarak biyomateryallerin sitotoksisitesini değerlendirmek için bir protokol öneriyoruz. Ekstraktların hazırlanması, pelet üretiminden bir kültür ortamında ekstraksiyonuna kadar detaylandırılmıştır. Biyomateryal sitotoksisite değerlendirmesi, MTT testi kullanılarak metabolik aktiviteye, Sülforhodamin B (SBR) testi kullanılarak hücre canlılığına, akış sitometrisi ile hücre ölüm profiline ve May-Grünwald Giemsa kullanılarak hücre morfolojisine dayanmaktadır. Sitotoksisite değerlendirmesine ek olarak, immünositokimya ve PCR ile değerlendirilen spesifik belirteçlerin ekspresyonuna dayanarak hücre fonksiyonunu değerlendirmek için bir protokol tanımlanmıştır. Bu protokol, ekstraktlar metodolojisini kullanarak biyomateryallerin sitotoksisitesi ve hücresel etkilerin değerlendirilmesi için tekrarlanabilir ve sağlam bir şekilde kapsamlı bir kılavuz sağlar.
Giriş
Biyouyumluluk, bir malzemenin dokuyu entegre etme ve lokal ve sistemik hasarlardan arındırılmış olumlu bir terapötik yanıtı indükleme kapasitesi olarak tanımlanabilir 1,2,3. Biyouyumluluk değerlendirmesi, tıbbi kullanıma yönelik herhangi bir malzemenin geliştirilmesi için çok önemlidir. Bu nedenle, bu protokol, yeni biyomalzemeler geliştirmeyi amaçlayan veya mevcut biyomalzemeler için yeni uygulamaları inceleyen her araştırmacı için sistematik ve kapsamlı bir yaklaşım sunmaktadır.
İn vitro sitotoksisite testleri, primer hücre kültürleri veya hücre hatları kullanılarak biyouyumluluk değerlendirmesi için ilk aşama olarak yaygın olarak kullanılmaktadır. Sonuçlar, potansiyel klinik uygulamanın ilk göstergesidir. Biyomalzeme gelişimi için hayati önem taşımasının yanı sıra, bu test, EUA ve AB düzenleyicilerinin (FDA ve CE sertifikası) 4,5,6,7,8 ile piyasaya sürülmesi için mevcut düzenlemelere uymak için zorunludur. Ayrıca, biyomedikal araştırmalarda standartlaştırılmış testler, tekrarlanabilirlik ve benzer biyomalzemeler veya cihazlar üzerinde yapılan farklı çalışmalardan elde edilen sonuçların karşılaştırılması açısından önemli bir avantaj sağlamaktadır9.
Uluslararası Standartlar Örgütü (ISO) yönergeleri, malzemeleri doğru ve tekrarlanabilir bir şekilde test etmek için birden fazla bağımsız ticari, düzenleyici ve akademik laboratuvar tarafından yaygın olarak kullanılmaktadır. ISO 10993-5, in vitro sitotoksisite değerlendirmesini ifade eder ve ISO 10993-12, numune alma preparatı10,11'e rapor verir. Biyomalzeme testi için, malzeme türüne, temas eden dokulara ve tedavi hedefine göre seçilecek üç kategori sağlanmıştır: ekstraktlar, doğrudan temas ve dolaylı temas 8,11,12,13. Ekstraktlar, bir hücre kültürü ortamının biyomateryal ile zenginleştirilmesiyle elde edilir. Doğrudan temas testleri için, biyomateryal doğrudan hücre kültürlerine yerleştirilir ve dolaylı temasta, hücrelerle inkübasyon, agaroz jeli11 gibi bir bariyerle ayrılmış olarak gerçekleştirilir. Uygun kontroller zorunludur ve en az üç bağımsız deney yapılmalıdır 5,8,10,11,14.
Sitotoksik potansiyeli belirlemek için klinik koşulları simüle etmek veya abartmak çok önemlidir. Ekstrakt testi durumunda, malzemenin yüzey alanı; orta hacimli; ortam ve malzeme pH; malzeme çözünürlüğü, ozmolarite ve difüzyon oranı; ve ajitasyon, sıcaklık ve zaman gibi ekstraksiyon koşulları medyayı etkilerEnrichmen 5.
Metodoloji, hem katı hem de sıvı olmak üzere çeşitli farmasötik formülasyonların sitotoksisitesinin kantitatif ve kalitatif olarak değerlendirilmesine izin verir. Nötr kırmızı alım testi, koloni oluşum testi, MTT testi ve XTT testi 5,10,14 gibi çeşitli testler yapılabilir.
Yayınlanan sitotoksisite değerlendirme çalışmalarının çoğu, sınırlı bilgi sağlayan MTT ve XTT gibi daha basit tahliller kullanmaktadır. Biyouyumluluğun değerlendirilmesi sadece sitotoksisitenin değerlendirilmesini değil, aynı zamanda bu protokolün onayladığı gibi belirli bir test materyali2'nin biyoaktivitesini de içermelidir. Yaslandırıldığında ve belgelendiğinde ek değerlendirme kriterleri kullanılmalıdır. Bu nedenle, bu protokol, biyomateryal sitotoksisite değerlendirmesi için bir dizi yöntemi detaylandıran kapsamlı bir rehber sağlamayı amaçlamaktadır. Ayrıca, hücre ölümünün tipi, hücre morfolojisi, spesifik proteinlerin sentezinde hücre fonksiyonu ve spesifik doku üretimi gibi farklı hücresel süreçlerin değerlendirilmesi açıklanmaktadır.
Protokol
1. Pelet hazırlama
- PVC plakalarda bilinen boyutlarda dairesel şekilli delikler açarak polivinil klorür (PVC) kalıplarını hazırlayın.
NOT: PVC pervazlar farklı boyutlarda yapılabilir. PVC kalıpların temas yüzeyini A= h(2πr)+2πr2 (r: silindirin yarıçapı; h: silindirin yüksekliği) formülünü kullanarak hesaplayın. - Test edilecek biyomateryali üreticinin talimatlarına göre ve deneyin başlangıcına mümkün olduğunca yakın bir şekilde hazırlayın.
NOT: Macun/macun formülasyonu biyomalzemelerinin hazırlanması için, yeterli miktarda baz macun ve katalizör bir karıştırma spatulası ile manuel olarak karıştırılır. Sıvı ve toz formülasyonlarına dayanan diğer malzemeler için, üreticinin talimatlarını izleyerek veya yeni malzemeler için yeterli olan manuel spatulasyon veya titreşimle mekanik karıştırma yapılmalıdır. Sıvı malzemeler için bu adım gerekli değildir. Adım 2'de protokolü başlatın. - Biyomateryali bir spatula ile kalıpların üzerine yerleştirin ve uygun süre için ayarlanmalarına izin verin.
NOT: Biyomalzemelerin ayar süresi ve ayar koşulları, üreticinin talimatlarına veya yeni malzemeler için yeterli talimatlara uygun olmalıdır. - Ayarladıktan sonra, biyomalzemenin peletlerini PVC kalıplarından çıkarın ve bir kaba yerleştirin (6 kuyucuklu bir plaka veya bir Petri kabı kullanılabilir).
- Peletleri, her iki taraf için 20 dakika boyunca ultraviyole ışık (UV) lambasının altına yerleştirerek sterilize edin.
2. Biyomateryallerin ekstraktlarının elde edilmesi
NOT: Tüm prosedürler sıkı steril koşullar altında yapılmalıdır.
- Pelet yüzey alanını 1.1'de açıklanan formüle göre hesaplayarak gerekli pelet sayısını belirleyin.
NOT: Referans değer olarak, 250 mm2/mL11,15 temas yüzey alanı, ortamın mL'si başına 9 pelet (r 3 mm x y 1,5 mm) eklenerek elde edilir. - Çözünür ekstraktları hazırlayın (biyomalzeme ile zenginleştirilmiş ekstrakt).
- Peletleri 50 mL'lik bir tüpe yerleştirin ve hücre kültürü ortamının karşılığını ekleyin. Tüpleri 24 saat boyunca inkübatöre 37 ° C'de, sürekli rotasyonda yerleştirin.
NOT: Hücre kültürleri için uygun hücre kültürü ortamını kullanın. - 24 saat sonra, tüpleri inkübatörden çıkarın. Bu noktada, ekstraktlar 1/1 veya% 100'lük bir konsantrasyona karşılık gelir.
- Hücre kültürü ortamına eşit hacimlerde şartlandırılmış ortamın sıralı olarak eklenmesiyle ekstraktın seyreltmesini yapın.
NOT: Ortama pH ayarı yapılmamalıdır.- %50 ekstrakt elde etmek için 1 mL'lik %100 ekstraktın içine 1 mL kültür ortamı ekleyin. %25'lik bir ekstrakt elde etmek için 1 mL'lik %50'lik ekstraktın 1 mL'sine 1 mL kültür ortamı ekleyin ve bu şekilde devam edin (Şekil 1).
NOT: Her bileşik için ilgili bulunan konsantrasyonları kullanın.
- %50 ekstrakt elde etmek için 1 mL'lik %100 ekstraktın içine 1 mL kültür ortamı ekleyin. %25'lik bir ekstrakt elde etmek için 1 mL'lik %50'lik ekstraktın 1 mL'sine 1 mL kültür ortamı ekleyin ve bu şekilde devam edin (Şekil 1).
- Peletleri 50 mL'lik bir tüpe yerleştirin ve hücre kültürü ortamının karşılığını ekleyin. Tüpleri 24 saat boyunca inkübatöre 37 ° C'de, sürekli rotasyonda yerleştirin.
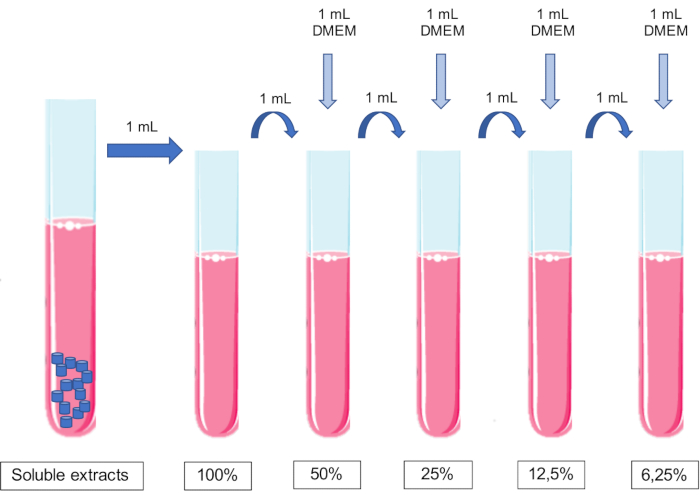
Şekil 1: Çözünür ekstraktların hazırlanması ve seyreltilmesi şeması. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
3. Biyomateryallerin özleri ile hücre inkübasyonu
- Hücresel bir süspansiyon hazırlayın ve deneyler için gereken hücre sayısına göre çok kuyulu bir plaka gibi yeterli bir hücre kabında plakalayın.
- İstenilen hücrelerin% 80 ila% 90 birleşme ile bir şişesi ile başlayın.
- Hücre kültürü ortamını atın, fosfat tamponlu salin çözeltisi (PBS) ile yıkayın ve hücreleri tripsin-EDTA ile ayırın (75cm2'lik bir hücre kültürü şişesi için 1 ila 2 mL).
- Hücre kültürü ortamını ekleyin (75cm2'lik bir hücre kültürü şişesi için 2 ila 4 mL), hücre süspansiyonunu bir tüpe aktarın ve 5 dakika boyunca 200 x g'de santrifüjleyin.
- Pelet, bilinen bir hücre kültürü ortamı hacminde askıya alın.
NOT: Bu protokol, yapışkan hücre kültürlerinin kullanımı için tasarlanmıştır; Bununla birlikte, süspansiyon hücre kültürleri ile çalışmak için basit uyarlamalar yapılabilir. - Hemositometredeki hücreleri sayın ve hücre süspansiyonunun hücre konsantrasyonunu hesaplayın.
- Belirlenen miktarda hücre süspansiyonunu kültür ortamında askıya alın ve çok kuyulu tabaklara aktarın. Tohumlama yoğunluğu için referans değer olarak, 5 – 20 x 105 hücre /cm2 düşünün.
NOT: Uygun hücre sayısı, hücre tipine ve hücre özelliklerine, yani hücre iki katına çıkma süresine göre hesaplanmalıdır.
- Hücre yapışmasına izin vermek için hücreleri 24 saat boyunca inkübe edin.
- Bu süreden sonra, çözünür ekstraktları kültür plakalarına uygulayın.
- Hücre kültürü ortamını aspire edin.
- Biyomalzemelerin ekstraktlarını, daha önce açıklandığı gibi, konsantrasyon sırasına göre her bir kuyucuğa ekleyin. Kontrol kuyucuklarına taze hücre kültürü ortamı ekleyin.
- Plakaları 24 saat veya daha uzun süre inkübe edin.
NOT: Her tahlilde, kültür ortamında muhafaza edilen, işlenmemiş hücrelere karşılık gelen negatif kontroller yapılmalıdır. Kuluçka süreleri çalışma hedeflerine göre seçilebilir.
4. Metabolik aktivitenin değerlendirilmesi
- Biyomateryallerin özleri ile hücre inkübasyonundan sonra, ortamı plakalardan aspire edin ve her bir PBS kuyusunu yıkayın.
- Her bir kuyucuğa, PBS, pH 7.4'te hazırlanan yeterli miktarda 0.5 mg / mL 3-(4,5-dimetiltiazol-2-yl)-2,5-difeniltetrazol bromür (MTT) yerleştirin.
- Plakaları 4 saat boyunca veya karanlıkta 37 ° C'de gece boyunca inkübe edin.
- Elde edilen formazan kristallerini çözündürmek için, her bir oyuğa izopropanolde yeterli miktarda 0.04 M hidroklorik asit çözeltisi ekleyin ve plakaları 30 dakika karıştırın.
NOT: MTT ve izopropanol miktarını kuyucukların boyutuna göre ayarlayın. - Gerekirse, kristal görülmeyene kadar yukarı ve aşağı pipetleyerek her bir kuyucuğun içeriğini karıştırın ve homojenize edin.
- Spektrofotometrede 620 nm referans filtresi ile 570 nm dalga boyundaki absorbansı ölçün.
- Metabolik aktiviteyi hesaplamak için, tedavi edilen hücrelerin emilimini kontrol kültürlerinin emilimine bölün. Yüzde değerlerini elde etmek için 100 ile çarpın.
5. Hücre ölümü değerlendirmesi
NOT: Bu değerlendirmeyi yapmak için koşul başına en az 106 hücre kullanılmalıdır.
- Değerlendirilen koşullara göre uygun şekilde tanımlanmış santrifüj tüpleri kullanın.
- Biyomateryallerin özleri ile hücre inkübasyonundan sonra, kültür ortamını ilgili tüpe toplayın.
- Hücreleri ayırın ve hücre süspansiyonunu ilgili tüplere ekleyin.
- Hücre süspansiyonlarını 5 dakika boyunca 120 x g'de santrifüjleme ile konsantre edin.
- Peletleri PBS ile yıkayın. PBS'yi 5 dakika boyunca 1.000 x g'de santrifüjleme ile çıkarın.
- 1 mL PBS ekleyin ve hücre peletlerini tanımlanmış sitometri tüplerine aktarın.
- PBS'yi 5 dakika boyunca 1.000 x g'de santrifüjleme ile çıkarın.
- 100 μL bağlayıcı tampon (0,01 M HEPES, 0,14 mM NaCl ve 0,25 mM CaCl2)16 ile inkübe edin ve hücre zarı geri kazanımı için hücrelerin yaklaşık 15 dakika dinlenmesine izin verin.
- Karanlıkta oda sıcaklığında 15 dakika boyunca Annexin-V etiketli 2,5 μL floresan ve 1 μL propidyum iyodür ekleyin.
- İnkübasyondan sonra, 400 μL PBS ekleyin ve sitometre üzerinde analiz edin. Bilgilerin analizi ve nicelleştirilmesi için uygun yazılımı kullanın.
- Sonuçları canlı hücrelerin yüzdesi, apoptoz, geç apoptoz/nekroz ve nekroz olarak sunar.
6. Morfoloji değerlendirmesi
- Çok kuyulu plakanın içine sığacak uygun boyutta sterilize edilmiş cam kapak fişlerini seçin.
- Her slaytı steril cımbız kullanarak bir kuyucuğa yerleştirin.
- Hücresel bir süspansiyonu kuyucuklara yeterli konsantrasyonda dağıtın ve% 95 hava ve% 5 CO 2 ile nemlendirilmiş bir atmosferde 37 ° C'de bir inkübatörde gece bekletin.
- Hücre kültürlerini daha önce tarif edildiği gibi ekstraktlara maruz bırakın.
- Medyayı aspire edin ve PBS ile yıkayın.
- Kapak fişlerinin oda sıcaklığında kurumasını bekleyin ve daha sonra kapak fişlerini örtmek için yeterli miktarda May-Grünwald çözeltisi ekleyin; 3 dakika boyunca inkübe edin.
- Boyayı çıkarın ve 1 dakika boyunca damıtılmış suyla yıkayın.
- Suyu çıkarın ve kapakları örtmek için yeterli miktarda Giemsa çözeltisi ekleyin; 15 dakika boyunca inkübe edin.
- Kapakları akan suda yıkayın.
- Kapak fişlerini bir slayta aktarın.
- Mikroskop altına bakın. Fotoğrafları seçilen büyütme ile çekin.
7. Ters transkripsiyon polimeraz zincir reaksiyonu (RT-PCR) ile hücre fonksiyon değerlendirmesi
NOT: Bu değerlendirmeyi gerçekleştirmek için koşul başına en az 2x106 hücre kullanılmalıdır. Örnek olarak, alkalen fosfataz, odontoblastların aktivite değerlendirmesi için ilgi çekici bir gen olarak sunulmuştur. İlgilenilen diğer genler Tablo 1'de görülebilir.
- Hücreleri yukarıda açıklandığı gibi plakalayın.
NOT: Kaplanan hücrelerin konsantrasyonunun, incelenen biyomateryallerin hücre tipine ve sitotoksisitesine göre ayarlanması gerekebilir. - Yukarıda tarif edildiği gibi çözünür ekstraktlarla inkübe edin.
- Daha önce açıklandığı gibi bir süspansiyon elde etmek için hücreleri ayırın.
- Hücreleri PBS ile iki kez yıkayın; Bu santrifüj için oda sıcaklığında 5 dakika boyunca 200 x g'de.
- Peletleri 1 mL RNA saflaştırma çözeltisinde (örneğin, NZYol), yoğun karıştırmada ve ardışık pipetlemede askıya alarak hücreleri lize edin.
- Numuneleri oda sıcaklığında 5 dakika boyunca inkübe edin.
- 200 μL kloroform ekleyin ve tüpleri 15 saniye boyunca elle çalkalayın.
- Oda sıcaklığında 3 dakika inkübe edin.
- Santrifüj, 12.000 x g'de 15 dakika boyunca 4 ° C'de santrifüj lizatları. Bu santrifüjleme sırasında, numunede iki faz ortaya çıkar ve RNA'yı sulu (üst) fazda bırakır.
- Sulu fazı yeni bir tüpe çıkarın ve RNA'yı çökeltmek için 500 μL soğuk izopropanol ekleyin.
- Numuneleri oda sıcaklığında 10 dakika boyunca inkübe edin ve 4 ° C'de 10 dakika boyunca 12.000 x g'de santrifüj yapın.
- Süpernatantı çıkarın ve peleti 7.500 x g'de santrifüjleme yoluyla 1 mL% 75 etanol ile 4 ° C'de 5 dakika yıkayın.
- Pelet etanol buharlaşana kadar oda sıcaklığında kurutun.
- RNase içermeyen suda askıya alın.
- 260 nm ve 280 nm dalga boylarında absorpsiyon spektrofotometrisini kullanarak numunelerin saflık derecesini ölçün ve belirleyin. RNA saflığını belirleyin ve 2.0 civarında saflık oranına (A260/280) sahip numuneler kullanın.
- Örnekleri -80 ° C'de saklayın
- RT-PCR'yi üreticinin protokolü17'ye uyarak gerçekleştirmeye devam edin.
NOT: Etüt hedefine göre, değerlendirilecek belirli belirteçleri seçin.
8. Protein tanımlama yoluyla hücre fonksiyon değerlendirmesi
NOT: Çalışma hedefine göre, değerlendirilecek spesifik proteinleri seçin. Örnek olarak, dentin sialoprotein (DSP), odontoblastların aktivite değerlendirmesi için ilgi çekici bir protein olarak sunulmuştur. İlgilenilen diğer proteinler Tablo 1'de görülebilir.
- Kültür hücreleri örtü kayması içinde ve daha önce tarif edildiği gibi ekstraktlara maruz kalır.
- Hücre kültürlerini PBS ile yıkayın.
- Oda sıcaklığında 30 dakika boyunca% 3.7 paraformaldehit ile sabitleyin.
- PBS ile iki kez yıkayın.
- PBS'de 15 dakika boyunca% 0.5 Triton ile geçirgenleştirin.
- Peroksidazın PBS'de% 0.3 hidrojen peroksit ile 5 dakika boyunca bloke edilmesi.
- PBS ile iki kez yıkayın.
- % 0.5 sığır serum albümini (BSA) ile iki kez yıkayın.
- Hücre kültürlerini 45 dakika boyunca% 2 BSA ile bloke edin.
- PBS'de %0,5 BSA ile yıkayın.
- Kültürleri, seçilen proteine göre birincil antikor ile oda sıcaklığında 60 dakika boyunca inkübe edin.
NOT: Bu protokol birincil antikor DSP (M20) Antikoru (1:100) ve ikincil antikor Poliklonal Tavşan Anti-keçi immünoglobulinleri/HRP'yi (1:100) kullanır. - PBS'de% 0.5 BSA ile beş kez yıkayın.
- Oda sıcaklığında 90 dakika boyunca ikincil antikor ile inkübe edin.
NOT: PBS'de %0.5 BSA kullanarak antikor seyreltmelerini yapın. - Her yıkamada 1 dakika boyunca PBS'de% 0.5 BSA ile beş kez yıkayın.
- Kültürleri 25 dakika boyunca 20 μL kromojen / mL substrat konsantrasyonunda bir substrat ve kromojen karışımı ile inkübe edin.
- PBS'de% 0.5 BSA ile iki kez yıkayın.
- 15 dakika boyunca Hematoksilin ile karşı boya yapın.
- Fazla boyayı çıkarmak için 0.037 mol / L amonyak ve damıtılmış su dizisi ile 5 dakika boyunca yıkayın.
- Kapak fişlerini slaytlara monte edin. Montaj ortamı olarak gliserol kullanın.
- Gece boyunca kurumaya bırakın.
- Mikroskop altına bakın. Fotoğrafları seçilen büyütme ile çekin.
9. Alizarin Red S testi ile mineralizasyon değerlendirmesi
- 40 mM18 konsantrasyonda bir Alizarin Red S çözeltisi hazırlayın. Homojenizasyon için çözeltiyi karanlıkta 12 saat karıştırın.
NOT: 100 mL Alizarin Red S çözeltisi hazırlamak için, 1.44 g alizarin tozunu (Moleküler ağırlık: 360 g / mol) ışıktan korunan ultra saf suda çözündürün. Bu çözelti için pH değeri kritiktir ve 4.1 ile 4.3 arasında olmalıdır. - Yukarıda tarif edildiği gibi, hücre kültürünü çözünür ekstraktlarla inkübe edin.
- Hücre kültürlerini PBS ile üç kez yıkayın.
- Oda sıcaklığında% 4 paraformaldehit ile 15 dakika boyunca sabitleyin.
- PBS ile üç kez yıkayın.
- Alizarin Kırmızı Boyama solüsyonu ile karanlıkta 37 ° C'de 20 dakika boyunca lekeleyin.
- Boyamadan sonra, fazla boyayı çıkarmak için plakaları PBS ile yıkayın.
- Mikroskop altına bakın. Fotoğrafları seçilen büyütme ile çekin.
- Her bir kuyucuğa% 10 (w / v) asetik asit ve% 20 (w / v) metanol içeren bir ekstraksiyon çözeltisi ekleyin ve oda sıcaklığında 40 dakika karıştırmaya bırakın.
- Bir spektrofotometre19 üzerinde 490 nm dalga boyunda absorbansı ölçün.
Sonuçlar
Buradaki temsili sonuçlar, diş biyomateryallerinin çalışmasına atıfta bulunmaktadır. Ekstrakt metodolojisi, dental materyallere maruz kaldıktan sonra, metabolik aktivite (Şekil 2), hücre canlılığı, hücre ölüm profili ve hücre morfolojisi (Şekil 3) ve spesifik proteinlerin ekspresyonu (Şekil 4) üzerindeki etkilerle ilgili olarak bir sitotoksisite profili ve hücre fonksiyonu elde etmeyi sağlar.
Tartışmalar
Bu protokol, dokularla temas eden biyomateryallerin in vitro sitotoksisitesinin değerlendirilmesini ifade eden ISO 10993-5 dikkate alınarak, biyouyumluluğu değerlendirmek ve tekrarlanabilirlik çalışmalarına katkıda bulunmak amacıyla tasarlanmıştır21. Bu, bilimde giderek artan bir endişe kaynağıdır ve birçok yazar, in vitro çalışmalarının deneysel tasarımında bu önerileri zaten izlemektedir 15,22,23,24,25,26,27,28.
Açıklamalar
Yazarların birbiriyle çelişen finansal çıkarları veya diğer çıkar çatışmaları yoktur.
Teşekkürler
Destek için aşağıdakilere teşekkür ederiz: GAI 2013 (Faculdade de Medicina da Universidade de Coimbra); CIBB, UIDB/04539/2020 ve UIDP/04539/2020 (CIBB) Stratejik Projesi aracılığıyla FCT (Bilim ve Teknoloji Vakfı) aracılığıyla Ulusal Fonlar tarafından finanse edilmektedir. Michigan Üniversitesi Diş Hekimliği Fakültesi'nden Jacques Nör'e MDPC-23 hücre hattını sağladığı için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CaCl2 | Sigma | 10035-04-8 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| DAB + Chromogen | Dako | K3468 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| DSP (M-20) Antibody, 1: 100 | Santa Cruz Biotechnology | LS-C20939 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Hepes 0.01 M | Sigma | MFCD00006158 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Giemsa Stain, modified GS-500 | Sigma | MFCD00081642 | |
| Glycerol | Dako | C0563 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| May-Grünwald Stain MG500 | Sigma | MFCD00131580 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Polyclonal Rabbit Anti-goat immunoglobulins / HRP, 1: 100 | Dako | G-21234 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Substrate Buffer | Dako | 926605 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| β-actin antibody | Sigma | A5316 |
Referanslar
- Williams, D. F. On the mechanisms of biocompatibility. Biomaterials. 29 (20), 2941-2953 (2008).
- Bruinink, A., Luginbuehl, R. Evaluation of biocompatibility using in vitro methods: interpretation and limitations. Advances in Biochemical Engineering/Biotechnology. 126, 117-152 (2012).
- Wataha, J. C. Principles of biocompatibility for dental practitioners. The Journal of Prosthetic Dentistry. 86 (2), 203-209 (2001).
- Mishra, S. F. D. A. CE mark or something else?-Thinking fast and slow. Indian Heart Journal. 69 (1), 1-5 (2016).
- Barbeck, M., et al. Balancing Purification and Ultrastructure of Naturally Derived Bone Blocks for Bone Regeneration: Report of the Purification Effort of Two Bone Blocks. Materials. 12 (19), 3234 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- Coelho, C. C., Araújo, R., Quadros, P. A., Sousa, S. R., Monteiro, F. J. Antibacterial bone substitute of hydroxyapatite and magnesium oxide to prevent dental and orthopaedic infections. Materials Science and Engineering: C. 97, 529-538 (2019).
- Jung, O., et al. Improved In Vitro Test Procedure for Full Assessment of the Cytocompatibility of Degradable Magnesium Based on ISO 10993-5/-12. International Journal of Molecular Sciences. 20 (2), 255 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- ISO. I.O. for S. ISO 10993-12:2012 - part 12: Sample preparation and reference materials. ISO. , (2012).
- ISO. I.O. for S. ISO 10993-5:2009 Biological evaluation of medical devices - part 5: Tests for in vitro cytotoxicity. ISO. , (2009).
- Srivastava, G. K., et al. Comparison between direct contact and extract exposure methods for PFO cytotoxicity evaluation. Scientific Reports. 8 (1), 1425 (2018).
- Pusnik, M., Imeri, M., Deppierraz, G., Bruinink, A., Zinn, M. The agar diffusion scratch assay--A novel method to assess the bioactive and cytotoxic potential of new materials and compounds. Scientific Reports. 6, 20854 (2016).
- Spiller, K. L., et al. The role of macrophage phenotype in vascularization of tissue engineering scaffolds. Biomaterials. 35 (15), 4477-4488 (2014).
- Zhou, H., et al. In Vitro Cytotoxicity Evaluation of a Novel Root Repair Material. Journal of Endodontics. 39 (4), 478-483 (2013).
- Bordron, A., et al. The binding of some human antiendothelial cell antibodies induces endothelial cell apoptosis. Journal of Clinical Investigation. 101 (10), 2029-2035 (1998).
- Palmini, G., et al. Establishment of Cancer Stem Cell Cultures from Human Conventional Osteosarcoma. Journal of Visualized Experiments. (116), e53884 (2016).
- Gregory, C. A., Grady Gunn, W., Peister, A., Prockop, D. J. An Alizarin red-based assay of mineralization by adherent cells in culture: comparison with cetylpyridinium chloride extraction. Analytical Biochemistry. 329 (1), 77-84 (2004).
- Cai, S., Zhang, W., Chen, W. PDGFRβ+/c-kit+ pulp cells are odontoblastic progenitors capable of producing dentin-like structure in vitro and in vivo. BMC Oral Health. 16 (1), 113 (2016).
- Paula, A., et al. Biodentine Boosts, WhiteProRoot MTA Increases and Life Suppresses Odontoblast Activity. Materials. 12 (7), 1184 (2019).
- Chander, N. G. Standardization of in vitro studies. Journal of Indian Prosthodontic Society. 16 (3), 227-228 (2016).
- Cavalcanti, B. N., Rode de M, S., França, C. M., Marques, M. M. Pulp capping materials exert an effect on the secretion of IL-1β and IL-8 by migrating human neutrophils. Brazilian Oral Research. 25 (1), 13-18 (2011).
- Chang, S., Lee, S. Y., Ann, H. J., Kum, K. Y., Kim, E. C. Effects of calcium silicate endodontic cements on biocompatibility and mineralization-inducing potentials in human dental pulp cells. Journal of Endodontics. 40 (8), 1194-1200 (2014).
- Daltoé, M. O., Paula-Silva, F. W. G., Faccioli, L. H., Gatón-Hernández, P. M., De Rossi, A., Bezerra Silva, L. A. Expression of Mineralization Markers during Pulp Response to Biodentine and Mineral Trioxide Aggregate. Journal of Endodontics. 42 (4), 596-603 (2016).
- Elias, R. V., Demarco, F. F., Tarquinio, S. B. C., Piva, E. Pulp responses to the application of a self-etching adhesive in human pulps after controlling bleeding with sodium hypochlorite. Quintessence International. 38 (2), 67-77 (2007).
- Huang, G. T. J., Shagramanova, K., Chan, S. W. Formation of odontoblast-like cells from cultured human dental pulp cells on dentin in vitro. Journal of endodontics. 32 (11), 1066-1073 (2006).
- Jafarnia, B., et al. Evaluation of cytotoxicity of MTA employing various additives. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology. 107 (5), 739-744 (2009).
- Paranjpe, A., Smoot, T., Zhang, H., Johnson, J. D. Direct contact with mineral trioxide aggregate activates and differentiates human dental pulp cells. Journal of Endodontics. 37 (12), 1691-1695 (2011).
- Spagnuolo, G., et al. In vitro cellular detoxification of triethylene glycol dimethacrylate by adduct formation with N-acetylcysteine. Dental Materials. 29 (8), 153-160 (2013).
- Murray, P. E., García Godoy, C., García Godoy C, F. How is the biocompatibilty of dental biomaterials evaluated. Medicina Oral, Patologia Oral y Cirugia Bucal. 12 (3), 258-266 (2007).
- Hanks, C. T., Wataha, J. C., Sun, Z. In vitro models of biocompatibility: a review. Dental Materials. 12 (3), 186-193 (1996).
- Eid, A. A., et al. In Vitro Biocompatibility and Oxidative Stress Profiles of Different Hydraulic Calcium Silicate Cements. Journal of Endodontics. 40 (2), 255-260 (2014).
- Nocca, G., et al. Effects of ethanol and dimethyl sulfoxide on solubility and cytotoxicity of the resin monomer triethylene glycol dimethacrylate. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 100 (6), 1500-1506 (2012).
- Abuarqoub, D., Aslam, N., Jafar, H., Abu Harfil, Z., Awidi, A. Biocompatibility of Biodentine with Periodontal Ligament Stem Cells: In Vitro Study. Dentistry Journal. 8 (1), 17 (2020).
- Coelho, A. S., et al. Cytotoxic effects of a chlorhexidine mouthwash and of an enzymatic mouthwash on human gingival fibroblasts. Odontology. 108 (2), 260-270 (2020).
- Wang, M. O., et al. Evaluation of the In Vitro Cytotoxicity of Cross-Linked Biomaterials. Biomacromolecules. 14 (5), 1321-1329 (2013).
- Tyliszczak, B., Drabczyk, A., Kudłacik-Kramarczyk, S., Bialik-Wąs, K., Sobczak-Kupiec, A. In vitro cytotoxicity of hydrogels based on chitosan and modified with gold nanoparticles. Journal of Polymer Research. 24 (10), 153 (2017).
- Widbiller, M., et al. Three-dimensional culture of dental pulp stem cells in direct contact to tricalcium silicate cements. Clinical Oral Investigations. 20 (2), 237-246 (2016).
- Pintor, A. V. B., et al. In Vitro and In Vivo Biocompatibility of ReOss in Powder and Putty Configurations. Brazilian Dental Journal. 29 (2), 117-127 (2018).
- Pellissari, C. V. G., et al. In Vitro Toxic Effect of Biomaterials Coated with Silver Tungstate or Silver Molybdate Microcrystals. Journal of Nanomaterials. 2020, 1-9 (2020).
- Collado-González, M., et al. Cytotoxicity and bioactivity of various pulpotomy materials on stem cells from human exfoliated primary teeth. International Endodontic Journal. 50, 19-30 (2017).
- Paula, A., et al. Direct Pulp Capping: Which is the Most Effective Biomaterial? A Retrospective Clinical Study. Materials. 12 (20), 3382 (2019).
- Williams, D. F. There is no such thing as a biocompatible material. Biomaterials. 35 (38), 10009-10014 (2014).
- Schuh, J. C. L. Medical device regulations and testing for toxicologic pathologists. Toxicologic Pathology. 36 (1), 63-69 (2008).
- Pizzoferrato, A., et al. Cell culture methods for testing Biocompatibility. Clinical Materials. 15 (3), (1994).
- Pereira Paula, A. B., et al. Direct pulp capping: what is the most effective therapy? - review and meta-analysis. Journal of Evidence Based Dental Practice. , (2018).
- Caiaffa, K. S., et al. Effect of analogues of cationic peptides on dentin mineralization markers in odontoblast-like cells. Archives of Oral Biology. 103, 19-25 (2019).
- Fujiwara, S., Kumabe, S., Iwai, Y. Isolated rat dental pulp cell culture and transplantation with an alginate scaffold. Okajimas Folia Anatomica Japonica. 83 (1), 15-24 (2006).
- Nakashima, M., et al. Stimulation of Reparative Dentin Formation by Ex Vivo Gene Therapy Using Dental Pulp Stem Cells Electrotransfected with Growth/differentiation factor 11 (Gdf11). Human Gene Therapy. 15 (11), 1045-1053 (2004).
- Narayanan, K., et al. Differentiation of embryonic mesenchymal cells to odontoblast-like cells by overexpression of dentin matrix protein 1. Proceedings of the National Academy of Sciences of the United States of America. 98 (8), 4516-4521 (2001).
- Kim, H. J., Yoo, J. H., Choi, Y., Joo, J. Y., Lee, J. Y., Kim, H. J. Assessing the effects of cyclosporine A on the osteoblastogenesis, osteoclastogenesis, and angiogenesis mediated by the human periodontal ligament stem cells. Journal of Periodontology. , (2019).
- Bou Assaf, R., et al. Healing of Bone Defects in Pig's Femur Using Mesenchymal Cells Originated from the Sinus Membrane with Different Scaffolds. Stem Cells International. , (2019).
- He, W., et al. Lipopolysaccharide enhances decorin expression through the toll-like receptor 4, myeloid differentiating factor 88, nuclear factor-kappa B, and mitogen-activated protein kinase pathways in odontoblast cells. Journal of Endodontics. 38 (4), 464-469 (2012).
- Xiong, Y., et al. Wnt Production in Dental Epithelium Is Crucial for Tooth Differentiation. Journal of Dental Research. 98 (5), 580-588 (2019).
- Haruyama, N., et al. Genetic evidence for key roles of decorin and biglycan in dentin mineralization. Matrix Biology. 28 (3), 129-136 (2009).
- Sreenath, T., et al. Dentin Sialophosphoprotein Knockout Mouse Teeth Display Widened Predentin Zone and Develop Defective Dentin Mineralization Similar to Human Dentinogenesis Imperfecta Type III. Journal of Biological Chemistry. 278 (27), 24874-24880 (2003).
- Yang, Y., Zhao, Y., Liu, X., Chen, Y., Liu, P., Zhao, L. Effect of SOX2 on odontoblast differentiation of dental pulp stem cells. Molecular Medicine Reports. 16 (6), 9659-9663 (2017).
- Tao, H., et al. Klf4 Promotes Dentinogenesis and Odontoblastic Differentiation via Modulation of TGF-β Signaling Pathway and Interaction With Histone Acetylation. Journal of Bone and Mineral Research. 34 (8), 1502-1516 (2019).
- Massa, L. F., Ramachandran, A., George, A., Arana-Chavez, V. E. Developmental appearance of dentin matrix protein 1 during the early dentinogenesis in rat molars as identified by high-resolution immunocytochemistry. Histochemistry and Cell Biology. 124 (3-4), 197-205 (2005).
- Hao, J., Zou, B., Narayanan, K., George, A. Differential expression patterns of the dentin matrix proteins during mineralized tissue formation. Bone. 34 (6), 921-932 (2004).
- Tompkins, K., Alvares, K., George, A., Veis, A. Two related low molecular mass polypeptide isoforms of amelogenin have distinct activities in mouse tooth germ differentiation in vitro. Journal of Bone and Mineral Research. 20 (2), 341-349 (2005).
- Zhai, Y., et al. Activation and Biological Properties of Human β Defensin 4 in Stem Cells Derived From Human Exfoliated Deciduous Teeth. Frontiers in Physiology. 10, (2019).
- Bègue-Kirn, C., Ruch, J. V., Ridall, A. L., Butler, W. T. Comparative analysis of mouse DSP and DPP expression in odontoblasts, preameloblasts, and experimentally induced odontoblast-like cells. European Journal of Oral Sciences. 106, 254-259 (1998).
- Kikuchi, H., Suzuki, K., Sakai, N., Yamada, S. Odontoblasts induced from mesenchymal cells of murine dental papillae in three-dimensional cell culture. Cell and Tissue Research. 317 (2), 173-185 (2004).
- Li, X., Yang, G., Fan, M. Effects of homeobox gene distal-less 3 on proliferation and odontoblastic differentiation of human dental pulp cells. Journal of Endodontics. 38 (11), 1504-1510 (2012).
- Chen, S., et al. Differential regulation of dentin sialophosphoprotein expression by Runx2 during odontoblast cytodifferentiation. Journal of Biological Chemistry. 280 (33), 29717-29727 (2005).
- Narayanan, K., Gajjeraman, S., Ramachandran, A., Hao, J., George, A. Dentin matrix protein 1 regulates dentin sialophosphoprotein gene transcription during early odontoblast differentiation. Journal of Biological Chemistry. 281 (28), 19064-19071 (2006).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. A substractive PCR-based cDNA library from human odontoblast cells: identification of novel genes expressed in tooth forming cells. Matrix Biology. 19 (5), 421-430 (2000).
- Miyazaki, T., Baba, T., Mori, T., Komori, T. Collapsin Response Mediator Protein 1, a Novel Marker Protein for Differentiated Odontoblasts. Acta Histochemica et Cytochemica. 51 (6), 185-190 (2018).
- Yokoi, M., Kuremoto, K., Okada, S., Sasaki, M., Tsuga, K. Effect of attenuation of fibroblast growth factor receptor 2b signaling on odontoblast differentiation and dentin formation. In Vitro Cellular and Developmental Biology - Animal. 55 (3), 211-219 (2019).
- Tohma, A., et al. Glucose Transporter 2 and 4 Are Involved in Glucose Supply during Pulpal Wound Healing after Pulpotomy with Mineral Trioxide Aggregate in Rat Molars. Journal of Endodontics. , (2019).
- Sueyama, Y., Kaneko, T., Ito, T., Kaneko, R., Okiji, T. Implantation of Endothelial Cells with Mesenchymal Stem Cells Accelerates Dental Pulp Tissue Regeneration/Healing in Pulpotomized Rat Molars. Journal of Endodontics. 43 (6), 943-948 (2017).
- Petersson, U., Hultenby, K., Wendel, M. Identification, distribution and expression of osteoadherin during tooth formation. European Journal of Oral Sciences. 111 (2), 128-136 (2003).
- Couble, M. L., et al. Immunodetection of osteoadherin in murine tooth extracellular matrices. Histochemistry and Cell Biology. 121 (1), 47-53 (2004).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. Expression of the small leucine-rich proteoglycan osteoadherin/osteomodulin in human dental pulp and developing rat teeth. Bone. 27 (2), 265-270 (2000).
- Salmon, B., et al. Abnormal osteopontin and matrix extracellular phosphoglycoprotein localization, and odontoblast differentiation, in X-linked hypophosphatemic teeth. Connective Tissue Research. 55, 79-82 (2014).
- Liao, C., Ou, Y., Wu, Y., Zhou, Y., Liang, S., Wang, Y. Sclerostin inhibits odontogenic differentiation of human pulp-derived odontoblast-like cells under mechanical stress. Journal of Cellular Physiology. 234 (11), 20779-20789 (2019).
- Deng, X., et al. The combined effect of oleonuezhenide and wedelolactone on proliferation and osteoblastogenesis of bone marrow mesenchymal stem cells. Phytomedicine. 153103, (2019).
- Choi, H., Kim, T. H., Yun, C. Y., Kim, J. W., Cho, E. S. Testicular acid phosphatase induces odontoblast differentiation and mineralization. Cell and Tissue Research. 364 (1), 95-103 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır