Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Zugang zur Zytotoxizität und Zellantwort auf Biomaterialien
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Diese Methodik zielt darauf ab, die Zytotoxizität von Biomaterialien durch die Herstellung löslicher Extrakte unter Verwendung von Viabilitätstests und phänotypischen Analysen, einschließlich Durchflusszytometrie, RT-PCR, Immunzytochemie und anderen zellulären und molekularbiologischen Techniken, zu bewerten.
Zusammenfassung
Biomaterialien stehen direkt oder indirekt in Kontakt mit dem menschlichen Gewebe, weshalb es wichtig ist, ihre Zytotoxizität zu bewerten. Diese Bewertung kann mit mehreren Methoden durchgeführt werden, jedoch besteht eine große Diskrepanz zwischen den verwendeten Ansätzen, was die Reproduzierbarkeit und den Vergleich zwischen den erhaltenen Ergebnissen beeinträchtigt. In dieser Arbeit schlagen wir ein Protokoll zur Bewertung der Zytotoxizität von Biomaterialien unter Verwendung löslicher Extrakte vor, die wir für dentale Biomaterialien verwenden. Die Herstellung der Extrakte ist detailliert, von der Herstellung der Pellets bis zur Extraktion in einem Nährmedium. Die Bewertung der Zytotoxizität von Biomaterialien basiert auf der metabolischen Aktivität mit dem MTT-Assay, der Zellviabilität mit dem Sulphorhodamin B (SBR)-Assay, dem Zelltodprofil mit Durchflusszytometrie und der Zellmorphologie mit May-Grünwald Giemsa. Zusätzlich zur Bewertung der Zytotoxizität wird ein Protokoll zur Bewertung der Zellfunktion beschrieben, das auf der Expression spezifischer Marker basiert, die durch Immunzytochemie und PCR bestimmt werden. Dieses Protokoll bietet einen umfassenden Leitfaden für die Bewertung der Zytotoxizität von Biomaterialien und zellulärer Effekte unter Verwendung der Extraktmethodik auf reproduzierbare und robuste Weise.
Einleitung
Biokompatibilität kann definiert werden als die Fähigkeit eines Materials, Gewebe zu integrieren und ein günstiges therapeutisches Ansprechen zu induzieren, das frei von lokalen und systemischen Schäden ist 1,2,3. Die Bewertung der Biokompatibilität ist entscheidend für die Entwicklung von Materialien, die für medizinische Zwecke bestimmt sind. Daher bietet dieses Protokoll einen systematischen und umfassenden Ansatz für jeden Forscher, der neue Biomaterialien entwickeln oder neue Anwendungen für bestehende Biomaterialien untersuchen möchte.
In-vitro-Zytotoxizitätstests werden häufig als erste Phase zur Bewertung der Biokompatibilität unter Verwendung von primären Zellkulturen oder Zelllinien eingesetzt. Die Ergebnisse stellen einen ersten Hinweis auf eine mögliche klinische Anwendung dar. Diese Tests sind nicht nur für die Entwicklung von Biomaterialien von entscheidender Bedeutung, sondern auch obligatorisch, um die aktuellen Vorschriften für die Markteinführung von EUA und EU-Aufsichtsbehörden (FDA- und CE-Zertifizierung) zu erfüllen4,5,6,7,8. Darüber hinaus bieten standardisierte Tests in der biomedizinischen Forschung einen erheblichen Vorteil in Bezug auf die Reproduzierbarkeit und den Vergleich von Ergebnissen aus verschiedenen Studien zu ähnlichen Biomaterialien oder Geräten9.
Die Richtlinien der Internationalen Organisation für Normung (ISO) werden häufig von mehreren unabhängigen kommerziellen, regulatorischen und akademischen Labors verwendet, um Materialien auf genaue und reproduzierbare Weise zu testen. Die ISO 10993-5 bezieht sich auf die In-vitro-Zytotoxizitätsbewertung und die ISO 10993-12 berichtet über die Probenahmevorbereitung10,11. Für die Biomaterialprüfung stehen drei Kategorien zur Verfügung, die je nach Materialtyp, Kontaktgewebe und Behandlungsziel ausgewählt werden können: Extrakte, direkter Kontakt und indirekter Kontakt 8,11,12,13. Extrakte werden durch Anreicherung eines Zellkulturmediums mit dem Biomaterial gewonnen. Für die Direktkontakttests wird das Biomaterial direkt auf die Zellkulturen aufgebracht, und bei indirektem Kontakt erfolgt die Inkubation mit den Zellen getrennt durch eine Barriere, wie z.B. ein Agarosegel11. Geeignete Kontrollen sind obligatorisch und es sollten mindestens drei unabhängige Experimente durchgeführt werden 5,8,10,11,14.
Es ist wichtig, klinische Bedingungen zu simulieren oder zu übertreiben, um das zytotoxische Potenzial zu bestimmen. Bei der Prüfung von Extrakten die Oberfläche des Materials; das mittlere Volumen; das Medium und der pH-Wert des Materials; die Materiallöslichkeit, Osmolarität und das Diffusionsverhältnis; und die Extraktionsbedingungen wie Rühren, Temperatur und Zeit beeinflussen die Medienanreicherung5.
Die Methodik ermöglicht die quantitative und qualitative Bewertung der Zytotoxizität verschiedener pharmazeutischer Formulierungen, sowohl fester als auch flüssiger. Es können mehrere Assays durchgeführt werden, wie z. B. der Neutralrot-Aufnahmetest, der Koloniebildungstest, der MTT-Assay und der XTT-Assay 5,10,14.
Die meisten veröffentlichten Studien zur Bewertung der Zytotoxizität verwenden einfachere Assays, nämlich MTT und XTT, die nur begrenzte Informationen liefern. Die Bewertung der Biokompatibilität sollte nicht nur die Bewertung der Zytotoxizität, sondern auch die Bioaktivität eines bestimmten Prüfmaterials2 umfassen, wie dieses Protokoll bestätigt. Zusätzliche Bewertungskriterien sollten verwendet werden, wenn sie begründet und dokumentiert sind. Daher zielt dieses Protokoll darauf ab, einen umfassenden Leitfaden bereitzustellen, der eine Reihe von Methoden für die Bewertung der Zytotoxizität von Biomaterialien detailliert beschreibt. Außerdem wird die Bewertung verschiedener zellulärer Prozesse, nämlich der Art des Zelltods, der Zellmorphologie, der Zellfunktion bei der Synthese spezifischer Proteine und der spezifischen Gewebeproduktion, beschrieben.
Protokoll
1. Vorbereitung der Pellets
- Bereiten Sie die Formen aus Polyvinylchlorid (PVC) vor, indem Sie kreisförmige Löcher mit bekannten Abmessungen in PVC-Platten bohren.
Anmerkungen: PVC-Formteile können in verschiedenen Größen hergestellt werden. Berechnen Sie die Kontaktfläche von PVC-Formen mit der Formel A= h(2πr)+2πr2 (r: Radius des Zylinders; h: Höhe des Zylinders). - Bereiten Sie das zu testende Biomaterial gemäß den Anweisungen des Herstellers und so nah wie möglich am Beginn des Experiments vor.
Anmerkungen: Für die Herstellung von Pasten-/Pastenformulierungs-Biomaterialien wird eine ausreichende Menge an Basispaste und Katalysator manuell mit einem Mischspatel gemischt. Bei anderen Materialien, die auf flüssigen und pulverförmigen Formulierungen basieren, sollte eine manuelle Spachtelung oder ein mechanisches Mischen mit Vibration durchgeführt werden, wobei die Anweisungen des Herstellers oder die für neue Materialien geeigneten Anweisungen zu befolgen sind. Bei flüssigen Materialien ist dieser Schritt nicht notwendig. Starten Sie das Protokoll in Schritt 2. - Legen Sie das Biomaterial mit einem Spatel auf die Formen und lassen Sie sie für die entsprechende Zeit aushärten.
Anmerkungen: Die Abbindezeit und die Abbindebedingungen der Biomaterialien müssen den Anweisungen des Herstellers oder den für neue Materialien geeigneten Anweisungen entsprechen. - Nehmen Sie nach dem Aushärten die Pellets des Biomaterials aus den PVC-Formen und legen Sie sie in einen Behälter (eine 6-Well-Platte oder eine Petrischale kann verwendet werden).
- Sterilisieren Sie die Pellets, indem Sie sie 20 Minuten lang für jede Seite unter eine UV-Lampe (UV) legen.
2. Gewinnung der Extrakte der Biomaterialien
Anmerkungen: Alle Verfahren sollten unter streng sterilen Bedingungen durchgeführt werden.
- Bestimmen Sie die erforderliche Anzahl von Pellets, indem Sie die Pelletoberfläche auf der Grundlage der in 1.1 beschriebenen Formel berechnen.
HINWEIS: Als Referenzwert wird die Kontaktfläche von 250 mm2/mL11,15 durch Zugabe von 9 Pellets (r 3 mm x h 1,5 mm) pro mL des Mediums erreicht. - Bereiten Sie die löslichen Extrakte vor (Extrakt, der mit dem Biomaterial angereichert ist).
- Geben Sie die Pellets in ein 50-ml-Röhrchen und fügen Sie das entsprechende Zellkulturmedium hinzu. Legen Sie die Röhrchen für 24 Stunden in den Inkubator bei 37°, in ständiger Rotation.
Anmerkungen: Verwenden Sie das für die Zellkulturen geeignete Zellkulturmedium. - Nach 24 Stunden nehmen Sie die Röhrchen aus dem Inkubator. Zu diesem Zeitpunkt entsprechen die Extrakte einer Konzentration von 1/1 oder 100%.
- Verdünnen Sie den Extrakt durch sequentielle Zugabe gleicher Volumina des konditionierten Mediums zum Zellkulturmedium.
Anmerkungen: Es sollte keine pH-Einstellung des Mediums vorgenommen werden.- Fügen Sie 1 ml Nährmedium zu 1 ml 100%igem Extrakt hinzu, um einen 50%igen Extrakt zu erhalten. Fügen Sie 1 ml Nährmedium zu 1 ml 50%igem Extrakt hinzu, um einen 25%igen Extrakt zu erhalten, und so weiter (Abbildung 1).
Anmerkungen: Verwenden Sie die Konzentrationen, die für jede Verbindung relevant sind.
- Fügen Sie 1 ml Nährmedium zu 1 ml 100%igem Extrakt hinzu, um einen 50%igen Extrakt zu erhalten. Fügen Sie 1 ml Nährmedium zu 1 ml 50%igem Extrakt hinzu, um einen 25%igen Extrakt zu erhalten, und so weiter (Abbildung 1).
- Geben Sie die Pellets in ein 50-ml-Röhrchen und fügen Sie das entsprechende Zellkulturmedium hinzu. Legen Sie die Röhrchen für 24 Stunden in den Inkubator bei 37°, in ständiger Rotation.
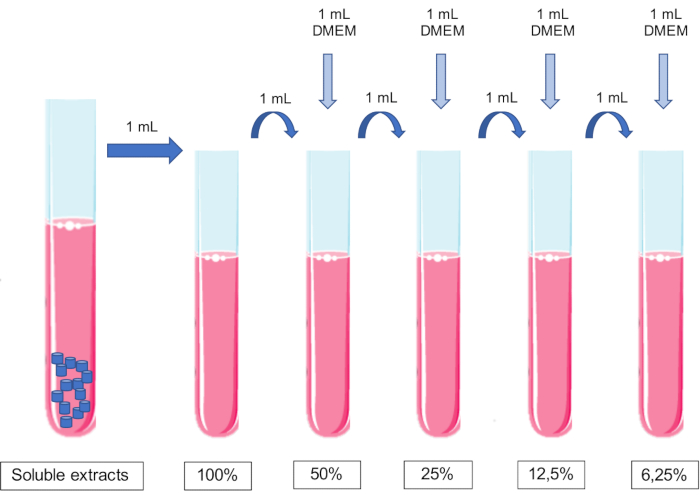
Abbildung 1: Schema der Herstellung und Verdünnung löslicher Extrakte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Zellinkubation mit den Extrakten der Biomaterialien
- Bereiten Sie eine zelluläre Suspension vor und legen Sie sie entsprechend der Anzahl der für die Experimente benötigten Zellen in einen geeigneten Zellbehälter, z. B. eine Multiwell-Platte.
- Beginnen Sie mit einem Kolben der gewünschten Zellen mit 80% bis 90% Konfluenz.
- Verwerfen Sie die Zellkulturmedien, waschen Sie sie mit phosphatgepufferter Kochsalzlösung (PBS) und lösen Sie die Zellen mit Trypsin-EDTA ab (1 bis 2 ml für einen 75 cm 2-Zellkulturkolben).
- Das Zellkulturmedium (2 bis 4 ml für einen 75cm 2 Zellkulturkolben) zugeben, die Zellsuspension in ein Röhrchen überführen und 5 min bei 200 x g zentrifugieren.
- Suspendieren Sie das Pellet in einem bekannten Volumen von Zellkulturmedien.
HINWEIS: Dieses Protokoll ist für die Verwendung von adhärenten Zellkulturen konzipiert. Es können jedoch einfache Anpassungen vorgenommen werden, um mit Suspensionszellkulturen zu arbeiten. - Zählen Sie die Zellen im Hämozytometer und berechnen Sie die Zellkonzentration der Zellsuspension.
- Die ermittelte Menge an Zellsuspension wird in Nährmedium suspendiert und in Multiwell-Schalen überführt. Als Referenzwert für die Aussaatdichte sind 5 – 20 x 105 Zellen/cm2 zu berücksichtigen.
HINWEIS: Die entsprechende Anzahl von Zellen muss entsprechend dem Zelltyp und den Zelleigenschaften berechnet werden, nämlich der Zellverdopplungszeit.
- Inkubieren Sie die Zellen 24 Stunden lang, um die Zelladhäsion zu ermöglichen.
- Nach dieser Zeit werden die löslichen Extrakte in die Kulturplatten gegeben.
- Saugen Sie das Zellkulturmedium ab.
- Geben Sie die Extrakte der Biomaterialien entsprechend der zuvor beschriebenen Konzentrationsreihenfolge in jede Vertiefung. Geben Sie frisches Zellkulturmedium in die Kontrollvertiefungen.
- Inkubieren Sie die Platten 24 Stunden oder länger.
HINWEIS: In jedem Assay müssen Negativkontrollen durchgeführt werden, die unbehandelten Zellen entsprechen und im Nährmedium aufbewahrt werden. Die Inkubationszeiten können entsprechend den Studienzielen gewählt werden.
4. Bewertung der Stoffwechselaktivität
- Nach der Inkubation der Zellen mit den Extrakten der Biomaterialien saugen Sie das Medium von den Platten ab und waschen Sie jedes Well PBS.
- In jede Vertiefung wird ein ausreichendes Volumen von 0,5 mg/ml 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolbromid (MTT) gegeben, das in PBS mit einem pH-Wert von 7,4 hergestellt wurde.
- Inkubieren Sie die Platten für 4 h oder über Nacht im Dunkeln bei 37 ° C.
- Um die erhaltenen Formazankristalle zu solubilisieren, wird das ausreichende Volumen von 0,04 M Salzsäurelösung in Isopropanol in jede Vertiefung gegeben und die Platten 30 Minuten lang umgerührt.
Anmerkungen: Passen Sie die Menge an MTT und Isopropanol entsprechend der Größe der Vertiefungen an. - Rühren und homogenisieren Sie den Inhalt jeder Vertiefung, falls erforderlich, indem Sie auf und ab pipettieren, bis keine Kristalle mehr zu sehen sind.
- Quantifizieren Sie die Absorption bei einer Wellenlänge von 570 nm mit einem 620 nm Referenzfilter im Spektralphotometer.
- Um die Stoffwechselaktivität zu berechnen, dividiert man die Absorption der behandelten Zellen durch die Absorption der Kontrollkulturen. Um Prozentwerte zu erhalten, multiplizieren Sie mit 100.
5. Bewertung des Zelltods
HINWEIS: Um diese Auswertung durchzuführen, sollten mindestens 10 bis6 Zellen pro Bedingung verwendet werden.
- Verwenden Sie Zentrifugenröhrchen, die entsprechend den zu bewertenden Bedingungen ordnungsgemäß gekennzeichnet sind.
- Nach der Zellinkubation mit den Extrakten der Biomaterialien sammeln Sie die Nährmedien in das entsprechende Röhrchen.
- Lösen Sie die Zellen ab und geben Sie die Zellsuspension in die entsprechenden Röhrchen.
- Die Zellsuspensionen werden durch Zentrifugation bei 120 x g für 5 Minuten konzentriert.
- Waschen Sie die Pellets mit PBS. Entfernen Sie das PBS durch Zentrifugieren bei 1.000 x g für 5 Minuten.
- Fügen Sie 1 ml PBS hinzu und übertragen Sie die Zellpellets in identifizierte Zytometrieröhrchen.
- Entfernen Sie das PBS durch Zentrifugieren bei 1.000 x g für 5 Minuten.
- Inkubieren Sie mit 100 μl Bindungspuffer (0,01 M HEPES, 0,14 mM NaCl und 0,25 mM CaCl2)16 und lassen Sie die Zellen etwa 15 Minuten ruhen, um sich von der Zellmembran zu erholen.
- Fügen Sie 2,5 μl fluoreszenzmarkiertes Annexin-V und 1 μl Propidiumiodid für 15 Minuten bei Raumtemperatur im Dunkeln hinzu.
- Nach der Inkubation werden 400 μl PBS hinzugefügt und auf dem Zytometer analysiert. Verwenden Sie für die Analyse und Quantifizierung der Informationen geeignete Software.
- Präsentieren Sie die Ergebnisse als Prozentsatz der lebenden Zellen, der Apoptose, der späten Apoptose/Nekrose und der Nekrose.
6. Beurteilung der Morphologie
- Wählen Sie die geeignete Größe der sterilisierten Glasdeckgläser, die in die Multiwell-Platte passen.
- Legen Sie jeden Objektträger mit einer sterilen Pinzette in eine Vertiefung.
- Verteilen Sie eine Zellsuspension in ausreichender Konzentration in den Vertiefungen und lassen Sie sie über Nacht in einem Inkubator bei 37 °C in einer befeuchteten Atmosphäre mit 95 % Luft und 5 % CO2 stehen.
- Setzen Sie die Zellkulturen den Extrakten aus, wie zuvor beschrieben.
- Saugen Sie die Medien ab und waschen Sie mit PBS.
- Lassen Sie die Deckgläser bei Raumtemperatur trocknen und fügen Sie dann eine ausreichende Menge May-Grünwald-Lösung hinzu, um die Deckgläser zu bedecken. 3 Minuten inkubieren.
- Entfernen Sie die Farbe und waschen Sie sie 1 Minute lang mit destilliertem Wasser.
- Entfernen Sie das Wasser und fügen Sie eine ausreichende Menge Giemsa-Lösung hinzu, um die Deckgläser zu bedecken. 15 Minuten inkubieren.
- Waschen Sie die Deckgläser unter fließendem Wasser.
- Übertragen Sie die Deckgläser auf einen Objektträger.
- Schauen Sie unter ein Mikroskop. Nehmen Sie die Fotos mit der gewählten Vergrößerung auf.
7. Beurteilung der Zellfunktion durch reverse Transkriptase-Polymerase-Kettenreaktion (RT-PCR)
HINWEIS: Um diese Auswertung durchzuführen, sollten mindestens 2x106 Zellen pro Bedingung verwendet werden. Als Beispiel wird die alkalische Phosphatase als ein Gen vorgestellt, das für die Aktivitätsbewertung von Odontoblasten von Interesse ist. Weitere interessante Gene sind in Tabelle 1 zu sehen.
- Platten Sie die Zellen wie oben beschrieben.
HINWEIS: Die Konzentration der plattierten Zellen muss möglicherweise entsprechend dem Zelltyp und der Zytotoxizität der untersuchten Biomaterialien angepasst werden. - Inkubieren Sie mit löslichen Extrakten, wie oben beschrieben.
- Lösen Sie die Zellen ab, um eine Suspension wie zuvor beschrieben zu erhalten.
- Waschen Sie die Zellen zweimal mit PBS; Dazu bei 200 x g für 5 Minuten bei Raumtemperatur zentrifugieren.
- Lysieren Sie die Zellen, indem Sie das Pellet in 1 ml RNA-Aufreinigungslösung (z. B. NZYol) suspendieren, intensiv umrühren und anschließend pipettieren.
- Inkubieren Sie die Proben 5 Minuten lang bei Raumtemperatur.
- Fügen Sie 200 μl Chloroform hinzu und schütteln Sie die Röhrchen 15 Sekunden lang von Hand.
- 3 Minuten bei Raumtemperatur inkubieren.
- Lysate bei 4°C für 15 min bei 12.000 x g zentrifugieren. Bei dieser Zentrifugation entstehen zwei Phasen in der Probe, so dass die RNA in der wässrigen (oberen) Phase verbleibt.
- Entfernen Sie die wässrige Phase in ein neues Röhrchen und fügen Sie 500 μl kaltes Isopropanol hinzu, um die RNA auszufällen.
- Proben bei Raumtemperatur 10 Minuten inkubieren und bei 12.000 x g für 10 Minuten bei 4 °C zentrifugieren.
- Entfernen Sie den Überstand und waschen Sie das Pellet mit 1 ml 75%igem Ethanol durch Zentrifugation bei 7.500 x g für 5 Minuten bei 4 ° C.
- Trocknen Sie das Pellet bei Raumtemperatur, bis das Ethanol verdunstet ist.
- In RNase-freiem Wasser suspendieren.
- Quantifizieren und bestimmen Sie den Reinheitsgrad der Proben mittels Absorptionsspektrophotometrie bei den Wellenlängen 260 nm und 280 nm. Bestimmen Sie die RNA-Reinheit und verwenden Sie Proben mit einem Reinheitsverhältnis (A260/280) um 2,0.
- Lagern Sie die Proben bei -80 ° C.
- Führen Sie die RT-PCR gemäß dem Protokoll des Herstellers17 durch.
HINWEIS: Wählen Sie entsprechend dem Studienziel die spezifischen Marker aus, die ausgewertet werden sollen.
8. Bewertung der Zellfunktion durch Proteinidentifikation
HINWEIS: Wählen Sie je nach Studienziel die spezifischen Proteine aus, die bewertet werden sollen. Als Beispiel wird das Dentin-Sialoprotein (DSP) als ein Protein vorgestellt, das für die Aktivitätsbewertung von Odontoblasten von Interesse ist. Weitere Proteine von Interesse sind in Tabelle 1 zu sehen.
- Kultivieren Sie Zellen in Deckgläsern und setzen Sie sie den Extrakten aus, wie zuvor beschrieben.
- Waschen Sie die Zellkulturen mit PBS.
- Mit 3,7 % Paraformaldehyd 30 Minuten bei Raumtemperatur fixieren.
- Zweimal mit PBS waschen.
- Permeabilisieren Sie mit 0,5 % Triton in PBS für 15 Minuten.
- Blockieren Sie die Peroxidase mit 0,3 % Wasserstoffperoxid in PBS für 5 Minuten.
- Zweimal mit PBS waschen.
- Zweimal mit 0,5 % Kälberserumalbumin (BSA) waschen.
- Zellkulturen mit 2% BSA für 45 Minuten blockieren.
- Mit 0,5% BSA in PBS waschen.
- Inkubieren Sie Kulturen mit dem primären Antikörper entsprechend dem ausgewählten Protein für 60 Minuten bei Raumtemperatur.
HINWEIS: Dieses Protokoll verwendet den primären Antikörper DSP(M20) Antikörper (1:100) und den sekundären Antikörper Polyclonal Rabbit Anti-goat Immunglobuline/HRP (1:100). - Fünfmal mit 0,5 % BSA in PBS waschen.
- Mit Sekundärantikörpern 90 Minuten bei Raumtemperatur inkubieren.
Anmerkungen: Nehmen Sie die Antikörperverdünnungen mit 0,5 % BSA in PBS vor. - Fünfmal mit 0,5 % BSA in PBS für 1 Minute in jeder Wäsche waschen.
- Inkubieren Sie Kulturen mit einem Substrat-Chromogen-Gemisch in einer Konzentration von 20 μL Chromogen/ml Substrat für 25 Minuten.
- Zweimal mit 0,5% BSA in PBS waschen.
- 15 Minuten lang mit Hämatoxylin gegenfärben.
- Mit einer Sequenz von 0,037 mol/L Ammoniak und destilliertem Wasser 5 Minuten lang waschen, um überschüssigen Farbstoff zu entfernen.
- Montieren Sie die Deckgläser auf den Objektträgern. Verwenden Sie Glycerin als Eindeckmedium.
- Über Nacht trocknen lassen.
- Schauen Sie unter ein Mikroskop. Nehmen Sie die Fotos mit der gewählten Vergrößerung auf.
9. Mineralisierungsbewertung mittels Alizarin-Rot-S-Assay
- Bereiten Sie eine Alizarinrot S-Lösung in einer Konzentration von 40 mM18 vor. Rühren Sie die Lösung für die Homogenisierung 12 Stunden im Dunkeln.
Anmerkungen: Zur Herstellung von 100 ml Alizarin Red S-Lösung werden 1,44 g Alizarinpulver (Molekulargewicht: 360 g/mol) in lichtgeschütztem Reinwasser solubilisiert. Für diese Lösung ist der pH-Wert kritisch und sollte zwischen 4,1 und 4,3 liegen. - Inkubieren Sie die Zellkultur mit löslichen Extrakten, wie oben beschrieben.
- Waschen Sie die Zellkulturen dreimal mit PBS.
- Mit 4% Paraformaldehyd 15 Minuten bei Raumtemperatur fixieren.
- Dreimal mit PBS waschen.
- Färben Sie mit Alizarin Red Färbelösung für 20 Minuten bei 37 °C im Dunkeln.
- Waschen Sie die Platten nach dem Färben mit PBS, um den überschüssigen Farbstoff zu entfernen.
- Schauen Sie unter ein Mikroskop. Nehmen Sie die Fotos mit der gewählten Vergrößerung auf.
- Eine Extraktionslösung, bestehend aus 10 % (w/v) Essigsäure und 20 % (w/v) Methanol, in jede Vertiefung geben und 40 Minuten bei Raumtemperatur rühren lassen.
- Messen Sie die Absorption bei einer Wellenlänge von 490 nm auf einem Spektralphotometer19.
Ergebnisse
Die repräsentativen Ergebnisse beziehen sich hier auf die Untersuchung von dentalen Biomaterialien. Die Extraktmethodik ermöglicht es, ein Zytotoxizitätsprofil und eine Zellfunktion nach Exposition gegenüber den Dentalmaterialien zu erhalten, hinsichtlich der Auswirkungen auf die Stoffwechselaktivität (Abbildung 2), die Zellviabilität, das Zelltodprofil und die Zellmorphologie (Abbildung 3) und die spezifische Proteinexpression (Abbildung 4).
Diskussion
Dieses Protokoll wurde unter Berücksichtigung der ISO 10993-5 entwickelt, die sich auf die Bewertung der In-vitro-Zytotoxizität von Biomaterialien, die mit dem Gewebe in Kontakt kommen, bezieht, um die Biokompatibilität zu bewerten und zur Reproduzierbarkeit der Studien beizutragen21. Dies ist ein wachsendes Problem in der Wissenschaft, und viele Autoren befolgen diese Empfehlungen bereits bei der experimentellen Planung ihrer In-vitro-Studien 15,22,23,24,25,26,27,28....
Offenlegungen
Die Autoren haben keine konkurrierenden finanziellen Interessen oder andere Interessenkonflikte.
Danksagungen
Wir danken für die Unterstützung: GAI 2013 (Faculdade de Medicina da Universidade de Coimbra); CIBB wird aus nationalen Mitteln über FCT (Foundation for Science and Technology) über das strategische Projekt UIDB/04539/2020 und UIDP/04539/2020 (CIBB) finanziert. Wir danken Jacques Nör, University of Michigan Dental School, für die Bereitstellung der Zelllinie MDPC-23.
Materialien
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CaCl2 | Sigma | 10035-04-8 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| DAB + Chromogen | Dako | K3468 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| DSP (M-20) Antibody, 1: 100 | Santa Cruz Biotechnology | LS-C20939 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Hepes 0.01 M | Sigma | MFCD00006158 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Giemsa Stain, modified GS-500 | Sigma | MFCD00081642 | |
| Glycerol | Dako | C0563 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| May-Grünwald Stain MG500 | Sigma | MFCD00131580 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Polyclonal Rabbit Anti-goat immunoglobulins / HRP, 1: 100 | Dako | G-21234 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Substrate Buffer | Dako | 926605 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| β-actin antibody | Sigma | A5316 |
Referenzen
- Williams, D. F. On the mechanisms of biocompatibility. Biomaterials. 29 (20), 2941-2953 (2008).
- Bruinink, A., Luginbuehl, R. Evaluation of biocompatibility using in vitro methods: interpretation and limitations. Advances in Biochemical Engineering/Biotechnology. 126, 117-152 (2012).
- Wataha, J. C. Principles of biocompatibility for dental practitioners. The Journal of Prosthetic Dentistry. 86 (2), 203-209 (2001).
- Mishra, S. F. D. A. CE mark or something else?-Thinking fast and slow. Indian Heart Journal. 69 (1), 1-5 (2016).
- Barbeck, M., et al. Balancing Purification and Ultrastructure of Naturally Derived Bone Blocks for Bone Regeneration: Report of the Purification Effort of Two Bone Blocks. Materials. 12 (19), 3234 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- Coelho, C. C., Araújo, R., Quadros, P. A., Sousa, S. R., Monteiro, F. J. Antibacterial bone substitute of hydroxyapatite and magnesium oxide to prevent dental and orthopaedic infections. Materials Science and Engineering: C. 97, 529-538 (2019).
- Jung, O., et al. Improved In Vitro Test Procedure for Full Assessment of the Cytocompatibility of Degradable Magnesium Based on ISO 10993-5/-12. International Journal of Molecular Sciences. 20 (2), 255 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- ISO. I.O. for S. ISO 10993-12:2012 - part 12: Sample preparation and reference materials. ISO. , (2012).
- ISO. I.O. for S. ISO 10993-5:2009 Biological evaluation of medical devices - part 5: Tests for in vitro cytotoxicity. ISO. , (2009).
- Srivastava, G. K., et al. Comparison between direct contact and extract exposure methods for PFO cytotoxicity evaluation. Scientific Reports. 8 (1), 1425 (2018).
- Pusnik, M., Imeri, M., Deppierraz, G., Bruinink, A., Zinn, M. The agar diffusion scratch assay--A novel method to assess the bioactive and cytotoxic potential of new materials and compounds. Scientific Reports. 6, 20854 (2016).
- Spiller, K. L., et al. The role of macrophage phenotype in vascularization of tissue engineering scaffolds. Biomaterials. 35 (15), 4477-4488 (2014).
- Zhou, H., et al. In Vitro Cytotoxicity Evaluation of a Novel Root Repair Material. Journal of Endodontics. 39 (4), 478-483 (2013).
- Bordron, A., et al. The binding of some human antiendothelial cell antibodies induces endothelial cell apoptosis. Journal of Clinical Investigation. 101 (10), 2029-2035 (1998).
- Palmini, G., et al. Establishment of Cancer Stem Cell Cultures from Human Conventional Osteosarcoma. Journal of Visualized Experiments. (116), e53884 (2016).
- Gregory, C. A., Grady Gunn, W., Peister, A., Prockop, D. J. An Alizarin red-based assay of mineralization by adherent cells in culture: comparison with cetylpyridinium chloride extraction. Analytical Biochemistry. 329 (1), 77-84 (2004).
- Cai, S., Zhang, W., Chen, W. PDGFRβ+/c-kit+ pulp cells are odontoblastic progenitors capable of producing dentin-like structure in vitro and in vivo. BMC Oral Health. 16 (1), 113 (2016).
- Paula, A., et al. Biodentine Boosts, WhiteProRoot MTA Increases and Life Suppresses Odontoblast Activity. Materials. 12 (7), 1184 (2019).
- Chander, N. G. Standardization of in vitro studies. Journal of Indian Prosthodontic Society. 16 (3), 227-228 (2016).
- Cavalcanti, B. N., Rode de M, S., França, C. M., Marques, M. M. Pulp capping materials exert an effect on the secretion of IL-1β and IL-8 by migrating human neutrophils. Brazilian Oral Research. 25 (1), 13-18 (2011).
- Chang, S., Lee, S. Y., Ann, H. J., Kum, K. Y., Kim, E. C. Effects of calcium silicate endodontic cements on biocompatibility and mineralization-inducing potentials in human dental pulp cells. Journal of Endodontics. 40 (8), 1194-1200 (2014).
- Daltoé, M. O., Paula-Silva, F. W. G., Faccioli, L. H., Gatón-Hernández, P. M., De Rossi, A., Bezerra Silva, L. A. Expression of Mineralization Markers during Pulp Response to Biodentine and Mineral Trioxide Aggregate. Journal of Endodontics. 42 (4), 596-603 (2016).
- Elias, R. V., Demarco, F. F., Tarquinio, S. B. C., Piva, E. Pulp responses to the application of a self-etching adhesive in human pulps after controlling bleeding with sodium hypochlorite. Quintessence International. 38 (2), 67-77 (2007).
- Huang, G. T. J., Shagramanova, K., Chan, S. W. Formation of odontoblast-like cells from cultured human dental pulp cells on dentin in vitro. Journal of endodontics. 32 (11), 1066-1073 (2006).
- Jafarnia, B., et al. Evaluation of cytotoxicity of MTA employing various additives. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology. 107 (5), 739-744 (2009).
- Paranjpe, A., Smoot, T., Zhang, H., Johnson, J. D. Direct contact with mineral trioxide aggregate activates and differentiates human dental pulp cells. Journal of Endodontics. 37 (12), 1691-1695 (2011).
- Spagnuolo, G., et al. In vitro cellular detoxification of triethylene glycol dimethacrylate by adduct formation with N-acetylcysteine. Dental Materials. 29 (8), 153-160 (2013).
- Murray, P. E., García Godoy, C., García Godoy C, F. How is the biocompatibilty of dental biomaterials evaluated. Medicina Oral, Patologia Oral y Cirugia Bucal. 12 (3), 258-266 (2007).
- Hanks, C. T., Wataha, J. C., Sun, Z. In vitro models of biocompatibility: a review. Dental Materials. 12 (3), 186-193 (1996).
- Eid, A. A., et al. In Vitro Biocompatibility and Oxidative Stress Profiles of Different Hydraulic Calcium Silicate Cements. Journal of Endodontics. 40 (2), 255-260 (2014).
- Nocca, G., et al. Effects of ethanol and dimethyl sulfoxide on solubility and cytotoxicity of the resin monomer triethylene glycol dimethacrylate. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 100 (6), 1500-1506 (2012).
- Abuarqoub, D., Aslam, N., Jafar, H., Abu Harfil, Z., Awidi, A. Biocompatibility of Biodentine with Periodontal Ligament Stem Cells: In Vitro Study. Dentistry Journal. 8 (1), 17 (2020).
- Coelho, A. S., et al. Cytotoxic effects of a chlorhexidine mouthwash and of an enzymatic mouthwash on human gingival fibroblasts. Odontology. 108 (2), 260-270 (2020).
- Wang, M. O., et al. Evaluation of the In Vitro Cytotoxicity of Cross-Linked Biomaterials. Biomacromolecules. 14 (5), 1321-1329 (2013).
- Tyliszczak, B., Drabczyk, A., Kudłacik-Kramarczyk, S., Bialik-Wąs, K., Sobczak-Kupiec, A. In vitro cytotoxicity of hydrogels based on chitosan and modified with gold nanoparticles. Journal of Polymer Research. 24 (10), 153 (2017).
- Widbiller, M., et al. Three-dimensional culture of dental pulp stem cells in direct contact to tricalcium silicate cements. Clinical Oral Investigations. 20 (2), 237-246 (2016).
- Pintor, A. V. B., et al. In Vitro and In Vivo Biocompatibility of ReOss in Powder and Putty Configurations. Brazilian Dental Journal. 29 (2), 117-127 (2018).
- Pellissari, C. V. G., et al. In Vitro Toxic Effect of Biomaterials Coated with Silver Tungstate or Silver Molybdate Microcrystals. Journal of Nanomaterials. 2020, 1-9 (2020).
- Collado-González, M., et al. Cytotoxicity and bioactivity of various pulpotomy materials on stem cells from human exfoliated primary teeth. International Endodontic Journal. 50, 19-30 (2017).
- Paula, A., et al. Direct Pulp Capping: Which is the Most Effective Biomaterial? A Retrospective Clinical Study. Materials. 12 (20), 3382 (2019).
- Williams, D. F. There is no such thing as a biocompatible material. Biomaterials. 35 (38), 10009-10014 (2014).
- Schuh, J. C. L. Medical device regulations and testing for toxicologic pathologists. Toxicologic Pathology. 36 (1), 63-69 (2008).
- Pizzoferrato, A., et al. Cell culture methods for testing Biocompatibility. Clinical Materials. 15 (3), (1994).
- Pereira Paula, A. B., et al. Direct pulp capping: what is the most effective therapy? - review and meta-analysis. Journal of Evidence Based Dental Practice. , (2018).
- Caiaffa, K. S., et al. Effect of analogues of cationic peptides on dentin mineralization markers in odontoblast-like cells. Archives of Oral Biology. 103, 19-25 (2019).
- Fujiwara, S., Kumabe, S., Iwai, Y. Isolated rat dental pulp cell culture and transplantation with an alginate scaffold. Okajimas Folia Anatomica Japonica. 83 (1), 15-24 (2006).
- Nakashima, M., et al. Stimulation of Reparative Dentin Formation by Ex Vivo Gene Therapy Using Dental Pulp Stem Cells Electrotransfected with Growth/differentiation factor 11 (Gdf11). Human Gene Therapy. 15 (11), 1045-1053 (2004).
- Narayanan, K., et al. Differentiation of embryonic mesenchymal cells to odontoblast-like cells by overexpression of dentin matrix protein 1. Proceedings of the National Academy of Sciences of the United States of America. 98 (8), 4516-4521 (2001).
- Kim, H. J., Yoo, J. H., Choi, Y., Joo, J. Y., Lee, J. Y., Kim, H. J. Assessing the effects of cyclosporine A on the osteoblastogenesis, osteoclastogenesis, and angiogenesis mediated by the human periodontal ligament stem cells. Journal of Periodontology. , (2019).
- Bou Assaf, R., et al. Healing of Bone Defects in Pig's Femur Using Mesenchymal Cells Originated from the Sinus Membrane with Different Scaffolds. Stem Cells International. , (2019).
- He, W., et al. Lipopolysaccharide enhances decorin expression through the toll-like receptor 4, myeloid differentiating factor 88, nuclear factor-kappa B, and mitogen-activated protein kinase pathways in odontoblast cells. Journal of Endodontics. 38 (4), 464-469 (2012).
- Xiong, Y., et al. Wnt Production in Dental Epithelium Is Crucial for Tooth Differentiation. Journal of Dental Research. 98 (5), 580-588 (2019).
- Haruyama, N., et al. Genetic evidence for key roles of decorin and biglycan in dentin mineralization. Matrix Biology. 28 (3), 129-136 (2009).
- Sreenath, T., et al. Dentin Sialophosphoprotein Knockout Mouse Teeth Display Widened Predentin Zone and Develop Defective Dentin Mineralization Similar to Human Dentinogenesis Imperfecta Type III. Journal of Biological Chemistry. 278 (27), 24874-24880 (2003).
- Yang, Y., Zhao, Y., Liu, X., Chen, Y., Liu, P., Zhao, L. Effect of SOX2 on odontoblast differentiation of dental pulp stem cells. Molecular Medicine Reports. 16 (6), 9659-9663 (2017).
- Tao, H., et al. Klf4 Promotes Dentinogenesis and Odontoblastic Differentiation via Modulation of TGF-β Signaling Pathway and Interaction With Histone Acetylation. Journal of Bone and Mineral Research. 34 (8), 1502-1516 (2019).
- Massa, L. F., Ramachandran, A., George, A., Arana-Chavez, V. E. Developmental appearance of dentin matrix protein 1 during the early dentinogenesis in rat molars as identified by high-resolution immunocytochemistry. Histochemistry and Cell Biology. 124 (3-4), 197-205 (2005).
- Hao, J., Zou, B., Narayanan, K., George, A. Differential expression patterns of the dentin matrix proteins during mineralized tissue formation. Bone. 34 (6), 921-932 (2004).
- Tompkins, K., Alvares, K., George, A., Veis, A. Two related low molecular mass polypeptide isoforms of amelogenin have distinct activities in mouse tooth germ differentiation in vitro. Journal of Bone and Mineral Research. 20 (2), 341-349 (2005).
- Zhai, Y., et al. Activation and Biological Properties of Human β Defensin 4 in Stem Cells Derived From Human Exfoliated Deciduous Teeth. Frontiers in Physiology. 10, (2019).
- Bègue-Kirn, C., Ruch, J. V., Ridall, A. L., Butler, W. T. Comparative analysis of mouse DSP and DPP expression in odontoblasts, preameloblasts, and experimentally induced odontoblast-like cells. European Journal of Oral Sciences. 106, 254-259 (1998).
- Kikuchi, H., Suzuki, K., Sakai, N., Yamada, S. Odontoblasts induced from mesenchymal cells of murine dental papillae in three-dimensional cell culture. Cell and Tissue Research. 317 (2), 173-185 (2004).
- Li, X., Yang, G., Fan, M. Effects of homeobox gene distal-less 3 on proliferation and odontoblastic differentiation of human dental pulp cells. Journal of Endodontics. 38 (11), 1504-1510 (2012).
- Chen, S., et al. Differential regulation of dentin sialophosphoprotein expression by Runx2 during odontoblast cytodifferentiation. Journal of Biological Chemistry. 280 (33), 29717-29727 (2005).
- Narayanan, K., Gajjeraman, S., Ramachandran, A., Hao, J., George, A. Dentin matrix protein 1 regulates dentin sialophosphoprotein gene transcription during early odontoblast differentiation. Journal of Biological Chemistry. 281 (28), 19064-19071 (2006).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. A substractive PCR-based cDNA library from human odontoblast cells: identification of novel genes expressed in tooth forming cells. Matrix Biology. 19 (5), 421-430 (2000).
- Miyazaki, T., Baba, T., Mori, T., Komori, T. Collapsin Response Mediator Protein 1, a Novel Marker Protein for Differentiated Odontoblasts. Acta Histochemica et Cytochemica. 51 (6), 185-190 (2018).
- Yokoi, M., Kuremoto, K., Okada, S., Sasaki, M., Tsuga, K. Effect of attenuation of fibroblast growth factor receptor 2b signaling on odontoblast differentiation and dentin formation. In Vitro Cellular and Developmental Biology - Animal. 55 (3), 211-219 (2019).
- Tohma, A., et al. Glucose Transporter 2 and 4 Are Involved in Glucose Supply during Pulpal Wound Healing after Pulpotomy with Mineral Trioxide Aggregate in Rat Molars. Journal of Endodontics. , (2019).
- Sueyama, Y., Kaneko, T., Ito, T., Kaneko, R., Okiji, T. Implantation of Endothelial Cells with Mesenchymal Stem Cells Accelerates Dental Pulp Tissue Regeneration/Healing in Pulpotomized Rat Molars. Journal of Endodontics. 43 (6), 943-948 (2017).
- Petersson, U., Hultenby, K., Wendel, M. Identification, distribution and expression of osteoadherin during tooth formation. European Journal of Oral Sciences. 111 (2), 128-136 (2003).
- Couble, M. L., et al. Immunodetection of osteoadherin in murine tooth extracellular matrices. Histochemistry and Cell Biology. 121 (1), 47-53 (2004).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. Expression of the small leucine-rich proteoglycan osteoadherin/osteomodulin in human dental pulp and developing rat teeth. Bone. 27 (2), 265-270 (2000).
- Salmon, B., et al. Abnormal osteopontin and matrix extracellular phosphoglycoprotein localization, and odontoblast differentiation, in X-linked hypophosphatemic teeth. Connective Tissue Research. 55, 79-82 (2014).
- Liao, C., Ou, Y., Wu, Y., Zhou, Y., Liang, S., Wang, Y. Sclerostin inhibits odontogenic differentiation of human pulp-derived odontoblast-like cells under mechanical stress. Journal of Cellular Physiology. 234 (11), 20779-20789 (2019).
- Deng, X., et al. The combined effect of oleonuezhenide and wedelolactone on proliferation and osteoblastogenesis of bone marrow mesenchymal stem cells. Phytomedicine. 153103, (2019).
- Choi, H., Kim, T. H., Yun, C. Y., Kim, J. W., Cho, E. S. Testicular acid phosphatase induces odontoblast differentiation and mineralization. Cell and Tissue Research. 364 (1), 95-103 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten