Method Article
Drosophila Larvalarında Mekanik Nosiception Ölçümü için Geliştirilmiş Bir Tahlil ve Araçlar
Bu Makalede
Özet
Bu protokolün amacı, Drosophila larvalarında mekanik nosiception için geliştirilmiş bir tahlilin nasıl gerçekleştirildiğini göstermektir. Buradaki tahlilleri, Drosophila larvalarında mekanik aşırı duyarlılığın (allodynia ve hiperaljezi) var olduğunu göstermek için kullanıyoruz.
Özet
Drosophila'da mekanik nosiception için yayınlanan tahliller, davranışların değişken değerlendirmelerine yol açmıştır. Burada, Drosophila larvaları, özelleştirilmiş metal nikel-titanyum alaşımları (nitinol) filamentleri ile kullanılmak üzere imal ettik. Bu mekanik problar, mekanik nosiception'ı ölçmek için omurgalılarda kullanılan von Frey filamentlerine benzer. Burada, bu mekanik probların nasıl oluşturulacağı ve kalibre edeceğinizi ve subthreshold'dan (zararsız veya zararlı olmayan aralık) suprathreshold (düşük ila yüksek zararlı aralık) uyaranlarına tam bir davranışsal doz-yanıtın nasıl oluşturulacağı gösterilmektedir. Probların yararını göstermek için Drosophila larvalarında doku hasarına bağlı aşırı duyarlılığı araştırdık. Drosophila larvalarında mekanik asidiya (normalde zararsız bir mekanik uyarana aşırı duyarlılık) ve hiperaljezi (zararlı mekanik uyarana abartılı yanıt verme) henüz kurulmamıştır. Normalde zararsız olan mekanik problar veya tipik olarak aversif bir davranış ortaya çıkan problar kullanarak, Drosophila larvalarının doku hasarından sonra mekanik aşırı duyarlılık (hem allodynia hem de hiperaljezi) geliştirdiğini gördük. Bu nedenle, burada gösterdiğimiz mekanik problar ve testler, mekanik aşırı duyarlılığın temel moleküler / genetik mekanizmalarını parçalamak için önemli araçlar olacaktır.
Giriş
Drosophila larvaları, farklı zararlı uyaranlara maruz kaldığında karakteristik bir aversif yuvarlanma davranışı sergiler: termal1, mekanik2ve kimyasal3. Bu davranış normal hareketten açıkça farklıdır. Burada mekanik nosiception ve mekanik duyarlılık değerlendirmek için kullanılabilecek geliştirilmiş bir mekanik tahlil açıklıyoruz.
Yeni bir çalışmada, nitinol telleri kullanarak von Frey benzeri filamentler imal ettik4. Farklı kuvvetler ve basınçlar uygulayan problar, her probu oluşturan nitinol tellerinin uzunlukları ve çapları değiştirerek yapılmıştır. Mekanik problar kalibre edildi ve ölçülen kuvvet değerleri (milinewton, mN cinsinden) her probun uç alanına göre basınca (kilopascal, kPa) dönüştürüldü4. Mekanik probların özel imalatı, prensip olarak mekanik aşırı duyarlılığı incelemek için yararlı olabilecek suprathreshold (225 kPa ila 5318 kPa) basınçlarına subthreshold (≤200 kPa) üretmemize izin verdi. Bu geliştirilmiş mekanik von Frey benzeri filamentleri kullanarak, basınç 4 Daha önce incelenen kuvvet2,5,6'nın aksine, Drosophila larvalarında aversif davranışsal yanıt verme ile daha tutarlı bir şekilde ilişkili olduğunu gösterdik. Burada açıklanan geliştirilmiş mekanik tahlil ayrıca, sineklerde ve sıçanlarda mekanik nosiception'ı düzenleyen bir yola işaret eden korunmuş bir Vasküler Endotel Büyüme Faktörü (VEGF) ile ilgili reseptör tirozin kinazını tanımlamaya yardımcı oldu4.
İki aşırı duyarlılık yöntemi olan mekanik asidina ve hiperaljezi, Drosophila larvalarında termal (ısı ve soğuk) ve kimyasal duyusal yöntemler 3,7 ,8,9,10ile karşılaştırıldığında nispeten yetersizdir. Bu muhtemelen zararsız uyaranlardan yüksek zararlı aralık 2,5,6'yakadar uzanan spesifik mekanik probların eksikliğinden kaynaklanmaktadır. Drosophila larvaları doku hasarı yaşadıktan sonra tipik aversif yuvarlanma davranışını ortaya çıkarır normalde zararsız bir uyaran3,7 allodynia olarak adlandırılır. Tipik olarak zararlı bir uyarana abartılı bir yuvarlanma yanıtı hiperaljezi7olarak bilinir. Zararlı uyaranlar, doku hasarı ortaya çıkan ve noseptörleri aktive debilenler olarak tanımlanır11. Drosophila larvalarına teslim edilen zararlı uyaranlar bariyer epidermisine, periferik nosiseptif duyusal nöronlara3, 4,7veya her ikisine de zarar verir.
Bu yazıda, Drosophila larvaları için uygun olan von Frey benzeri mekanik probların nasıl özel olarak üretilir ve kalibre edilir. Ayrıca, Drosophila larvalarında mekanik nosiseptif yanıtları test etmek için bu probların nasıl kullanılacağını gösteriyoruz. Son olarak, Drosophila larvalarındaki doku hasarını takiben hem allodynia hem de hiperaljezi olmak üzere mekanik aşırı duyarlılık varlığını göstermek için bunları kullanarak bu probların yararını daha da gösteriyoruz (bkz. Temsili Sonuçlar).
Protokol
1. Mekanik prob yapımı
- Her nitinol filamentini (Şekil 1B), uzun eksenine dik olarak, küçük bir tel kesici (Şekil 1C) kullanarak belirtilen uzunluğa (Şekil 1M-N) kesin. Filamentler önceden ayarlanmış üç farklı çapta gelir (Şekil 1B).
NOT: Burada belirtilen uzunluklar, montajın inşası için benzer bir protokol kullanarak belirtilen yaklaşık basınçları elde etmek için bir kılavuzdur. Sonuç olarak, filament kesiminin uzunluğuna ve montajdaki deliğin derinliğine bakılmaksızın, filamentler tam kuvvet / basınç değerini elde etmek için bir denge üzerinde ölçülmeli / kalibre edilmelidir. - Larvaların cildinde doku hasarına neden olabileceği ve kalibrasyona müdahale edebileceğinden keskin veya düzensiz kenarların kalmadığından emin olmak için filamentin ucunu stereomikroskop altında inceleyin.
- Keskin düzensizlikler devam edene kadar bir bileme taşı kullanarak mekanik probun keskin kenarlarını manuel olarak pürüzsüzleştirin(Şekil 1D).
- Hipodermik bir iğne kullanarak ahşap bir dondurma çubuğunun sonuna doğru bir delik açın (Şekil 1E) (bkz. Malzeme Tablosu). İğneyi dondurma çubuğunun yüksekliğinin en az yarısına yerleştirin (Şekil 1E). Bu, nitinol filamentinin yerleştirilmesi için bir oda oluşturur.
- Tek bir nitinol filamentine ahşap tutkal uygulayın (Şekil 1F) ve tutkal kaplı filamenti ahşap bir dondurma çubuğuna(Şekil 1G)iğne yuvasına yerleştirin. ~5 saat kurumaya bırakın.
- Her mekanik probu, mekanik prob bükülene kadar bir teraziye bastırarak kalibre edin(Şekil 1H-L). Bu, gram olarak kaydedilebilecek maksimum kuvvet noktasıdır. Filament çaplarına (önceden ayarlanmış) ve uzunluklara (kullanıcı tarafından belirlenen) bağlı olarak tam bir kuvvet ve basınç aralığı oluşturulabilir.
- Adım 1.6'da kaydedilen kütleyi f = ma formülünü kullanarak milinewton (mN) cinsinden kuvvete dönüştürün (Kuvvet kütleçekimsel ivme ile çarpılan kütleye eşittir). f: kuvvet; m: kütle; a: yerçekimsel ivme (9,8 m/sn2) (Şekil 1M).
- Son olarak, ölçülen kuvveti filament ucunun yüzey alanına bölerek kilopaskal (kPa) cinsinden hesaplanan kuvveti basınca (kuvvet/alan) dönüştürün (Şekil 1M). Alanı hesaplamak için, farklı nitinol filamentlerinin çapını inçten (0,04", 0,06" ve 0,08") santimetreye dönüştürün. Daha sonra πr2 (burada, r = nitinol filament yarıçapı) alanı belirler (bkz. Şekil 1M). Farklı çaplarda ve uzunluklarda filamentler kullanarak birden fazla prob hazırlamak, Drosophila larvaları için duyarlı aralığı kapsayan tam bir set oluşturacaktır (Örnek seti Şekil 1N'degösterilmiştir).
NOT: Her mekanik probu en az 3-4 haftada bir kontrol edin. Basınç orijinal ölçüden % 3'± fazla saptığında, yeni bir mekanik prob üretilmelidir.
2. Larvaların hazırlanması
- 25°C inkübatörde standart gıdalar üzerinde ppk-Gal4>UAS-mCD8-GFP (duyusal nöronların hasarını görselleştirmek için) transgenes içeren larva soyu veya larvaları yükseltin. Tipik olarak, stoklar rutin olarak 18 ° C'de tutulur, ancak hem ebeveynler hem de larva yavruları deneyler için standart mısır unu yiyecekleri üzerinde 25 ° C'de yetiştirilir.
NOT: Yetişkin sinekler (beş erkek ve on dişi, 1:2 oranı) yaklaşık 24 saat boyunca yumurtlamaya izin vermek için sinek şişelerinde tutulur. Yumurtlamadan sonraki zaman (AEL) yetişkinlerin çıkarıldığı zamandan başlar. - Yaklaşık 96 saat yumurtlamadan sonra, larvaları içeren yumuşak sinek mamasına hafifçe musluk suyu fışkırtarak üçüncü başlangıç larvalarını toplayın. Yiyecekleri terk eden veya hiç ön veya arka spiracles olan gezgin larvalar, bu test için çok büyük / eskidir. İkinci instar larvaları (~ 4 mm'den daha kısa boy) çok küçüktür.
- Yumuşak sinek mamasının içeriğini temiz standart boyutta petri kabına (100 mm x 15 mm) dökün.
- Asaları kullanarak, orta üçüncü instar, orta büyüklükteki larvaları (bkz. Şekil 2A)daha küçük (ikinci instar ve erken üçüncü instar) veya daha büyük (geç veya dolaşan üçüncü instar) larvalardan sıralayın. Larvalara herhangi bir doku hasarını önlemek için asaletlerle nazik manipülasyon önerilir.
NOT: Kümes uçları kullanılarak yapılan transfer çoğunlukla su gerilimine dayanır ve larvalara kanatların bıçaklarıyla basınç uygulayarak değil. Larvaların manevrası için forseps kullanımına bir alternatif yumuşak boya fırçalarıdır. Her iki araçla da, kullanıcı davranışsal ölçümleri zorlaştırabilecek istenmeyen doku hasarına neden olmamak için hayvanları aktarma alıştırması yapmalıdır. - Orta üçüncü başlangıç larvalarını, kümes uçlarını kullanarak, oda sıcaklığında suyla nemlendirilmiş küçük bir sinek yemi fişi içeren küçük bir Petri kabına (30 mm x 15 mm) aktarın. Larvaları deneyler yapılana kadar küçük Petri kabında tutun, ancak 20 dakikadan uzun değil.
NOT: Genellikle, 20-30 larvanın gıda fişine aktarılması, 20 dakikalık davranışsal tahliller için yeterli bir sayı verecektir.
3. Mekanik nociception tahlil
- Parlak bir alan stereomikroskopu altında ince bir siyah veya koyu vinil pedi üzerine üçüncü bir başlangıç larvası (kümesps kullanarak) yerleştirin. Koyu renk, larvaların görselleştirilmesini geliştiren kontrast sağlar. Serbestçe hareketli bir koyu vinil parçasına sahip olmak tercih edilir, çünkü kullanıcının larvaya dokunmadan veya zarar vermeden hizalamasını sağlar.
- Optik fiber ışıkları mikroskop objektif lensler ile siyah veya koyu vinil ped arasına koyun; bu, larvayı görmek için yeterli yüksek kontrastlı aydınlatmaya izin verecektir.
- Ped'e transferden sonra normal hareketlenmeyen larvaları atın. Bunlar normal nosceptive davranışsal tepkiyi engelleyebilir. Normal hareket için, bkz: Video 1.
- Bir kağıt havlu kullanarak, larvaların vinil ped üzerinde yüzmesine neden olabilecek larvaları çevreleyen fazla suyu silin.
- Koyu vinil pedi hareket ettirerek larvayı yönlendirin. Sağ elini kullanıyorsanız larva başı/ağzı sola, solaksanız ise tam tersini göstermelidir(Şekil 2A–B).
- Seçilen mekanik probu, tipik olarak 1-2 s için, larvaların arka sırt tarafına yaklaşık karın segmenti A8'de uygulayın (bkz. Şekil 2B),prob bükülene ve önceden ölçülen basınç miktarını ortaya çıkarır (Şekil 2C). Probun larvaların dorsal yüzeyine bastırması ve larvaları prob teması noktasında alttaki ped içine sıkıştırması önemlidir.
NOT: Nitinol filamentinin ucu ile dorsal lütikül-epidermisin arasındaki temas noktasında, 2.300 kPa'dan daha düşük problar, esas olarak lütikül ve alttaki dokulara nüfuz etmeden bükülür. Bu tür problar nadiren larva mortalitesini etkiler4. Daha yüksek basınçlarda (>5.000 kPa) problar hem bükülür hem de bazen manikül ve alttaki dokulara nüfuz eder. Larvaların delinmesi larva sağkalımını bozar4 ve gözlemlenirse, bu larvalar tipik olarak davranışsal analizden atılır. - Her larva için davranışsal yanıtı kaydedin. Larva 3 s içinde vücudunun ekseni boyunca 360 ° 'lik tam bir rulo gösterirse pozitif bir nosceptif yanıt (Video 2) belirtilir. Diğer yanıtlar (dönmeye çalışmak, hızlı gezinmek ve kıpırdamak) bu tahlil amaçları için olumsuz olarak kabul edilir.
NOT: Bir subthreshold mekanik uyaran (200 kPa) ile uyarılan larvalar tipik nosceptive veya yuvarlanan yanıtı ortaya çıkarmadı (Video 3). Bazı larvalar, hareket yönünde değişiklikler gibi hızlı ileri veya hafif dokunma tepkileri sergiledi. - Larvaları atın ve bir sonrakini test için hazırlayın, 3.1 ile 3.7 arasında adımları tekrarlayın.
- İstenilen larva sayısına ulaşılana kadar 3.1-3.7 adımlarını tekrarlayın (her prob için burada üç ila altı n = 10 larva kümesi kullanılmıştır).
NOT: Daha düşük basınçlı mekanik problar (174-462 kPa) kullanırken, test larva başına daha fazla zaman alacaktır. Bunun nedeni, daha uzun filamentlerin ucunun daha fazla salınarak larvaları A8 segmentinin merkezinde dürtmeyi zorlaştırır. Bu problarda pratik yapmak gereklidir.
4. Nöronal morfolojiyi değerlendirmek için konfokal mikroskopi
- Daha önce nitinol filamenti ile uyarılmış bir larvayı (duyusal nöronları etiketlemek için genotip ppk-Gal4>UAS-mCD8-GFP) bir Coplin kavanozunun içindeki bir eterizasyon odasına yerleştirin ve ~1 mL dietil eter ile ıslatılmış bir pamuk topu taşıyan 10 mL'lik bir beher içerir. Larvaların odada ~ 5 dakika oturmasına izin verin.
NOT: Grubumuz tarafından yayınlanan önceki bir çalışmada eterizasyon için ayrıntılı bir protokolsağlanmıştır 12. - Larvaları eterizasyon odasından küçük bir Petri kabına hafifçe durulayın.
- Hazır bir mikroskop slaytı, iki küçük kapak kılıfı (22 x 22 mm) ve bir uzun kapak parçası (22 x 54 mm) (bkz. Malzeme Tablosu).
- Slaytın her iki ucuna küçük eter damlaları ekleyin:yağ çözeltisi (1:5 etil eterin halokarbon yağı çözeltisine oranı, bkz. Malzeme Tablosu)ve ardından küçük kapakları küçük damlacıkların üzerine yerleştirin. Bu düzenleme larvaların sığabileceği küçük bir alan boşluğu oluşturur.
NOT: Küçük kapakları mikroskop kaydırana karşı, kayması zor olana kadar bastırın. - Mikroskop slaydının ortasına bazı eter damlaları:yağ çözeltisi ekleyin ve ardından larvaları forseps kullanarak mikroskop slaytının ortasına (küçük kapaklar arasına) yerleştirin. Larvaların anteroposterior ekseninin slaytın kısa tarafına paralel olduğundan ve sırt tarafının yukarı dönük olduğundan emin olun.
- Larvaları, larvaların üzerine yerleştirilen uzun kapakla ve iki küçük kapakla örtün.
NOT: Larva neredeyse düz olana kadar uzun kapak zarını cömertçe bastırın. - Lazer dalga boyu 488 (GFP) kullanarak konfokal mikroskop kullanarak larvaların görüntü segmenti A8 (bkz. Malzeme Tablosu).
NOT: Eter yoluyla anestezi hızlı bir şekilde kaybolacağından (~5-10 dk) ve larva uyanıp hareket edeceğinden larvaları hemen görüntüleyin, bu da daha fazla görüntülemeyi zorlaştıracaktır. - 1x yakınlaştırmada 20x sayısal diyafram açıklığı (NA) 0,7 kuru objektif lens kullanarak 1024 x 1024 piksel çözünürlükte Z yığını görüntüler yakalayın, adım boyutu 1,5 μm.
5. Doku hasarının niceliği
- Bölüm 4.8'deki Z serisi yığın görüntülerini toplayın ve tek bir Z projeksiyonuna dönüştürün (farklı odak düzlemelerde çekilen birden fazla görüntünün düzleştirerek tek bir bileşik görüntüye dönüştürülmesi). Bu, piyasada bulunan yazılımlar (örneğin, Olympus Fluoview) veya fiji/Image J gibi herhangi bir eşdeğer açık kaynak platformu kullanılarak gerçekleştirilebilir.
- Görüntü analiz programı Fiji/ImageJ'yi açın.
- Menü çubuğundan Dosya'yı tıklatın ve görüntülenen pencereden Aç'ı seçin.
- Analiz edilecek TIFF biçiminde kaydedilmiş depolanan tek görüntü projeksiyonu seçin.
- Menü çubuğundan Düzenle 'yitıklatın ve görüntülenen pencerede Ters Çevir seçeneğini belirleyin.
- Menüçubuğundan Görüntü 'ye tıklayın, sonra görüntülenen pencereden Ayarla 'yı seçin ve son olarak Parlaklık/Karşıtlık seçeneğini belirleyin.
- Boşluğun alanını ölçmek için araç çubuğundan Serbest Şekil seçeneğini belirleyin (varsa).
- Menü çubuğundan Çözümle'ye tıklayın ve Ölçü seçeneğini belirleyin. Bu, boşluğun veya yaranın alanını gösterecektir.
Sonuçlar
Mekanik olarak çağrıştırılan davranışları ortaya çıkarmak için nitinol filamentleri (Şekil 1A,N) kullanarak özelleştirilmiş mekanik problar geliştirdik ve bu probların temel(yaralanmayokluğunda) mekanik nociception'ı incelemek için kullanılabileceğini gösteren hem zararsız hem de zararlı mekanik probları kullanarak tam bir davranışsal doz yanıt eğrisi oluşturduk.
Davranışsal test sonuçlarımız, Drosophila larvalarına uygulandığında 200 kPa (~1,57 mN) (Şekil 1M)altında basınç uygulayan probların aversif bir yuvarlanma tepkisine neden olmadığını belirledi (Şekil 2D ve Video 3). Beklendiği gibi, bu subthreshold veya zararlı olmayan mekanik problar (175 kPa veya 200 kPa) görünür nöronal doku hasarı ortaya çıkarmadı (Şekil 2E). Hasara neden olmadıkları için, bu tür problar mekanik asidyayı (normalde zararlı olmayan mekanik uyaranlara aşırı duyarlılık) değerlendirmek için yararlı olabilir. Tersine, suprathreshold veya zararlı problar (462 kPa'dan 5.116 kPa'ya kadar), daha yüksek basınçların daha güçlü davranışsal tepkiler ortaya çıkardığı, doza bağlı bir şekilde artırılmış bir davranışsal yanıt(Şekil 2D)ortaya çıkarmıştır. Beklendiği gibi, suprathreshold mekanik basıncı da periferik duyusal nöronların kendi doz bağımlı doku hasarına neden oldu(Şekil 2E). Her grup için dört larvadan alınan ölçülen doku hasarı alanı(μm 2 ± standart sapmada) şu şekildeydi: 2.051,03 ± 703,81 (462 kPa), 5,102 .29 ± 1.004,67 (2.283 kPa) ve 12.238,83 ± 3.724,11 (5.116 kPa). Bu nedenle, 462 kPa'dan (~63 mN) daha büyük veya buna eşit basınçlar, aversif bir yuvarlanma tepkisini çağrıştırır (larvaların% 25'inde veya daha fazlasında) ve görünür nöronal doku hasarına neden olur (Şekil 2E), mekanik hiperaljeziyi (normalde zararlı mekanik uyaranlara aşırı duyarlılık) incelemek için uygun olabilir. Nosceptive mekanik problar (≥462 kPa) her zaman doku hasarına neden olur (n = 10, nitel olarak değerlendirilir) ancak her zaman averatif bir yuvarlanma tepkisine neden olmaz.
Mekanik aşırı duyarlılığı (allodynia ve hiperaljezi) değerlendirmek için, doku hasarına neden olmak için ultraviyole ışık (UV) ışınlama kullanan iyi kurulmuş bir Drosophila larva larva modeli kullandık7,12. Bu tahlil, termal nosceptif aşırı duyarlılık 8 ,9 , 10 ,13,14,15'ingenetik ve hücresel mekanizmalarınıparçalamayayardımcıolmuştur. UV tedavisinin mekanik allodyniaya neden olup olmadığını belirlemek için, orta üçüncü instar kontrolü (w1118) larvalar sahte ışınlandı veya UV ışınlandı (15-20 mJ / cm2) (Şekil 3A). Daha sonra larvalar, normalde subthreshold mekanik prob (200 kPa, 1.57 mN) ile tedavi sonrası 2 saat, 4 saat, 8 saat, 16 saat ve 24 saat davranışsal olarak test edildi. Larvaların yaklaşık % 20'si UV tedavisinden sonra 2 saat kadar erken yanıt verirken, % 50'si 4 saatte yanıt verirken, sırasıyla% 6.6 ve% 8.3 sahte UV ışınlanmış hayvanlara karşılık gelir (Şekil 3B). Bu, UV kaynaklı doku hasarının ışınlama sonrası 4 saatte mekanik allodyniaya neden olduğunu gösterir. Daha sonraki zaman noktalarında (8 h, 16 h ve 24 h) UV ile tedavi edilen larvaların davranışsal tepkisi% 16-20 yanıt veren aralığındaydı (her biri ortalama n = 3-6 10 larva kümesi), sahte ışınlanmış kontrol grubuna kıyasla (ancak istatistiksel olarak anlamlı değil) (yanıt verenlerin% 3-6'sı aralığında), ortalama ortalama n = her biri 10 larvadan oluşan 3-6 set) (Şekil 3B).
Mekanik hiperaljeziyi araştırmak için, normalde larvaların ~% 20'sinde (Şekil 2D) averaj tepkisine neden olan ve nöronal doku hasarına neden olan bir suprathreshold basıncı(462kPa, 3.63 mN) kullanılmıştır (Şekil 2E). 462 kPa probunun UV kaynaklı doku hasarı olan veya olmayan larvaların dorsal tarafına uygulanması (Şekil 3A). UV tedavisinden sonra 4 saat, 8 saat ve 16 h'de araştırılan larvaların, 4 h'nin davranışsal aşırı duyarlılığın zirvesi (~% 60 duyarlı) ile aversif yuvarlanma yanıtında önemli bir artış gösterdiğini bulduk; sahte UV ışınlanmış hayvanlar aversif yanıtın ~% 27'sini gösterdi (Şekil 3C). Mekanik asidiya benzer şekilde, UV ile tedavi edilen hayvanların 8 saat, 16 saat ve 24 saat davranışsal tepkisi (%36-%42 aralığında) tedavi edilmeyen larvalardan istatistiksel olarak ayırt edilemezdi (%20-%26 aralığında). Geç üçüncü instar aşamasındaki larvalar, orta üçüncü instar aşaması ile karşılaştırıldığında temel davranışsal tepkide hafif bir azalma göstermiştir. Bunun larvaların artan büyüklüğü (Şekil 2A) veya vücudu kaplayan kütikül kalınlığının artmasıyla olabileceğini vardır. Bu gerçek, gelişimin daha sonraki bir aşamasında UV tedavisinin, UV sonrası 4 h tedavide gözlemlendiği gibi neden daha fazla mekanik hassasiyete neden olmadığını açıklayabilir.
Birlikte ele alındığında, sonuçlarımız Drosophila larvalarının UV kaynaklı doku hasarından sonra hem mekanik allodynia hem de mekanik hiperaljezi geliştirdiğini göstermektedir. Mekanik asidina ve hiperaljezinin en yoğun zamanı aynıdır, UV tedavisinden sonra 4 saat; bununla birlikte, mekanik hiperaljezi, mekanik asidina kıyasla daha yavaş taban çizgisine geri döndüğü için daha belirgin bir zamansal kuyruğa sahiptir.

Şekil 1: Drosophila larvalarında mekanik nosiception değerlendirmek için Von Frey benzeri bir aletin geliştirilmesi. (A) Drosophila larvalarında mekanik nosikür üzerinde çalışmak için kullanılan mekanik bir probun resmi. (B) Nitinol filamentleri ve bağıl çapları göreli ölçeğe gösterilir. (C) Nitinol filamentlerini kesmek için kullanılan diyagonal tel kesicinin resmi. (D) Kesilen nitinol filamentinin keskin kenarlarının bir bileme taşı ile yumuşatılır. (E) Probun ahşap dondurma çubuğu sapına delik açmak için kullanılan hipodermik iğne. İğnenin ucunun, güvenli filament yerleştirme için sap çubuğunun en az yarısına ulaşması gerekir. (F–G) Nitinol filamentinin ekleme deliği ile ahşap bir dondurma çubuğu sapına yapıştırılarak bağlanması. (H–L) Mekanik probların bir teraziye bastırılarak kalibrasyonu. (M) Farklı mekanik problar tarafından üretilen kuvvet değerleri (mN olarak) ve basınç (kPa'da). Probları oluşturmak için kullanılan her nitinol filamentinin uzunluğu (P1–P10; P: prob) santimetre (cm) olarak ayrıntılı olarak açıktır. (N) 174 kPa ila 5.116 kPa arasında değişen eksiksiz bir mekanik prob setinin resmi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Mekanik nociception tahlil: Von Frey benzeri filamentler, aversif yuvarlanma davranışının doz-tepki eğrisini oluşturur ve duyusal nöronlarda doku hasarına neden olur. (A) Drosophila larvalarının farklı aşamalarının (ikinci ve üçüncü instar) resimleri. Ölçek çubuğu: 2 mm. (B) Üçüncü instar Drosophila larvalarının dorsal görünümünün karikatürü. Kırmızı nokta, mekanik probun uygulandığı karın segmentini gösterir. T: torasik segment; A: karın segmenti. Diğer anatomik yerler etiketlenmiştir. (C) Test karikatürü: Larvanın sırt tarafına, aşağıdaki yüzeye doğru bükülene kadar mekanik bir prob uygulanır ve daha sonra 2 s boyunca tutulur. Basınç yeterince yüksekse, bu serbest bırakıldığında aversif bir yuvarlanma tepkisi ortaya çıkarır. (D) Davranışsal doz yanıtı; her mavi nokta, 10 hayvandan oluşan bir set içindeki mekanik stimülasyona aversif haddeleme ile yanıt veren larvaların yüzdesini temsil eder. Farklı mekanik problar tarafından indüklenen aversif yuvarlanma davranışının yüzdesinin keman arsası. kPa: kilopascals. Kutu çizimleri ortanca (yeşil), bıyıklar (kırmızı) 10. (E) Doku hasarı: Üçüncü instar larvaları (genotip ppk-Gal4>UAS-mCD8-GFP'nin noseptif duyusal nöronları etiketlemek için) belirtilen basınçlarla dorsal segment A8'de araştırıldı. Floresan etiketli eşleştirilmiş ddaC sınıfı IV duyusal nöronlar (sırt orta çizgisi boyunca) incelendi (bkz. bölüm 4 ve 5). Beyaz alanlar (kırmızı yıldız işaretleri) boşlukları veya doku hasarını temsil eder. Ölçek çubuğu: 100 μm. B panelinde larva dorsal görünümde gösterilirken, C'de yanal görünümdür. Larvaların dorsal lütikül-epidermis tarafına bastırılan mekanik problar, probun ucunun ve çevresindeki alanların temas noktasında cep gibi bir çöküstü üretir. Ventral tarafa doğru kavisli düz siyah çizgi cebin üstüdür, kesikli gri yanal çizgi ise yanal tarafı ve cebin altını temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
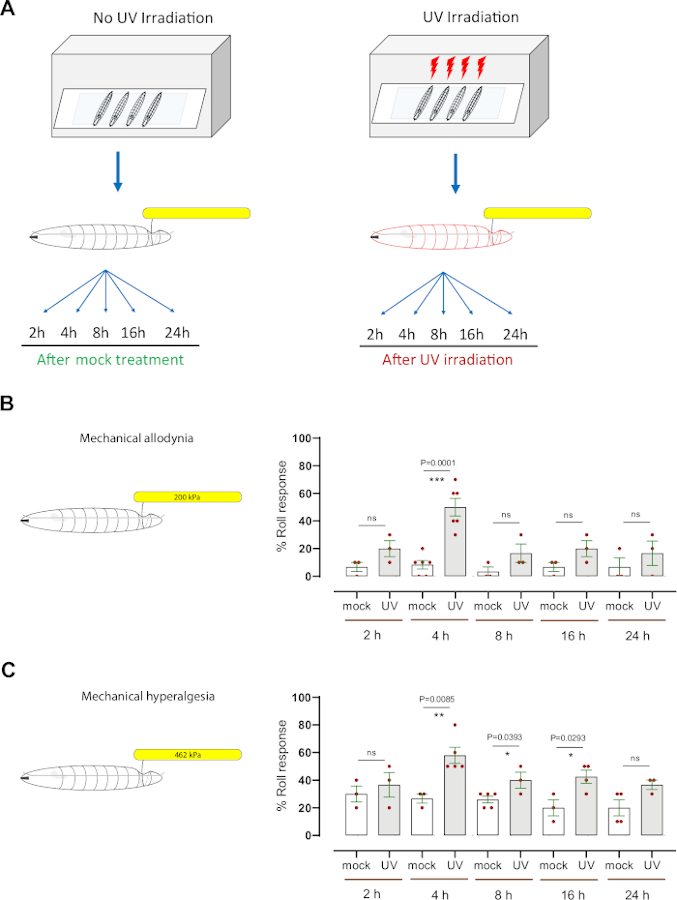
Şekil 3: UV hasarından sonra mekanik aşırı duyarlılık. (A) Duyarlılık test etmek için deneysel tasarımın şeması. Orta üçüncü instar sahte tedavi edildi (UV olmayan) veya UV ışınlandı. Mekanik nosiception tahlil daha sonra sahte tedavi veya ışınlama sonrasında farklı zaman noktalarında (2 saat, 4 saat, 8 saat, 16 saat ve 24 saat) gerçekleştirildi. (B) Mekanik allodynia: Sahte tedavi veya UV ışınlamadan sonra belirtilen zaman noktalarında normal bir subthreshold veya zararlı olmayan mekanik uyaran (200 kPa, 1.57 mN) ile problamadan sonra averajlı yuvarlanma sergileyen larvaların yüzdesi. (C) Mekanik hiperaljezi: Sahte tedavi veya UV ışınlamadan sonra belirtilen zaman noktalarında normalde suprathreshold veya zararlı mekanik uyaran (462 kPa, 3.63 mN) ile problamadan sonra aversif yuvarlanma gösteren larvaların yüzdesi. Hata çubukları ortalamayı gösterir +/- SEM. İstatistiksel analiz için iki kuyruklu eşleşmeyen t-testi kullanıldı: *p < 0.05, **p < 0.01; ns: önemli değil. Her kırmızı nokta, B ve C panellerinde, zaman noktası/koşul başına 10 larva, n = 3-6 setlerinin ortalama oranını temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Video 1: Drosophila larvalarının normal locomotion. Bu videoyu indirmek için lütfen tıklayınız.
Video 2: Drosophila larvalarının zararlı mekanik uyarılması. Bu videoyu indirmek için lütfen tıklayınız.
Video 3: Drosophila larvalarının mekanik stimülasyonunu subthreshold. Bu videoyu indirmek için lütfen tıklayınız.
Tartışmalar
Nitinol filamentlerinden üretilen özelleştirilmiş mekanik problar kullanarak yerleşik bir mekaniktest1,2,16'yı değiştirdik. Bu metal alaşım, Drosophila larvalarının büyüklüğüne uygun daha küçük çaplı filamentler kullanmamızı sağlar. Balıkçılık hattı tabanlı monofilamentler bugüne kadar sinek mekanik nosiception alanına hakimdir2,5,6,16. Nitinol filamentlerimiz yaklaşık ~3-5 ay boyunca şekillerini korur ve basıncı ölçer (deneyimlerimize göre). Nitinol filamentlerinin uzunluğunu ve çapını değiştirerek, kullanıcı alt gövdeden neredeyse eksiksiz bir yuvarlanma tepkisine kadar geniş bir basınç yelpazesi üretebilir. Özellikle, alt koruma probları yapmak daha küçük çaplı nitinol filamentleri ile daha kolaydır. Bu probları kullanarak, kuvvet yerine basıncın daha tutarlı nosifensif davranışsal yanıtlar ortaya çıkardığı bulundu4. Burada, iyi kurulmuş bir UV kaynaklı nosceptive duyarlılık modeli7,10,13kullanarak, bu filamentlerin mekanik aşırı duyarlılığı (asidiyans ve hiperaljezi) incelemek için de yararlı bir araç olduğunu gösteriyoruz.
Oltadan üretilen mekanik probların kullanılarak yapılan önceki çalışmalar davranışsal yanıt verme 2 , 6,16,17'debelirli bir değişkenliğe yol açmıştır. Bunu çeşitli faktörler hesaba katabilir. İlk olarak, basınç önemli değişken olduğundan, filament ucunun yuvarlatılmış ve keskin kenarları olmayacak şekilde kabarması kritik öneme sahiptir. İkincisi, deneylerin tekrarlanabilirliği için sadece kuvvet yerine basınç değerlerini raporlamak önemlidir, çünkü benzer kuvvetler üreten farklı mekanik problar farklı basınçlar ortaya çıkabilir4. Üçüncüsü, zararlı problar kullanarak larva başına sadece bir mekanik stimülasyon uygulamak önemlidir, çünkü bu tür problar epidermal4 ve duyusal nöronal seviyelerde doza bağımlı bir doku hasarı üretir (Şekil 2E). Doku hasarı indüklendikten sonra ikinci veya sonraki zararlı mekanik uyaran, etkilenen periferik duyusal nöronların işlevini bozabilir ve değiştirilmiş bir davranışsal yanıt ortaya çıkabilir. Başka bir çalışmada, zararlı mekanik problarla iki kez uyarılan larvalar çoğunlukla gelişmiş bir davranışsal yanıt gösterdi5, ilk zararlı mekanik uyaranın neden olduğu doku hasarından kaynaklanabilecek akut mekanik duyarlılık (hiperaljezi) gelişimini düşündürmektedir. Tersine, diğer yazarlar6, değişen davranışsal yanıtın nöronal dokunun hasarına / işlev bozukluğuna bağlı olabileceğini gösteren karışık (artmış veya azalmış) bir davranışsal yanıt bildirmiştir. Her larvayı sadece bir kez uyarmak, duyarlılık veya doku hasarından kaynaklanan davranışsal yanıtlardaki olası varyansı ortadan kaldırır. Dördüncüsü, önceki çalışmalara göre daha arka olan A8 segmentini mekanik olarak uyardık (tercih edilen alanlar A3–A4)2,5,16. A2 veya A8 segmentine uygulanan ~3.900 kPa ile 5.300 kPa arasındaki problar herhangi bir davranışsal farklılık göstermedi4. Ek olarak, A8, A2-A4 ile karşılaştırıldığında, daha düşük basınçlar (<300 kPa) üreten mekanik problarla uyarılması daha kolaydır, çünkü larva bu bölgede daha incedir ve böylece daha kolay sıkıştırılır. Diğer çalışmalar, larvaların arka ucunun zararlı mekanik stimülasyonunun (forseps ile tutulan sert bir böcek iğnesi tarafından teslim edildiğini) çoğunlukla averatif veya yuvarlanan bir yanıt yerine ileriye doğru hareket uyandırdığını göstermiştir18. Bu farklı davranışsal yanıt, kullanılan malzemelerin özelliklerindeki farklılıklardan (bükülebilir nitinol filament vs sıkıştırılamaz böcek pimi) veya larvalara verilen farklı basınçlardan kaynaklanabilir (böcek piminin basınç değeri bildirilmedi).
Drosophila larvaları için mekanik bir nosiception tahlilinin geliştirilmesi, alanın farklı mekanik duyusal iyon kanallarının ve sinir devrelerinin mekanik nociception 5 , 6,16,17'yearacılıkettiğini keşfetmesini sağlamıştır. Bununla birlikte, mekanik aşırı duyarlılık (allodynia ve hiperaljezi) çalışması, diğer duyusal yöntemlerin duyarlı hale getirilmesine kıyasla geri kaldı - ısı7, 8,10,13,14, soğuk9ve kimyasal3. Bu gecikme kısmen, suprathreshold basınçlarına kadar uzanan tam bir tepki aralığı oluşturabilecek uygun mekanik probların yokluğundan kaynaklanıyor olabilir. Özellikle mekanik asidiyatı değerlendirmek için özel bir öneme sahip olan, yaralanmamış larvalardan aversif bir yuvarlanma tepkisi vermeyen alt gövde problarıdır. Geliştirilmiş mekanik problarımızın önemi, zararsız uyaranları (subthreshold ~174 kPa–200 kPa) veya düşük ila yüksek zararlı aralığı (suprathreshold ~225 kPa ila ~ 5.116 kPa) kapsayacak şekilde üretilebilmesidir. Burada, Drosophila larvalarının UV ışınlamadan sonra hem mekanik allodynia hem de mekanik hiperaljezi geliştirdiği nitinol von Frey benzeri filamentleri kullanarak gösteriyoruz. Mekanik duyarlılık, termal duyarlılıkla karşılaştırıldığında bazı farklılıklar gösterir. Mekanik duyarlılığın hem başlangıcı hem de zirvesi termal (ısı) duyarlılıkla karşılaştırıldığında daha erkendir (~4 h) (hiperaljezi için ~ 8 h ve allodynia için ~ 24 saat)7. Ek olarak, mekanik asidina ve hiperaljezi eşlik edendir (her ikisi de ~4 saat zirvede). Ayrıca, ısı duyarlılığı (allodynia ve hiperaljezi) daha sonraki zaman noktalarında tamamen çözülürken7, mekanik aşırı duyarlılık taban çizgisinin biraz üzerinde kalan uzun bir kuyruk sergiledi. Drosophila'daki soğuk duyarlılık, soğuk uyarılmış davranışlar9'da bir geçiş ve mekanik stimülasyonla gözlenmemiş bir fenomen olan yeni soğuk çağrışımlı davranışların ortaya çıkmasını içerir. Başlangıç, süre ve gözlemlenen davranışlardaki bu farklılıklar, her duyusal modalitenin farklı sinyal yolları tarafından kontrol edilebileceğini göstermektedir. Burada açıklanan duyarlılık testini Drosophila'da bulunan güçlü genetik araçlarla birleştirmek, gözlenen mekanik aşırı duyarlılığın (allodynia ve hiperalgezi) kesin bir genetik diseksiyonuna izin vermelidir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Prototip von Frey filamentlerini geliştirdiği için Thomas Wang'a, mekanik prob testini geliştirdiği için Patrick J. Huang'a, kontrol için Bloomington Drosophila Stok Merkezi'ne(w1118)ve ppk-Gal4>UAS-mCD8-GFP sinek stoklarına ve Galko laboratuvar üyelerine el yazmasını eleştirel bir şekilde okuduklarından dolayı teşekkür ederiz. Bu çalışma R21NS087360 ve R35GM126929 tarafından MJG'ye desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Beaker | Fisher Scientific | 02-540C | Beaker of 10 ml of capacity. Any similar container will do. |
| Black (Arkansas) bench stone | Dan’s Whetstone | SKU: I200306B24b-HQ-BAB-622-C | Used to smoothe any irregularities of the nitinol wire tips. https://www.danswhetstone.com/product/special-extra-wide-black-bench-stone-6-x-2-1-2-x-1-2/ |
| Confocal microscope | Olympus | FV1000 | Any equivalent confocal microscope will do |
| Coplin Jar | Fisher Scientific | 08-816 | https://www.fishersci.com/shop/products/fisherbrand-glass-staining-dishes-10-slides-screw-cap/08816#?keyword=08-816 |
| Diethyl ether | Fisher Scientific | E138-500 | For anesthetizing larvae. |
| Etherization chamber | This is a homemade customized chamber. Please see details of its construction in our previous published paper12. The purpose of the etherization chamber is allow entry of diethyl ether fumes but prevent larval escape. | ||
| Fiber Optic Light Guide | Schott AG | A08575 | Schott Dual Gooseneck 23 inch |
| Forceps | Fine Science Tool | FS-1670 | For transferring larvae |
| Glue | Aleene's | N/A | Aleene's® Wood Glue, formerly called (Aleene's All-Purpose Wood Glue) https://www.aleenes.com/aleenes-wood-glue |
| Graspable holder | Loew Cornell | N/A | Loew-Cornell Simply Art Wood Colored Craft Sticks, 500 pieces. |
| Halocarbon oil 700 | Sigma | H8898-100ML | |
| Hypodermic needle 30G 1/2"L | Fisher Scientific | NC1471286 | BD Precisionglide® syringe needles, gauge 30, L 1/2 inches. Used to make a hole into the wooden holder for the nitinol wires |
| Large Petridish | Falcon | 351007 | 60 mm x 10 mm Polystyrene Petridish |
| Microscope (Zeiss) Stemi 2000 | Carl Zeiss, Inc. | NT55-605 | Any equivalent microscope will do |
| Microscope Cover Glass 22x22 | Fisher | 12-545-B | |
| Microscope Cover Glass 22x40 | Corning | 2980-224 | Tickness 1 1/2 |
| Microscope Slides | Globe Scientific Inc. | 1358Y | |
| Mini Diagonal Cutter | Fisher Scientific | S43981 | For cutting nitinol filaments |
| Nitinol filaments, Diameters: 0.004”, 0.006”, 0.008” | Mailin Co | N/A | Fifteen pieces of each diameter of 12” length were ordered. https://malinco.com/ |
| Piece of black vinyl | Office Depot | N/A | We use a small piece of vinyl cut from a binder. Dark color provides contrast. A small piece allows orientation of the larva |
| Small Petridish | Falcon | 351008 | 35 mm x 10 mm Polystyrene Petridish |
| Spatula | Fisher Scientific | 21-401-10 | Double-Ended Micro-Tapered Stainless Steel Spatula. Used to place the food in the petri dish |
| Wipes | Fisher Scientific | 06-666A | Kimpes KMTECH, Science Brand. Used to dry larvae of excess moisture. |
| W1118 | Bloomington Drosophila Stock Center | 3605 | Control strain for behavioral assays |
| ppk-Gal4>UAS-mCD8-GFP | Bloomington Drosophila Stock Center | 8749 | Strain for fluorescent labeling of class IV md neurons |
Referanslar
- Tracey, W. D., Wilson, R. I., Laurent, G., Benzer, S. Painless, a Drosophila gene essential for nociception. Cell. 113 (2), 261-273 (2003).
- Zhong, L., Hwang, R. Y., Tracey, W. D. Pickpocket is a DEG/ENaC protein required for mechanical nociception in Drosophila larvae. Current Biology. 20 (5), 429-434 (2010).
- Lopez-Bellido, R., Himmel, N. J., Gutstein, H. B., Cox, D. N., Galko, M. J. An assay for chemical nociception in Drosophila larvae. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 374 (1785), 20190282 (2019).
- Lopez-Bellido, R., et al. Growth factor signaling regulates mechanical nociception in flies and vertebrates. Journal of Neuroscience. 39 (30), 6012-6030 (2019).
- Hu, C., et al. Sensory integration and neuromodulatory feedback facilitate Drosophila mechanonociceptive behavior. Nature Neuroscience. 20 (8), 1085-1095 (2017).
- Kim, S. E., Coste, B., Chadha, A., Cook, B., Patapoutian, A. The role of Drosophila Piezo in mechanical nociception. Nature. 483 (7388), 209-212 (2012).
- Babcock, D. T., Landry, C., Galko, M. J. Cytokine signaling mediates UV-induced nociceptive sensitization in Drosophila larvae. Current Biology. 19 (10), 799-806 (2009).
- Babcock, D. T., et al. Hedgehog signaling regulates nociceptive sensitization. Current Biology. 21 (18), 1525-1533 (2011).
- Turner, H. N., Patel, A. A., Cox, D. N., Galko, M. J. Injury-induced cold sensitization in Drosophila larvae involves behavioral shifts that require the TRP channel Brv1. PloS One. 13 (12), 0209577 (2018).
- Im, S. H., et al. Tachykinin acts upstream of autocrine Hedgehog signaling during nociceptive sensitization in Drosophila. eLife. 4, 10735 (2015).
- Cervero, F., Merskey, H. What is a noxious stimulus. Pain Forum. 5 (3), 157-161 (1996).
- Chattopadhyay, A., Gilstrap, A. V., Galko, M. J. Local and global methods of assessing thermal nociception in Drosophila larvae. Journal of Visualized Experiments: JoVE. (63), e3837 (2012).
- Follansbee, T. L., et al. Drosophila nociceptive sensitization requires BMP signaling via the canonical SMAD pathway. Journal of Neuroscience. 37 (35), 8524-8533 (2017).
- Im, S. H., Patel, A. A., Cox, D. N., Galko, M. J. Drosophila insulin receptor regulates the persistence of injury-induced nociceptive sensitization. Disease Models & Mechanisms. 11 (5), (2018).
- Jo, J., et al. Drosophila caspase activity is required independently of apoptosis to produce active TNF/Eiger during nociceptive sensitization. Cell Death & Disease. 8 (5), 2786 (2017).
- Hwang, R. Y., et al. Nociceptive neurons protect Drosophila larvae from parasitoid wasps. Current Biology. 17 (24), 2105-2116 (2007).
- Guo, Y., Wang, Y., Wang, Q., Wang, Z. The role of PPK26 in Drosophila larval mechanical nociception. Cell Reports. 9 (4), 1183-1190 (2014).
- Takagi, S., et al. Divergent connectivity of homologous command-like neurons mediates segment-specific touch responses in Drosophila. Neuron. 96 (6), 1373-1387 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır