Method Article
Um ensaio e ferramentas aprimoradas para medir o nocicepção mecânico em larvas de Drosophila
Neste Artigo
Resumo
O objetivo deste protocolo é mostrar como realizar um ensaio melhorado para o nocicepção mecânica em larvas de Drosophila. Usamos o ensaio aqui para demonstrar que a hipersensibilidade mecânica (aodínia e hiperalgesia) existe em larvas de Drosophila.
Resumo
Ensaios publicados para nocicepção mecânica em Drosophila levaram a avaliações variáveis de comportamento. Aqui, fabricamos, para uso com larvas de Drosophila, filamentos personalizados de liga de níquel-titânio metálico (nitinol). Estas sondas mecânicas são semelhantes aos filamentos von Frey usados em vertebrados para medir a nocicepção mecânica. Aqui, demonstramos como fazer e calibrar essas sondas mecânicas e como gerar uma dose-resposta comportamental completa de subtenses (alcance inócuo ou não nocivo) para estímulos supraterreshold (de baixo a alto alcance nocivo). Para demonstrar a utilidade das sondas, investigamos hipersensibilidade induzida por danos teciduais em larvas de Drosophila. A hipânia mecânica (hipersensibilidade a um estímulo mecânico normalmente inócuo) e a hiperalgesia (resposta exagerada a um estímulo mecânico nocivo) ainda não foram estabelecidas em larvas de Drosophila. Usando sondas mecânicas que normalmente são inócuas ou sondas que normalmente provocam um comportamento aversivo, descobrimos que as larvas de Drosophila desenvolvem hipersensitização mecânica (tanto a allodynia quanto hiperalgesia) após danos teciduais. Assim, as sondas mecânicas e ensaios que ilustramos aqui provavelmente serão ferramentas importantes para dissecar os mecanismos moleculares/genéticos fundamentais da hipersensibilidade mecânica.
Introdução
As larvas de drosophila apresentam um comportamento de rolamento aversivo característico quando expostas a diferentes estímulos nocivos: térmico1,mecânico2e químico3. Este comportamento é claramente distinto da locomoção normal. Aqui descrevemos um ensaio mecânico melhorado que pode ser usado para avaliar a nocicepção mecânica e a sensibilização mecânica.
Em um estudo recente, fabricamos filamentos como von Frey usando fios de nitinol4. Sondas exercendo diferentes forças e pressões foram feitas variando os comprimentos e diâmetros dos fios nitinol formando cada sonda. As sondas mecânicas foram calibradas e os valores de força medidos (em mililiton, mN) foram convertidos em pressão (kilopascal, kPa), com base na área de ponta de cada sonda4. A fabricação personalizada de sondas mecânicas nos permitiu gerar subtensidade (≤200 kPa) para as pressões suprathreshold (225 kPa a 5318 kPa), o que poderia, em princípio, ser benéfico para o estudo da hipersensibilidade mecânica. Utilizando esses filamentos mecânicos melhorados como von Frey, mostramos que a pressão4, em oposição à força previamente examinada2,5,6 correlaciona-se de forma mais consistente com a resposta comportamental aversiva nas larvas de Drosophila. O ensaio mecânico melhorado aqui descrito também ajudou a identificar um fator de crescimento endotelial vascular conservado (VEGF) que sinaliza uma via que regula o nociception mecânico em moscas e ratos4.
A hipânia mecânica e a hiperalgesia, duas modalidades de hipersensibilidade, são relativamente subestudadas em larvas de Drosophila, em comparação com as modalidades térmica (calor e frio) e sensorial química3,7,8,9,10. Isso provavelmente se deve à falta de sondas mecânicas específicas que vão desde estímulos inócuos até a alta faixa nociva2,5,6. Um estímulo normalmente inócuo que provoca o típico comportamento de rolagem aversivo após a larva de Drosophila experimentar danos teciduais3,7 é referido como aodínia. Uma resposta exagerada a um estímulo tipicamente nocivo é conhecida como hiperalgesia7. Estímulos nocivos são definidos como aqueles que provocam danos teciduais e podem ativar nociceptores11. Estímulos nocivos entregues às larvas de Drosophila danificam a epiderme da barreira, os neurônios sensoriais nociceptivos periféricos3,4,7ou ambos.
Neste artigo, demonstramos como fabricar e calibrar sondas mecânicas semelhantes a von Frey que são apropriadas para larvas de Drosophila. Além disso, mostramos como usar essas sondas para avaliar respostas nociceptivas mecânicas em larvas de Drosophila. Por fim, demonstramos ainda a utilidade dessas sondas utilizando-as para demonstrar a presença de hipersensibilidade mecânica, tanto a liga quanto a hiperalgesia, após danos teciduais em larvas de Drosophila (ver Resultados Representativos).
Protocolo
1. Construção de sonda mecânica
- Corte cada filamento nitinol(Figura 1B),perpendicular ao seu eixo longo, ao comprimento especificado(Figura 1M-N) utilizando um pequeno cortador de arame(Figura 1C). Os filamentos vêm em três diâmetros pré-definidos diferentes(Figura 1B).
NOTA: Os comprimentos especificados aqui são um guia para alcançar as pressões aproximadas indicadas, utilizando um protocolo semelhante para a construção da montagem. Em última análise, independentemente do comprimento do corte do filamento e da profundidade do orifício na montagem, os filamentos devem ser medidos/calibrados em um equilíbrio para obter o valor exato de força/pressão. - Examine a ponta do filamento sob um estereótipo para garantir que não permaneçam bordas afiadas ou irregulares, pois estas podem causar danos teciduais à pele das larvas e interferir na calibração.
- Alise manualmente as bordas afiadas da sonda mecânica usando uma pedra de afiação até que não persistam irregularidades nítidas(Figura 1D).
- Faça um buraco na extremidade de um palito de picolé de madeira(Figura 1E) usando uma agulha hipodérmica (ver Tabela de Materiais). Insira a agulha pelo menos na metade da altura do palito de picolé(Figura 1E). Isso cria uma câmara para inserção do filamento nitinol.
- Aplique cola de madeira em um único filamento de nitinol(Figura 1F)e insira o filamento revestido de cola na ranhura da agulha em um palito de picolé de madeira(Figura 1G). Deixe secar por ~5 h.
- Calibrar cada sonda mecânica pressionando-a contra uma balança até que a sonda mecânica dobre(Figura 1H-L). Este é o ponto de força máxima que pode ser registrado em gramas. Dependendo dos diâmetros do filamento (pré-definido) e comprimentos (determinados pelo usuário) uma gama completa de forças e pressões pode ser gerada.
- Converta a massa registrada na etapa 1.6 para forçar em millinewton (mN) usando a fórmula f = ma (A força é igual à massa multiplicada pela aceleração gravitacional). f: força; m: massa; a: aceleração gravitacional (9,8 m/s2) (Figura 1M).
- Por fim, converta a força calculada em pressão (força/área) em quilopascal (kPa) dividindo a força medida pela área superficial da ponta do filamento(Figura 1M). Para calcular a área, converta o diâmetro dos diferentes filamentos de nitinol de polegadas (0,04", 0,06 e 0,08") em centímetros. Em seguida, πr2 (onde, r = o raio de filamento nitinol) determina a área (ver Figura 1M). A preparação de várias sondas usando filamentos de diferentes diâmetros e comprimentos gerará um conjunto completo abrangendo a faixa responsiva das larvas de Drosophila (conjunto amostral mostrado na Figura 1N).
NOTA: Verifique cada sonda mecânica pelo menos a cada 3-4 semanas. Quando a pressão se desvia em mais de ± 3% da medida original, uma nova sonda mecânica deve ser fabricada.
2. Preparação de larvas
- Aumentar a cepa de controle(w1118) progêneria larva ou larvas contendo o transgenes ppk-Gal4>UAS-mCD8-GFP (para visualizar danos aos neurônios sensoriais) em alimentos padrão em uma incubadora de 25 °C. Normalmente, os estoques são mantidos rotineiramente a 18 °C, mas tanto os pais quanto os filhotes larvais são criados a 25 °C em alimentos padrão de farinha de milho para experimentos.
NOTA: Moscas adultas (cinco machos e dez fêmeas, proporção 1:2) são mantidas nos frascos de mosca, para permitir a colocação de ovos, por cerca de 24 h. O tempo após a colocação do ovo (AEL) começa a partir de quando os adultos são removidos. - Colete a terceira larva instar, depois de aproximadamente 96 h de colocação de ovos, esguichando suavemente a água da torneira para o alimento de mosca macia contendo as larvas. Larvas errantes que deixaram a comida, ou que já se formaram em espirros anteriores ou posteriores, são muito grandes/velhas para este ensaio. As segundas larvas instar (~ menos de 4 mm de comprimento) são muito pequenas.
- Despeje o conteúdo do alimento de mosca macia em uma placa Petri de tamanho padrão limpo (100 mm x 15 mm).
- Usando fórceps, classificar o meio do terceiro instar, tamanho médio, larvas (ver Figura 2A) de larvas menores (segunda instar e terceira instar) ou larvas maiores (tardia ou errante terceira estrela). Recomenda-se manipulação suave com fórceps para evitar qualquer dano tecidual às larvas.
NOTA: A transferência utilizando fórceps é baseada principalmente na tensão da água e não aplicando pressão nas larvas com as lâminas dos fórceps. Uma alternativa ao uso de fórceps para manobras de larvas são pincéis de tinta macia. Com qualquer ferramenta, o usuário deve praticar a transferência dos animais, para não causar danos teciduais não intencionais que possam complicar as medidas comportamentais. - Transfira o terço médio das larvas instar, usando fórceps, para uma pequena placa de Petri (30 mm x 15 mm) contendo um pequeno plugue de alimentos de mosca umedecidos com água em temperatura ambiente. Mantenha as larvas na pequena placa de Petri até que os experimentos sejam realizados, mas não mais do que 20 minutos.
NOTA: Geralmente, a transferência de 20 a 30 larvas para o plugue alimentar dará um número adequado para 20 minutos de ensaios comportamentais.
3. Ensaio de nocicepção mecânica
- Coloque uma larva instar de meio terço (usando fórceps) em uma almofada fina de vinil preto ou escuro sob um estereóscópio de campo brilhante. A cor escura proporciona contraste que melhora a visualização da larva. É preferível ter um pedaço livremente móvel de vinil escuro porque permite ao usuário alinhar a larva sem tocá-la ou machucá-la.
- Coloque as luzes de fibra óptica entre as lentes objetivas do microscópio e a almofada de vinil preto ou escuro; isso permitirá uma iluminação adequada de alto contraste para ver a larva.
- Descarte larvas que não apresentem locomoção normal após a transferência para a almofada. Estes podem interferir com a resposta comportamental nociceptiva normal. Para locomoção normal, consulte Vídeo 1.
- Limpe, usando uma toalha de papel, qualquer excesso de água ao redor da larva que possa fazer com que a larva flutue na almofada de vinil.
- Oriente a larva movendo a almofada de vinil escuro. A cabeça/boca da larva deve apontar para a esquerda se você for destro e vice-versa se você for canhoto(Figura 2A-B).
- Aplique a sonda mecânica escolhida, tipicamente para 1-2 s, no lado dorsal posterior da larva no segmento aproximadamente abdominal A8 (ver Figura 2B),até que a sonda dobre e provoque a quantidade de pressão previamente medida(Figura 2C). É importante que a sonda pressione contra a superfície dorsal da larva e comprime as larvas na almofada subjacente no ponto de contato da sonda.
NOTA: No ponto de contato entre a ponta do filamento nitinol e a cutícula dorsal-epiderme, sondas inferiores a 2.300 kPa, dobram principalmente sem penetrar na cutícula e nos tecidos subjacentes. Tais sondas raramente afetam a mortalidade larval4. Em pressões mais altas (>5.000 kPa) as sondas dobram e, ocasionalmente, penetram na cutícula e nos tecidos subjacentes. A puncturação das larvas prejudica a sobrevivência larval4 e, se observadas, essas larvas são tipicamente descartadas a partir da análise comportamental. - Regisso responsável por cada larva. Uma resposta nociceptiva positiva (Vídeo 2) é indicada se a larva mostra um rolo completo de 360° ao longo do eixo de seu corpo dentro de 3 s. Outras respostas (tentando girar, rastejar rápido e balançando) são consideradas negativas para os propósitos deste ensaio.
NOTA: Larvas estimuladas com estímulo mecânico sublocante (200 kPa) não provocaram a resposta nociceptiva ou rolando típica(Vídeo 3). Algumas larvas apresentaram respostas rápidas para a frente ou de toque leve, como mudanças na direção do movimento. - Descarte a larva e prepare a próxima para o ensaio, repetindo as etapas 3.1 a 3.7.
- Repetição de passos 3.1-3.7 até que o número desejado de larvas seja atingido (três a seis conjuntos de n = 10 larvas foram usadas aqui para cada sonda).
NOTA: Ao usar sondas mecânicas de pressão mais baixa (174-462 kPa), o ensaio levará mais tempo por larva. Isso porque a ponta de filamentos mais longos oscila mais, tornando mais difícil cutucar a larva no centro do segmento A8. A prática é necessária com essas sondas.
4. Microscopia confocal para avaliar morfologia neuronal
- Coloque uma larva (de genótipo ppk-Gal4>UAS-mCD8-GFP para rotular neurônios sensoriais) previamente estimulada com um filamento de nitinol em uma câmara de etherização dentro de um frasco de Coplin contendo um béquer de 10 mL carregando uma bola de algodão encharcada com ~1 mL de éter dietil. Deixe a larva sentar na câmara por ~5 min.
NOTA: Um protocolo detalhado para etherização é fornecido em um estudo anterior publicado pelo nosso grupo12. - Enxágüe a larva suavemente da câmara de etherização em uma pequena placa de Petri.
- Tenha pronto um slide de microscópio, duas pequenas tampas (22 x 22 mm) e um deslizamento de tampas longos (22 x 54 mm) (ver Tabela de Materiais).
- Adicione pequenas gotas de solução de éter:óleo (proporção 1:5 de éter etílico à solução de óleo de halocarbono, consulte Tabela de Materiais) em ambas as extremidades do slide e, em seguida, coloque as pequenas tampas em cima das pequenas gotículas. Este arranjo cria uma pequena lacuna de espaço onde a larva pode caber.
NOTA: Pressione as pequenas tampas contra o deslizamento do microscópio até que seja difícil escorregar. - Adicione algumas gotas de solução de éter:óleo no meio do slide do microscópio e, em seguida, coloque a larva, usando fórceps, no centro do slide do microscópio (entre as pequenas tampas). Certifique-se de que o eixo anteroposterior da larva é paralelo ao lado curto do slide e que o lado dorsal está voltado para cima.
- Cubra as larvas com o longo deslizamento de cobertura colocado em cima da larva e as duas tampas menores.
NOTA: Pressione generosamente a tampa longa até que a larva esteja quase plana. - Segmento de imagem A8 da larva usando um microscópio confocal (ver Tabela de Materiais) usando comprimento de onda laser 488 (GFP).
NOTA: Imagem da larva imediatamente porque a anestesia via éter desaparecerá rapidamente (~5-10 min) e a larva acordará e se moverá, o que complicará mais imagens. - Capture imagens de pilha Z em uma resolução de 1024 x 1024 pixels usando uma abertura numérica de 20x (NA) 0,7 lente objetiva seca a 1x de zoom, tamanho da etapa de 1,5 μm.
5. Quantitação de danos teciduais
- Colete e converta as imagens de pilha da série Z, da seção 4.8, em uma única projeção Z (um achatamento de múltiplas imagens tiradas em diferentes planos focais em uma única imagem composta). Isso pode ser realizado usando software comercialmente disponível (por exemplo, Olympus Fluoview) ou qualquer plataforma de código aberto equivalente, por exemplo, Fiji/Image J. Salve a projeção Z única no formato TIFF.
- Abra o programa de análise de imagens Fiji/ImageJ.
- Clique em Arquivo, na barra de menu e selecione Abrir na janela que é exibida.
- Selecione a projeção de imagem única armazenada, salva no formato TIFF, a ser analisada.
- Clique em Editar, na barra de menu e selecione a opção Inverter na janela que é exibida.
- Clique na imagem, na barra de menu, em seguida, selecione Ajustar, na janela que é exibida e, finalmente, selecione a opção Brilho/Contraste.
- Selecione a opção Forma à mão livre na barra de ferramentas para medir a área da lacuna (se houver).
- Clique em Analisar, na barra de menu, e selecione a opção Medir. Isso mostrará a área da abertura ou ferida.
Resultados
Desenvolvemos sondas mecânicas personalizadas, utilizando filamentos nitinol(Figura 1A,N),para obter comportamentos mecanicamente evocados e geramos uma curva completa de resposta de dose comportamental usando sondas mecânicas inócuas e nociiosas de intensidade variada(Figura 2D) demonstrando que essas sondas podem ser usadas para estudar a linha de base (na ausência de lesão) nocicepção mecânica.
Nossos resultados de ensaio comportamental determinaram que as sondas que exercem pressões abaixo de 200 kPa (~1,57 mN)(Figura 1M), quando aplicadas às larvas de Drosophila, não provocam uma resposta de rolamento aversiva(Figura 2D e Vídeo 3). Como esperado, essas sondas mecânicas subtenindo ou não nocivas (175 kPa ou 200 kPa) não provocaram danos visíveis no tecido neuronal(Figura 2E). Por não induzirem danos, tais sondas podem ser úteis para avaliar a aodínia mecânica (hipersensibilidade a um estímulo mecânico normalmente não nocivo). Por outro lado, testes suprathreshold ou nocivos (de 462 kPa a 5.116 kPa), provocaram uma resposta comportamental aumentada(Figura 2D) de forma dependente de dose — com as pressões mais altas provocando respostas comportamentais mais fortes. Como previsto, a pressão mecânica suprathreshold também induziu danos teciduais dependentes de dose aos próprios neurônios sensoriais periféricos(Figura 2E). A área medida de dano tecidual (em μm2 ± desvio padrão) retirada de quatro larvas para cada grupo foram: 2.051,03 ± 703,81 (462 kPa), 5.102.02.03.03.81 (462 kPa), 5.102.02.29 ± 1.004,67 (2.283 kPa) e 12.238,83 ± 3.724,11 (5.116 kPa). Assim, pressões maiores ou iguais a 462 kPa (~63 mN), que evocam uma resposta de rolamento aversiva (em 25% ou mais das larvas) e causam danos visíveis no tecido neuronal(Figura 2E),poderiam ser apropriadas para estudar hiperalgesia mecânica (hipersensibilidade a estímulos mecânicos normalmente nocivos). Sondas mecânicas nociceptivas (≥462 kPa) sempre induzem danos teciduais (n = 10, avaliados qualitativamente), mas nem sempre provocam uma resposta de rolamento aversiva.
Para avaliar a hipersensibilidade mecânica (aodínia e hiperalgesia), utilizou-se um modelo larval drosophila bem estabelecido de sensibilização nociceptiva que usa irradiação de luz ultravioleta (UV) para induzir danos teciduais7,12. Este ensaio ajudou a dissecar os mecanismos genéticos e celulares da hipersensibilidade nociceptiva térmica8,9,10,13,14,15. Para determinar se o tratamento UV causa a aodínia mecânica, o controle médio da terceira instar(w1118) larvas foram irradiadas simuladas ou irradiadas UV (15-20 mJ/cm2)(Figura 3A). Em seguida, as larvas foram testadas comportamentalmente às 2h, 4h, 8h, 16 h e 24h após o tratamento com uma sonda mecânica normalmente sub-ressarada (200 kPa, 1,57 mN). Aproximadamente 20% das larvas responderam logo às 2h após o tratamento UV, enquanto 50% responderam às 4h, contra 6,6% e 8,3% simularam animais irradiados por UV, respectivamente(Figura 3B). Isso indica que danos teciduais induzidos por UV causam aodínia mecânica a 4h após a irradiação. Em tempos posteriores (8h, 16 h e 24h) a resposta comportamental das larvas tratadas com UV foi na faixa de 16%-20% de respondentes (média de n = 3-6 conjuntos de 10 larvas cada), ligeiramente aumentada (mas não estatisticamente significativa) em comparação com o grupo de controle irradiado simulado (na faixa de 3%-6% dos respondentes, média média de n = 3-6 conjuntos de 10 larvas cada) (Figura 3B).
Para investigar a hiperalgesia mecânica, foi utilizada uma pressão suprathreshold (462 kPa, 3,63 mN), que normalmente induz uma resposta aversiva em ~20% das larvas(Figura 2D) e causa danos no tecido neuronal(Figura 2E). Aplicamos a sonda de 462 kPa no lado dorsal das larvas com ou sem danos teciduais induzidos por UV(Figura 3A). Descobrimos que as larvas sondadas às 4h, 8 h e 16h após o tratamento UV apresentaram um aumento significativo na resposta aversiva, sendo 4h o pico da hipersensibilidade comportamental (~60% responsivo); animais irradiados por UV simulados mostraram ~27% de resposta aversiva(Figura 3C). Semelhante à aodínia mecânica, a resposta comportamental às 8h, 16 h e 24h de animais tratados com UV (na faixa de 36%-42%) foi estatisticamente indistinguível das larvas não tratadas (na faixa de 20%a 26%). Larvas no final do terceiro estágio instar mostraram uma ligeira diminuição da resposta comportamental da linha de base quando comparada com o terceiro estágio instar médio. Nós imaginamos que isso pode ser pelo aumento do tamanho das larvas (Figura 2A) ou pelo aumento da espessura da cutícula que cobre o corpo. Esse fato poderia explicar por que, em um estágio posterior de desenvolvimento, o tratamento UV não induz maior sensibilização mecânica, como observado 4h pós tratamento UV.
Juntos, nossos resultados indicam que as larvas de Drosophila desenvolvem ligas mecânicas e hiperalgesia mecânica após danos teciduais induzidos por UV. O horário de pico da aodínia mecânica e hiperalgesia é o mesmo, 4h após o tratamento UV; no entanto, a hiperalgesia mecânica tem uma cauda temporal mais pronunciada à medida que retorna à linha de base mais lentamente em comparação com a aodínia mecânica.

Figura 1: Desenvolvimento de uma ferramenta semelhante a Von Frey para avaliar o nocicepção mecânica em larvas de Drosophila. (A) Imagem de uma sonda mecânica usada para estudar nocicepção mecânica em larvas de Drosophila. (B) Filamentos de nitinol e seus diâmetros relativos são mostrados em escala relativa. (C) Imagem do cortador de arame diagonal usado para cortar os filamentos de nitinol. (D) Suavizar as bordas afiadas do filamento nitinol cortado com uma pedra afiada. (E) Agulha hipodérmica usada para fazer um buraco na alça do palito de picolé de madeira da sonda. A ponta da agulha precisa atingir pelo menos metade da altura da vara de alça para inserção segura do filamento. (F-G) Fixação do filamento nitinol colando em uma alça de palito de picolé de madeira com orifício de inserção. (H-L) Calibração de sondas mecânicas pressionando-as contra uma balança. (M) Valores de força (em mN) e pressão (em kPa) gerados por diferentes sondas mecânicas. O comprimento de cada filamento nitinol usado para construir as sondas (P1-P10; P: sonda) é detalhada em centímetros (cm). (N) Uma imagem de um conjunto completo de sondas mecânicas, variando de 174 kPa a 5.116 kPa. Clique aqui para ver uma versão maior desta figura.

Figura 2: Ensaio de nocicepção mecânica: Filamentos semelhantes a Von Frey geram uma curva dose-resposta do comportamento de rolamento aversivo e causam danos teciduais aos neurônios sensoriais. (A) Fotos dos diferentes estágios (segunda e terceira instar) das larvas de Drosophila. Barra de escala: 2 mm. (B) Desenho animado da vista dorsal da terceira larva instar Drosophila. O ponto vermelho indica o segmento abdominal onde a sonda mecânica é aplicada. T: segmento torácico; A: segmento abdominal. Outros marcos anatômicos são rotulados. (C) Desenho animado do ensaio: Uma sonda mecânica é aplicada no lado dorsal da larva até que se dobra contra a superfície abaixo e, em seguida, é mantida por 2 s. Se a pressão for suficientemente alta, isso provoca uma resposta aversiva ao ser liberada. (D) Resposta à dose comportamental; cada ponto azul representa a porcentagem de larvas que responderam, com rolamento aversivo, à estimulação mecânica dentro de um conjunto de 10 animais. Gráfico de violino da porcentagem de comportamento aversivo de rolamento induzido por diferentes sondas mecânicas. kPa: kilopascals. As parcelas da caixa representam medianas (verdes), os bigodes (vermelho) representam os percentis 10 e 90. (E) Danos teciduais: Terceira larva instar (do genótipo ppk-Gal4>UAS-mCD8-GFP para rotular neurônios sensoriais nociceptivos) foram sondadas no segmento dorsal A8 com as pressões indicadas. Os neurônios sensoriais classe IV com a classe IV (através da linha dorsal) foram então examinados (ver seções 4 e 5). As áreas brancas (asteriscos vermelhos) representam lacunas ou danos teciduais. Barra de escala: 100 μm. No painel B, a larva é mostrada na visão dorsal, enquanto em C é a visão lateral. Sondas mecânicas pressionadas contra o lado da cutícula dorsal-epiderme da larva produzem uma depressão semelhante ao bolso no ponto de contato da ponta da sonda e das áreas circundantes. A linha preta sólida curvada em direção ao lado ventral é a parte superior do bolso, enquanto a linha lateral cinza tracejada representa o lado lateral e a parte inferior do bolso. Clique aqui para ver uma versão maior desta figura.
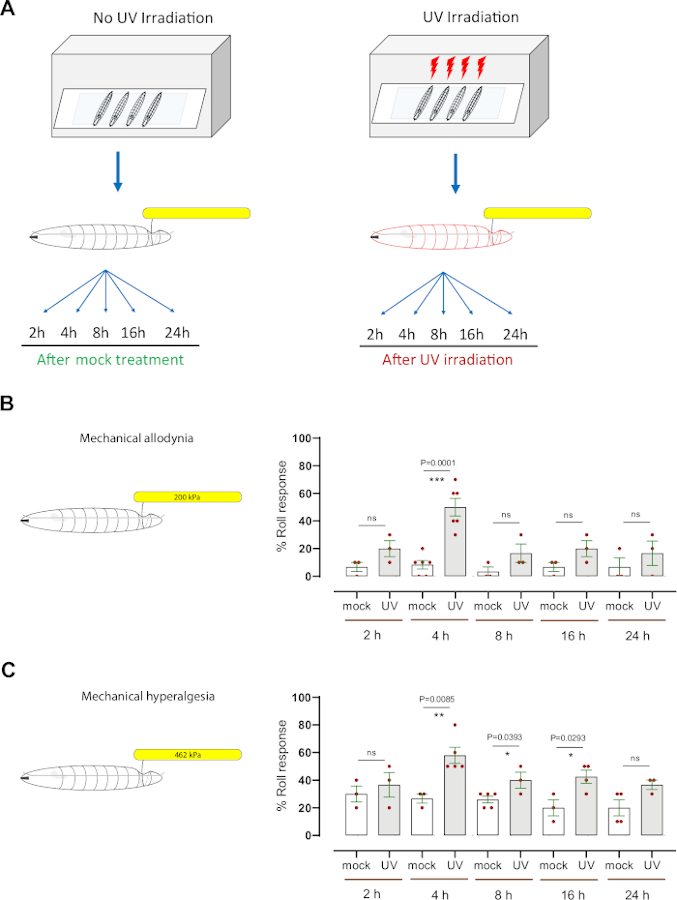
Figura 3: Hipersensibilidade mecânica após dano uv. (A) Esquema do projeto experimental para testar a sensibilização. A instar do terço médio foi tratada simulada (não-UV) ou UV irradiada. O ensaio de nocicepção mecânica foi então realizado em diferentes pontos de tempo (2h, 4h, 8h, 16h e 24h) após tratamento simulado ou irradiação. (B) Alodinia mecânica: A porcentagem de larvas que exibem rolamento aversivo após sondagem com um estímulo mecânico normalmente subtenido ou não nocivo (200 kPa, 1,57 mN) nos pontos de tempo indicados após o mock-treatment ou irradiação UV. (C) Hiperalgesia mecânica: A porcentagem de larvas que apresentam rolamento aversivo após sondagem com um normalmente suprathreshold ou estímulo mecânico nocivo (462 kPa, 3,63 mN) nos pontos de tempo indicados após o mock-treatment ou irradiação UV. As barras de erro indicam que o teste tnão remunerado de duas caudas foi utilizado para análise estatística: *p < 0,05, **p < 0,01; ns: não significativo. Cada ponto vermelho, nos painéis B e C, representa a proporção média de 10 larvas, n = 3-6 conjuntos por ponto/condição. Clique aqui para ver uma versão maior desta figura.
Vídeo 1: Locomoção normal de larvas de Drosophila. Clique aqui para baixar este vídeo.
Vídeo 2: Estimulação mecânica nociva de larvas de Drosophila. Clique aqui para baixar este vídeo.
Vídeo 3: Estimulação mecânica subthreshold de larvas de Drosophila. Clique aqui para baixar este vídeo.
Discussão
Modificamos um ensaio mecânico estabelecido1,2,16 utilizando sondas mecânicas personalizadas fabricadas a partir de filamentos de nitinol. Esta liga metálica nos permite usar filamentos de diâmetro menor que são apropriados para o tamanho das larvas de Drosophila. Monofilamentos baseados em linha de pesca dominaram o campo de nocicepção mecânica de moscas até as2,5,6,16. Nossos filamentos nitinol mantêm sua forma e mediram a pressão por aproximadamente ~3-5 meses (em nossa experiência). Variando o comprimento e o diâmetro dos filamentos de nitinol, o usuário pode gerar uma ampla gama de pressões que abrangem desde sub-retenção até uma resposta de rolamento quase completa. Em particular, fazer sondas de sub-retenção é mais simples com os filamentos nitinol de menor diâmetro. Usando essas sondas, descobrimos que a pressão, em vez de força, provoca respostas comportamentais não-defensivas mais consistentes4. Demonstramos aqui, usando um modelo de sensibilização nociceptiva induzida por UV bem estabelecidomodelo 7,10,13, que esses filamentos também são uma ferramenta útil para estudar a hipersensibilidade mecânica — a allodynia e a hiperalgesia.
Estudos anteriores utilizando sondas mecânicas fabricadas a partir da linha de pesca levaram a uma certa variabilidade na responsividade comportamental2,6,16,17. Vários fatores podem explicar isso. Primeiro, como a pressão é a variável importante, o polimento da ponta de filamento para que ela seja arredondada e não tenha bordas afiadas é fundamental. Em segundo lugar, relatar valores de pressão em vez de apenas força é importante para a reprodutibilidade dos experimentos, pois diferentes sondas mecânicas que geram forças semelhantes podem provocar pressões díspares4. Em terceiro lugar, é fundamental aplicar apenas uma estimulação mecânica por larva usando sondas nocivas, pois tais sondas produzem um dano tecidual dependente de dose nos níveis epidérmico4 e neuronal sensorial(Figura 2E). Um segundo ou subsequente estímulo mecânico nocivo, após danos teciduais induzidos, poderia, concebivelmente, prejudicar a função dos neurônios sensoriais periféricos afetados e provocar uma resposta comportamental alterada. Em outro estudo, as larvas estimuladas duas vezes com sondas mecânicas nocivas apresentaram principalmente uma resposta comportamental aprimorada5,sugerindo o desenvolvimento de uma sensibilização mecânica aguda (hiperalgesia), que pode resultar do dano tecidual provocado pelo primeiro estímulo mecânico nocivo. Por outro lado, outros autores6 relataram uma resposta comportamental mista (aumentada ou diminuída), indicando que a resposta comportamental alterada pode ser devido a danos/disfunção do tecido neuronal. Estimular cada larva apenas uma vez elimina uma possível variância nas respostas comportamentais resultantes da sensibilização ou dano tecidual. Em quarto lugar, estimulamos mecanicamente o segmento A8, que é mais posterior do que estudos anteriores (áreas preferenciais A3-A4)2,5,16. As sondas entre ~3.900 kPa e 5.300 kPa aplicadas no segmento A2 ou A8 não mostraram diferenças comportamentais4. Além disso, o A8, comparado ao A2-A4, é mais fácil de estimular com sondas mecânicas que geram pressões mais baixas (<300 kPa) porque a larva é mais fina nesta região e, portanto, mais facilmente compactada. Outros estudos mostraram que a estimulação mecânica nociva da extremidade posterior da larva (fornecida por um pino de inseto rígido, mantida com fórceps) evocava principalmente a locomoção para a frente, em vez de uma resposta aversiva ou rolando18. Essa resposta comportamental diferente pode ser devido a diferenças nas propriedades dos materiais usados (filamento nitinol flexível versus pino de inseto incompressível) ou a diferentes pressões entregues às larvas (o valor de pressão do pino de inseto não foi relatado).
O desenvolvimento de um ensaio mecânico de nocicepção para larvas de Drosophila permitiu que o campo descobrisse que diferentes canais de íons sensoriais mecânicos e circuitos neurais mediam a nocicepção mecânica5,6,16,17. No entanto, o estudo da hipersensibilidade mecânica (aodínia e hiperalgesia) tem defasado, comparado à sensibilização das outras modalidades sensoriais — calor7,8,10,13,14, frio9e químico3. Essa defasagem pode ser devido, em parte, à ausência de sondas mecânicas adequadas que podem gerar uma faixa de resposta completa que abrange sublocações a pressões suprathreshold. De particular importância, especialmente para avaliar a alodynia mecânica, são sondas sub-retenção que não provocam uma resposta aversiva de larvas não feridas. O significado de nossas sondas mecânicas melhoradas é que elas podem ser fabricadas para abranger estímulos inócuos (subthreshold ~174 kPa-200 kPa) ou a faixa nociva de baixa a alta (suprathreshold ~225 kPa a ~5.116 kPa). Aqui, demonstramos usando os filamentos nitinol von Frey que as larvas de Drosophila desenvolvem tanto a allodinia mecânica quanto hiperalgesia mecânica após a irradiação UV. A sensibilização mecânica mostra algumas diferenças quando comparadas à sensibilização térmica. Tanto o início quanto o pico de sensibilização mecânica é anterior (~4 h) em comparação com a sensibilização térmica (calor) (~8 h para hiperalgesia e ~24 h para a allodynia)7. Além disso, a aodínia mecânica e a hiperalgesia são concomitantes (ambos com pico de ~4 h). Além disso, enquanto a sensibilização do calor (liga e hiperalgesia) resolve completamente nos pontosposteriores 7, a hipersensibilidade mecânica exibiu uma cauda longa que permaneceu ligeiramente acima da linha de base. A sensibilização a frio em Drosophila envolve uma mudança nos comportamentos evocados a frio9 e o surgimento de novos comportamentos evocados a frio — um fenômeno que não é observado com estimulação mecânica. Essas diferenças de início, duração e comportamentos observados sugerem que cada modalidade sensorial pode ser controlada por diferentes vias de sinalização. A combinação do ensaio de sensibilização aqui descrito com as poderosas ferramentas genéticas disponíveis em Drosophila deve permitir uma dissecção genética precisa da hipersensibilidade mecânica (aodínia e hiperalgesia) observada.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos a Thomas Wang por desenvolver o protótipo de filamentos von Frey, Patrick J. Huang por melhorar o ensaio da sonda mecânica, o Bloomington Drosophila Stock Center para o controle (w1118) e ppk-Gal4>UAS-mCD8-GFP, e os membros do laboratório Galko para ler criticamente o manuscrito. Este trabalho foi apoiado por R21NS087360 e R35GM126929 para MJG.
Materiais
| Name | Company | Catalog Number | Comments |
| Beaker | Fisher Scientific | 02-540C | Beaker of 10 ml of capacity. Any similar container will do. |
| Black (Arkansas) bench stone | Dan’s Whetstone | SKU: I200306B24b-HQ-BAB-622-C | Used to smoothe any irregularities of the nitinol wire tips. https://www.danswhetstone.com/product/special-extra-wide-black-bench-stone-6-x-2-1-2-x-1-2/ |
| Confocal microscope | Olympus | FV1000 | Any equivalent confocal microscope will do |
| Coplin Jar | Fisher Scientific | 08-816 | https://www.fishersci.com/shop/products/fisherbrand-glass-staining-dishes-10-slides-screw-cap/08816#?keyword=08-816 |
| Diethyl ether | Fisher Scientific | E138-500 | For anesthetizing larvae. |
| Etherization chamber | This is a homemade customized chamber. Please see details of its construction in our previous published paper12. The purpose of the etherization chamber is allow entry of diethyl ether fumes but prevent larval escape. | ||
| Fiber Optic Light Guide | Schott AG | A08575 | Schott Dual Gooseneck 23 inch |
| Forceps | Fine Science Tool | FS-1670 | For transferring larvae |
| Glue | Aleene's | N/A | Aleene's® Wood Glue, formerly called (Aleene's All-Purpose Wood Glue) https://www.aleenes.com/aleenes-wood-glue |
| Graspable holder | Loew Cornell | N/A | Loew-Cornell Simply Art Wood Colored Craft Sticks, 500 pieces. |
| Halocarbon oil 700 | Sigma | H8898-100ML | |
| Hypodermic needle 30G 1/2"L | Fisher Scientific | NC1471286 | BD Precisionglide® syringe needles, gauge 30, L 1/2 inches. Used to make a hole into the wooden holder for the nitinol wires |
| Large Petridish | Falcon | 351007 | 60 mm x 10 mm Polystyrene Petridish |
| Microscope (Zeiss) Stemi 2000 | Carl Zeiss, Inc. | NT55-605 | Any equivalent microscope will do |
| Microscope Cover Glass 22x22 | Fisher | 12-545-B | |
| Microscope Cover Glass 22x40 | Corning | 2980-224 | Tickness 1 1/2 |
| Microscope Slides | Globe Scientific Inc. | 1358Y | |
| Mini Diagonal Cutter | Fisher Scientific | S43981 | For cutting nitinol filaments |
| Nitinol filaments, Diameters: 0.004”, 0.006”, 0.008” | Mailin Co | N/A | Fifteen pieces of each diameter of 12” length were ordered. https://malinco.com/ |
| Piece of black vinyl | Office Depot | N/A | We use a small piece of vinyl cut from a binder. Dark color provides contrast. A small piece allows orientation of the larva |
| Small Petridish | Falcon | 351008 | 35 mm x 10 mm Polystyrene Petridish |
| Spatula | Fisher Scientific | 21-401-10 | Double-Ended Micro-Tapered Stainless Steel Spatula. Used to place the food in the petri dish |
| Wipes | Fisher Scientific | 06-666A | Kimpes KMTECH, Science Brand. Used to dry larvae of excess moisture. |
| W1118 | Bloomington Drosophila Stock Center | 3605 | Control strain for behavioral assays |
| ppk-Gal4>UAS-mCD8-GFP | Bloomington Drosophila Stock Center | 8749 | Strain for fluorescent labeling of class IV md neurons |
Referências
- Tracey, W. D., Wilson, R. I., Laurent, G., Benzer, S. Painless, a Drosophila gene essential for nociception. Cell. 113 (2), 261-273 (2003).
- Zhong, L., Hwang, R. Y., Tracey, W. D. Pickpocket is a DEG/ENaC protein required for mechanical nociception in Drosophila larvae. Current Biology. 20 (5), 429-434 (2010).
- Lopez-Bellido, R., Himmel, N. J., Gutstein, H. B., Cox, D. N., Galko, M. J. An assay for chemical nociception in Drosophila larvae. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 374 (1785), 20190282(2019).
- Lopez-Bellido, R., et al. Growth factor signaling regulates mechanical nociception in flies and vertebrates. Journal of Neuroscience. 39 (30), 6012-6030 (2019).
- Hu, C., et al. Sensory integration and neuromodulatory feedback facilitate Drosophila mechanonociceptive behavior. Nature Neuroscience. 20 (8), 1085-1095 (2017).
- Kim, S. E., Coste, B., Chadha, A., Cook, B., Patapoutian, A. The role of Drosophila Piezo in mechanical nociception. Nature. 483 (7388), 209-212 (2012).
- Babcock, D. T., Landry, C., Galko, M. J. Cytokine signaling mediates UV-induced nociceptive sensitization in Drosophila larvae. Current Biology. 19 (10), 799-806 (2009).
- Babcock, D. T., et al. Hedgehog signaling regulates nociceptive sensitization. Current Biology. 21 (18), 1525-1533 (2011).
- Turner, H. N., Patel, A. A., Cox, D. N., Galko, M. J. Injury-induced cold sensitization in Drosophila larvae involves behavioral shifts that require the TRP channel Brv1. PloS One. 13 (12), 0209577(2018).
- Im, S. H., et al. Tachykinin acts upstream of autocrine Hedgehog signaling during nociceptive sensitization in Drosophila. eLife. 4, 10735(2015).
- Cervero, F., Merskey, H. What is a noxious stimulus. Pain Forum. 5 (3), 157-161 (1996).
- Chattopadhyay, A., Gilstrap, A. V., Galko, M. J. Local and global methods of assessing thermal nociception in Drosophila larvae. Journal of Visualized Experiments: JoVE. (63), e3837(2012).
- Follansbee, T. L., et al. Drosophila nociceptive sensitization requires BMP signaling via the canonical SMAD pathway. Journal of Neuroscience. 37 (35), 8524-8533 (2017).
- Im, S. H., Patel, A. A., Cox, D. N., Galko, M. J. Drosophila insulin receptor regulates the persistence of injury-induced nociceptive sensitization. Disease Models & Mechanisms. 11 (5), (2018).
- Jo, J., et al. Drosophila caspase activity is required independently of apoptosis to produce active TNF/Eiger during nociceptive sensitization. Cell Death & Disease. 8 (5), 2786(2017).
- Hwang, R. Y., et al. Nociceptive neurons protect Drosophila larvae from parasitoid wasps. Current Biology. 17 (24), 2105-2116 (2007).
- Guo, Y., Wang, Y., Wang, Q., Wang, Z. The role of PPK26 in Drosophila larval mechanical nociception. Cell Reports. 9 (4), 1183-1190 (2014).
- Takagi, S., et al. Divergent connectivity of homologous command-like neurons mediates segment-specific touch responses in Drosophila. Neuron. 96 (6), 1373-1387 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados