Method Article
Un test amélioré et des outils pour mesurer la nociception mécanique chez les larves de Drosophila
Dans cet article
Résumé
Le but de ce protocole est de montrer comment effectuer un essai amélioré pour la nociception mécanique chez les larves de Drosophila. Nous utilisons l'analyse ici pour démontrer que l'hypersensibilité mécanique (allodynie et hyperalgésie) existe chez les larves de Drosophila.
Résumé
Les analyses publiées pour la nociception mécanique dans Drosophila ont mené aux évaluations variables du comportement. Ici, nous avons fabriqué, pour une utilisation avec des larves de Drosophila, des filaments en alliage nickel-titane métal personnalisé (nitinol). Ces sondes mécaniques sont similaires aux filaments von Frey utilisés chez les vertébrés pour mesurer la nociception mécanique. Ici, nous démontrons comment fabriquer et calibrer ces sondes mécaniques et comment générer une dose-réponse comportementale complète des stimuli subthreshold (gamme anodine ou non nocive) aux stimuli suprathreshold (gamme nocive basse à élevée). Pour démontrer l'utilité des sondes, nous avons étudié l'hypersensibilité induite par les lésions tissulaires chez les larves de Drosophila. L'allodynie mécanique (hypersensibilité à un stimulus mécanique normalement inoffensif) et l'hyperalgésie (réactivité exagérée à un stimulus mécanique nocif) n'ont pas encore été établies chez les larves de Drosophila. À l'aide de sondes mécaniques normalement anodines ou de sondes qui provoquent généralement un comportement aversif, nous avons constaté que les larves de Drosophila développent une hypersensibilité mécanique (allodynie et hyperalgésie) après des lésions tissulaires. Ainsi, les sondes mécaniques et l'analyse que nous montrons ici seront probablement des outils importants pour disséquer les mécanismes moléculaires/génétiques fondamentaux de l'hypersensibilité mécanique.
Introduction
Les larves de drosophile présentent un comportement de roulement aversif caractéristique lorsqu'elles sont exposées à différents stimuli nocifs :thermique 1,mécanique 2etchimique 3. Ce comportement est clairement distinct de la locomotion normale. Ici, nous décrivons un essai mécanique amélioré qui peut être utilisé pour évaluer la nociception mécanique et la sensibilisation mécanique.
Dans une étude récente, nous avons fabriqué des filaments de von Frey à l'aide de fils nitinol4. Des sondes exerçant des forces et des pressions différentes ont été faites en variant les longueurs et les diamètres des fils nitinol formant chaque sonde. Les sondes mécaniques ont été calibrées et les valeurs de force mesurées (en millinewton, mN) ont été converties en pression (kilopascal, kPa), en fonction de la zone de pointe dechaque sonde 4. La fabrication personnalisée de sondes mécaniques nous a permis de générer des pressions subthreshold (≤200 kPa) à suprathreshold (225 kPa à 5318 kPa), ce qui pourrait, en principe, être bénéfique pour l'étude de l'hypersensibilité mécanique. En utilisant ces filaments mécaniques améliorés de von Frey- comme, nous avons montré quela pression 4, par opposition à la forceprécédemment examinée 2,5,6 corrèle plus uniformément avec la réactivité comportementale aversive dans les larves de Drosophila. L'analyse mécanique améliorée décrite ici a également aidé à identifier un facteur de croissance endothélial vasculaire conservé (VEGF) récepteur tyrosine kinase signalant une voie qui régule la nociception mécanique chez les mouches et les rats4.
L'allodynie mécanique et l'hyperalgésie, deux modalités d'hypersensibilité, sont relativement sous-étudiées chez les larves de Drosophila, par rapport aux modalités thermiques (chaleur et froid) et sensorielleschimiques 3,7,8,9,10. Cela est probablement dû à l'absence de sondes mécaniques spécifiques qui s'étendent des stimuli inoffensifs à la gamme nociveélevée 2,5,6. Un stimulus normalement inoffensif qui provoque le comportement de roulement aversif typique après que les larves de Drosophila éprouvent des dommages detissu 3,7 est appelé allodynia. Une réponse exagérée de roulement à un stimulus typiquement nocif est connue sous le nom d'hyperalgésie7. Les stimuli nocifs sont définis comme ceux qui provoquent des lésions tissulaires et peuvent activer les nocicepteurs11. Les stimuli nocifs livrés aux larves de Drosophila endommagent soit l'épiderme barrière, les neurones sensoriels périphériques nociceptifs3,4,7,ou les deux.
Dans cet article, nous démontrons comment fabriquer et calibrer sur mesure des sondes mécaniques de type von Frey qui conviennent aux larves de Drosophila. En outre, nous montrons comment utiliser ces sondes pour apaiser les réponses mécaniques nociceptives chez les larves de Drosophila. Enfin, nous démontrons davantage l'utilité de ces sondes en les utilisant pour démontrer la présence d'hypersensibilité mécanique, à la fois allodynie et hyperalgésie, suite à des lésions tissulaires chez les larves de Drosophila (voir Résultats représentatifs).
Protocole
1. Construction mécanique de sonde
- Couper chaque filament nitinol (figure 1B), perpendiculaire à son long axe, à la longueur spécifiée (figure 1M-N ) àl'aided'un petit coupe-fil (Figure 1C). Les filaments sont de trois diamètres préédités différents (Figure 1B).
REMARQUE : Les longueurs spécifiées ici sont un guide pour atteindre les pressions approximatives indiquées, en utilisant un protocole similaire pour la construction de la monture. En fin de compte, quelle que soit la longueur de la coupe de filament et la profondeur du trou dans la monture, les filaments doivent être mesurés/calibrés sur un équilibre pour obtenir la valeur exacte de force/pression. - Examinez la pointe du filament sous un stéréomicroscope pour vous assurer qu'il ne reste pas de bords tranchants ou irréguliers, car ceux-ci pourraient endommager la peau des larves et interférer avec l'étalonnage.
- Lisser manuellement les bords tranchants de la sonde mécanique à l'aide d'une pierre d'affûtage jusqu'à ce qu'aucune irrégularité aiguë ne persiste (Figure 1D).
- Faire un trou vers l'extrémité d'un bâton de popsicle en bois (Figure 1E) à l'aide d'une aiguille hypodermique (voir tableau des matériaux). Insérez l'aiguille au moins à mi-hauteur du bâton de popsicle(figure 1E). Cela crée une chambre pour l'insertion du filament nitinol.
- Appliquez de la colle de bois sur un seul filament nitinol(figure 1F)et insérez le filament recouvert de colle dans la fente de l'aiguille dans un bâton de popsicle en bois (Figure 1G). Laisser sécher pendant ~5 h.
- Calibrer chaque sonde mécanique en la pressant contre une balance jusqu'à ce que la sonde mécanique se plie(figure 1H-L). C'est le point de force maximale qui peut être enregistré en grammes. Selon les diamètres de filament (prédéterminés) et les longueurs (déterminées par l'utilisateur), une gamme complète de forces et de pressions peut être générée.
- Convertir la masse enregistrée à l'étape 1.6 pour la forcer en millinewton (mN) en utilisant la formule f = ma (La force est égale à la masse multipliée par l'accélération gravitationnelle). f: force; m: masse; a: accélération gravitationnelle (9,8 m/s2) (Figure 1M).
- Enfin, convertir la force calculée en pression (force/zone) en kilopascal (kPa) en divisant la force mesurée par la surface de la pointe filament(figure 1M). Pour calculer la zone, convertir le diamètre des différents filaments nitinol de pouces (0,04 », 0,06 », et 0,08 ») en centimètres. Ensuite, δr2 (où, r = le rayon de filament nitinol) détermine la zone (voir la figure 1M). La préparation de plusieurs sondes à l'aide de filaments de diamètres et de longueurs différents générera un ensemble complet couvrant la plage réactive des larves de Drosophila (ensemble d'échantillons indiqué à la figure 1N).
REMARQUE : Vérifiez chaque sonde mécanique au moins toutes les 3 à 4 semaines. Lorsque la pression s'écarte de plus de ± 3 % par rapport à la mesure initiale, une nouvelle sonde mécanique doit être fabriquée.
2. Préparation des larves
- Augmenter la souche de contrôle (w1118) descendance larvaire ou les larves contenant les transgènes ppk-Gal4>UAS-mCD8-GFP (pour visualiser les dommages aux neurones sensoriels) sur les aliments standard dans un incubateur de 25 °C. En règle générale, les stocks sont régulièrement maintenus à 18 °C, mais les parents et les descendants larvaux sont élevés à 25 °C sur des aliments standard pour semoule de maïs pour des expériences.
REMARQUE : Les mouches adultes (cinq mâles et dix femelles, rapport de 1:2) sont conservées dans les flacons de mouche, pour permettre la ponte, pendant environ 24 h. Le temps après la ponte (AEL) commence à partir du moment où les adultes sont enlevés. - Recueillir les larves du troisième stade, après environ 96 h de ponte, en giclant doucement l'eau du robinet dans les aliments à mouche molle contenant les larves. Les larves errantes qui ont quitté la nourriture, ou qui ont everted spiracles antérieures ou postérieures, sont trop grandes /vieilles pour ce test. Les larves du deuxième stade (~ de moins de 4 mm de longueur) sont trop petites.
- Verser le contenu des aliments à mouche molle dans une boîte de Pétri de taille standard propre (100 mm x 15 mm).
- À l'aide de forceps, trier le milieu du troisième stade, de taille moyenne, les larves (voir la figure 2A)des larves plus petites (deuxième instar et début du troisième stade) ou plus grandes (troisième stade tardif ou errant). Une manipulation douce avec des forceps pour éviter tout dommage tissulaire aux larves est recommandée.
REMARQUE : Le transfert à l'aide de forceps est principalement basé sur la tension de l'eau et non sur l'application de pression sur les larves avec les lames des forceps. Une alternative à l'utilisation de forceps pour manœuvrer les larves est brosses à peinture douce. Avec l'un ou l'autre outil, l'utilisateur doit pratiquer le transfert des animaux, afin de ne pas causer de lésions tissulaires involontaires qui pourraient compliquer les mesures comportementales. - Transférer les larves du milieu du troisième stade, à l'aide de forceps, dans une petite boîte de Pétri (30 mm x 15 mm) contenant une petite prise de nourriture volante humidifiée avec de l'eau à température ambiante. Gardez les larves dans la petite boîte de Pétri jusqu'à ce que les expériences soient effectuées, mais pas plus de 20 minutes.
REMARQUE : En général, le transfert de 20 à 30 larves à la fiche alimentaire donnera un nombre suffisant pour 20 min d'analyses comportementales.
3. Essai mécanique de nociception
- Placez une larve de instar du milieu du tiers (à l'aide de forceps) sur une mince garniture de vinyle noir ou foncé sous un stéréomicroscope à champ lumineux. La couleur foncée offre un contraste qui améliore la visualisation de la larve. Il est préférable d'avoir un morceau librement mobile de vinyle foncé, car il permet à l'utilisateur d'aligner la larve sans la toucher ou la blesser.
- Placez les lumières de fibre optique entre les lentilles objectives de microscope et le tampon noir ou foncé de vinyle ; cela permettra un éclairage à contraste élevé adéquat pour voir la larve.
- Jetez les larves qui ne présentent pas de locomotion normale après le transfert à la garniture. Ceux-ci peuvent interférer avec la réponse comportementale nociceptive normale. Pour une locomotion normale, voir vidéo 1.
- Essuyez, à l'aide d'une serviette en papier, tout excès d'eau entourant la larve qui pourrait faire flotter la larve sur le tampon de vinyle.
- Orientez la larve en déplaçant le tampon de vinyle foncé. La tête/l'embouchure de la larve doit pointer vers la gauche si vous êtes droitier et vice versa si vous êtes gaucher (Figure 2A-B).
- Appliquer la sonde mécanique choisie, généralement pour 1-2 s, sur le côté dorsale postérieur de la larve à environ le segment abdominal A8 (voir figure 2B),jusqu'à ce que la sonde se plie et provoque la quantité de pression précédemment mesurée (Figure 2C). Il est important que la sonde appuie contre la surface dorsale de la larve et comprime les larves dans la garniture sous-jacente au point de contact avec la sonde.
REMARQUE : Au point de contact entre la pointe du filament nitinol et l'épiderme cuticule dorsale, sondes inférieures à 2 300 kPa, se plient principalement sans pénétrer la cuticule et les tissus sous-jacents. De telles sondes affectent rarement la mortalité larvaire4. À des pressions plus élevées (>5 000 kPa), les sondes se plient et pénètrent parfois dans la cuticule et les tissus sous-jacents. La ponctuation des larves nuit à la survie larvaire4 et, si elle est observée, ces larves sont généralement écartées de l'analyse comportementale. - Enregistrez la réponse comportementale pour chaque larve. Une réponse nonciceptive positive (Vidéo 2) est indiquée si la larve montre un roulis complet de 360° le long de l'axe de son corps dans les 3 s. D'autres réponses (essayant de tourner, rampant rapidement, et agitant) sont considérées négatives aux fins de cet essai.
REMARQUE : Les larves stimulées par un stimulus mécanique subthreshold (200 kPa) n'ont pas suscité la réponse nociceptive ou roulante typique (Vidéo 3). Certaines larves ont fait preuve de réactions de contact rapides vers l'avant ou légères, comme des changements dans la direction du mouvement. - Jeter la larve et préparer la suivante pour l'analyse, en répétant les étapes 3.1 à 3.7.
- Répétez les étapes 3.1-3.7 jusqu'à ce que le nombre désiré de larves soit atteint (trois à six séries de n = 10 larves ont été utilisées ici pour chaque sonde).
REMARQUE : Lorsque vous utilisez des sondes mécaniques à basse pression (174-462 kPa), l'essai prendra plus de temps par larve. C'est parce que la pointe des filaments plus longs oscille plus, ce qui rend plus difficile de piquer la larve au centre du segment A8. La pratique est nécessaire avec ces sondes.
4. Microscopie confocale pour évaluer la morphologie neuronale
- Placez une larve (de génotype ppk-Gal4>UAS-mCD8-GFP pour étiqueter les neurones sensoriels) préalablement stimulée par un filament nitinol dans une chambre d'étherisation à l'intérieur d'un bocal Coplin contenant un bécher de 10 mL portant une boule de coton trempée avec ~1 mL d'éther de détyle. Laissez la larve s'asseoir dans la chambre pendant ~5 min.
REMARQUE : Un protocole détaillé pour l'étherisation est fourni dans une étude précédente publiée par notre groupe12. - Rincer délicatement la larve de la chambre d'étherisation dans une petite boîte de Pétri.
- Préparez une diapositive au microscope, deux petites couvertures (22 x 22 mm) et une longue couverture (22 x 54 mm) (voir tableau des matériaux).
- Ajouter de petites gouttes d'éther: solution huile (1:5 rapport de l'éther éthylique à la solution d'huile d'halocarbone, voir tableaudes matériaux ) aux deux extrémités de la diapositive, puis placer les petits coverslips sur le dessus des petites gouttelettes. Cet arrangement crée un petit espace où la larve peut s'adapter.
REMARQUE : Appuyez sur les petites couvertures contre la lame du microscope jusqu'à ce qu'il soit difficile de glisser. - Ajouter quelques gouttes d'éther: solution d'huile sur le milieu de la diapositive microscope, puis placer la larve, à l'aide de forceps, sur le centre de la diapositive microscope (entre les petites couvertures). Assurez-vous que l'axe entéroposterior de la larve est parallèle au côté court de la glissière et que le côté dorsal est orienté vers le haut.
- Couvrez les larves avec le long coverslip placé sur le dessus de la larve et les deux plus petites couvertures.
REMARQUE : Appuyez généreusement sur le long coverslip jusqu'à ce que la larve soit presque plate. - Segment d'image A8 de la larve à l'aide d'un microscope confocal (voir tableau des matériaux)à l'aide de la longueur d'onde laser 488 (GFP).
REMARQUE : Imagez la larve immédiatement parce que l'anesthésie par l'intermédiaire de l'éther s'estompera rapidement (~5-10 min) et la larve se réveillera et se déplacera, ce qui compliquera davantage l'imagerie. - Capturez des images Z-stack à une résolution de 1024 x 1024 pixels à l'aide d'une ouverture numérique 20x (NA) 0,7 objectif sec à 1x zoom, taille de l'étape de 1,5 μm.
5. Quantitation des lésions tissulaires
- Collecter et convertir les images de pile de la série Z, à partir de la section 4.8, en une seule projection Z (un aplatissement de plusieurs images prises à différents plans focaux en une seule image composite). Cela peut être effectué à l'aide de logiciels disponibles dans le commerce (par exemple, Olympus Fluoview) ou de toute plate-forme open source équivalente, par exemple, Fidji/Image J. Enregistrer la projection Z unique dans le format TIFF.
- Ouvrez le programme d'analyse d'images Fiji/ImageJ.
- Cliquez sur Fichier, à partir de la barre de menu, et sélectionnez Ouvrir à partir de la fenêtre qui est affichée.
- Sélectionnez la projection d'image unique stockée, enregistrée dans le format TIFF, à analyser.
- Cliquez sur Modifier, à partir de la barre de menu, et sélectionnez l'option Inverse à partir de la fenêtre qui est affichée.
- Cliquez sur l'image, à partir de la barre de menu, puis sélectionnez Ajuster, à partir de la fenêtre qui est affichée, et enfin sélectionner l'option Luminosité / Contraste.
- Sélectionnez l'option Forme à main levée de la barre d'outils pour mesurer la zone de l'écart (le cas échéant).
- Cliquez sur Analyser,à partir de la barre de menu, et sélectionnez l'option Mesure. Cela affichera la zone de l'écart ou de la plaie.
Résultats
Nous avons mis au point des sondes mécaniques personnalisées, à l'aide de filaments nitinols (figure 1A,N), pour susciter des comportements mécaniquement évoqués et généré une courbe de réponse à la dose comportementale complète à l'aide de sondes mécaniques anodines et nocives d'intensité variable (figure 2D) démontrant que ces sondes peuvent être utilisées pour étudier la nociception mécanique de base (en l'absence de blessures).
Nos résultats d'analyse comportementale ont déterminé que les sondes exerçant des pressions inférieures à 200 kPa (~1,57 mN) (figure 1M), lorsqu'elles sont appliquées aux larves de Drosophila, ne provoquent pas une réponse aversive (Figure 2D et Vidéo 3). Comme prévu, ces sondes mécaniques subthreshold ou non nocives (175 kPa ou 200 kPa) n'ont pas causé de lésions visibles des tissus neuronaux (figure 2E). Parce qu'elles n'induisent pas de dommages, de telles sondes pourraient être utiles pour évaluer l'allodynie mécanique (hypersensibilité à un stimulus mécanique normalement non nocif). Inversement, les sondes suprathreshold ou nocives (de 462 kPa à 5 116 kPa) ont suscité une réaction comportementale augmentée (figure 2D) d'une manière dépendante de la dose, les pressions plus élevées suscitant des réactions comportementales plus fortes. Comme prévu, la pression mécanique suprathreshold a également induit des lésions tissulaires dépendantes de la dose aux neurones sensoriels périphériques eux-mêmes (Figure 2E). La zone mesurée des lésions tissulaires (en écart typede μm 2 ±) prélevée sur quatre larves pour chaque groupe était la suivante : 2 051,03 ± 703,81 (462 kPa), 5 102,102,1 29 ± 1 004,67 (2 283 kPa) et 12 238,83 ± 3 724,11 (5 116 kPa). Ainsi, des pressions supérieures ou égales à 462 kPa (~63 mN), qui évoquent une réponse aversive de roulement (dans 25% ou plus des larves) et causent des dommages visibles aux tissus neuronaux (figure 2E), pourraient être appropriées pour étudier l'hyperalgésie mécanique (hypersensibilité aux stimuli mécaniques normalement nocifs). Les sondes mécaniques nociceptives (≥462 kPa) induisent toujours des lésions tissulaires (n = 10, évaluées qualitativement) mais ne provoquent pas toujours une réponse aversive.
Pour évaluer l'hypersensibilité mécanique (allodynie et hyperalgésie), nous avons utilisé un modèle larvaire bien établi de Drosophila de sensibilisation nociceptive qui utilise l'irradiation de la lumière ultraviolette (UV) pour induire des lésionstissulaires 7,12. Cet essai a aidé à disséquer les mécanismes génétiques et cellulaires de l'hypersensibilité nociceptive thermique8,9,10,13,14,15. Pour déterminer si le traitement UV provoque une allodynie mécanique, les larvesdu milieudu troisième stade ( w1118) ont été simulées ou irradiées aux UV (15 à 20 mJ/cm2)(figure 3A). Ensuite, les larves ont été testées comportementalement à 2 h, 4 h, 8 h, 16 h et 24 h après le traitement avec une sonde mécanique normalement sous-threshold (200 kPa, 1,57 mN). Environ 20 % des larves ont répondu dès 2 h après le traitement aux UV, tandis que 50 % ont répondu à 4 h, comparativement à 6,6 % et 8,3 % des animaux irradiés aux UV simulés, respectivement (figure 3B). Ceci indique que les dommages induits par UV de tissu causent l'allodynie mécanique à 4 h post-irradiation. À des moments ultérieurs (8 h, 16 h et 24 h), la réponse comportementale des larves traitées aux UV était de l'aire de répartition de 16 % à 20 % des répondants (moyenne moyenne de n = 3 à 6 séries de 10 larves chacune), légèrement augmentée (mais non statistiquement significative) par rapport au groupe témoin irradié par maquette (de l'âge de 3 % à 6 % des intervenants, moyenne de n = 3-6 séries de 10 larves chacune) (Figure 3B).
Pour étudier l'hyperalgésie mécanique, une pression suprathreshold (462 kPa, 3,63 mN), qui induit normalement une réponse aversive de roulement dans ~20% des larves (figure 2D) et cause des dommages neuronaux de tissu (figure 2E), a été employée. Nous avons appliqué la sonde 462 kPa sur le côté dorsal des larves avec ou sans dommages tissulaires induits par les UV (Figure 3A). Nous avons constaté que les larves sondées à 4 h, 8 h et 16 h après le traitement UV ont montré une augmentation significative de la réponse aversive de roulement, avec 4 h étant le sommet de l'hypersensibilité comportementale (~60% sensible) ; les animaux irradiés aux UV simulés ont montré environ 27 % de la réponse aversive (figure 3C). Semblable à l'allodynie mécanique, la réponse comportementale à 8 h, 16 h, et 24 h des animaux UV-traités (dans la gamme de 36%-42%) était statistiquement indiscernable des larves non traitées (de l'âge de 20 % à 26 %). Les larves à la fin du troisième stade de l'instar ont montré une légère diminution de la réponse comportementale de base par rapport au troisième stade du troisième stade. Nous émettons l'hypothèse que cela pourrait être soit par la taille accrue des larves (figure 2A) ou l'épaisseur accrue de la cuticule couvrant le corps. Ce fait pourrait expliquer pourquoi à un stade ultérieur de développement le traitement UV n'induit pas une plus grande sensibilisation mécanique, comme observé 4 h après traitement UV.
Pris ensemble, nos résultats indiquent que les larves de Drosophila développent l'allodynie mécanique et l'hyperalgésie mécanique suivant des dommages de tissu UV-induits. L'heure de pointe de l'allodynie mécanique et de l'hyperalgésie est la même, 4 h après le traitement UV; cependant, l'hyperalgésie mécanique a une queue temporelle plus prononcée pendant qu'elle retourne à la ligne de base plus lentement comparée à l'allodynie mécanique.

Figure 1 : Mise au point d'un outil de von Frey pour évaluer la nociception mécanique chez les larves de Drosophila. (A) Image d'une sonde mécanique utilisée pour étudier la nociception mécanique chez les larves de Drosophila. (B) Les filaments nitinol et leurs diamètres relatifs sont montrés à l'échelle relative. (C) Image du coupe-fil diagonal utilisé pour couper les filaments de nitinol. (D) Lissage des bords tranchants du filament nitinol coupé avec une pierre d'affûtage. (E) Aiguille hypodermique utilisée pour faire un trou dans la poignée en bois bâton popsicle de la sonde. Le bout de l'aiguille doit atteindre au moins la moitié de la hauteur du bâton de poignée pour l'insertion sécurisée de filament. (F-G) Fixation du filament de nitinol en collant dans une poignée en bois de bâton de popsicle avec le trou d'insertion. (H-L) Étalonnage des sondes mécaniques en les appuyant contre une balance. (M) Valeurs de force (en mN) et de pression (en kPa) générées par différentes sondes mécaniques. La longueur de chaque filament nitinol utilisé pour construire les sondes (P1-P10; P: sonde) est détaillé en centimètres (cm). (N) Une image d'un ensemble complet de sondes mécaniques, allant de 174 kPa à 5116 kPa. S'il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2 : Essai mécanique de nociception : Les filaments von Frey-like génèrent une courbe dose-réponse du comportement aversif de roulement et causent des dommages de tissu aux neurones sensoriels. (A) Photos des différentes étapes (deuxième et troisième stade) des larves de Drosophila. Barre d'échelle: 2 mm. (B) Dessin animé de la vue dorsale des larves de Drosophila troisième instar. Le point rouge indique le segment abdominal où la sonde mécanique est appliquée. T: segment thoracique; R: segment abdominal. D'autres repères anatomiques sont étiquetés. (C) Dessin animé de l'analyse: Une sonde mécanique est appliquée sur le côté dorsal de la larve jusqu'à ce qu'elle se plie contre la surface ci-dessous et est ensuite maintenue pendant 2 s. Si la pression est suffisamment élevée, cela provoque une réponse aversive au moment de la libération. (D) Réponse à la dose comportementale; chaque point bleu représente le pourcentage de larves qui ont répondu, par roulement aversif, à la stimulation mécanique dans un ensemble de 10 animaux. Intrigue de violon du pourcentage de comportement de roulement aversif induit par différentes sondes mécaniques. kPa: kilopascals. Les parcelles de boîte représentent la médiane (verte), les moustaches (rouges) représentent les 10e et 90e percentiles. (E) Lésions tissulaires : Des larves de troisième instar (du génotype ppk-Gal4>UAS-mCD8-GFP pour étiqueter les neurones sensoriels nociceptifs) ont été sondées au segment dorsal A8 avec les pressions indiquées. Des neurones sensoriels ddaC de classe IV étiquetés fluorescents (à travers la ligne médiane dorsale) ont ensuite été examinés (voir les sections 4 et 5). Les zones blanches (astérisques rouges) représentent des lacunes ou des lésions tissulaires. Barre d'échelle : 100 μm. Dans le panneau B, la larve est montrée dans la vue dorsale, tandis qu'en C c c'est la vue latérale. Les sondes mécaniques pressées contre le côté cuticule-épiderme dorsal de la larve produisent une dépression comme la poche au point de contact de la pointe de la sonde et des zones environnantes. La ligne noire solide courbée vers le côté ventral est le haut de la poche, tandis que la ligne latérale grise pointillée représente le côté latéral et le fond de la poche. S'il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
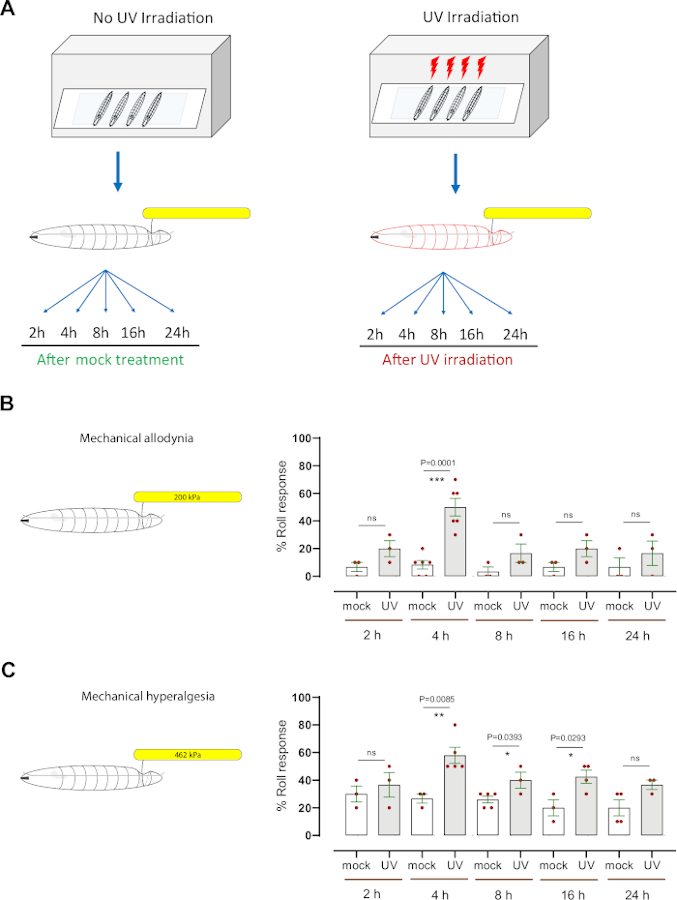
Figure 3 : Hypersensibilité mécanique après dommages aux UV. (A) Schéma de la conception expérimentale pour tester la sensibilisation. Le milieu du troisième stade a été simulé traité (non UV) ou irradié aux UV. L'essai mécanique de nociception a alors été exécuté à différents points de temps (2 h, 4 h, 8 h, 16 h, et 24 h) suivant le traitement simulé ou l'irradiation. (B) allodynie mécanique : Pourcentage de larves présentant un roulement aversif après sonder avec un stimulus mécanique normalement sous-threshold ou non nocif (200 kPa, 1,57 mN) aux points de temps indiqués après un simulacre de traitement ou une irradiation UV. (C) Hyperalgésie mécanique : Pourcentage de larves présentant un roulement aversif après sonder avec un stimulus mécanique normalement suprathreshold ou nocif (462 kPa, 3,63 mN) aux points de temps indiqués après un simulacre de traitement ou une irradiation UV. Les barres d'erreur indiquent que le test tnon appriré à deux queues a été utilisé pour l'analyse statistique : *p < 0,05, **p < 0,01; ns: pas significatif. Chaque point rouge, dans les panneaux B et C, représente la proportion moyenne de 10 larves, n = 3-6 ensembles par point de temps/état. S'il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Vidéo 1 : Locomotion normale des larves de Drosophila. S'il vous plaît cliquez ici pour télécharger cette vidéo.
Vidéo 2 : Stimulation mécanique nocive des larves de Drosophila. S'il vous plaît cliquez ici pour télécharger cette vidéo.
Vidéo 3 : Subthreshold stimulation mécanique des larves de Drosophila. S'il vous plaît cliquez ici pour télécharger cette vidéo.
Discussion
Nous avons modifié un essai mécanique établi1, 2,16àl'aide de sondes mécaniques personnalisées fabriquées à partir de filaments nitinol. Cet alliage métallique nous permet d'utiliser des filaments de plus petit diamètre qui conviennent à la taille des larves de Drosophila. Les monofilaments à base de lignes de pêche ont dominé le domaine de la nociception mécanique àla mouche à ce jour 2,5,6,16. Nos filaments de nitinol maintiennent leur forme et la pression mesurée pendant approximativement ~3-5 mois (dans notre expérience). En variant la longueur et le diamètre des filaments nitinol, l'utilisateur peut générer un large éventail de pressions allant de sous-propriété à une réponse de roulement presque complète. En particulier, la fabrication de sondes subthreshold est plus simple avec les filaments nitinol de plus petit diamètre. À l'aide de ces sondes, nous avons constaté que la pression, plutôt que la force, suscite des réactions comportementales plus cohérentes4. Nous démontrons ici, à l'aide d'un modèle de sensibilisation nociceptive induite par les UVbien établi 7,10,13, que ces filaments sont également un outil utile pour étudier l'hypersensibilité mécanique — allodynie et hyperalgésie.
Des études antérieures utilisant des sondes mécaniques fabriquées à partir de la ligne de pêche ont conduit à une certaine variabilité de la réactivitécomportementale 2,6,16,17. Plusieurs facteurs peuvent expliquer cela. Tout d'abord, parce que la pression est la variable importante, le polissage de la pointe filament de sorte qu'il est arrondi et n'a pas de bords tranchants est critique. Deuxièmement, la déclaration des valeurs de pression plutôt que de la seule force est importante pour la reproductibilité des expériences, car différentes sondes mécaniques qui génèrent des forces similaires peuvent provoquer des pressionsdisparates 4. Troisièmement, il est essentiel d'appliquer une seule stimulation mécanique par larve à l'aide de sondes nocives, car ces sondes produisent des lésions tissulaires dépendantes de la dose aux niveaux neuronal épidermique4 et sensoriel(figure 2E). Un deuxième stimulus mécanique nocif ou suivant, après que des dommages de tissu aient été induits, pourrait éventuellement altérer la fonction des neurones sensoriels périphériques affectés et obtenir une réponse comportementale altérée. Dans une autre étude, les larves stimulées deux fois avec des sondes mécaniques nocives ont la plupart du temps montré une réponse comportementaleaméliorée 5,suggérant le développement d'une sensibilisation mécanique aiguë (hyperalgésie), qui pourrait résulter des dommages de tissu provoqués par le premier stimulus mécanique nocif. Inversement,d'autres auteurs 6 ont rapporté une réponse comportementale mélangée (augmentée ou diminuée), indiquant que la réponse comportementale altérée pourrait être due aux dommages/dysfonctionnement du tissu neuronal. Stimuler chaque larve une seule fois élimine la variance possible dans les réponses comportementales résultant soit de la sensibilisation ou des lésions tissulaires. Quatrièmement, nous avons stimulé mécaniquement le segment A8, qui est plus postérieur que les études précédentes (zones privilégiées A3-A4)2,5,16. Les sondes entre ~3,900 kPa et 5,300 kPa appliquées soit au segment A2 ou A8 n'ont montré aucune différence comportementale4. En outre, a8, par rapport à A2-A4, est plus facile à stimuler avec des sondes mécaniques qui génèrent des pressions inférieures (<300 kPa) parce que la larve est plus mince dans cette région et donc plus facilement comprimé. D'autres études ont montré que la stimulation mécanique nocive de l'extrémité postérieure de la larve (livrée par une goupille rigide d'insecte, tenue avec des forceps) a surtout évoqué la locomotion vers l'avant, plutôt qu'une réponse aversive ouroulante 18. Cette réponse comportementale différente pourrait être due à des différences dans les propriétés des matériaux utilisés (filament nitinol pliable vs broche d'insecte incompressible) ou à différentes pressions transmises aux larves (la valeur de pression de l'épingle à insectes n'a pas été signalée).
Le développement d'un essai mécanique de nociception pour les larves de Drosophila a permis au champ de découvrir que différents canaux ioniques sensoriels mécaniques et circuits neuronaux médient la nociceptionmécanique 5,6,16,17. Cependant, l'étude de l'hypersensibilité mécanique (allodynie et hyperalgésie) a pris du retard, par rapport à la sensibilisation des autres modalités sensorielles — chaleur7,8,10,13,14, froid9, et chimique3. Ce décalage peut être dû en partie à l'absence de sondes mécaniques appropriées qui peuvent générer une plage de réponse complète couvrant subthreshold aux pressions suprathreshold. D'une importance particulière, en particulier pour l'évaluation de l'allodynie mécanique, sont des sondes subthreshold qui ne provoquent pas une réponse aversive roulement des larves non blessées. L'importance de nos sondes mécaniques améliorées est qu'elles peuvent être fabriquées pour couvrir des stimuli inoffensifs (subthreshold ~174 kPa-200 kPa) ou la gamme nocive basse à élevée (suprathreshold ~225 kPa à ~5,116 kPa). Ici, nous démontrons en utilisant les filaments nitinol von Frey-like que les larves de Drosophila développent à la fois l'allodynie mécanique et l'hyperalgésie mécanique après irradiation UV. La sensibilisation mécanique montre quelques différences par rapport à la sensibilisation thermique. L'apparition et le pic de sensibilisation mécanique sont plus précoces (~4 h) que la sensibilisation thermique (chaleur) (~8 h pour l'hyperalgésie et ~24 h pour l'allodynie)7. En outre, l'allodynie mécanique et l'hyperalgésie sont concomitantes (les deux culminent à ~4 h). En outre, tandis que la sensibilisation à la chaleur (allodynie et hyperalgésie) se résout complètement aux points7ultérieurs, l'hypersensibilité mécanique a montré une longue queue qui est restée légèrement au-dessus de la ligne de base. La sensibilisation au froid à Drosophila implique un changement dans les comportements évoqués par lefroid 9 et l'émergence de nouveaux comportements évoqués par le froid , un phénomène qui n'est pas observé avec la stimulation mécanique. Ces différences dans l'apparition, la durée et les comportements observés suggèrent que chaque modalité sensorielle peut être contrôlée par différentes voies de signalisation. La combinaison de l'analyse de sensibilisation décrite ici avec les puissants outils génétiques disponibles dans Drosophila devrait permettre une dissection génétique précise de l'hypersensibilité mécanique (allodynie et hyperalgésie) observée.
Déclarations de divulgation
Les auteurs n'ont rien à divulguer.
Remerciements
Nous remercions Thomas Wang pour le développement du prototype de filaments von Frey, Patrick J. Huang pour l'amélioration de l'analyse de sonde mécanique, le Bloomington Drosophila Stock Center pour le contrôle (w1118) et ppk-Gal4>UAS-mCD8-GFP stocks de mouches, et les membres du laboratoire Galko pour la lecture critique du manuscrit. Ces travaux ont été soutenus par R21NS087360 et R35GM126929 à MJG.
matériels
| Name | Company | Catalog Number | Comments |
| Beaker | Fisher Scientific | 02-540C | Beaker of 10 ml of capacity. Any similar container will do. |
| Black (Arkansas) bench stone | Dan’s Whetstone | SKU: I200306B24b-HQ-BAB-622-C | Used to smoothe any irregularities of the nitinol wire tips. https://www.danswhetstone.com/product/special-extra-wide-black-bench-stone-6-x-2-1-2-x-1-2/ |
| Confocal microscope | Olympus | FV1000 | Any equivalent confocal microscope will do |
| Coplin Jar | Fisher Scientific | 08-816 | https://www.fishersci.com/shop/products/fisherbrand-glass-staining-dishes-10-slides-screw-cap/08816#?keyword=08-816 |
| Diethyl ether | Fisher Scientific | E138-500 | For anesthetizing larvae. |
| Etherization chamber | This is a homemade customized chamber. Please see details of its construction in our previous published paper12. The purpose of the etherization chamber is allow entry of diethyl ether fumes but prevent larval escape. | ||
| Fiber Optic Light Guide | Schott AG | A08575 | Schott Dual Gooseneck 23 inch |
| Forceps | Fine Science Tool | FS-1670 | For transferring larvae |
| Glue | Aleene's | N/A | Aleene's® Wood Glue, formerly called (Aleene's All-Purpose Wood Glue) https://www.aleenes.com/aleenes-wood-glue |
| Graspable holder | Loew Cornell | N/A | Loew-Cornell Simply Art Wood Colored Craft Sticks, 500 pieces. |
| Halocarbon oil 700 | Sigma | H8898-100ML | |
| Hypodermic needle 30G 1/2"L | Fisher Scientific | NC1471286 | BD Precisionglide® syringe needles, gauge 30, L 1/2 inches. Used to make a hole into the wooden holder for the nitinol wires |
| Large Petridish | Falcon | 351007 | 60 mm x 10 mm Polystyrene Petridish |
| Microscope (Zeiss) Stemi 2000 | Carl Zeiss, Inc. | NT55-605 | Any equivalent microscope will do |
| Microscope Cover Glass 22x22 | Fisher | 12-545-B | |
| Microscope Cover Glass 22x40 | Corning | 2980-224 | Tickness 1 1/2 |
| Microscope Slides | Globe Scientific Inc. | 1358Y | |
| Mini Diagonal Cutter | Fisher Scientific | S43981 | For cutting nitinol filaments |
| Nitinol filaments, Diameters: 0.004”, 0.006”, 0.008” | Mailin Co | N/A | Fifteen pieces of each diameter of 12” length were ordered. https://malinco.com/ |
| Piece of black vinyl | Office Depot | N/A | We use a small piece of vinyl cut from a binder. Dark color provides contrast. A small piece allows orientation of the larva |
| Small Petridish | Falcon | 351008 | 35 mm x 10 mm Polystyrene Petridish |
| Spatula | Fisher Scientific | 21-401-10 | Double-Ended Micro-Tapered Stainless Steel Spatula. Used to place the food in the petri dish |
| Wipes | Fisher Scientific | 06-666A | Kimpes KMTECH, Science Brand. Used to dry larvae of excess moisture. |
| W1118 | Bloomington Drosophila Stock Center | 3605 | Control strain for behavioral assays |
| ppk-Gal4>UAS-mCD8-GFP | Bloomington Drosophila Stock Center | 8749 | Strain for fluorescent labeling of class IV md neurons |
Références
- Tracey, W. D., Wilson, R. I., Laurent, G., Benzer, S. Painless, a Drosophila gene essential for nociception. Cell. 113 (2), 261-273 (2003).
- Zhong, L., Hwang, R. Y., Tracey, W. D. Pickpocket is a DEG/ENaC protein required for mechanical nociception in Drosophila larvae. Current Biology. 20 (5), 429-434 (2010).
- Lopez-Bellido, R., Himmel, N. J., Gutstein, H. B., Cox, D. N., Galko, M. J. An assay for chemical nociception in Drosophila larvae. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 374 (1785), 20190282(2019).
- Lopez-Bellido, R., et al. Growth factor signaling regulates mechanical nociception in flies and vertebrates. Journal of Neuroscience. 39 (30), 6012-6030 (2019).
- Hu, C., et al. Sensory integration and neuromodulatory feedback facilitate Drosophila mechanonociceptive behavior. Nature Neuroscience. 20 (8), 1085-1095 (2017).
- Kim, S. E., Coste, B., Chadha, A., Cook, B., Patapoutian, A. The role of Drosophila Piezo in mechanical nociception. Nature. 483 (7388), 209-212 (2012).
- Babcock, D. T., Landry, C., Galko, M. J. Cytokine signaling mediates UV-induced nociceptive sensitization in Drosophila larvae. Current Biology. 19 (10), 799-806 (2009).
- Babcock, D. T., et al. Hedgehog signaling regulates nociceptive sensitization. Current Biology. 21 (18), 1525-1533 (2011).
- Turner, H. N., Patel, A. A., Cox, D. N., Galko, M. J. Injury-induced cold sensitization in Drosophila larvae involves behavioral shifts that require the TRP channel Brv1. PloS One. 13 (12), 0209577(2018).
- Im, S. H., et al. Tachykinin acts upstream of autocrine Hedgehog signaling during nociceptive sensitization in Drosophila. eLife. 4, 10735(2015).
- Cervero, F., Merskey, H. What is a noxious stimulus. Pain Forum. 5 (3), 157-161 (1996).
- Chattopadhyay, A., Gilstrap, A. V., Galko, M. J. Local and global methods of assessing thermal nociception in Drosophila larvae. Journal of Visualized Experiments: JoVE. (63), e3837(2012).
- Follansbee, T. L., et al. Drosophila nociceptive sensitization requires BMP signaling via the canonical SMAD pathway. Journal of Neuroscience. 37 (35), 8524-8533 (2017).
- Im, S. H., Patel, A. A., Cox, D. N., Galko, M. J. Drosophila insulin receptor regulates the persistence of injury-induced nociceptive sensitization. Disease Models & Mechanisms. 11 (5), (2018).
- Jo, J., et al. Drosophila caspase activity is required independently of apoptosis to produce active TNF/Eiger during nociceptive sensitization. Cell Death & Disease. 8 (5), 2786(2017).
- Hwang, R. Y., et al. Nociceptive neurons protect Drosophila larvae from parasitoid wasps. Current Biology. 17 (24), 2105-2116 (2007).
- Guo, Y., Wang, Y., Wang, Q., Wang, Z. The role of PPK26 in Drosophila larval mechanical nociception. Cell Reports. 9 (4), 1183-1190 (2014).
- Takagi, S., et al. Divergent connectivity of homologous command-like neurons mediates segment-specific touch responses in Drosophila. Neuron. 96 (6), 1373-1387 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon