Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Ti İmplantların TrombositTen Türetilmiş Hücre Dışı Veziklin İşlevselleştirilmesi
Bu Makalede
Özet
Burada, trombosit lysates (PL) elde edilen Hücre Dışı Vezikliklerin (EV) izolasyonu ve titanyum (Ti) implant yüzeylerinin kaplanması için kullanımları için bir yöntem sunuyoruz. Damla döküm kaplama yöntemini, yüzeylerden EV salınım profilini ve EV kaplamalı Ti yüzeylerinin in vitro biyouyumluluğunu açıklıyoruz.
Özet
Hücre dışı Veziklinler (EV' ler) hücre iletişiminde kilit rol oynayan biyolojik nanovesiküllerdir. İçerikleri, rejeneratif tıpta büyük potansiyel sunan proteinler ve nükleik asitler gibi aktif biyomolekülleri içerir. Daha yakın zamanda, Platelet Lysate'den (PL) elde edilen EV'ler PL ile karşılaştırılabilir bir osteojenik yetenek göstermiştir. Ayrıca, biyomalzemeler ortopedide veya diş restorasyonunda sıklıkla kullanılmaktadır. Burada, osteojenik özelliklerini geliştirmek için Ti yüzeylerini PL türevli EV'lerle işlevselleştirmek için bir yöntem sunuyoruz.
EV'ler PL'den boyut dışlama kromatografisi ile izole edilir ve daha sonra Ti yüzeyleri pl-EV'ler ile damla dökümü ile işlevsel hale getirilir. fonksiyonelleştirme, ED'lerin salınımı ve biyouyumluluğu laktat dehidrogenaz (LDH) salınımı test ile kanıtlanmıştır.
Giriş
EV'ler herhangi bir hücre tarafından salgılanan membran veziklinlerdir (30-200 nm) ve kargolarını teslim ederek hücreden hücreye iletişimde kilit rol oynarlar. Nükleik asitler, büyüme faktörleri veya biyoaktif lipitler içerebilecek çeşitli aktif biyomoleküller içerirler1. Bu nedenlerle, EV'ler terapötiklerde potansiyel kullanımları açısından değerlendirilmiştir. Ortopedi ve kemik yenilenmesi açısından farklı kaynaklardan gelen EV'ler test edilmiştir. Bunlar arasında trombosit türevli EV'lerin düşük sitotoksik profili korurken kök hücreler üzerinde farklılaşma etkisi yarattığı gösterilmiştir2,3. Bu nedenle, günlük klinik uygulamalarda kullanmak için EV'leri biyomalzemelerle birleştirme olasılığını araştırmak için daha fazla araştırma yapılması gerekmektedir.
Titanyum bazlı biyomalzemeler, mekanik özellikleri, yüksek biyouyumlulukları ve uzun süreli dayanıklılıkları nedeniyle kemik iyileştirici klinik müdahaleler için iskele olarak yaygın olarak kullanılmaktadır4. Bununla birlikte, Ti implantlar biyoinert bir malzemedir ve bu nedenle çevredeki kemik dokusuyla bağlanmak için zayıf bir yetenek sunar5. Bu nedenle yüzeyinde daha fonksiyonel bir mikroçevrme elde ederek performanslarını artırmak için titanyum modifikasyonları çalışılmaktadır4,6,7. Bu anlamda, EV'ler kimyasal8 veya fiziksel etkileşimlerle titanyuma tutturulabilir9,10. Kök hücrelerden veya makrofajlardan elde edilen hareketsiz EV'ler, hücresel yapışıklığı ve çoğalmayı teşvik ederek Ti'nin biyoaktivitesini arttırır ve böylece osteojenik bir etki yaratır8,9,10.
Bu makalede, Ti yüzeylerinin PL türevli EV'lerle ayrıntılı olarak kaplanması için bir damla döküm stratejisi üzerinde durulacaktır. Buna ek olarak, EV'lerin zaman içinde kaplamalı yüzeyden çıkış profilini değerlendireceğiz ve hücresel biyouyumluluk in vitrosunu onaylayacağız.
Access restricted. Please log in or start a trial to view this content.
Protokol
Platelet Lysate (PL), daha önce kurumsal yönergelere uygun olarak daha önce açıklandığı şekilde elde edilir3 , IdISBa Biobank tarafından başlangıç malzemesi olarak sağlanan taze buffy paltolar kullanılarak. Mevcut proje için kullanımları Etik Kurulu tarafından onaylanmıştır (IB 1995/12 BIO).
1. PL'den EV izolasyonu
- Daha büyük gövdelerin çıkarılması
- PL'nin oda sıcaklığında çözülmesi.
- 4 °C'de 15 dakika boyunca 1.500 x g'da santrifüj PL. Peletin hücre kalıntılarını içerdiği için atın.
- Süpernatantı toplayın ve 4 °C'de 30 dakika boyunca 10.000 x g'da ardışık iki santrifüj gerçekleştirin.
NOT: Pelet mikrovesiküller gibi daha büyük EV'lere karşılık gelir ve bu durumda atılır. - Süpernatantı önce 0,8 μm gözenekli membrandan sonra 0,2 μm gözenekli membrandan filtreleyin.
NOT: Bu adımlar, istenen tüm EV'leri kaldırır. - Filtrelenmiş PL'yi bir kenara alın ve kullanıma kadar -20 °C'de saklayın.
- Boyut dışlama kromatografisi
- Filtrelenmiş PBS ile kromatografi ekipmanına bağlı sütunu istenen akış hızında dengeleyin.
NOT: Kullanılan akış hızı sütun özelliklerine bağlıdır; bu durumda, 0,5 mL / dak olarak ayarlanır. - İşlenen PL'yi (5 mL) bir şırınna ile ekipmana yükleyin.
- PL'yi sütuna enjekte edin ve 15 mL tüplerde 5 mL fraksiyonları toplamaya başlayın.
- Ev zenginleştirilmiş fraksiyonları toplayın ve kullanıma kadar -80 °C'de saklayın.
NOT: Deneyi ilk kez gerçekleştirirken, tüm fraksiyonları protein nicelemesi ve immünodeteksiyon ile karakterize ederek EV'lerle zenginleştirilmiş olanı belirleyin3,11. Bu deneyde, 9. - Kromatografik sütunu % 0,2 NaOH çözeltisinin 30 mL'si ile yıkayın ve dengeye ulaştığında% 20 etanol çözeltisinde saklayın.
- Filtrelenmiş PBS ile kromatografi ekipmanına bağlı sütunu istenen akış hızında dengeleyin.
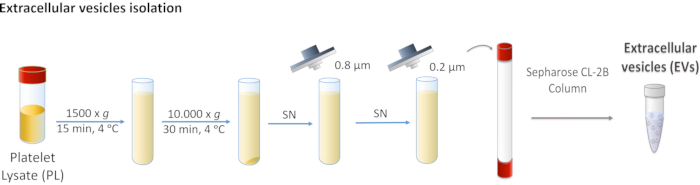
Şekil 1: Platelet Lysate (PL) hücre dışı veziklin (EV) izolasyonunun şematik diyagramı. PL, daha büyük gövdeleri çıkarmak için önce 1.500 x g'da, daha sonra 10.000 x g'da santrifüj edilir. Süpernatant 0.8 ve 0.2 μm filtreler aracılığıyla filtrelenmiştir. İşlenmiş PL sütuna yüklenir ve EV'ler boyut dışlama kromatografisi ile ayrılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
2. EV karakterizasyonu
NOT: Fonksiyonel çalışmalar yapmak için EV karakterizasyonu gereklidir12. Elektron mikroskopisi veya batı lekesi karakterizasyonu daha önce bildirilmiştir13. Bu rapor, Ti yüzey fonksiyonelleştirme için temel karakterizasyon tekniklerine odaklanacaktır.
- Nanopartikül Takip Analizi (NTA)
- EV'leri (1:1000) 0,2 μm filtreli PBS'de seyreltin.
NOT: Çok konsantre numuneler veya çok seyreltilmiş numuneler NTA tayini için aralık dışında olacak ve ayarlama gerekecektir. - Seyreltilmiş EV'lerin 1 mL'sini bir şırınna ile NTA ekipmanına yükleyin ve NTA ekipmanına enjekte edin.
- Parçacık konsantrasyonu ve boyut dağılımı belirleme için üreticinin protokolünü izleyin.
- EV'leri (1:1000) 0,2 μm filtreli PBS'de seyreltin.
- Protein konsantrasyonu
- 1 μL EV çözeltisi kullanarak konsantrasyonu belirleyin. Absorbansı 280 nm dalga boyunda bir spektrofotometre ile ölçün.
NOT: EV'ler partikül sayısına kıyasla düşük protein seviyeleri sunmalıdır. - Spektrofotometreyi kullanarak absorbans okumasını elde etmek için üreticinin talimatlarını izleyin.
- 1 μL EV çözeltisi kullanarak konsantrasyonu belirleyin. Absorbansı 280 nm dalga boyunda bir spektrofotometre ile ölçün.
3. Titanyum yüzey fonksiyonelleştirme
NOT: Bu yöntemde, c.p. sınıf IV, 6,2 mm çapında ve 2 mm yüksekliğinde işlenmiş titanyum diskler kullanılır. Diskler Ti cımbızla manipüle edilebilir, ancak yüzeyi çizmemek önemlidir. Ayrıca, işlenmiş taraf tüm işlem boyunca yukarı doğru bakmalıdır.
- Ti diskler yıkama
NOT: Ti yıkama için kullanılan çözeltilerin hacmi Ti diskleri kapsayacak şekilde yeterli olmalıdır. Ti diskleri cam bir kabın içine yerleştirin ve üzerlerine çözeltiler dökün. Ardından, çözeltiyi dekante 1000'den fazla çıkarın.- Ti implantları deiyonize (DI) suyla yıkayın ve ardından suyu atın.
- Ti implantları % 70 etanol ile yıkayın ve ardından çözeltiyi çıkarmak için dejenaant.
- İmplantları DI suyuna yerleştirin ve 5 dakika boyunca 50 °C'de sonikat. Suyu atın.
- Ti implantları 50 °C'de %40 NaOH çözeltisinde ajitasyonla 10 dakika boyunca kuluçkaya yatır. Çözümü atın.
DİkKAT: NaOH çözeltisi hazırlık sırasında ılıktır. Çözelti aşındırıcıdır ve bir duman kaputunun içinde kullanılmalıdır. - İmplantları 50 °C'de DI suyunda 5 dakika sonicate edin ve ardından suyu çıkarın.
- Nötr pH'a ulaşana kadar DI suyu (en az 5) ile birkaç yıkama gerçekleştirin. pH göstergeleri ile pH'ı kontrol edin.
- İmplantları 50 °C'de DI suyunda 5 dakika boyunca sonicate edin ve suyu çıkarın.
- Ti implantları 50 °C'de %50 HNO3 çözeltisinde ajitasyon ile 10 dakika kuluçkaya yatırın. Çözümü kaldırın.
DİkKAT: HNO3 aşındırıcı ve oksitleyici bir maddedir ve duman kaputunun içinde kullanılmalıdır. - İmplantları 5 dakika boyunca 50 °C'de DI suyunda sonicate edin. Suyu çıkarın.
- Nötr pH elde edilene kadar DI suyu (en az 5) ile birkaç yıkama gerçekleştirin. pH göstergeleri ile pH'ı kontrol edin.
- İmplantları 5 dakika boyunca 50 °C'de DI suyunda sonicate edin. Suyu çıkarın.
NOT: Bu noktada Ti implantların %70 etanol çözeltisinde depolanması ile deney durdurulabilir.
- Ti pasivasyonu
NOT: Ti passivasyon adımları, Ti disklerin aşağıda listelenen sırayla farklı çözümlerle tamamen kaplanmasıyla gerçekleştirilir. Ti diskler cam bir kabın içine yerleştirilir ve çözeltiler hafifçe üzerlerine dökülür. Tüm yıkama adımlarında kullanılan hacimler implantları tamamen örtmeli ve dekantasyonu ile çıkarılmalıdır.- Ti implantları nazik ajitasyon altında oda sıcaklığında 30 dakika boyunca% 30 HNO3 çözeltisinde kuluçkaya yatırın. Çözümü kaldırın.
- Nötr pH'a ulaşana kadar DI suyu (en az 5) ile birkaç yıkama gerçekleştirin. pH göstergeleri ile pH'ı kontrol edin.
- Di suyunda oda sıcaklığında gece boyunca Ti implantları kuluçkaya bırakın.
- İmplantları 40 °C'de vakum koşullarında 10 dakika kurutun.
- EV'ler dökümü düşürüyor
NOT: Hücre fonksiyonel çalışmaları için hücre kültürü kabininde çalışmak önemlidir.- Ti implantları, işlenmiş tarafı yukarı bakacak şekilde 96 kuyulu bir tabağa yerleştirin.
NOT: İmplantlar ters çevrilirse, onları geri döndürmek için bir iğne kullanılabilir. - EV'lerin çözeltisini çözün ve ajitasyonla karıştırın. 3 sn için nabız için bir girdap kullanın.
- EV'leri Ti yüzeye yatırın. Bu çalışmada, NTA tarafından belirlenen konsantrasyona göre implant başına en fazla 4 x 1011 EV'yi hareketsiz hale getirmek için Ti'ye 40 μL'lik EV çözeltisi damlaları yerleştirilir.
- Ti'yi içeren plakaları, damlalar tamamen kuruyana (~2 saat) 37 °C'de vakum koşulları altında yerleştirin.
NOT: İmplant sayısına ve vakum odasında bulunan suya bağlı olarak süreyi ayarlayın.
- Ti implantları, işlenmiş tarafı yukarı bakacak şekilde 96 kuyulu bir tabağa yerleştirin.
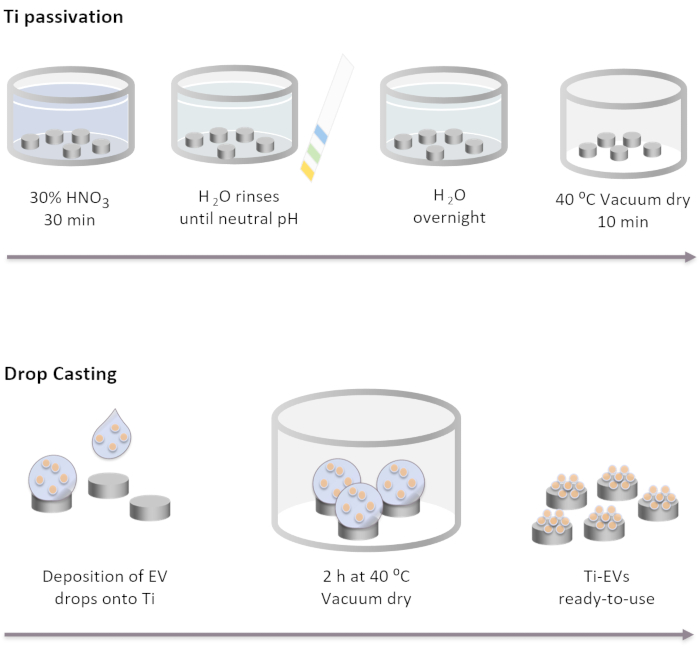
Şekil 2: Damla dökümü ile Ti pasivasyon ve EV fonksiyonelleştirme şematik diyagramı. Ti implantlar oda sıcaklığında %30 HNO3 çözeltisinde 30 dakika kuluçka ile önce pasif hale gelir. DI suyu ile birkaç yıkamadan sonra, pH nötr ulaşır. Daha sonra, Ti implantlar DI suyunda oda sıcaklığında gece boyunca inkübe edilir. Bundan sonra, implantlar 40 ° C'de vakum koşullarında kurutulur. EV'lerin hareketsiz hale getirilmesi için Ti implantlara 40 μL EV çözeltisi biriktirilir. Daha sonra, implantlar, EV'ler yüzeye fiziksel olarak bağlanana kadar 2 saat boyunca vakumda inkübe edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Ti yüzey karakterizasyonu
- Sürüm çalışması
- Ti yüzeyini 37 °C'de 200 μL filtrelenmiş PBS ile kuluçkaya yatırın.
NOT: PBS, NTA ölçümüne müdahaleleri önlemek için filtrelenir. - PBS'yi farklı zaman noktalarında değiştirin ve -80 °C'de saklayın.
NOT: Bu çalışmada 2-, 6, 10 ve 14 günlük zaman noktaları analiz edilmiştir. - Üreticinin talimatlarına göre NTA tarafından parçacık çalışmaları için depolanan PBS'yi analiz edin.
NOT: PBS'de farklı zamanlarda partikül konsantrasyonu, zaman içinde EV'lerin serbest bırakma profilinin bir temsilidir.
- Ti yüzeyini 37 °C'de 200 μL filtrelenmiş PBS ile kuluçkaya yatırın.
- Biyouyumbilite çalışmaları
NOT: İnsan göbek kordonu türevi mezenkimal kök hücreler (hUC-MSC) IdISBa Biobank'tan kurumsal yönergelere uygun olarak elde edilir.- Kullanıma kadar %20 FBS ile desteklenmiş DMEM düşük glikozda hUC-MSC'nin bakımını yaptırın. Ortamı haftada iki kez değiştirin.
- Hücre tohumlama için, hücreleri 5 mL PBS ile şişelerde iki kez yıkayın.
- Trypsine hUC-MSC 1 mL tripsin çözeltisi ekleyerek. Hücrelerin monolayerini tamamen kapladığından emin olun. Tripsin çözeltisini çıkarın ve hücre kültürü şişesini yaklaşık 2 dakika boyunca 37 °C'ye yerleştirin. Mikroskop altında hücre müfrezesini görüntüleyin. Ayrılmış hücreler yuvarlak şekilli görünecek ve süspansiyonda olacaktır.
- DMEM düşük glikozdaki hücreleri %1 EV'ler FBS tükenmiş olarak yeniden biriktirin.
NOT: FBS-EV'leri çıkarmak için %1 FBS ile desteklenmiş medya hazırlayın ve ardından 18 saat boyunca 120.000 x g'da ultracentrifuge hazırlayın. Trombosit EV'lere müdahaleleri önlemek için EV'lerin çıkarılması önemlidir. - Neubauer chamber14 ile hücre sayısını sayarak hücre konsantrasyonu belirleyin.
- hUC-MSC'yi 50.000 hücre/mL konsantrasyonuna getirin.
- Ti implantlarına hücre çözeltisinin 200 μL tohum.
- 48 saat sonra, 50 μL ortam toplayın ve üreticinin protokolüne göre laktat dehidrogenaz (LDH) aktivite kiti kullanarak sitotoksik belirlemeyi gerçekleştirin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bu makalede sunulan yöntem, EV'lerin işlevselleştirilmiş titanyum diskler elde etmeyi sağlar. EV'ler yüzeye fiziksel olarak bağlanır, bu da zaman içinde sürekli bir salınım sağlar. Serbest bırakılan EV miktarı 2, 6, 10 ve 14. 2. Günde yapılan ilk ölçümler, yaklaşık 109 EV'nin serbest bırakıldığını ve ardından 6. günde sürekli bir sürüm (~108 EV) olduğunu göstermektedir; 10. gün (~107 EV) ve 14. Bu, zaman içinde piyasaya sürülen EV miktar?...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu protokol, Ti yüzeylerinde EV'lerin işlevselleştirilmesi için net talimatlar sağlamayı amaçlamaktadır. Sunulan yöntem, bir fonksiyonelleştirmenin fitorpsiyon türü olan bir damla döküm stratejisine dayanmaktadır. Ti yüzeylerinde EV fonksiyonelleştirme ile ilgili kötü kaynakça mevcuttur, ancak Ti10'da EV'leri hareketsiz hale getirmenin farklı avantajlarını gösteren çok az çalışma vardır. Her neyse, araştırılan stratejilerden bazıları biyokimyasal
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu araştırma, ESF Avrupa Sosyal Fonu ve ERDF Avrupa Bölgesel Kalkınma Fonu (MS16/00124) tarafından ortaklaşa finanse edilen Instituto de Salud Carlos III, Ministerio de Economía y Competitividad tarafından finanse edildi; CP16/00124; PI17/01605), Balear Adaları'nın sürdürülebilir turizm vergisi tarafından finanse edilen Direcció General d'Investigació, Conselleria d'Investigació, Govern Balear (FPI/2046/2017) ve PROGRAMA JUNIOR del projecte TALENT PLUS, construyendo SALUD, generando VALOR (JUNIOR01/18).
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0,8 µm syringe filter | Sartorius | 16592K | |
| 1.5 mL Centrifuge tube | SPL life sciences | PLC60015 | |
| 1mL syringe | BD | 303174 | |
| 96-well culture plate | SPL life sciences | PLC30096 | |
| Absolut ethanol | Scharlau | ET0006005P | Used to prepare 20 % ethanol with Milli-Q® water |
| AKTA purifier System | GE Healthcare | 8149-30-0014 | |
| Allegra X-15R Centrifuge | Beckman Coutler | 392934 | SX4750A swinging rotor |
| Centrifuge 5430 R | Eppendorf | 5428000210 | F-45-48-11 rotor |
| Conical Tube, Conical Bottom, 50ml | SPL life sciences | PLC50050 | |
| Cytotoxicity Detection Kit (LDH) | Roche | 11644793001 | |
| Disposable Syringes 10 ml | Becton Dickinson | BDH307736 | |
| DMEM Low Glucose Glutamax | GIBCO | 21885025 | |
| Dulbecco's PBS (1x) | Capricorn Scientific | PBS-1A | |
| Fetal Bovine Serum (FBS) Embrionic Certified | GIBCO | 16000044 | |
| Filtropur S 0.2 µm syringe filter | Sarstedt | 83.1826.001 | |
| HiPrep 16/60 Sephacryl S-400 HR | GE Healthcare | 28-9356-04 | Precast columns |
| human umbilical cord-derived mesenchymal stem cells (hUC-MSC) | IdISBa Biobank | ||
| Nanodrop 2000 spectrophotometer | ThermoFisher | ND-2000 | |
| NanoSight NS300 nanoparticle tracking analysis | Malvern | NS300 | Device with embedded laser at λ= 532 nm and camera sCMOS |
| Needle | Terumo | 946077135 | |
| Nitric acid 69,5% | Scharlau | AC16071000 | |
| Optima L-100 XP Ultracentrifuge | Beckman Coulter | 8043-30-1124 | SW-32Ti Rotor |
| Penicillin-Streptomycin Solution 100X | Biowest | L0022 | |
| pH Test strips 4.5-10.0 | Sigma | P-4536 | |
| Platelet Lysate (PL) | IdISBa Biobank | Obtained from buffy coats discarded after blood donation | |
| Polypropylene centrifuge tubs | Beckman Coutler | 326823 | |
| Power wave HT | BioTek | 10340763 | |
| Screw cap tube, 15 ml, (LxØ): 120 x 17 mm, PP, with print | Sarstedt | 62554502 | |
| Sodium hidroxide | Sharlau | SO04251000 | |
| Titanium implants replicas | Implantmedia, SA | NA | Titanium grade IV. Diameter: 6,2 mm. Height: 1,95 mm |
| Trypsin-EDTA 1 X | Biowest | L0930 | |
| Tryton X100 | Sigma | T8787 |
Referanslar
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19 (4), 213-228 (2018).
- Torreggiani, E., et al. Exosomes: novel effectors of human platelet lysate activity. European Cells & Materials. 28, 137-151 (2014).
- Antich-Rosselló, M., et al. Platelet-derived extracellular vesicles promote osteoinduction of mesenchymal stromal cells. Bone and Joint Research. 9 (10), 667-674 (2020).
- Li, Y., et al. New developments of Ti-based alloys for biomedical applications. Materials. 7 (3), Basel, Switzerland. 1709-1800 (2014).
- Lan, W. C., et al. The potential of a nanostructured titanium oxide layer with self-assembled monolayers for biomedical applications: Surface properties and biomechanical behaviors. Applied Sciences. 10 (2), 590(2020).
- Jemat, A., Ghazali, M. J., Razali, M., Otsuka, Y. Surface modifications and their effects on titanium dental implants. BioMed Research International. 2015, 791725(2015).
- Damiati, L., et al. Impact of surface topography and coating on osteogenesis and bacterial attachment on titanium implants. Journal of Tissue Engineering. 9, 2041731418790694(2017).
- Chen, L., et al. Self-assembled human adipose-derived stem cell-derived extracellular vesicle-functionalized biotin-doped polypyrrole titanium with long-term stability and potential osteoinductive ability. ACS Applied Materials & Interfaces. 11 (49), 46183-46196 (2019).
- Wei, F., Li, M., Crawford, R., Zhou, Y., Xiao, Y. Exosome-integrated titanium oxide nanotubes for targeted bone regeneration. Acta Biomaterialia. 86, 480-492 (2019).
- Wang, X., et al. Exosomes influence the behavior of human mesenchymal stem cells on titanium surfaces. Biomaterials. 230, 119571(2020).
- Lozano-Ramos, I., et al. Size-exclusion chromatography-based enrichment of extracellular vesicles from urine samples. Journal of Extracellular Vesicles. 4, 27369(2015).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Liu, J., et al. Isolation and characterization of extracellular vesicles from adult schistosoma japonicum. Journal of Visualized Experiments: JoVE. (135), e57541(2018).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , JoVE. Cambridge, MA. (2021).
- Chouirfa, H., Bouloussa, H., Migonney, V., Falentin-Daudré, C. Review of titanium surface modification techniques and coatings for antibacterial applications. Acta Biomaterialia. 83, 37-54 (2019).
- Córdoba, A., Monjo, M., Hierro-Oliva, M., González-Martín, M. L., Ramis, J. M. Bioinspired quercitrin nanocoatings: A fluorescence-based method for their surface quantification, and their effect on stem cell adhesion and differentiation to the osteoblastic lineage. ACS Applied Materials and Interfaces. 7 (30), 16857-16864 (2015).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır