A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
תפקוד ארסיות חוץ-תאית שמקורה בטסיות דם של שתלי Ti
In This Article
Summary
כאן, אנו מציגים שיטה לבידוד של שלל חוץ תאי (EVs) הנגזר טסיות (PL) ואת השימוש בהם עבור ציפוי משטחי שתל טיטניום (Ti). אנו מתארים את שיטת ציפוי יציקת הטיפות, את פרופיל שחרור ה- EVs מהמשטחים, ואת תאימות ביולוגית במבחנה של משטחי Ti מצופים EVs.
Abstract
שלשלות חוץ-תאיות (EVs) הן ננו-ורידים ביולוגיים הממלאים תפקיד מפתח בתקשורת התא. התוכן שלהם כולל ביומולקולים פעילים כגון חלבונים וחומצות גרעין, אשר מציגים פוטנציאל גדול ברפואה רגנרטיבית. לאחרונה, EVs נגזר טסיות ליסאט (PL) הראו יכולת אוסטאוגנית דומה PL. חוץ מזה, ביו-חומרים משמשים לעתים קרובות באורתופדיה או בשיקום שיניים. כאן, אנו מספקים שיטה לפונקציונליזציה משטחי Ti עם PL נגזר EVs על מנת לשפר את המאפיינים האוסטאוגניים שלהם.
EVs מבודדים PL על ידי גודל אי הכללת כרומטוגרפיה, ולאחר מכן משטחי Ti הם פונקציונליים עם PL-EVs על ידי יציקת טיפה. פונקציונליזציה מוכחת על ידי שחרור EVs ואת תאימות ביולוגית שלה על ידי בדיקת שחרור לקטט דהידרוגנאז (LDH).
Introduction
רכבים EV הם שלל ממברנה (30-200 ננומטר) המופרשים על ידי כל תא וממלאים תפקיד מפתח בתקשורת בין תאים לתא על ידי אספקת המטען שלהם. הם מכילים מגוון של ביומולקולים פעילים שעשויים לכלול חומצות גרעין, גורמי גדילה, או שומנים ביואקטיביים1. מסיבות אלה, EVs הוערכו לשימוש הפוטנציאלי שלהם טיפולית. במונחים של אורתופדיה והתחדשות עצם, נבדקו EVs ממקורות שונים. ביניהם, הוכח כי EVs שמקורם בטסיות דם גורם להשפעת בידול על תאי גזע תוך שמירה על פרופיל ציטוטוקסי נמוך2,3. לכן, דרוש מחקר נוסף כדי לבחון את האפשרות של שילוב EVs עם biomaterials על מנת להשתמש בהם בפועל קליני יומי.
ביו-חומרים מבוססי טיטניום נמצאים בשימוש נרחב כפיגומים להתערבויות קליניות לריפוי עצמות בשל תכונותיהם המכניות, תאימות ביולוגית גבוהה ועמידות ארוכת טווח4. עם זאת, שתלי Ti הם חומר ביו-אינרטי, ולכן הם מציגים יכולת ירודה להתחברות עם רקמת העצם שמסביב5. מסיבה זו, שינויים טיטניום נחקרים על מנת לשפר את הביצועים שלהם על ידי השגת microenvironment פונקציונלי יותר על פני השטח שלה 4,6,7. במובן זה, EVs יכול להיות מעוגן טיטניום על ידי כימי8 או אינטראקציות פיזיות9,10. רכבים חשמליים משותקים המופקים מתאי גזע או מקרופאגים משפרים את הביואקטיביות של Ti על ידי קידום הידבקות והתפשטות תאית ובכך לגרום לאפקט אוסטאוגני8,9,10.
מאמר זה יתמקד באסטרטגיית יציקת טיפה לציפוי משטחי Ti עם EVs שמקורם ב- PL בפירוט. בנוסף, אנו נעריך פרופיל שחרור EVs מהמשטח המצולף לאורך זמן ונאשר את תאימות הביולוגית התאית שלה במבחנה.
Access restricted. Please log in or start a trial to view this content.
Protocol
טסיות דם Lysate (PL) מתקבל כפי שתואר בעבר בהתאם להנחיות המוסדיות3 באמצעות מעילי באפי טריים המסופקים על ידי הבנק הביולוגי IdISBa כחומר התחלתי. השימוש בפרויקט הנוכחי אושר על ידי ועדת האתיקה שלה (IB 1995/12 BIO).
1. בידוד EVs מ PL
- הסרת גופים גדולים יותר
- להפשיר PL בטמפרטורת החדר.
- צנטריפוגה PL ב 1,500 x גרם במשך 15 דקות ב 4 °C (70 °F). להשליך את הכדור כפי שהוא מכיל פסולת תא.
- לאסוף את supernatant ולבצע שני centrifugations רצופים ב 10,000 x g במשך 30 דקות ב 4 °C (70 °F).
הערה: הכדור מתאים ל- EVs גדול יותר כגון microvesicles, ובמקרה זה, הוא מושלך. - לסנן את supernatant תחילה דרך 0.8 מיקרומטר קרום נקבובי, ולאחר מכן דרך 0.2 מיקרומטר קרום נקבובי.
הערה: שלבים אלה מסירים את כל ה-EVs שאינם רצויים. - יש לאגור את PL המסונן ולאחסן ב-20 מעלות צלזיוס עד לשימוש.
- כרומטוגרפיה של אי-הכללת גודל
- ישיבב את העמודה בשילוב ציוד כרומטוגרפיה בקצב הזרימה הרצוי עם PBS מסונן.
הערה: קצב הזרימה המשמש תלוי במאפייני העמודה; במקרה זה, הוא מוגדר ל 0.5 מ"ל / דקה. - טען את PL המעובד (5 מ"ל) עם מזרק לציוד.
- הזריק את PL לתוך העמודה ולהתחיל לאסוף שברים 5 מ"ל בצינורות 15 מ"ל.
- לאסוף את שברים מועשרים EVs ולאחסן אותם ב -80 °C (50 °F) עד לשימוש.
הערה: בעת ביצוע הניסוי בפעם הראשונה, לאפיין את כל השברים על ידי כימות חלבון וחיסון כדי לקבוע את אחד מועשר EVs3,11. בניסוי זה, השבר התשיעי נאסף. - לשטוף את הטור הכרומטוגרפי עם 30 מ"ל של 0.2% פתרון NaOH ולאחסן אותו 20% פתרון אתנול ברגע שהוא מגיע שיווי משקל.
- ישיבב את העמודה בשילוב ציוד כרומטוגרפיה בקצב הזרימה הרצוי עם PBS מסונן.
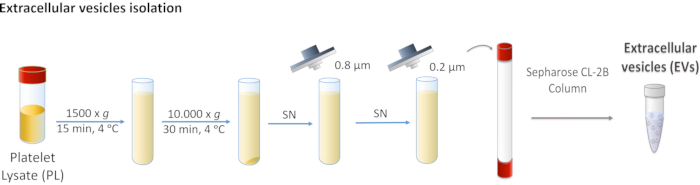
איור 1: דיאגרמה סכמטית של בידוד צעיות דם (PL) חוץ-תאיות(EVs). PL הוא צנטריפוגה תחילה ב 1,500 x g, ולאחר מכן ב 10,000 x g כדי להסיר גופים גדולים יותר. סופר-נט מסונן דרך מסנני 0.8 ו-0.2 מיקרומטר. PL מעובד נטען על העמודה, ו- EVs מופרדים על-ידי כרומטוגרפיה של אי-הכללת גודל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. אפיון EVs
הערה: אפיון EVs יש צורך לבצע מחקרים פונקציונליים12. מיקרוסקופיית אלקטרונים או אפיון כתם מערבי דווחו בעבר13. דו"ח זה יתמקד בטכניקות האפיון החיוניות לפונקציונליזציה של משטח Ti.
- ניתוח מעקב חלקיקים (NTA)
- לדלל את הרכבים EVs (1:1000) ב 0.2 מיקרומטר מסונן PBS.
הערה: דגימות מרוכזות מדי או דגימות מדוללות מדי יהיו מחוץ לטווח לקביעת NTA, ותידרש התאמה. - טען 1 מ"ל של EVs מדולל עם מזרק לציוד NTA ולהזריק אותם לתוך ציוד נת"ע.
- פעל לפי פרוטוקול היצרן לריכוז חלקיקים וקביעת התפלגות גודל.
- לדלל את הרכבים EVs (1:1000) ב 0.2 מיקרומטר מסונן PBS.
- ריכוז חלבונים
- לקבוע את הריכוז באמצעות 1 μL של פתרון EVs. מדוד את הספיגה עם ספקטרופוטומטר אורך גל של 280 ננומטר.
הערה: EVs צריך להציג רמות נמוכות של חלבונים לעומת מספר החלקיקים. - בצע את הוראות היצרן כדי לקבל את קריאת הספיגה באמצעות ספקטרופוטומטר.
- לקבוע את הריכוז באמצעות 1 μL של פתרון EVs. מדוד את הספיגה עם ספקטרופוטומטר אורך גל של 280 ננומטר.
3. פונקציונליזציה משטח טיטניום
הערה: בשיטה זו, דיסקים טיטניום במכונה, c.p. כיתה IV, קוטר 6.2 מ"מ, וגובה 2 מ"מ, משמשים. הדיסקים עשויים להיות מניפולציה עם פינצטה Ti, אבל חשוב לא לגרד את פני השטח. יתר על כן, הצד המכונה חייב לפנות כלפי מעלה במהלך כל התהליך.
- שטיפת דיסקים של Ti
הערה: נפח הפתרונות המשמשים לשטיפת Ti אמור להספיק כדי לכסות את הדיסקים של Ti. מניחים את הדיסקים של Ti בכוס זכוכית ויוצקים עליהם פתרונות. לאחר מכן, הסר את הפתרון על ידי decanting.- לשטוף את שתלי Ti עם מים deionized (DI), ולאחר מכן להשליך את המים.
- לשטוף את שתלי Ti עם אתנול 70%, ולאחר מכן decant כדי להסיר את הפתרון.
- מניחים את השתלים במי DI וסוניקאט ב 50 °C (50 °F) במשך 5 דקות. זרוק את המים.
- שתלים דגירה Ti בתמיסת 40% NaOH ב 50 °C (50 °F) במשך 10 דקות עם עצבנות. בטל את הפתרון.
אזהרה: פתרון NaOH מתחמם במהלך ההכנה. הפתרון הוא מאכל ויש להשתמש בו בתוך מכסה המנוע אדים. - Sonicate השתלים במי DI ב 50 °C (5 °F) במשך 5 דקות, ולאחר מכן להסיר את המים.
- בצע מספר שטיפות עם מים DI (לפחות 5) עד שהוא מגיע pH נייטרלי. בדוק pH עם מחווני pH.
- Sonicate השתלים במי DI ב 50 °C (50 °F) במשך 5 דקות ולהסיר את המים.
- שתלים דגירה Ti בתמיסת 50% HNO3 ב 50 °C (50 °F) במשך 10 דקות עם עצבנות. הסר את הפתרון.
זהירות: HNO3 הוא חומר מאכל חמצון, וזה צריך לשמש בתוך מכסה המנוע אדים. - Sonicate השתלים במי DI ב 50 °C (50 °F) במשך 5 דקות. מוציאים את המים.
- בצע מספר שטיפות עם מים DI (לפחות 5) עד pH נייטרלי מתקבל. בדוק את ה- pH עם מחווני pH.
- Sonicate השתלים במי DI ב 50 °C (50 °F) במשך 5 דקות. מוציאים את המים.
הערה: בשלב זה, הניסוי יכול להיפסק על ידי אחסון שתלי Ti בתמיסת אתנול 70%.
- Ti passivation
הערה: שלבי הפסיביציה של Ti מבוצעים על-ידי כיסוי מלא של דיסקי Ti עם הפתרונות השונים בסדר המפורט להלן. דיסקי Ti ממוקמים בכוס זכוכית ופתרונות נשפכים עליהם בעדינות. אמצעי אחסון המשמשים בכל שלבי הכביסה חייבים לכסות לחלוטין את השתלים ולהוסר באמצעות decanting.- לדגור על שתלי Ti בתמיסת HNO3 של 30% למשך 30 דקות בטמפרטורת החדר תחת תסיסה עדינה. הסר את הפתרון.
- בצע מספר שטיפות עם מים DI (לפחות 5) עד שהוא מגיע pH נייטרלי. בדוק את ה- pH עם מחווני pH.
- שתלים מדגירה Ti לילה בטמפרטורת החדר במי DI.
- יבש את השתלים בתנאי ואקום ב 40 °C (50 °F) במשך 10 דקות.
- יציקת טיפות של EVs
הערה: עבור מחקרים פונקציונליים של תאים, חשוב לעבוד בארון תרביות תאים.- מניחים את שתלי ה-Ti בצלחת של 96 באר, כשהצד במכונה פונה כלפי מעלה.
הערה: אם השתלים הפוכים, ניתן להשתמש במחט כדי להחזיר אותם אחורה. - להפשיר את פתרון EVs ולערבב אותם עם עצבנות. השתמש מערבולת לדופק עבור 3 s.
- הפקד את EVS על פני השטח Ti. במחקר זה, טיפות של 40 μL של פתרון EVs ממוקמים על Ti כדי לשתק מקסימום של 4 x 1011 EVs לכל שתל על פי הריכוז שנקבע על ידי NTA.
- מניחים את הצלחות המכילות את Ti בתנאי ואקום ב 37 °C (37 °F) עד טיפות יבשות לחלוטין (~ 2 שעות).
הערה: התאימו את השעה בהתאם למספר השתלים והמים הקיימים בתא הוואקום.
- מניחים את שתלי ה-Ti בצלחת של 96 באר, כשהצד במכונה פונה כלפי מעלה.
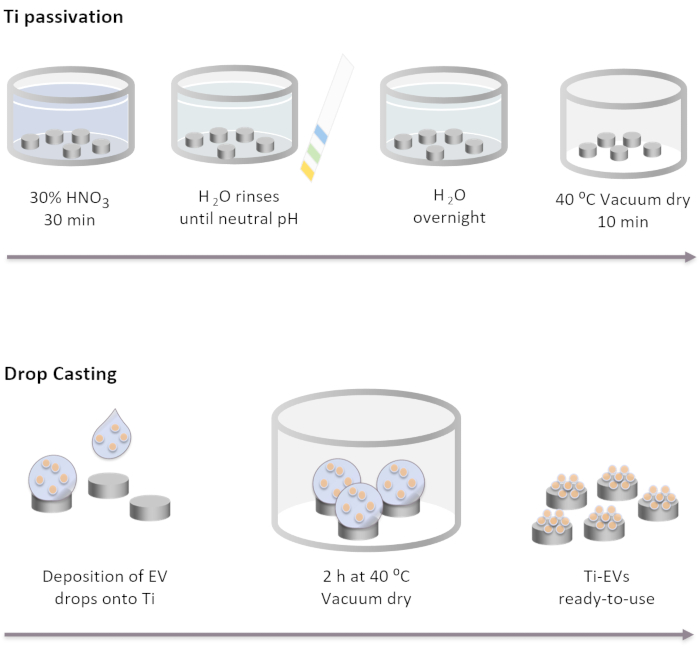
איור 2: תרשים סכמטי של פונקציונליות של Ti passivation ו- EVs על-ידי יציקת טיפה. שתלים Ti הם פסיביים תחילה על ידי דגירה במשך 30 דקות בתמיסת 30% HNO3 בטמפרטורת החדר. לאחר מספר שטיפות עם מים DI, pH מגיע נייטרלי. לאחר מכן, שתלי Ti הם דגירה לילה בטמפרטורת החדר במי DI. לאחר מכן, השתלים מיובשים בתנאי ואקום ב 40 °C (50 °F). עבור immobilization EVs, 40 μL של פתרון רכבים רישיות הופקדו על שתלים Ti. לאחר מכן, שתלים הם דגירה בוואקום במשך 2 שעות עד EVs קשורים פיזית לפני השטח. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
4. אפיון משטח Ti
- מחקר שחרור
- משטח טי דוגרה עם 200 μL של PBS מסונן ב 37 °C (50 °F).
הערה: PBS מסונן כדי למנוע הפרעות במדידת NTA. - החלף את PBS בנקודות זמן שונות ולאחסן ב -80 °C (70 °F).
הערה: במחקר זה נותחו נקודות זמן של 2, 6, 10 ו-14 ימים. - לנתח PBS מאוחסן עבור מחקרי חלקיקים על ידי NTA על פי הוראות היצרן.
הערה: ריכוז חלקיקים ב- PBS בזמנים שונים הוא ייצוג של פרופיל שחרור EVs לאורך זמן.
- משטח טי דוגרה עם 200 μL של PBS מסונן ב 37 °C (50 °F).
- מחקרי תאימות ביולוגית
הערה: תאי גזע מזנכימליים שמקורם בחבל הטבור האנושיים (hUC-MSC) מתקבלים מהבנק הביולוגי IdISBa בהתאם להנחיות המוסדיות.- יש לשמור על hUC-MSC בגלוקוז נמוך DMEM בתוספת 20% FBS עד לשימוש. שנה את המדיום פעמיים בשבוע.
- עבור זריעת תאים, לשטוף את התאים צלוחיות עם 5 מ"ל של PBS פעמיים.
- Trypsinize hUC-MSC על ידי הוספת 1 מ"ל של פתרון טריפסין. ודא שהוא מכסה לחלוטין את השוטל של התאים. הסר את פתרון טריפסין ומניחים את בקבוקון תרבית התא ב 37 °C (50 °F) במשך 2 דקות בערך. הצג ניתוק תאים מתחת למיקרוסקופ. תאים מנותקים יופיעו עגולים בצורה ויהיו בהשעיה.
- תאים resuspend ברמת הגלוקוז הנמוכה DMEM עם 1% EVs מרוקן FBS.
הערה: הכן מדיה בתוספת 1% FBS ולאחר מכן ultracentrifuge ב 120,000 x g עבור 18 שעות כדי להסיר FBS-EVs. חשוב להסיר EVs כדי למנוע הפרעות עם EVs טסיות דם. - קבע את ריכוז התאים על-ידי ספירת מספר התאים עם תא Neubauer14.
- להביא hUC-MSC לריכוז של 50,000 תאים / מ"ל.
- זרע 200 μL של פתרון התא על שתלים Ti.
- לאחר 48 שעות, לאסוף 50 μL של מדיה ולבצע את הקביעה הציטוטוקסית באמצעות ערכת פעילות לקטט דהידרוגנאז (LDH), על פי פרוטוקול היצרן.
Access restricted. Please log in or start a trial to view this content.
תוצאות
השיטה המוצגת במאמר זה מאפשרת קבלת תקליטורי טיטניום פונקציונליים של EVs. EVs נקשרים פיזית לפני השטח, המאפשר שחרור מתמשך לאורך זמן. כמות ה-EVs ששוחררו יכולה להימדד על ידי NTA ביום 2, 6, 10 ו-14. המדידות הראשונות, ביום 2, מראות כי סביב 109 EVs שוחררו, ואחריו שחרור מתמשך ביום 6 (~ 108 EVs); יום 10 (~ 107...
Access restricted. Please log in or start a trial to view this content.
Discussion
פרוטוקול זה נועד לספק הוראות ברורות לפונקציונליזציה של EVs על משטחי Ti. השיטה המוצגת מבוססת על אסטרטגיית יציקת טיפה, שהיא סוג של פונקציונליזציה. ביבליוגרפיה גרועה קיימת לגבי פונקציונליזציה של רכבים אלקטרוניים על משטחי Ti, אם כי ישנם מחקרים מעטים המראים יתרונות שונים על ידי שתק רכבים אלקטרונ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה מומן על ידי המכון לסאלוד קרלוס השלישי, שר הכלכלה y Competitividad, במימון משותף של הקרן החברתית האירופית ESF והקרן לפיתוח אזורי אירופי ERDF (MS16/00124; CP16/00124; PI17/01605), דירצ'יו ג'נרל ד'חקירות, קונסלריה ד'חקירות, שלטון באלאר (FPI/2046/2017) ו- PROGRAMA JUNIOR del projecte TALENT PLUS, לפרש את סאלוד, ג'נראנדו ואלור (JUNIOR01/18), הממומן על ידי מס התיירות בת קיימא של האיים הבלאריים.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0,8 µm syringe filter | Sartorius | 16592K | |
| 1.5 mL Centrifuge tube | SPL life sciences | PLC60015 | |
| 1mL syringe | BD | 303174 | |
| 96-well culture plate | SPL life sciences | PLC30096 | |
| Absolut ethanol | Scharlau | ET0006005P | Used to prepare 20 % ethanol with Milli-Q® water |
| AKTA purifier System | GE Healthcare | 8149-30-0014 | |
| Allegra X-15R Centrifuge | Beckman Coutler | 392934 | SX4750A swinging rotor |
| Centrifuge 5430 R | Eppendorf | 5428000210 | F-45-48-11 rotor |
| Conical Tube, Conical Bottom, 50ml | SPL life sciences | PLC50050 | |
| Cytotoxicity Detection Kit (LDH) | Roche | 11644793001 | |
| Disposable Syringes 10 ml | Becton Dickinson | BDH307736 | |
| DMEM Low Glucose Glutamax | GIBCO | 21885025 | |
| Dulbecco's PBS (1x) | Capricorn Scientific | PBS-1A | |
| Fetal Bovine Serum (FBS) Embrionic Certified | GIBCO | 16000044 | |
| Filtropur S 0.2 µm syringe filter | Sarstedt | 83.1826.001 | |
| HiPrep 16/60 Sephacryl S-400 HR | GE Healthcare | 28-9356-04 | Precast columns |
| human umbilical cord-derived mesenchymal stem cells (hUC-MSC) | IdISBa Biobank | ||
| Nanodrop 2000 spectrophotometer | ThermoFisher | ND-2000 | |
| NanoSight NS300 nanoparticle tracking analysis | Malvern | NS300 | Device with embedded laser at λ= 532 nm and camera sCMOS |
| Needle | Terumo | 946077135 | |
| Nitric acid 69,5% | Scharlau | AC16071000 | |
| Optima L-100 XP Ultracentrifuge | Beckman Coulter | 8043-30-1124 | SW-32Ti Rotor |
| Penicillin-Streptomycin Solution 100X | Biowest | L0022 | |
| pH Test strips 4.5-10.0 | Sigma | P-4536 | |
| Platelet Lysate (PL) | IdISBa Biobank | Obtained from buffy coats discarded after blood donation | |
| Polypropylene centrifuge tubs | Beckman Coutler | 326823 | |
| Power wave HT | BioTek | 10340763 | |
| Screw cap tube, 15 ml, (LxØ): 120 x 17 mm, PP, with print | Sarstedt | 62554502 | |
| Sodium hidroxide | Sharlau | SO04251000 | |
| Titanium implants replicas | Implantmedia, SA | NA | Titanium grade IV. Diameter: 6,2 mm. Height: 1,95 mm |
| Trypsin-EDTA 1 X | Biowest | L0930 | |
| Tryton X100 | Sigma | T8787 |
References
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19 (4), 213-228 (2018).
- Torreggiani, E., et al. Exosomes: novel effectors of human platelet lysate activity. European Cells & Materials. 28, 137-151 (2014).
- Antich-Rosselló, M., et al. Platelet-derived extracellular vesicles promote osteoinduction of mesenchymal stromal cells. Bone and Joint Research. 9 (10), 667-674 (2020).
- Li, Y., et al. New developments of Ti-based alloys for biomedical applications. Materials. 7 (3), Basel, Switzerland. 1709-1800 (2014).
- Lan, W. C., et al. The potential of a nanostructured titanium oxide layer with self-assembled monolayers for biomedical applications: Surface properties and biomechanical behaviors. Applied Sciences. 10 (2), 590(2020).
- Jemat, A., Ghazali, M. J., Razali, M., Otsuka, Y. Surface modifications and their effects on titanium dental implants. BioMed Research International. 2015, 791725(2015).
- Damiati, L., et al. Impact of surface topography and coating on osteogenesis and bacterial attachment on titanium implants. Journal of Tissue Engineering. 9, 2041731418790694(2017).
- Chen, L., et al. Self-assembled human adipose-derived stem cell-derived extracellular vesicle-functionalized biotin-doped polypyrrole titanium with long-term stability and potential osteoinductive ability. ACS Applied Materials & Interfaces. 11 (49), 46183-46196 (2019).
- Wei, F., Li, M., Crawford, R., Zhou, Y., Xiao, Y. Exosome-integrated titanium oxide nanotubes for targeted bone regeneration. Acta Biomaterialia. 86, 480-492 (2019).
- Wang, X., et al. Exosomes influence the behavior of human mesenchymal stem cells on titanium surfaces. Biomaterials. 230, 119571(2020).
- Lozano-Ramos, I., et al. Size-exclusion chromatography-based enrichment of extracellular vesicles from urine samples. Journal of Extracellular Vesicles. 4, 27369(2015).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Liu, J., et al. Isolation and characterization of extracellular vesicles from adult schistosoma japonicum. Journal of Visualized Experiments: JoVE. (135), e57541(2018).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , JoVE. Cambridge, MA. (2021).
- Chouirfa, H., Bouloussa, H., Migonney, V., Falentin-Daudré, C. Review of titanium surface modification techniques and coatings for antibacterial applications. Acta Biomaterialia. 83, 37-54 (2019).
- Córdoba, A., Monjo, M., Hierro-Oliva, M., González-Martín, M. L., Ramis, J. M. Bioinspired quercitrin nanocoatings: A fluorescence-based method for their surface quantification, and their effect on stem cell adhesion and differentiation to the osteoblastic lineage. ACS Applied Materials and Interfaces. 7 (30), 16857-16864 (2015).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved