A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الصفائح الدموية المشتقة من وظائف الحويكل خارج الخلية من يزرع تي
In This Article
Summary
هنا، نقدم طريقة لعزل Vesicles خارج الخلية (EVs) المستمدة من الصفائح الدموية (PL) واستخدامها لطلاء التيتانيوم (Ti) زرع السطوح. نحن نصف طريقة طلاء الصب قطرة، وEVs الافراج عن الملف الشخصي من الأسطح، والتوافق البيولوجي في المختبر من المركبات الكهربائية المغلفة تي السطوح.
Abstract
الحويصلات خارج الخلية (EVs) هي نانوفيسيكليس البيولوجية التي تلعب دورا رئيسيا في الاتصالات الخلوية. ويشمل محتواها الجزيئات الحيوية النشطة مثل البروتينات والأحماض النووية، والتي تمثل إمكانات كبيرة في الطب التجديدي. في الآونة الأخيرة، أظهرت المركبات الكهربائية المشتقة من الصفائح الدموية Lysate (PL) قدرة العظام مماثلة لPL. الى جانب ذلك ، وكثيرا ما تستخدم المواد الحيوية في جراحة العظام أو ترميم الأسنان. هنا، ونحن نقدم طريقة لوظيفية الأسطح تي مع المركبات الكهربائية PL المستمدة من أجل تحسين خصائصها العظام.
يتم عزل المركبات الكهربائية من PL حسب اللونية استبعاد الحجم، وبعد ذلك يتم وظيفية الأسطح تي مع PL-EVs عن طريق إسقاط الصب. ثبت وظيفية من قبل EVs الافراج والتوافق البيولوجي من قبل dehydrogenase اللاكتات (LDH) الافراج عن المقايسة.
Introduction
المركبات الكهربائية هي الحويصلات الغشاء (30-200 نانومتر) تفرزها أي خلية وتلعب دورا رئيسيا في الاتصالات من خلية إلى خلية عن طريق تسليم حمولتها. وهي تحتوي على مجموعة متنوعة من الجزيئات الحيوية النشطة التي قد تشمل الأحماض النووية، وعوامل النمو، أو الدهون النشطة بيولوجيا1. لهذه الأسباب، تم تقييم المركبات الكهربائية لاستخدامها المحتمل في العلاجات. من حيث جراحة العظام وتجديد العظام، تم اختبار المركبات الكهربائية من مصادر مختلفة. ومن بينها، ثبت أن المركبات الكهربائية المشتقة من الصفائح الدموية تحفز على إحداث تأثير تمايز على الخلايا الجذعية مع الحفاظ على مستوى منخفض من السمية الخلوية2,3. لذلك، هناك حاجة إلى مزيد من البحوث لاستكشاف إمكانية الجمع بين المركبات الكهربائية مع المواد الحيوية من أجل استخدامها في الممارسة السريرية اليومية.
تستخدم المواد الحيوية القائمة على التيتانيوم على نطاق واسع كسقالات للتدخلات السريرية لشفاء العظام بسبب خصائصها الميكانيكية ، والتوافق البيولوجي العالي ، والمتانة على المدى الطويل4. ومع ذلك، يزرع تي هي مادة خامدة الحيوية، وبالتالي، تقديم قدرة ضعيفة للترابط مع الأنسجة العظمية المحيطة5. ولهذا السبب، تجري دراسة تعديلات التيتانيوم من أجل تحسين أدائها من خلال تحقيق بيئة صغيرة أكثر وظيفية على سطحها4,6,7. وبهذا المعنى، يمكن تثبيت المركبات الكهربائية على التيتانيوم عن طريق المادة الكيميائية8 أو التفاعلات الفيزيائية9,10. المركبات الكهربائية غير المشلوم المستمدة من الخلايا الجذعية أو الضامة تعزيز النشاط الحيوي للتي من خلال تعزيز الالتصاق الخلوي والانتشار مما يؤدي إلى تأثير العظام8,9,10.
هذه المادة سوف تركز على استراتيجية قطرة الصب لطلاء الأسطح تي مع المركبات الكهربائية PL المستمدة بالتفصيل. بالإضافة إلى ذلك، سنقوم بتقييم ملف تعريف إصدار المركبات الكهربائية من السطح المغلف بمرور الوقت وتأكيد توافقه البيولوجي الخلوي في المختبر.
Protocol
يتم الحصول على الصفائح الدموية Lysate (PL) كما هو موضح سابقا في الامتثال للمبادئ التوجيهية المؤسسية3 باستخدام المعاطف برتقالي الطازجة التي تقدمها IdISBa بيوبنك كمادة البداية. وقد وافقت لجنة الأخلاقيات التابعة لها على استخدامها في المشروع الحالي (IB 1995/12 BIO).
1. عزل المركبات الكهربائية من PL
- إزالة أجسام أكبر
- ذوبان PL في درجة حرارة الغرفة.
- جهاز الطرد المركزي PL عند 1,500 x g لمدة 15 دقيقة عند 4 °C. تجاهل بيليه كما أنه يحتوي على حطام الخلية.
- جمع supernatant وأداء جهازي الطرد المركزي على التوالي في 10،000 × ز لمدة 30 دقيقة في 4 درجة مئوية.
ملاحظة: بيليه يتوافق مع المركبات الكهربائية أكبر مثل microvesicles، وفي هذه الحالة، يتم التخلص منه. - تصفية supernatant أولا من خلال غشاء مسامية 0.8 ميكرومتر، ومن ثم من خلال غشاء مسامية 0.2 ميكرومتر.
ملاحظة: هذه الخطوات إزالة كافة المركبات الكهربائية غير المطلوبة. - تجمع PL المصفاة وتخزينها في -20 درجة مئوية حتى الاستخدام.
- اللونيات استبعاد الحجم
- إعادة توازن العمود إلى جانب معدات الكروماتوغرافيا بمعدل التدفق المطلوب مع برنامج تلفزيوني تمت تصفيته.
ملاحظة: يعتمد معدل التدفق المستخدم على خصائص العمود; في هذه الحالة، يتم تعيين إلى 0.5 مل/دقيقة. - تحميل PL المعالجة (5 مل) مع حقنة إلى المعدات.
- حقن PL في العمود والبدء في جمع 5 كسور مل في أنابيب 15 مل.
- جمع الكسور EVs المخصب وتخزينها في -80 درجة مئوية حتى الاستخدام.
ملاحظة: عند إجراء التجربة لأول مرة، قم بتصفية جميع الكسور عن طريق قياس كمية البروتين والاستئصال المناعي لتحديد الكسور المخصبة ب EVs3,11. في هذه التجربة، يتم جمع الكسر التاسع. - غسل العمود الكروماتوغرافي مع 30 مل من محلول NaOH 0.2٪ وتخزينه في محلول الإيثانول 20٪ بمجرد وصوله إلى التوازن.
- إعادة توازن العمود إلى جانب معدات الكروماتوغرافيا بمعدل التدفق المطلوب مع برنامج تلفزيوني تمت تصفيته.
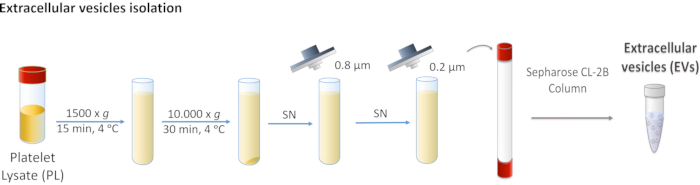
الشكل 1: رسم تخطيطي لعزل الحويكل خارج الخلية (EVs) من الصفائح الدموية. يتم طرد PL أولا عند 1,500 × ز، ثم عند 10,000 × غرام لإزالة الأجسام الأكبر. تتم تصفية الناتنات الفائق من خلال مرشحات 0.8 و 0.2 ميكرومتر. يتم تحميل PL المعالجة على العمود، ويتم فصل المركبات الكهربائية من خلال الكروماتوغرافيا استبعاد الحجم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. توصيف المركبات الكهربائية
ملاحظة: توصيف المركبات الكهربائية ضروري لإجراء الدراسات الوظيفية12. تم الإبلاغ سابقا عن المجهر الإلكتروني أو توصيف البقع الغربية13. وسيركز هذا التقرير على تقنيات التوصيف الأساسية لوظيفية سطح تي.
- تحليل تتبع الجسيمات النانوية (NTA)
- تمييع المركبات الكهربائية (1:1000) في 0.2 ميكرومتر PBS المصفاة.
ملاحظة: ستكون العينات المركزة جدا أو العينات المخففة جدا خارج النطاق لتحديد NTA، وستكون هناك حاجة إلى التعديل. - تحميل 1 مل من المركبات الكهربائية المخففة مع حقنة لمعدات NTA وحقنها في معدات NTA.
- اتبع بروتوكول الشركة المصنعة لتركيز الجسيمات وتحديد توزيع الحجم.
- تمييع المركبات الكهربائية (1:1000) في 0.2 ميكرومتر PBS المصفاة.
- تركيز البروتين
- تحديد التركيز باستخدام 1 ميكرولتر من محلول المركبات الكهربائية. قياس الامتصاص مع مطياف عند الطول الموجي من 280 نانومتر.
ملاحظة: يجب أن تقدم المركبات الكهربائية مستويات منخفضة من البروتينات مقارنة بعدد الجسيمات. - اتبع تعليمات الشركة المصنعة للحصول على قراءة الامتصاص باستخدام مطياف.
- تحديد التركيز باستخدام 1 ميكرولتر من محلول المركبات الكهربائية. قياس الامتصاص مع مطياف عند الطول الموجي من 280 نانومتر.
3. التيتانيوم سطح الوظيفية
ملاحظة: في هذه الطريقة، تستخدم أقراص التيتانيوم المصناة، C.p. الصف الرابع، قطر 6.2 مم، وارتفاع 2 مم. قد يتم التلاعب الأقراص مع تي ملاقط، ولكن من المهم عدم خدش السطح. وعلاوة على ذلك، يجب أن تواجه الجانب تشكيلها صعودا خلال العملية برمتها.
- تي أقراص غسل
ملاحظة: حجم الحلول المستخدمة لغسل تي ينبغي أن تكون كافية لتغطية أقراص تي. ضع أقراص Ti في كوب زجاجي واسكب الحلول عليها. ثم قم بإزالة الحل عن طريق إزالة التكفير.- يغسل تي بالماء المتأين (DI)، ثم يتخلص من الماء.
- يغسل تي يزرع مع الإيثانول 70٪، ومن ثم decant لإزالة الحل.
- ضع الغرسات في ماء DI وصوتيت عند 50 درجة مئوية لمدة 5 دقائق. تجاهل الماء.
- يحضن تي يزرع في محلول NaOH 40٪ في 50 درجة مئوية لمدة 10 دقائق مع التحريض. تجاهل الحل.
تنبيه: يدفئ محلول NaOH أثناء التحضير. الحل هو تآكل وينبغي استخدامها داخل غطاء محرك السيارة الدخان. - Sonicate يزرع في المياه DI في 50 درجة مئوية لمدة 5 دقائق، ومن ثم إزالة الماء.
- قم بإجراء العديد من الغسيلات بماء DI (5 على الأقل) حتى تصل إلى درجة الحموضة المحايدة. تحقق من رقم الحموضة مع مؤشرات الحموضة.
- Sonicate يزرع في المياه DI في 50 درجة مئوية لمدة 5 دقائق وإزالة الماء.
- احتضان تي يزرع في حل HNO3 50٪ في 50 درجة مئوية لمدة 10 دقيقة مع التحريض. إزالة الحل.
تنبيه: HNO3 هو مادة مسببة للتآكل والأكسدة، وينبغي استخدامه داخل غطاء الدخان. - Sonicate يزرع في المياه DI في 50 درجة مئوية لمدة 5 دقائق. إزالة الماء.
- قم بإجراء العديد من الغسيل بماء DI (5 على الأقل) حتى يتم الحصول على درجة الحموضة المحايدة. تحقق من رقم الحموضة مع مؤشرات الحموضة.
- Sonicate يزرع في المياه DI في 50 درجة مئوية لمدة 5 دقائق. إزالة الماء.
ملاحظة: عند هذه النقطة، يمكن إيقاف التجربة عن طريق تخزين يزرع تي في محلول الإيثانول 70٪.
- تي ي باسيفيشن
ملاحظة: يتم تنفيذ خطوات passivation Ti بواسطة تغطية أقراص Ti بالكامل مع حلول مختلفة بالترتيب المذكور أدناه. يتم وضع أقراص Ti في كوب زجاجي ويتم سكب الحلول عليها بلطف. يجب أن تغطي الأحجام المستخدمة في جميع خطوات الغسيل الغرسات تماما ويتم إزالتها عن طريق إزالة التكرير.- احتضان يزرع تي في حل HNO3 30٪ لمدة 30 دقيقة في درجة حرارة الغرفة تحت التحريض لطيف. إزالة الحل.
- قم بإجراء العديد من الغسيلات بماء DI (5 على الأقل) حتى تصل إلى درجة الحموضة المحايدة. تحقق من رقم الحموضة مع مؤشرات الحموضة.
- احتضان تي يزرع بين عشية وضحاها في درجة حرارة الغرفة في المياه DI.
- تجف يزرع تحت ظروف فراغ في 40 درجة مئوية لمدة 10 دقيقة.
- EVs إسقاط الصب
ملاحظة: بالنسبة للدراسات الوظيفية للخلايا، من المهم العمل في خزانة ثقافة الخلية.- ضع غرسات Ti في لوحة من 96 بئرا ، مع مواجهة الجانب الماكين.
ملاحظة: إذا انقلبت الغرسات رأسا على عقب، يمكن استخدام إبرة لإعادتها إلى الوراء. - إذابة حل المركبات الكهربائية ومزجها مع التحريض. استخدم دوامة للنبض لمدة 3 ثوان.
- إيداع المركبات الكهربائية على سطح تي. في هذه الدراسة، يتم وضع قطرات من 40 ميكرولتر من محلول المركبات الكهربائية على تي لشل حركة بحد أقصى 4 × 1011 EVs لكل زرع وفقا للتركيز الذي تحدده NTA.
- ضع اللوحات التي تحتوي على Ti تحت ظروف الفراغ عند 37 درجة مئوية حتى تجف القطرات تماما (~ 2 ساعة).
ملاحظة: ضبط الوقت اعتمادا على عدد يزرع والمياه الموجودة في غرفة فراغ.
- ضع غرسات Ti في لوحة من 96 بئرا ، مع مواجهة الجانب الماكين.
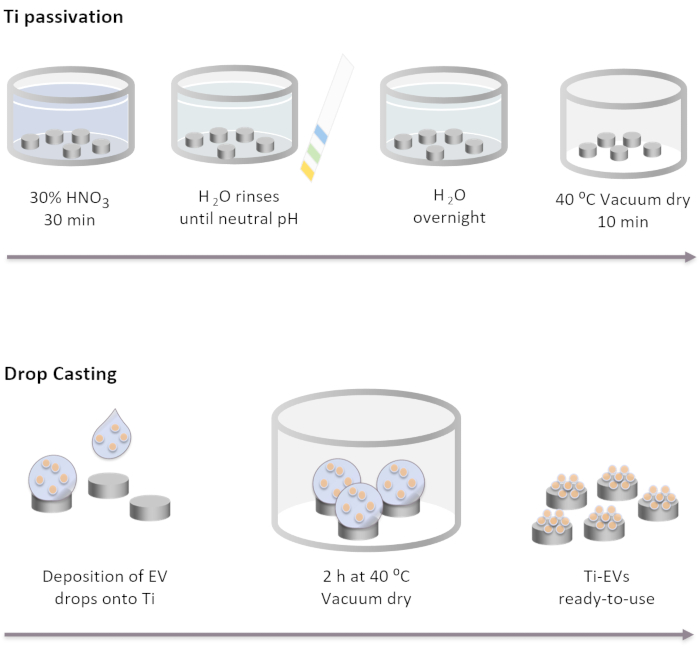
الشكل 2: مخطط تخطيطي لتي ي تخميل وEVs الوظيفية عن طريق إسقاط الصب. يتم تمرير غرسات Ti أولا عن طريق الحضانة لمدة 30 دقيقة في محلول HNO3 بنسبة 30٪ في درجة حرارة الغرفة. بعد غسل عدة مع المياه DI، درجة الحموضة تصل محايدة. ثم، يتم احتضان يزرع تي بين عشية وضحاها في درجة حرارة الغرفة في المياه DI. بعد ذلك ، يتم تجفيف الغرسات في ظل ظروف الفراغ عند 40 درجة مئوية. لشل حركة المركبات الكهربائية، يتم إيداع 40 ميكرولتر من محلول المركبات الكهربائية على غرسات Ti. بعد ذلك ، يتم احتضان الغرسات في فراغ لمدة 2 ساعة حتى تكون المركبات الكهربائية مرتبطة جسديا بالسطح. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تي خصائص السطح
- دراسة الافراج عن
- احتضان سطح Ti مع 200 ميكرولتر من برنامج تلفزيوني تمت تصفيته عند 37 درجة مئوية.
ملاحظة: يتم تصفية برنامج تلفزيوني لتجنب التداخل مع قياس NTA. - استبدل برنامج تلفزيوني في نقاط زمنية مختلفة وتخزينها في -80 درجة مئوية.
ملاحظة: في هذه الدراسة، تم تحليل النقاط الزمنية 2-و6-و10-و14 يوما. - تحليل برنامج تلفزيوني المخزنة لدراسات الجسيمات من قبل NTA وفقا لتعليمات الشركة المصنعة.
ملاحظة: تركيز الجسيمات في برنامج تلفزيوني في أوقات مختلفة هو تمثيل للمركبات الكهربائية الافراج عن التشكيل الجانبي مع مرور الوقت.
- احتضان سطح Ti مع 200 ميكرولتر من برنامج تلفزيوني تمت تصفيته عند 37 درجة مئوية.
- دراسات التوافق البيولوجي
ملاحظة: يتم الحصول على الخلايا الجذعية النخاعية المشتقة من الحبل السري البشري (hUC-MSC) من بنك IdISBa الحيوي وفقا للمبادئ التوجيهية المؤسسية.- الحفاظ على hUC-MSC في DMEM منخفض الجلوكوز تكملها مع 20٪ FBS حتى الاستخدام. تغيير المتوسط مرتين في الأسبوع.
- لزرع الخلايا، وغسل الخلايا في قوارير مع 5 مل من برنامج تلفزيوني مرتين.
- جربسينيز hUC-MSC بإضافة 1 مل من حل تريبسين. تأكد من أنه يغطي تماما طبقة أحادية من الخلايا. إزالة الحل تريبسين ووضع قارورة ثقافة الخلية في 37 درجة مئوية لمدة 2 دقيقة تقريبا. عرض انفصال الخلية تحت المجهر. ستظهر الخلايا المنفصلة في شكل دائري وستكون في حالة تعليق.
- خلايا إعادة الإنفاق في DMEM انخفاض الجلوكوز مع 1٪ EVs استنفدت FBS.
ملاحظة: إعداد الوسائط المكملة ب 1٪ FBS، ثم جهاز الطرد المركزي الفائق عند 120,000 × ز لمدة 18 ساعة لإزالة أجهزة FBS-EVs. من المهم إزالة المركبات الكهربائية لتجنب التداخل مع الصفائح الدموية الكهربائية. - تحديد تركيز الخلية عن طريق حساب عدد الخلايا مع غرفة نيوباور14.
- جلب hUC-MSC إلى تركيز 50،000 خلية / مل.
- البذور 200 ميكرولتر من محلول الخلية على يزرع تي.
- بعد 48 ساعة، وجمع 50 ميكرولتر من وسائل الإعلام وإجراء تحديد السامة للخلايا باستخدام مجموعة نشاط اللاكتات ديهيدروجيناز (LDH)، وفقا لبروتوكول الشركة المصنعة.
النتائج
الطريقة المعروضة في هذه المقالة يسمح الحصول على المركبات الكهربائية أقراص التيتانيوم وظيفية. يتم ربط المركبات الكهربائية جسديا بالسطح ، مما يسمح بالإفراج المستمر بمرور الوقت. يمكن قياس كمية المركبات الكهربائية الصادرة عن NTA في اليوم 2 و 6 و 10 و 14. وتبين القياسات الأولى، في اليوم الثاني، أن ...
Discussion
يهدف هذا البروتوكول إلى توفير تعليمات واضحة للوظائف المركبات الكهربائية على الأسطح تي. ويستند الأسلوب المقدم على استراتيجية قطرة الصب، وهو نوع من physisorption الوظيفية. يوجد ضعف الببليوغرافيا فيما يتعلق بوظيفة المركبات الكهربائية على أسطح Ti ، على الرغم من وجود عدد قليل من الدراسات التي تظهر م...
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
وقد مول هذا البحث معهد سالود كارلوس الثالث، الوزير الاقتصادي، الذي شارك في تمويله الصندوق الاجتماعي الأوروبي وصندوق التنمية الإقليمية الأوروبي التابع للصندوق الأوروبي للتنمية الاقتصادية (MS16/00124؛ CP16/00124; PI17/01605)، وDirecció العام d'Investigació، كونسيليريا D'Investigació، حكم البليار (FPI/2046/2017)، وPORA جونيور ديل projecte TALENT PLUS، construyendo سالود، جينيراندو فالور (JUNIOR01/18)، بتمويل من ضريبة السياحة المستدامة لجزر البليار.
Materials
| Name | Company | Catalog Number | Comments |
| 0,8 µm syringe filter | Sartorius | 16592K | |
| 1.5 mL Centrifuge tube | SPL life sciences | PLC60015 | |
| 1mL syringe | BD | 303174 | |
| 96-well culture plate | SPL life sciences | PLC30096 | |
| Absolut ethanol | Scharlau | ET0006005P | Used to prepare 20 % ethanol with Milli-Q® water |
| AKTA purifier System | GE Healthcare | 8149-30-0014 | |
| Allegra X-15R Centrifuge | Beckman Coutler | 392934 | SX4750A swinging rotor |
| Centrifuge 5430 R | Eppendorf | 5428000210 | F-45-48-11 rotor |
| Conical Tube, Conical Bottom, 50ml | SPL life sciences | PLC50050 | |
| Cytotoxicity Detection Kit (LDH) | Roche | 11644793001 | |
| Disposable Syringes 10 ml | Becton Dickinson | BDH307736 | |
| DMEM Low Glucose Glutamax | GIBCO | 21885025 | |
| Dulbecco's PBS (1x) | Capricorn Scientific | PBS-1A | |
| Fetal Bovine Serum (FBS) Embrionic Certified | GIBCO | 16000044 | |
| Filtropur S 0.2 µm syringe filter | Sarstedt | 83.1826.001 | |
| HiPrep 16/60 Sephacryl S-400 HR | GE Healthcare | 28-9356-04 | Precast columns |
| human umbilical cord-derived mesenchymal stem cells (hUC-MSC) | IdISBa Biobank | ||
| Nanodrop 2000 spectrophotometer | ThermoFisher | ND-2000 | |
| NanoSight NS300 nanoparticle tracking analysis | Malvern | NS300 | Device with embedded laser at λ= 532 nm and camera sCMOS |
| Needle | Terumo | 946077135 | |
| Nitric acid 69,5% | Scharlau | AC16071000 | |
| Optima L-100 XP Ultracentrifuge | Beckman Coulter | 8043-30-1124 | SW-32Ti Rotor |
| Penicillin-Streptomycin Solution 100X | Biowest | L0022 | |
| pH Test strips 4.5-10.0 | Sigma | P-4536 | |
| Platelet Lysate (PL) | IdISBa Biobank | Obtained from buffy coats discarded after blood donation | |
| Polypropylene centrifuge tubs | Beckman Coutler | 326823 | |
| Power wave HT | BioTek | 10340763 | |
| Screw cap tube, 15 ml, (LxØ): 120 x 17 mm, PP, with print | Sarstedt | 62554502 | |
| Sodium hidroxide | Sharlau | SO04251000 | |
| Titanium implants replicas | Implantmedia, SA | NA | Titanium grade IV. Diameter: 6,2 mm. Height: 1,95 mm |
| Trypsin-EDTA 1 X | Biowest | L0930 | |
| Tryton X100 | Sigma | T8787 |
References
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19 (4), 213-228 (2018).
- Torreggiani, E., et al. Exosomes: novel effectors of human platelet lysate activity. European Cells & Materials. 28, 137-151 (2014).
- Antich-Rosselló, M., et al. Platelet-derived extracellular vesicles promote osteoinduction of mesenchymal stromal cells. Bone and Joint Research. 9 (10), 667-674 (2020).
- Li, Y., et al. New developments of Ti-based alloys for biomedical applications. Materials. 7 (3), 1709-1800 (2014).
- Lan, W. C., et al. The potential of a nanostructured titanium oxide layer with self-assembled monolayers for biomedical applications: Surface properties and biomechanical behaviors. Applied Sciences. 10 (2), 590 (2020).
- Jemat, A., Ghazali, M. J., Razali, M., Otsuka, Y. Surface modifications and their effects on titanium dental implants. BioMed Research International. 2015, 791725 (2015).
- Damiati, L., et al. Impact of surface topography and coating on osteogenesis and bacterial attachment on titanium implants. Journal of Tissue Engineering. 9, 2041731418790694 (2017).
- Chen, L., et al. Self-assembled human adipose-derived stem cell-derived extracellular vesicle-functionalized biotin-doped polypyrrole titanium with long-term stability and potential osteoinductive ability. ACS Applied Materials & Interfaces. 11 (49), 46183-46196 (2019).
- Wei, F., Li, M., Crawford, R., Zhou, Y., Xiao, Y. Exosome-integrated titanium oxide nanotubes for targeted bone regeneration. Acta Biomaterialia. 86, 480-492 (2019).
- Wang, X., et al. Exosomes influence the behavior of human mesenchymal stem cells on titanium surfaces. Biomaterials. 230, 119571 (2020).
- Lozano-Ramos, I., et al. Size-exclusion chromatography-based enrichment of extracellular vesicles from urine samples. Journal of Extracellular Vesicles. 4, 27369 (2015).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Liu, J., et al. Isolation and characterization of extracellular vesicles from adult schistosoma japonicum. Journal of Visualized Experiments: JoVE. (135), e57541 (2018).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , (2021).
- Chouirfa, H., Bouloussa, H., Migonney, V., Falentin-Daudré, C. Review of titanium surface modification techniques and coatings for antibacterial applications. Acta Biomaterialia. 83, 37-54 (2019).
- Córdoba, A., Monjo, M., Hierro-Oliva, M., González-Martín, M. L., Ramis, J. M. Bioinspired quercitrin nanocoatings: A fluorescence-based method for their surface quantification, and their effect on stem cell adhesion and differentiation to the osteoblastic lineage. ACS Applied Materials and Interfaces. 7 (30), 16857-16864 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved