需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
血小板衍生的Ti植入物的细胞外囊泡功能化
摘要
在这里,我们提出了一种分离来自血小板裂解物(PL)的细胞外囊泡(EV)的方法及其用于包衣钛(Ti)植入物表面的方法。我们描述了滴铸涂层方法,电动汽车从表面的释放曲线,以及电动汽车涂层Ti表面的 体外 生物相容性。
摘要
细胞外囊泡(EV)是生物纳米囊泡,在细胞通讯中起关键作用。其含量包括蛋白质和核酸等活性生物分子,在再生医学中具有巨大的潜力。最近,来自血小板裂解物(PL)的EV显示出与PL相当的成骨能力。此外,生物材料经常用于骨科或牙齿修复。在这里,我们提供了一种用PL衍生的EV功能化Ti表面的方法,以改善其成骨性能。
通过尺寸排阻色谱法从PL中分离出EV,然后通过滴铸将Ti表面与PL-EV功能化。功能化通过EV释放和乳酸盐脱氢酶(LDH)释放测定的生物相容性得到证明。
引言
EV是由任何细胞分泌的膜囊泡(30-200nm),通过传递其货物在细胞间通信中起着关键作用。它们含有多种活性生物分子,其中可能包括核酸、生长因子或生物活性脂质1。由于这些原因,电动汽车已被评估其在治疗中的潜在用途。在骨科和骨再生方面,来自不同来源的EV已经过测试。其中,血小板衍生的EV已被证明可以诱导干细胞的分化作用,同时保持低细胞毒性2,3。因此,需要进一步的研究来探索将EV与生物材料相结合的可能性,以便在日常临床实践中使用它们。
钛基生物材料由于其机械性能、高生物相容性和长期耐用性,被广泛用作骨愈合临床干预的支架4。然而,Ti植入物是一种生物惰性材料,因此与周围骨组织的结合能力较差5。因此,正在研究钛改性,以便通过在其表面实现功能更强大的微环境来提高其性能4,6,7。从这个意义上说,电动汽车可以通过化学8 或物理相互作用与钛锚定9,10。来自干细胞或巨噬细胞的固定化EV通过促进细胞粘附和增殖来增强Ti的生物活性,从而诱导成骨作用8,9,10。
本文将重点介绍使用PL衍生的EV涂覆Ti表面的液滴铸造策略。此外,我们将评估EV在一段时间内从包被表面的释放曲线,并在 体外确认其细胞生物相容性。
研究方案
血小板裂解物(PL)按照先前所述使用IdISBa生物库提供的新鲜白蛋白涂层作为起始材料获得,符合机构指南3 。它们在当前项目中的使用得到了其道德委员会的批准(IB 1995/12 BIO)。
1. 电动汽车与PL隔离
- 较大的身体移除
- 在室温下解冻PL。
- 在4°C下以1,500× g 离心PL15分钟。 丢弃含有细胞碎片的沉淀。
- 收集上清液并在4°C下以10,000× g 连续离心30分钟。
注意:沉淀对应于较大的EV,例如微泡,在这种情况下,它被丢弃。 - 过滤上清液首先通过0.8μm多孔膜,然后通过0.2μm多孔膜。
注意:这些步骤将删除所有不需要的电动汽车。 - 将过滤后的PL池化并储存在-20°C直至使用。
- 尺寸排阻色谱
- 用过滤的PBS以所需的流速平衡耦合到色谱设备的色谱柱。
注:使用的流速取决于色谱柱特性;在这种情况下,它被设置为0.5毫升/分钟。 - 用注射器将处理后的PL(5 mL)装载到设备上。
- 将PL注入色谱柱中,并开始在15 mL管中收集5 mL级分。
- 收集EV富集馏分并将其储存在-80°C直至使用。
注意:首次进行实验时,通过蛋白质定量和免疫检测表征所有组分,以确定富含EVs的组分3,11。在这个实验中,收集了第 9个分数。 - 用30mL的0.2%NaOH溶液洗涤色谱柱,一旦达到平衡,将其储存在20%乙醇溶液中。
- 用过滤的PBS以所需的流速平衡耦合到色谱设备的色谱柱。
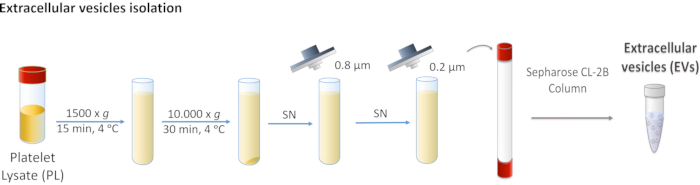
图1:血小板裂解物(PL)细胞外囊泡(EV)分离的示意图。 PL首先以1,500 x g 离心,然后以10,000 x g 离心以除去较大的主体。上清液通过0.8和0.2μm过滤器过滤。将处理后的PL加载到色谱柱上,并通过尺寸排阻色谱分离EV。 请点击此处查看此图的放大版本。
2. 电动汽车特性描述
注:EV表征是进行功能研究所必需的12。电子显微镜或蛋白质印迹表征以前已有报道13。本报告将重点介绍Ti表面功能化的基本表征技术。
- 纳米颗粒跟踪分析
- 将EV(1:1000)稀释在0.2μm过滤的PBS中。
注意:过于浓缩的样品或太稀释的样品将超出NTA测定的范围,并且需要进行调整。 - 用注射器将1 mL稀释的EV加载到NTA设备中,并将其注入NTA设备。
- 遵循制造商的颗粒浓度和尺寸分布测定协议。
- 将EV(1:1000)稀释在0.2μm过滤的PBS中。
- 蛋白质浓度
- 使用1μLEV溶液测定浓度。使用分光光度计测量波长为280nm的吸光度。
注意:与颗粒数量相比,电动汽车的蛋白质水平应该较低。 - 按照制造商的说明使用分光光度计获取吸光度读数。
- 使用1μLEV溶液测定浓度。使用分光光度计测量波长为280nm的吸光度。
3. 钛表面功能化
注:在这种方法中,使用机加工的钛圆盘,c.p.等级IV,直径6.2毫米,高度2毫米。这些光盘可以用Ti镊子操纵,但重要的是不要划伤表面。此外,在整个过程中,机加工侧必须朝上。
- 钛盘清洗
注:用于Ti洗涤的溶液体积应足以覆盖Ti盘。将Ti圆盘放入玻璃烧杯中,并将溶液倒入其中。然后,通过倾析取溶液。- 用去离子(DI)水清洗Ti植入物,然后丢弃水。
- 用乙醇洗涤Ti植入物70%,然后倾析以除去溶液。
- 将植入物置于DI水中,并在50°C下超声处理5分钟。丢弃水。
- 将Ti植入物在40%NaOH溶液中孵育50°C并搅拌10分钟。丢弃解决方案。
注意:NaOH溶液在制备过程中会变暖。该溶液具有腐蚀性,应在通风橱内使用。 - 将植入物在50°C的DI水中超声处理5分钟,然后取出水。
- 用去离子水(至少5次)进行几次洗涤,直到达到中性pH值。使用pH指示剂检查pH值。
- 在50°C的DI水中超声处理植入物5分钟,然后取出水。
- 将Ti植入物在50°C的50%HNO3 溶液中孵育10分钟,搅拌。删除解决方案。
注意:HNO3 是一种腐蚀性和氧化性物质,应在通风橱内使用。 - 将植入物在50°C的DI水中超声处理5分钟。取出水。
- 用去离子水(至少5次)进行几次洗涤,直到获得中性pH值。使用pH指示剂检查pH值。
- 将植入物在50°C的DI水中超声处理5分钟。取出水。
注意:此时,可以通过将Ti植入物储存在70%乙醇溶液中来停止实验。
- 钛钝化
注:Ti钝化步骤是通过按下面列出的顺序用不同的溶液完全覆盖Ti光盘来执行的。将Ti圆盘放入玻璃烧杯中,并将溶液轻轻倒在上面。所有洗涤步骤中使用的体积必须完全覆盖植入物,并通过倾析去除。- 将Ti植入物在30%HNO3 溶液中孵育30分钟,在室温下温和搅拌。删除解决方案。
- 用去离子水(至少5次)进行几次洗涤,直到达到中性pH值。使用pH指示剂检查pH值。
- 将Ti植入物在室温下在DI水中孵育过夜。
- 在40°C的真空条件下干燥植入物10分钟。
- 电动汽车下降铸件
注意:对于细胞功能研究,在细胞培养柜中工作很重要。- 将Ti植入物置于96孔板中,加工面朝上。
注意:如果植入物倒置,可以使用针头将其放回去。 - 解冻电动汽车溶液,并将其与搅拌混合。使用涡旋脉冲3秒。
- 将EV沉积在Ti表面上。在这项研究中,将滴剂40μL的EV溶液滴到Ti上,根据NTA确定的浓度,每个植入物最多固定4 x 1011 个EV。
- 将含有Ti的板置于37°C的真空条件下,直到滴完全干燥(〜2小时)。
注意:根据植入物的数量和真空室中存在的水来调整时间。
- 将Ti植入物置于96孔板中,加工面朝上。
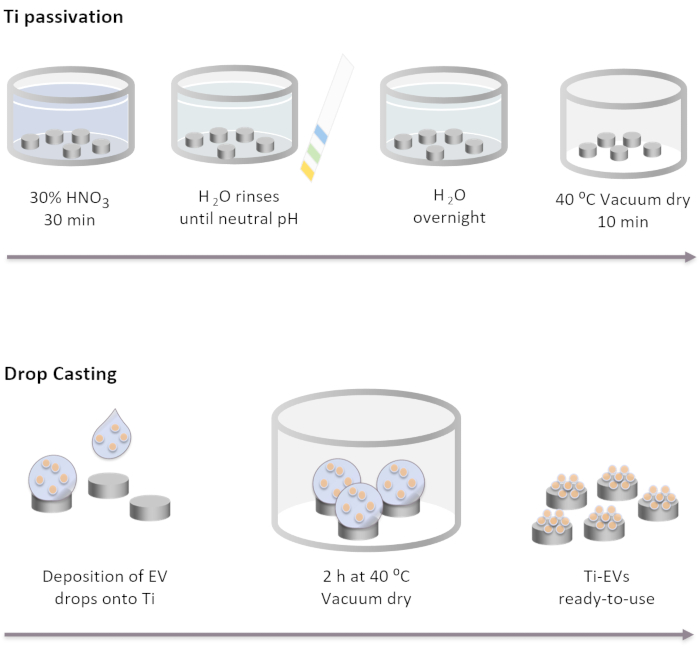
图2:Ti钝化和EV通过液滴铸造功能化的原理图。 Ti植入物首先在室温下在30%HNO3 溶液中孵育30分钟,钝化。用去离子水洗涤几次后,pH值达到中性。然后,将Ti植入物在室温下在DI水中孵育过夜。之后,植入物在40°C的真空条件下干燥。 对于EV固定化,将40μLEV溶液沉积到Ti植入物上。接下来,植入物在真空下孵育2小时,直到EV物理结合到表面。 请点击此处查看此图的放大版本。
4. Ti 表面表征
- 发布研究
- 在37°C下用200μL过滤的PBS孵育Ti表面。
注:PBS经过滤波,以避免干扰NTA测量。 - 在不同的时间点更换PBS并储存在-80°C。
注意:在这项研究中,分析了2天,6天,10天和14天的时间点。 - 根据制造商的说明,NTA分析存储的PBS以进行颗粒研究。
注:PBS中不同时间的颗粒浓度是电动汽车随时间变化的释放曲线的表示。
- 在37°C下用200μL过滤的PBS孵育Ti表面。
- 生物相容性研究
注意:人脐带来源间充质干细胞(hUC-MSC)是根据机构指南从IdISBa生物库获得的。- 在补充 20% FBS 的 DMEM 低血糖中维持 hUC-MSC,直至使用。每周更换两次培养基。
- 对于细胞接种,用5 mL PBS在烧瓶中洗涤细胞两次。
- 通过加入 1 mL 胰蛋白酶溶液对 hUC-MSC 进行胰蛋白酶消化。确保它完全覆盖细胞的单层。除去胰蛋白酶溶液并将细胞培养瓶置于37°C约2分钟。在显微镜下观察细胞脱离。分离的细胞将呈现圆形,并将处于悬浮状态。
- 将细胞重悬于 DMEM 低葡萄糖中,1% 的 EV 耗尽 FBS。
注意:准备补充有1%FBS的培养基,然后以120,000× g 超速离心18小时以除去FBS-EV。重要的是要去除EV以避免与血小板EV的干扰。 - 通过用Neubauer室计数细胞数量来确定细胞浓度14。
- 使hUC-MSC达到50,000个细胞/ mL的浓度。
- 将200μL细胞溶液接种到Ti植入物上。
- 48小时后,根据制造商的协议,收集50μL培养基并使用乳酸脱氢酶(LDH)活性试剂盒进行细胞毒性测定。
结果
本文中介绍的方法允许获得EV功能化的钛盘。电动汽车与表面物理粘合,这允许随着时间的推移持续释放。NTA可以在第2天,第6天,第10天和第14天测量释放的EV数量。第2天的第一次测量显示,大约有109 辆电动汽车被释放,然后在第6天持续释放(约108 辆电动汽车);第10天(约107 辆电动汽车)和第14天(约107 辆电动汽车)。这证实了持续释放,尽管随着时间的推移?...
讨论
该协议旨在为电动汽车在Ti表面上的功能化提供明确的说明。所提出的方法基于液滴铸造策略,这是一种物理吸附类型的功能化。关于Ti表面上的EV功能化,书目很差,尽管很少有研究表明在Ti10上固定EV具有不同的优势。无论如何,探索的一些策略包括生化结合8,聚合物截留9 或滴铸10。虽然通过共价键使用化学涂层可能会实?...
披露声明
作者没有什么可透露的。
致谢
这项研究由卡洛斯三世社会研究所资助,由欧洲社会基金和ERDF欧洲区域发展基金共同资助(MS16/00124;CP16/00124;PI17/01605)、Direcció General d'Investigació、Conselleria d'Investigació、Govern Balear (FPI/2046/2017)和PROJECTA JUNIOR DEL PROJECTE TALENT PLUS, construyendo SALUD, generando VALOR (JUNIOR01/18),由巴利阿里群岛的可持续旅游税资助。
材料
| Name | Company | Catalog Number | Comments |
| 0,8 µm syringe filter | Sartorius | 16592K | |
| 1.5 mL Centrifuge tube | SPL life sciences | PLC60015 | |
| 1mL syringe | BD | 303174 | |
| 96-well culture plate | SPL life sciences | PLC30096 | |
| Absolut ethanol | Scharlau | ET0006005P | Used to prepare 20 % ethanol with Milli-Q® water |
| AKTA purifier System | GE Healthcare | 8149-30-0014 | |
| Allegra X-15R Centrifuge | Beckman Coutler | 392934 | SX4750A swinging rotor |
| Centrifuge 5430 R | Eppendorf | 5428000210 | F-45-48-11 rotor |
| Conical Tube, Conical Bottom, 50ml | SPL life sciences | PLC50050 | |
| Cytotoxicity Detection Kit (LDH) | Roche | 11644793001 | |
| Disposable Syringes 10 ml | Becton Dickinson | BDH307736 | |
| DMEM Low Glucose Glutamax | GIBCO | 21885025 | |
| Dulbecco's PBS (1x) | Capricorn Scientific | PBS-1A | |
| Fetal Bovine Serum (FBS) Embrionic Certified | GIBCO | 16000044 | |
| Filtropur S 0.2 µm syringe filter | Sarstedt | 83.1826.001 | |
| HiPrep 16/60 Sephacryl S-400 HR | GE Healthcare | 28-9356-04 | Precast columns |
| human umbilical cord-derived mesenchymal stem cells (hUC-MSC) | IdISBa Biobank | ||
| Nanodrop 2000 spectrophotometer | ThermoFisher | ND-2000 | |
| NanoSight NS300 nanoparticle tracking analysis | Malvern | NS300 | Device with embedded laser at λ= 532 nm and camera sCMOS |
| Needle | Terumo | 946077135 | |
| Nitric acid 69,5% | Scharlau | AC16071000 | |
| Optima L-100 XP Ultracentrifuge | Beckman Coulter | 8043-30-1124 | SW-32Ti Rotor |
| Penicillin-Streptomycin Solution 100X | Biowest | L0022 | |
| pH Test strips 4.5-10.0 | Sigma | P-4536 | |
| Platelet Lysate (PL) | IdISBa Biobank | Obtained from buffy coats discarded after blood donation | |
| Polypropylene centrifuge tubs | Beckman Coutler | 326823 | |
| Power wave HT | BioTek | 10340763 | |
| Screw cap tube, 15 ml, (LxØ): 120 x 17 mm, PP, with print | Sarstedt | 62554502 | |
| Sodium hidroxide | Sharlau | SO04251000 | |
| Titanium implants replicas | Implantmedia, SA | NA | Titanium grade IV. Diameter: 6,2 mm. Height: 1,95 mm |
| Trypsin-EDTA 1 X | Biowest | L0930 | |
| Tryton X100 | Sigma | T8787 |
参考文献
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19 (4), 213-228 (2018).
- Torreggiani, E., et al. Exosomes: novel effectors of human platelet lysate activity. European Cells & Materials. 28, 137-151 (2014).
- Antich-Rosselló, M., et al. Platelet-derived extracellular vesicles promote osteoinduction of mesenchymal stromal cells. Bone and Joint Research. 9 (10), 667-674 (2020).
- Li, Y., et al. New developments of Ti-based alloys for biomedical applications. Materials. 7 (3), 1709-1800 (2014).
- Lan, W. C., et al. The potential of a nanostructured titanium oxide layer with self-assembled monolayers for biomedical applications: Surface properties and biomechanical behaviors. Applied Sciences. 10 (2), 590 (2020).
- Jemat, A., Ghazali, M. J., Razali, M., Otsuka, Y. Surface modifications and their effects on titanium dental implants. BioMed Research International. 2015, 791725 (2015).
- Damiati, L., et al. Impact of surface topography and coating on osteogenesis and bacterial attachment on titanium implants. Journal of Tissue Engineering. 9, 2041731418790694 (2017).
- Chen, L., et al. Self-assembled human adipose-derived stem cell-derived extracellular vesicle-functionalized biotin-doped polypyrrole titanium with long-term stability and potential osteoinductive ability. ACS Applied Materials & Interfaces. 11 (49), 46183-46196 (2019).
- Wei, F., Li, M., Crawford, R., Zhou, Y., Xiao, Y. Exosome-integrated titanium oxide nanotubes for targeted bone regeneration. Acta Biomaterialia. 86, 480-492 (2019).
- Wang, X., et al. Exosomes influence the behavior of human mesenchymal stem cells on titanium surfaces. Biomaterials. 230, 119571 (2020).
- Lozano-Ramos, I., et al. Size-exclusion chromatography-based enrichment of extracellular vesicles from urine samples. Journal of Extracellular Vesicles. 4, 27369 (2015).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Liu, J., et al. Isolation and characterization of extracellular vesicles from adult schistosoma japonicum. Journal of Visualized Experiments: JoVE. (135), e57541 (2018).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , (2021).
- Chouirfa, H., Bouloussa, H., Migonney, V., Falentin-Daudré, C. Review of titanium surface modification techniques and coatings for antibacterial applications. Acta Biomaterialia. 83, 37-54 (2019).
- Córdoba, A., Monjo, M., Hierro-Oliva, M., González-Martín, M. L., Ramis, J. M. Bioinspired quercitrin nanocoatings: A fluorescence-based method for their surface quantification, and their effect on stem cell adhesion and differentiation to the osteoblastic lineage. ACS Applied Materials and Interfaces. 7 (30), 16857-16864 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。