Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
BiFC-FRET-FLIM Tahlilinde MADS Kutusu Transkripsiyon Faktörünün İki Monomeri ile Kalsiyum Sensör Proteini Arasındaki Üçlü Etkileşimin Belirlenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, BiFC tabanlı FRET-FLIM test tarafından floresan etiketli proteinler kullanarak üç protein ortağı arasındaki üçlü kompleks oluşumunu görselleştirmek için bir yöntem sunuyoruz. Bu yöntem, protein-proteinetkileşim komplekslerini vivo olarak incelemek için değerlidir.
Özet
Protein-protein etkileşimleri hücresel fonksiyonların düzenlenmesinde, sürdürülmesinde ve değiştirilmesinde çok önemli bir rol oynadıkları için hücrelerdeki tüm biyolojik süreçlerin ayrılmaz bir parçasıdır. Bu etkileşimler sinyal transdüksiyon, patojen yanıtı, hücre-hücre etkileşimleri, metabolik ve gelişimsel süreçler gibi çok çeşitli fenomenlerde yer almaktadır. Transkripsiyon faktörleri söz konusu olduğunda, bu etkileşimler alt ünüllerin oligomerizasyonuna, çekirdek, sitoplazma vb. Burada, Floresan Ömür Boyu Görüntülemeyi (FLIM) içeren Bimoleküler Floresan Kompleasyonu (BiFC) tabanlı Förster Rezonans Enerji Transferi (FRET) kullanarak in vivo üçlü etkileşimi görselleştirmek için bir metodoloji sunuyoruz. Bu gösteri için seçilen proteinlerden ikisi BiFC ortağı olarak etkileşime girer ve yeniden inşa edilen floresan aktiviteleri üçüncü ortakla FRET-FLIM'i test etmek için kullanılır. Dört ila beş haftalık büyüme odası tarafından yetiştirilen Nicotiana benthamiana bitkileri bu gösteri için model bitki sistemi olarak kullanılmıştır.
Giriş
Protein-protein etkileşimleri (PPI'ler) çeşitli metabolik ve gelişimsel süreçleri düzenleyerek ökaryotik hücrelerin düzgün çalışmasının temelini oluşturur. Bazı PPI'lar kararlıdır, bazıları ise doğada geçicidir. Etkileşimler, dimerik, trimerik, tetramerik homomerik ve heteromerik1gibi etkileşimdeki üye sayısına ve türüne göre kategorize edilebilir. Protein etkileşimlerinin tanımlanması ve karakterizasyonu, protein fonksiyonlarının ve düzenleyici ağların daha iyi anlaşılmasına neden olabilir.
Transkripsiyon faktörleri düzenleyici işlevlerde yer alan proteinlerdir. DNA'ya bağlanarak aşağı akış genlerinin transkripsiyon oranını düzenlerler. Bazen proteinler tarafından oligomerizasyon veya daha yüksek sıralı komplekslerin oluşumu, işlevlerini yerine getirmek için bir ön koşuldur2. Bitki MADS kutusu transkripsiyon faktörleri çiçek geçişi, çiçek organ gelişimi, gübreleme, tohum gelişimi, senescence ve vejetatif gelişim gibi çeşitli süreçleri düzenleyen homeotik genlerdir. DNA3,4'e bağlanan daha yüksek sıralı kompleksler oluşturdukları bilinmektedir. Transkripsiyon faktörleri ve etkileşimcileri arasında ÜFE ağlarının incelenmesi, transkripsiyonsal düzenlemenin altında kalan karmaşıklık hakkında içgörüler sağlar.
Nicotiana benthamiana'da geçici protein ekspresyasyonu, protein lokalizasyonunu veya protein-protein etkileşimlerini incelemek için popüler bir yaklaşımolmuştur 5. BiFC ve FRET, floresan muhabir sistemlerini kullanarak in vivo protein-protein etkileşimlerini incelemek için yöntemlerdir6. Bu iki tekniğin bir kombinasyonunun üç protein arasındaki etkileşimi ortaya çıkardığı gösterilmiştir7. FRET, kabul edici fotobleaching, duyarlı emisyon ve Floresan Ömür Boyu Görüntüleme (FLIM) tekniği kullanılarak ölçülür. FLIM tabanlı FRET tahlilleri, floresan ömürlerine göre iki molekül arasındaki enerji transferi ölçümlerine doğru nicelik ve mekansal özgüllük sağlayan bir araç olarak ortaya çıkmıştır8. FLIM, bir foton yaymadan önce bir flororforun heyecanlı bir durumda kaldığı zamanı ölçen ve sadece yoğunluk ölçümlerini kullanan tekniklerden daha iyidir9,10. Nicotiana benthamiana ve soğan epidermal peelingleri gibi heterolog sistemlerin yanı sıra, daha yeni raporlar, yerelkoşullaraltında protein-protein etkileşimlerinin in vivo analizi için Arabidopsis köklerinin ve genç pirinç fidelerininvb.
Uygun bir ifade sistemi dışında, BiFC ve FRET tahlilleri için etkileşime giren ortakların seçimi de bu deneyin başarısı için çok önemlidir. BiFC yapılandırmasında kullanılan ortaklar arasındaki ÜFE, FRET denemesinde eşleştirilmiş bir ortak olarak kullanılmadan önce uygun denetimler kullanılarak doğrulanmalıdır13. BiFC, floresan proteinin N ve C-terminal parçalarının yapısal tamamlayıcısını kullanır. BiFC tahlillerinde kullanılan tüm floresan proteinlerin çoğunda yaygın bir sınırlama, iki türev nonfluoresan parçası arasındaki kendi kendine montaj olmuştur, yanlış-pozitif floresanlara katkıda bulunur ve sinyal-gürültü (S / N) oranınıazaltır 14. Nokta mutasyonları veya floresan proteini bölme pozisyonu da dahil olmak üzere son gelişmeler, artan yoğunluk, daha yüksek özgüllük, yüksek S / N oranı15,16ile BiFC çiftlerine yol açtı. Bu floresan proteinler, deneyin uygunluğuna bağlı olarak BiFC'yi gerçekleştirmek için de kullanılabilir.
Geleneksel olarak, CFP ve YFP, FRET deneylerinde donör ve alıcı çift olarak kullanılmıştır17. Bununla birlikte, YFP veya m-Sitrin'in Arabidopsis kök sisteminde hedef proteinlerin doğal ekspresyumu sırasında yüksek kuantum verimi (QY) nedeniyle daha iyi FRET donörleri (kabul eden olarak RFP ile kullanıldığında) olduğu bulunmuştur. Organizatörlerin seçimi (konsitutive versus native/endogenous) ve fluorophore da başarılı bir BiFC-FRET-FLIM deneyi tasarlamada çok önemli bir rol oynamaktadır. FRET donörlerinin verimliliğinin ve FRET çiftlerinin uygunluğunun, organizatördeki değişiklik ve ifade için kullanılan biyolojik sistemle değişme eğiliminde olduğunu belirtmek önemlidir. Parlaklığı ile ilgili floroforun QY'si pH'a, sıcaklığa ve kullanılan biyolojik sisteme bağlıdır. FRET deneyi için florofor çiftini seçmeden önce bu kriterlerin iyice dikkate alınmasını öneriyoruz. Bu protokol için kullanılan biyolojik sistem, promotörler ve proteinler BiFC FRET-FLIM deneyi için CFP-YFP floroforları ile iyi çalıştı.
Bu çalışmada, BiFC tabanlı FRET kullanarak üç protein molekülü arasındaki etkileşimi görselleştirmek için FLIM özelliğini birleştiriyoruz. Bu teknikte, iki protein bölünmüş YFP proteini ve üçüncü protein CFP ile etiketlenir. Mads kutusu protein (M) homodimerinin Kalsiyum sensör proteini (C) ile etkileşimini incelemek istediğimizden, bu proteinler pSITE-1CA ve pSITE-3CA vektörlerinde floresan proteinlerle etiketlenmiştir18. Etkileşime giren ortaklardan ikisi, bu testte, pSPYNE-35S ve pSPYCE-35S vektörlerinde YFP'nin N ve C-terminal parçaları ile etiketlenmiştir veetkileşimleri,CFP (FRET donörü olarak hareket eden) ile etiketlenen üçüncü etkileşim ortağına FRET kabul edicisi olarak hareket eden işlevsel YFP'nin yeniden birleşmesi ile sonuçlanır (Şekil 1 ). Bu özel durumda, iki M monomeri ile M ve C arasındaki PPI, BiFC'nin maya-iki-hibrid sistemle birlikte üç farklı sistemde gerçekleştirilmesiyle doğrulanmıştır. Bu vektörler elektroporasyon ile Agrobacterium tumifaciens GV3101 suşu içine harekete geçirildi. GV3101 suşu, gentamisin direnci20olan etkisiz hale tedaklı bir Ti plazmid pMP90'a (pTiC58DT-DNA) sahiptir. Transgene susturma önlemek için tüm infiltratyonlarla birlikte bir p19 Agrobacterium suşu eklendi21. Üç proteinin üçlü etkileşimleri doğrulamak için zıt konformasyonlarda da kullanılmasını öneririz.
Bu teknikte, ilk olarak, bağışçının floresan ömrünün (söndürülmemiş donör ömrü) bir alıcının yokluğunda ölçüldüğü FLIM'i çalıştırdık. Bundan sonra, ömrü alıcının varlığında ölçülür (söndürülen donör ömrü). Donör floresan ömürlerindeki bu fark, floresan ömründe bir azalma gösteren foton sayısına bağlı olan FRET verimliliğini hesaplamak için kullanılır. Aşağıda, Nicotiana benthamiana'daki floresan etiketli proteinleri geçici olarak ifade ederek ve BiFC-FRET-FLIM ile etkileşimlerini test ederek herhangi bir üç protein arasında üçlü bir kompleks oluşumunu belirlemek için ayrıntılı bir protokol verilmiştir.
Protokol
1. Giriş ve varış vektörlerindeki genlerin klonlatma (Şekil 2)
- İlgi genlerinin (bizim durumumuzda M ve C genleri) kodlama sırasını (CDS) PCR ile güçlendirin ve uygun giriş vektörlerinde (örneğin, pENTR/D-TOPO vektörü) klonlayın; Bu denemede kullanılan vektörler için Tablo 1'e bakın).
- Klonları antibiyotik içeren plakalarda yetiştirin. Antibiyotikler üzerinde seçilen klonları,22,23'üsınırlandırarak ve DNA dizileme yaparak doğrulayın.
- Yeniden inşa edilen CDS'leri giriş klonlarından hedef vektörlere (pSPYNE-35S, pSPYCE-35S, pSITE-1CA ve pSITE-3CA) harekete geçirin ve dizilerin girişten hedef vektörlere transferini kısıtlama enzim sindirimi ile onaylayın.
NOT: Bu denemede kullanılan tüm vektörler Tablo 1'de listelenmiştir. - Son olarak, Agrobacterium GV3101 (pMP90 (GentR))hücrelerini hedef vektörlerle elektroporasyonla dönüştürün (Şekil 3)24.
2. Nicotiana benthamiana bitkileri için büyüme koşulları
NOT: Nicotiana bitkilerini kontrol koşullarında 4-6 yaprak aşamasına kadar yetiştirin.
- Nicotiana bitkilerini yetiştirmek için, piyasada bulunan toprak karışımlarını 2:1:1 oranında kakao ve kompost ile karıştırarak toprak karışımını hazırlayın.
- Toprak yatağı yapmak ve deiyonize suyla doyurmak için bu toprak karışımının 1 inç kalınlığında bir tabakasını plastik bir tepsiye yayın. Bu toprak yatağa yaklaşık 200 tohum serpin.
- 1 cm duran su içeren daha büyük bir tepsiye aktarın. Nem odası oluşturmak için bu tepsiyi plastik sargı ile örtün.
- Bu seti 16 saat açık ve 8 saat karanlık döngü ile 23 °C'de 150-170 μmol/m2s ışık yoğunluğuna sahip bir büyüme odasına aktarın.
- İki hafta sonra, genç fideleri suya doymuş toprak karışımı içeren küçük, 3-4 inç saksılara aktarın.
- Bu saksıları plastik tepsilere yerleştirin ve dört hafta daha büyüme odasına aktarın.
3. Agro-infiltration için bakteriyel suşlar hazırlayın
NOT: Agro-infiltration için bakteriyel suşların taze alt kültüre edilmesi ve uygun oranlarda p19 Agrobacterium suşu ile karıştırılması gerekir.
- pSPYNE-35S ve pSPYCE-35S vektörü barındıran Agrobacterium için rifampicin (100 μg/mL), gentamisin (25 μg/mL) ve kanamycin (50 μg/mL) içeren 2xYT agar plakaları hazırlayın. Gerinim içeren pSITE vektörü için rifampicin (100 μg/mL), gentamisin (25 μg/mL) ve spektinomisin (50 μg/mL) kullanın.
- Laminer akış davlumbazında steril aşılama döngüleri kullanarak bu plakalardaki plazmidleri içeren Agrobacterium suşlarını çizgile.
- Bunları 28 °C'de karanlıkta 48 saat kuluçkaya yatır.
- BiFC ve FRET yapılarını barındıran Agrobacterium GV3101 suşu aşılayarak bu prosedüre başlayın (pSPYNE-35S'de hazırlanmıştır, pSPYCE-35S ve pSITE vektörleri) uygun antibiyotikler içeren 2xYT suyunun 10 mL'sinde çizgili plakalardan (Rifampicin (100 μg) /mL), gentamisin (25 μg/mL), kanamycin (50 μg/mL) veya spektinomisin (50 μg/mL)).
- Ek olarak, rifampicin (100 μg/mL) ve kanamycin (50 μg/mL) içeren 10 mL 2xYT et suyu aşılayarak p19 Agrobacteria suşu kültürünü başlatın.
NOT: Transgene susturma önlemek için p19 suşu eklenir. - Matarayı alüminyum bir folyo ile örtün ve karanlıkta 16 saat boyunca 28 °C ve 170 rpm'de ayarlanmış inkübatör çalkalayıcıda tutun.
- Bir gecede büyümeden sonra, spektrofotometre kullanarak 600 nm'de kültürlerin optik yoğunluğunu (O.D.) ölçmek için bu kültürün 1 mL'lik kısmını tek kullanımlık bir cuvette'e aktarın.
- Her kültürün son O.D.'si 0,5 ve p19'unki 2 mL'lik toplam hacimde 0,3 olacak şekilde suşlar içeren uygun BiFC ve FRET ortağının kültürlerini karıştırın.
- Bu oranlara ulaşmak için aşağıda belirtilen formülü kullanın:
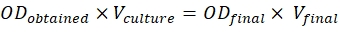
Eldeedilen OD = 600 nm olarak ölçülen kültürün O.D.
Vkültürü = Gereken kültürün hacmi
ODfinali = yapılar için 0,5 ve p19 için 0,3
Vfinali = 2 mL olan sızma için son hacim
NOT: Bu çalışmada kullanılan yapı kombinasyonları Tablo 2'de belirtilmiştir. - Karışık Agrobacterium kültürlerini oda sıcaklığında 5 dakika boyunca 3.000 x g'da santrifüj edin ve süpernatantı dikkatlice atın. Peletin 2 mL taze hazırlanmış sızma tamponunda (10 mM MES, 100 μM Asetosyringone ve 10 mM MgCl2)yeniden canlandırıldığını. Homojen bir hücre süspansiyonu yapmak için bir girdap karıştırıcı kullanın.
- Resüspended hücreleri içeren tüpleri oda sıcaklığında 3 saat boyunca inkübte edin.
- Bu arada, her bitki saksısını içine sızacağı yapı karışımıyla etiketleyin. Her sızma karışımı için iki bitki kullanın.
- 1 mL iğnesiz şırıngayı agrobakteriyal karışımla doldurun. Şırınnayı tamamen genişletilmiş yaprağın abaksiyel tarafına hafifçe ama sıkıca bastırın ve yaprağı diğer taraftan destekleyin. Çözeltiler şırıng ucunun 2-3 katına eşdeğer yaprak bölgesinde dolana kadar pistonu hafifçe itin.
- Şekil 4'tegösterildiği gibi, bir yaprak üzerinde dört noktaya ve bitki başına 3-4 yaprak sızın.
NOT: Çapraz kontaminasyonu önlemek için eldivenleri değiştirin veya numuneler arasında %70 alkol içeren eldivenleri silin. - Tüm tencereleri bir tepsiye aktarın ve 2.
- Agroinfiltrated yaprağın küçük bir kısmını floresan mikroskobu kullanarak farklı zaman noktalarında kontrol edin. Hücrelerde hem YFP hem de CFP floresan tespit edildiğinde, BiFC-FRET FLIM tahlil için konfokal mikroskopa geçin. Bu deneyde, analiz agro-infiltrationdan 3 gün sonra gerçekleştirildi.
NOT: BiFC-FRET FLIM testinde kullanılan kimerik proteinlerin aşırı ekspresyonunu önlemek için her organizatör ve gen kombinasyonu için kuluçka sonrası dönemi ayrı ayrı ayarlayın. Partner proteinlerin aşırı ekspresyonu yanlış-pozitif etkileşimlere yol açabilir.
4. Floresan görselleştirme için slaytlar hazırlayın
- Bitkiler görselleştirmeye hazır olduğunda, sızma yarasından 5-8 mm uzakta kare yaprak örneklerini kesin ve temiz slaytlarda damıtılmış suya monte edin.
NOT: Arka plan floresanını en aza indirmek için, slaytları% 80 etanol ve ardından 3-4 kez damıtılmış su ile temizleyin, havayla kurutun ve emici bir tabaka üzerinde tutun. - Yaprak örneğini temiz bir kapakla örtün ve bir tırnak minesi kullanarak mühürleyin.
- Bu örnekleri konfokal lazer tarama mikroskobu altında görselleştirin.
5. Konfokal lazer tarama mikroskobu kullanılarak FRET-FLIM analizi
NOT: Bu prosedürde, iki protein arasındaki etkileşimi belirlemenin ve ölçmenin temeli, FRET'in verimliliğini hesaplamak için kullanılan kabul edenle etkileşimi üzerine FRET-donör ortağının floresan ömrünün azalmasıdır. Üçlü etkileşim durumunda karmaşıklık daha da artar, çünkü FRET-kabul edici, bu durumda, tek bir molekül değil, işlevsel bir FRET-kabul edici florofor olmak için in vivo olarak yeniden inşa edilmesi gereken bölünmüş bir YFP-BiFC çiftidir. FRET-FLIM'i gerçekleştirmek için, donör molekülün floresan ömrünün tek başına ve daha sonra bir FRET ortağının varlığında belirlenmesi gerekir.
- FLIM uygulamasını konfokal lazer tarama mikroskobunda açın, konsolu başlatın ve floresan ömrünü ölçmek için desen tanıma foton sayımını kullanın. Standart 'Tüm foton sayımı' ölçüm modunu seçin.
- İki tür tarıma sızmış bitkiden alınan örnekleri analiz edin: biri sadece donörle (C-CFP) diğeri donör ve alıcı (C-CFP, M-YFP ile birlikte) ile.
NOT: M proteininin etkileşimi BiFC ve Y2H kullanılarak C proteini ile zaten doğrulandığından, bu etkileşim çifti ile iyi FRET verimliliği beklenmiştir. - Ardından, C-CFP agro-infiltrated yaprağı tarayın ve iyi CFP floresan gösteren bir hücreye odaklanın. Lazer tarama modunu başlatın ve CFP görselleştirme ve FLIM ölçümleri için sistemi ayarlayın(φ ex 440 nm darbe lazer, hibrit dedektörler tarafından φem 480-520 nm, Tarama hızı 512 x 512 piksel 400 Hz).
- Yakalanması gereken alana odaklanmak için odağı, yakınlaştırmayı ve akıllı kazancı ayarlayın.
- Darbe başına yaklaşık 0,1 foton yakalamayı sağlamak için numuneyi yeterli lazer gücüyle aydınlatın. Değişken floresan yoğunluğuna sahip numuneler için, ömür boyu ölçüm için gerekli yeterli fotonları toplamak için 50 kare yakalayın. CFP, konformasyonsal adaptasyonu nedeniyle iki floresan ömrü sergiler; bu nedenle, n değerini 2'ye eşit tutarken n-üstel reconvolution modelini kullanarak verileri sığdırın.
- Bu ayarlarda CFP, 1.0 ve 3.2 ns'lik iki ömür gösterir. Burada daha yüksek, 3.2 ns, sonraki tüm hesaplamalar için ömürkullanılır 25,26.
- İki protein arasındaki etkileşim derecesinin ölçüsü olan FLIM kullanarak FRET verimliliğini hesaplamak için, C-CFP ve M-YFP ile birlikte sızmış bir yaprak örneği alın. Hem C-CFP hem de M-YFP'yi ifade eden bir hücre arayın ve φex 440 nm darbe lazeri, φem 480-520 nm ve φex 514 nm beyaz ışık lazeri kullanarak heyecanlandırarak ilgili emisyon modellerini onaylayın. Hem CFP hem de YFP floresanını gösteren bir hücreyi sırayla tarayın ve tanımlayın.
- Her iki proteinden de floresan doğruladıktan sonra, C-CFP'nin ömrünü ölçmek için daha önce kullandığımız ayarları kullanarak CFP'nin ömrünü ölçmek için FLIM konsoluna geçin (adım 5.5).
NOT: Bu hücre ayrıca C-CFP ile potansiyel olarak etkileşime girebilen ve C-CFP ömründe bir azalmaya neden olabilen M-YFP'yi ifade ediyor. - n-üstel rekonsvolution modeli kullanılarak elde edilen grafiği n = 2 ile sığdırın. CFP ve YFP arasında Förster rezonans enerji transferini gösteren CFP ömründe 3,2 ila 2,6 ns arasında bir azalma gözlenmiştir (Şekil 5A).
- Şimdi yazılımda FRET konsolunu başlatın ve yazılımda sağlanan denkleme söndürülmemiş donör ömrünü manuel olarak girerek FRET verimliliğini hesaplayın. Ve gözlemlenen FRET verimliliği: % 56.
- Üçlü etkileşim
- Son olarak, üç ortak arasındaki etkileşimleri görselleştirmek için, yaprak örneğini C-CFP, M-YFPn ve M-YFPc ile birlikte sızmış bir tesisten alın.
- İki M proteini arasındaki BiFC etkileşiminden kaynaklanan hem CFP hem de yeniden inşa edilmiş YFP floresanını gösteren bir hücre için yaprak eksplantını tarayın. Daha önce kullanılan lazer ve emisyon dalga boylarını kullanın.
- Ardından, 514 nm lazeri kapatın ve FLIM konsoluna geçin.
NOT: M-YFP dimer C-CFP ile etkileşime girerse, M-YFP ile etkileşimi sırasında gözlendiği gibi C-CFP ömründe bir azalma görülmelidir. Ancak, C-CFP M-YFP dimer ile etkileşime giremezse, floresan ömrü 3,2 ns'de kalmalıdır. - Yukarıda belirtildiği gibi benzer ayarları kullanarak, cfp ömrünü yeniden inşa edilmiş YFP'nin varlığında ölçün. n-üstel rekonsvolution modeli kullanılarak elde edilen grafiği n = 2 ile takın ve FRET konsoluna geçin.
NOT: CFP ömründe 3,2 ila 2,3 ns arasında bir düşüş vardır. Yukarıda açıklandığı gibi FRET verimliliğini hesaplayın. Hesaplanan FRET verimliliği% 55'tir. Donör ömründeki azalma ve % 55'lik iyi FRET verimliliği, iki M proteini ile C protein in vivo arasındaki üçlü etkileşimi doğrular (bkz. Şekil 5B).
Sonuçlar
Bu protokol, bitkilerdeki vivo üçlü protein-protein etkileşimlerini incelemek için optimize edilmiş bir yöntemi temsil eder. Protokolün temel ilkesi, üç protein ortağı arasındaki üçlü kompleks oluşumunu ölçmek için bir test oluşturmak için iki floresan etiketli protein etkileşimi tekniğini, yani BiFC ve FRET'i birleştirmektir. Burada FRET bağışçısının varlığında ve yokluğunda FRET donör ortağının floresan ömrünü ölçmek için FLIM'i kullandık. İki protein arasında o...
Tartışmalar
Mevcut protokol, MADS kutu proteininin iki monomeri ile kalsiyum sensör proteini arasında üçlü bir kompleks oluşumunu belirlemek için BiFC tabanlı FRET-FLIM testinin kullanımını göstermektedir. Protokol, Y. John Shyu ve ark. tarafından hazırlanan ve Fos-Jun heterodimers ile NFAT veya p65 arasında oluşturulan üçlü kompleksi hassaslaştırılmış emisyon yöntemi7kullanarak görselleştirmek için BiFC tabanlı bir FRET yöntemi geliştirdikleri bir rapordan uyarlanmıştır. Dah...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan eder.
Teşekkürler
NB, GG, SB, KC, üniversite hibe komisyonuna (UGC), UGC-BSR, DBT-INSPIRE ve Bilimsel ve Endüstriyel Araştırma Konseyi'ne (CSIR) araştırma bursları için içtenlikle teşekkür eder. Biyoteknoloji Departmanı (DBT), Hindistan Hükümeti, Bilim ve Teknoloji Bakanlığı (DST-FIST), Hindistan Hükümeti'ni finansal destek için çok şükür kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 ml Syringes without needles | Dispovan | - | |
| Acetosyringone | Sigma-Aldrich | D134406 | |
| Gateway LR Clonase II Enzyme mix | Thermo Fischer Scientific | 11791020 | The vectors used in the study are Gateway based |
| Gentamycin Sulphate | Himedia | CMS461 | |
| Kanamycin Sulphate | Himedia | MB105 | |
| MES hydrate | Sigma-Aldrich | M2933 | |
| MgCl2 | Sigma-Aldrich | M2670 | |
| pENTR/D-TOPO Cloning Kit | Thermo Fischer Scientific | K240020 | The vectors used in the study are Gateway based |
| Phusion high fidelity Taq DNA polymerase | Thermo Fischer Scientific | F530-S | Any High fidelity Polymerase can work |
| Rifampicin | Himedia | CMS1889 | |
| SP8 FALCON Confocal laser scanning microscope | Leica | SP8 FALCON | Any CLSM with FLIM capabilities can be used for this analysis |
| Spectinomycin dihydrochloride pentahydrate | Himedia | TC034 |
Referanslar
- Grove, C. A., Walhout, A. J. M. Transcription factor functionality and transcription regulatory networks. Molecular Biosystem. (4), 309-314 (2008).
- Amoutzias, G. D., Robertson, D. L., Van de Peer, Y., Oliver, S. G. Choose your partners: dimerization in eukaryotic transcription factors. Trends in Biochemical Sciences. 33 (5), 220-229 (2008).
- Arora, R., et al. MADS-box gene family in rice: genome-wide identification, organization and expression profiling during reproductive development and stress. BMC Genomics. 8 (242), (2007).
- Theißen, G., Gramzow, L. Structure and evolution of plant MADS domain transcription factors. Plant Transcription Factors: Evolutionary, Structural and Functional Aspects. , 127-138 (2016).
- Schweiger, R., Schwenkert, S. Protein-protein interactions visualized by bimolecular fluorescence complementation in tobacco protoplasts and leaves. Journal of Visualized Experiments: JoVE. (85), (2014).
- Bracha-Drori, K., et al. Detection of protein-protein interactions in plants using bimolecular fluorescence complementation. Plant Journal. 40 (3), 419-427 (2004).
- Shyu, Y. J., Suarez, C. D., Hu, C. Visualization of ternary complexes in living cells by using a BiFC-based FRET assay. Nature Protocols. 3 (11), 1693-1702 (2008).
- Kwaaitaal, M., Keinath, N. F., Pajonk, S., Biskup, C., Panstruga, R. Combined bimolecular fluorescence complementation and förster resonance energy transfer reveals ternary SNARE complex formation in living plant cells. Plant Physiology. 152 (3), 1135-1147 (2010).
- Margineanu, A., et al. Screening for protein-protein interactions using Förster resonance energy transfer (FRET) and fluorescence lifetime imaging microscopy (FLIM). Scientific Reports. 6, (2016).
- Datta, R., Heaster, T. M., Sharick, J. T., Gillette, A. A., Skala, M. C. Fluorescence lifetime imaging microscopy: fundamentals and advances in instrumentation, analysis, and applications. Journal of Biomedical Optics. 25 (07), 1 (2020).
- Long, Y., et al. Optimizing FRET-FLIM labeling conditions to detect nuclear protein interactions at native expression levels in living Arabidopsis roots. Frontiers in Plant Science. 9, 1-13 (2018).
- Burman, N., Chandran, D., Khurana, J. P. A Rapid and highly efficient method for transient gene expression in rice plants. Frontiers in Plant Science. , 11 (2020).
- Kudla, J., Bock, R. Lighting the way to protein-protein interactions: Recommendations on best practices for bimolecular fluorescence complementation analyses. Plant Cell. 28 (5), 1002-1008 (2016).
- Shyu, Y. J., Hu, C. D. Fluorescence complementation: an emerging tool for biological research. Trends in Biotechnology. 26 (11), 622-630 (2008).
- Kodama, Y., Hu, C. D. An improved bimolecular fluorescence complementation assay with a high signal-to-noise ratio. BioTechniques. 49 (5), 793-803 (2010).
- Kodama, Y., Hu, C. D. Bimolecular fluorescence complementation (BiFC): A 5-year update and future perspectives. BioTechniques. 53 (5), 285-298 (2012).
- Piston, D. W., Kremers, G. J. Fluorescent protein FRET: the good, the bad and the ugly. Trends in Biochemical Sciences. 32 (9), 407-414 (2007).
- Chakrabarty, R., et al. pSITE vectors for stable integration or transient expression of autofluorescent protein fusions in plants: Probing Nicotiana benthamiana- Virus Interactions. Molecular Plant-Microbe Interactions. 20 (7), 740-750 (2007).
- Walter, M., et al. Visualization of protein interactions in living plant cells using bimolecular fluorescence complementation. Plant Journal. 40 (3), 428-438 (2004).
- Hellens, R., Mullineaux, P., Klee, H. A guide to Agrobacterium binary Ti vectors. Trends in Plant Science. 5 (10), 446-451 (2000).
- Van Der Hoorn, R. A. L., Rivas, S., Wulff, B. B. H., Jones, J. D. G., Joosten, M. H. A. J. Rapid migration in gel filtration of the Cf-4 and Cf-9 resistance proteins is an intrinsic property of Cf proteins and not because of their association with high-molecular-weight proteins. Plant Journal. 35 (3), 305-315 (2003).
- Xie, X., et al. Engineering SARS-CoV-2 using a reverse genetic system. Nature Protocols. 16, (2021).
- Xu, J., et al. Optimized plasmid construction strategy for Cas9. Cellular Physiology and Biochemistry. 48, 131-137 (2018).
- Mattanovich, D., et al. Efficient transformation of Agrobacterium spp. by electroporation. Nucleic Acids Research. 17 (16), 6747 (1989).
- Rizzo, M. A., Springer, G. H., Granada, B., Piston, D. W. An improved cyan fluorescent protein variant useful for FRET. Nature Biotechnology. 22 (4), 445-449 (2004).
- Tramier, M., et al. Picosecond-hetero-FRET microscopy to probe protein-protein interactions in live cells. Biophysical Journal. 83 (6), 3570-3577 (2002).
- Alvarez, L. A. J., et al. SP8 FALCON: a novel concept in fluorescence lifetime imaging enabling video-rate confocal FLIM. Nature Methods. 20, 2-4 (2019).
- Postma, M., Goedhart, J. Plotsofdata-a web app for visualizing data together with their summaries. PLoS Biology. 17 (3), 1-8 (2019).
- Galperin, E., Verkhusha, V. V., Sorkin, A. Three-chromophore fret microscopy to analyze multiprotein interactions in living cells. Nature Methods. 1 (3), 209-217 (2004).
- Waadt, R., Kudla, J. In plant visualization of protein interactions using bimolecular fluorescence complementation (BiFC). Cold Spring Harbor Protocols. 3 (4), (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır