Method Article
Kültürlü Astrositlerde Mitokondriyal Sistemin Canlı Görüntülenmesi
Bu Makalede
Özet
Bu makalede, MitoTimer biyosensör ile donatılmış astrosit kültürlerinin mitokondriyal zaman atlamalı görüntüleme yöntemi ve mitokondriyal dinamiklerin, hareketliliğin, morfolojinin, biyogenezin, redoks durumunun ve cironun çokparametrik analizi açıklanmaktadır.
Özet
Nöronal düzeyde mitokondriyal değişikliklere çok dikkat edilmiş olsa da, son kanıtlar mitokondriyal dinamiklerin ve astrositlerdeki fonksiyonun bilişe karıştığını göstermektedir. Bu makalede, mitokondriyal biyosensör ile donatılmış astrosit kültürlerinin zaman atlamalı görüntülenmesi yöntemi açıklanmaktadır: MitoTimer. MitoTimer mitokondriyal dinamikleri, hareketliliği, morfolojiyi, biyogenez ve redoks durumunu değerlendirmek için güçlü ve benzersiz bir araçtır. Burada kültür, imaj edinimi ve sonraki mitokondriyal analizler için farklı prosedürler sunulmaktadır.
Giriş
Astrositler beyin homeostazının bakımında kritik oyunculardır. Belki de en iyi beyinde, kan-beyin bariyeri1'in bir parçası olarak ve beyin boyunca nöronları ve sinapsları destekleyerek önemli yapısal rollere sahip oldukları bilinmektedir2. Nöronların astrosit desteği hem yapısal3 hem de metabolik4,5, nörogenez ve sinaptogenez teşvik eden astrositler ile aynı zamanda aktif nöronlara laktat gibi anahtar metabolitler sağlar 4,6,7. Yapısal destek rolünün ötesinde, astrositler Ca2+ sinyalizasyon ve tamponlamada (spontan mitokondriyal Ca2+ akınları dahil) 8,9, K+ tamponlama10'da yer alan aktif hücrelerdir ve yaralanma zamanlarında beynin ihtiyaçlarına uyum sağlayabilen ve tepki verebilen aktif hücrelerdir11,12 . Bu tür dinamik hücreler olan astrositler, verimli bir mitokondriyal ağ gerektiren sağlam enerji gereksinimlerine sahiptir. Bu mitokondriler ayrıca aşırı reaktif oksijen türlerinin (ROS) tamponlamada çok önemli bir role sahiptir13. Enerji üretimi ve ROS arabelleğe almanın bireysel veya yerel rollerine ek olarak, mitokondri bir ağ olarak işlev görür14. Bu anlamda, sırasıyla yeni / azaltılmış mitokondri ve eski / oksitlenmiş mitokondrileri temsil eden fizyon ve füzyonmitokondrileri arasındaki dengeyi korurlar. Bir hücrenin genel redoks durumu, mitokondriyal ağın redoks durumu ile ölçülebilir. Patolojide, bu, hangi hücrelerin en iyi şekilde çalışmayabileceğine ışık tutabilecek kritik bir bilgidir.
Son yıllarda, mitokondrilerin hücrelerdeki dinamiklerini ve işlevlerini incelemek için birçok sensör geliştirilmiştir. Örneğin, mitokondriyal fonksiyon16'nınçalışmasında enerjideğişimini (ATP), redoks durumunu (NADH/NAD + , ROS) ve enzimatik işlevselliği (cAMP, Ca2+,Zn 2+) ölçen sensörler kullanılmaktadır. Bunlar arasında MitoTimer, mitokondriyal morfoloji (boyut, şekil, yüzey alanı), hareketlilik (hız, yer değiştirme) ve dinamiklerin (füzyon ve fisyon olayları) yanı sıra genel mitokondriyal ciro oranı ve redoks durumundaki değişiklikleri takip etmesine izin verir. MitoTimer bir mutant kırmızı floresan proteinidir, drFP58317, insan sitokrom c oksidaz18, 19'unalt bireyi VIII'den mitokondriyal sinyal ile yeşil(488 nm) ve oksitlenmiş mitokondrileri kırmızı (555 nm) olarak görselleştirmek için. Yeşil (488 nm) ve kırmızı (555 nm) floresan oranının kullanılması, bireysel mitokondrilerin, morfoloji analizlerinin, füzyon / fisyon olaylarının ve redoks durum geçmişinin eşzamanlı değerlendirilmesini sağlar20,21. Bu benzersiz özellik, mitokondrilerin fizyolojik ve patolojik rolleriyle ilgili birçok bilimsel soruyu araştırmak için kullanılabilir ve bu nedenle birçok farklı hücre tipinde mitokondriyal dinamiklerin altında kalan mekanizmaları ortaya çıkarmak için çok umut vericidir.
Yakın zamanda mitokondrilerin dinamiği ve fonksiyonlarını incelemek için yeni bir lentiviral vektör geliştirdik (LV-G1-MitoTimer-MiR124T, bundan böyle LV-G1-MitoTimer olarak adlandırılacaktır) özellikle astrositlerde in vitro ve in vivo22. LV-G1-MitoTimer, glial fibril asidik protein (GFAP) promotörü gfaABC1D'nin kesilmiş bir versiyonunu kullanır, B3 arttırıcı (gfaABC1D(B3), bundan sonra G1 olarak adlandırılır) ve daha önce tanımlanmış miR124T nöronal detargeting sistemi23ile birlikte . Astrositlerde mitokondriyal biyosensörün özel ekspresyona izin verir in vitro ve in vivo22. Burada sunulan sıçan hipokampal astrosit kültürünü gerçekleştirmek ve onları LV-G1-MitoTimer biyosensörü ile donatmak için farklı adımların yanı sıra birkaç ardışık saat / gün boyunca astrosit mitokondri davranışını takip etmek için farklı mikroskopi adımları.
Protokol
Mevcut protokol etik bir komitenin (anlaşma VD3602, Lozan, İsviçre) onayı ile gerçekleştirilmiştir ve hayvanların kullanımı için Avrupa yönergelerine uyar.
1. Sıçan hipokampal astrosit birincil kültürü
- Doğum sonrası 1-2 günde kafa keserek beş sıçan yavruyu (Wistar IGS Rat) kurban edin.
- Beyni çıkarın ve 5 mL taze astrosit ortamı içeren bir Petri kabında tutun (% 1 Penisilin / Streptomisidin ve% 10 taze At Serumu ile desteklenmiş GlutaMAX ile DMEM).
- Hipokampusu izole et. Astrositik ortamın 5 mL'sinde 21 G iğneden üç pasaj ve 25 G iğneden üç pasajla ayrışın.
- Ayrışmış hücreleri 15 mL santrifüj tüpüne aktarın ve hemositometrede sayın.
- Plaka 20.000-25.000 hücre/cm2 çok mutfaklı yemeklerde (9,4 mm x 10,7 mm x 9,3 mm) ve deneyin geri kalanında %5 CO2 içeren bir atmosfer altında 37 °C'de saklayın.
- Ortamı tamamen 3 günlük in vitro (DIV3) olarak değiştirin.
- DIV8'de, fosfat tamponlu salin (PBS + % 0.01 BSA) ile seyreltilmiş mitokondriyal biyosensör MitoTimer (LV-G1-MitoTimer22)için lentiviral vektör kodlama hücresi başına 0.6 pg p24 antijeni ekleyin.
- DIV9'da önceden ısıtılmış 1x steril PBS (37 °C) ile yıkayın ve taze astrosit ortamı ekleyin.
- DIV11'de önceden ısıtılmış 1x steril PBS (37 °C) ile 2 yıkama yapın ve fenol kırmızısı olmadan taze astrosit ortamı ekleyin.
NOT: Kaplamanın seçimi hedeflenen teste bağlıdır. Astrosit birincil kültürü için standart bir kaplama olarak, 0.2 mg/mL poli-D-lizin veya 8.7 μg/cm2 bodrum membran matrisi (örneğin Matrigel) kullanılması önerilir. Astrositlerin mitokondriyal sistemini görselleştirmek için düzleştirilmiş ve gerilmiş hücreler üzerinde çalışmak önemlidir. Bu bağlamda, IBIDI u-slaytlarda bodrum membran matrisinin kombinasyonu en uygun olanıdır. Ayrıca, tekrar tekrar ışığa maruz kalan hücre için toksik olan fenol kırmızısı ile çalışmamak da çok önemlidir.
2. Mitokondriyal sistemin uzun süreli izlenmesi.
- Astrositik mitokondriyal sistemi LV-G1-MitoTimer ile lentiviral enfeksiyonlardan en az 3-5 gün sonra değerlendirin (mitokondrilerde yeterli floresan seviyesine izin vermek için).
- Hücreleri, satın alma ve analiz yazılımı tarafından kontrol edilen ters bir mikroskop ve tam satın alma otomasyonu için bir modül ile görüntüleyin.
NOT: Bu çalışmada kullanılan yazılım ve modülün ayrıntıları için Malzeme Tablosuna bakın. - Deney boyunca astrosit kültürünü %5 CO2 ve 37 °C'de korumak için mikroskobun bir kafes inkübatörü (bkz. Malzeme Tablosu)ile donatıldığından emin olun.
- 490 nm (yeşil kanal için) ve 550 nm (kırmızı kanal için) sıralı ekscitasyon kullanarak floresan görüntüleri yakalayın, yeşil (yeşil kanal için 500-540 nm) ve kırmızı (kırmızı kanal için 550-600 nm) floresan sinyallerinin algılanmasıyla.
- 40x büyütme kullanarak yeterli LV-G1-MitoTimer seviyelerini ifade eden bir mitokondriyal ağ ile kuyu başına 5 astrosit seçin. Astrositleri mümkün olduğunca düz ve büyük seçmeye ve hücre kümelerinde (tek tek hücreler üzerinde çalışmak için) yer almaya özenin.
- Seçili 5 hücrenin koordinatlarını bir xlm dosyasına (map.xlm) kaydedin. Bu map.xlm, kullanıcının zaman içinde aynı hücrelere dönmesini sağlar.
- Her koordinat için 150x (100x yağ daldırma hedefi, 1,5x ara büyütme) büyütme kullanarak görüntü dizileri (60 s için 1 görüntü/sn) elde edin.
- Tedavilerden sonra aynı astrositler 6 h, 12 h ve 24 h için görüntü alımını (60 s için 1 görüntü/sn) tekrarlayın.
NOT: Hızlı ve verimli bir otomatik odaklama sistemi ile donatılmış bir mikroskop kullanın. Bu kapsamda Perfect Focus System (PFS) adı verilen donanım çözümü kullanıldı. PFS, uzun süreli görüntüleme incelemeleri sırasında gerçek zamanlı olarak eksenel odak dalgalanmalarıyla mücadele etmek için kızılötesine yakın 870-nm LED ve CCD hat sensörleri kullanır.
3. Bireysel mitokondriyal morfoloji ve LV-G1-MitoTimer oranının analizi
NOT: Bu çalışmada morfometrik analizi otomatize etmek için Nikon'dan NIS Genel Analiz 3 (GA3) kullanılmıştır.
- Her görüntü dizisi için (taban çizgisi, 6 h, 12 h, 24 h), ND İşleme> Çerçeve Seç 'e tıklayarak kırmızı ve yeşil kanallar için ilk kareyi seçin.
- Dönüşümler> Birleştirme Kanalı 'nı seçerek kırmızı ve yeşil kanalları birleştirin.
- Görüntü gölgelendirmeyi düzeltmek için, Otomatik Gölgelendirme Düzeltmesi > Ön İşleme 'yiseçin.
- Rolling Ball'u Ön İşleme > Seçerek Yuvarlanan Top algoritmasınıuygulayın.
- Her mitokondrion için ikili maskeler oluşturmak için Segmentasyon > Eşiği 'niseçin.
- kenarlıkla dokunmak > İkili işleme 'yi seçerekkenarlık tarafından kesilen nesneleri kaldırın.
- Yüzey alanını ölçmek için Nesne Alanı > Ölçü 'nünöğesini seçin.
- Çapı ölçmek için Ölçü > Eq Çapı 'nıseçin.
- Uzunluğu ölçmek için Ölçüm > Uzunluğu '>seçin.
- Genişliği ölçmek için Ölçü > Genişliği'ni seçin.
- Pürüzlülüğü ölçmek için Pürüzlülük > Ölçü 'lüt 'üseçin.
- Döngüselliği ölçmek için Döngüsellik > Ölçü 'nünüseçin.
- Uzamayı ölçmek için Uzama > Ölçü 'lütma 'yıseçin.
- Yukarıdaki ölçümle bir grup oluşturun (sağ tıklatın) ve MorphoData olarak yeniden adlandırın.
- Ölçüm > Ortalama Yoğunluk 'u seçerek ortalama yeşil yoğunluğu ölçün.
- Ölçüm > Ortalama Yoğunluk 'u seçerek ortalama kırmızı yoğunluğu ölçün.
- Kırmızı/Yeşil oranını ölçmek için Ölçüm > Oranı'nı seçin.
- Yukarıdaki ölçümle bir grup oluşturun (sağ tıklatın) ve bunu RatioData olarak yeniden adlandırın.
- Tabloyu CSV'ye Başvuru >'i seçerek tabloyu bir CSV dosyasına verin.
- Farklı Kaydet'i seçerek GA3 çözümleme komut dosyasını kaydetme
NOT: Bu yordamda kullanılan ölçütlerin kapsamlı olmayan bir listesi Şekil 1, Tablo 1 ve Tablo 2'de özetlenmiştir. Analiz GA3 komut dosyası ek olarak mevcuttur (Ek Kodlama Dosyası 1 ve Şekil 2). Kullanılan eşikler mümkün olduğunca çok mitokondriyi bireyselleştirmek için uyarlanmıştır (mümkün olduğunca büyük mitokondriyal ağlar hariç). Mümkün olan her yerde, mitokondriyal ağlar manuel olarak bireyselleştirilir veya analizlerin dışında tutulur. Hücreler arası değişkenlik nedeniyle, bu analizleri durum başına en az 20-25 hücre üzerinde (hücre başına en az 50 mitokondri ile) gerçekleştirin.
4. Mitokondriyal hareketliliğin analizi
NOT: Mitokondriyal hareketlerin yüksek karmaşıklığı nedeniyle manuel hareketlilik analizi tercih edilir. Burada Nikon'un NIS Element sistemi mitokondrileri manuel olarak izlemek için kullanıldı.
- İzleme modülünüzü NIS'de açın, > Analiz > İzlemeyi Görüntüle 'yiseçin.
- Yeni Yatırım Getirisi Tanımla 'yıtıklatın.
- Otomatik Algılama Aracıile, görüntü dizisinin ilk görüntüsünde 25-50 mitokondri seçin.
- Otomatik Algılanan ROI Çözümlemeyi İzle 'yitıklatın.
- Gerekirse, yanlış yatırım getirisi parçalarını silin.
- Tabloyu bir CSV dosyasına verin.
NOT: Bu yordamda kullanılan ölçütlerin kapsamlı olmayan bir listesi Şekil 1 ve Tablo 3'teözetlenmiştir. İzleme analizi genellikle izlenen her nesnenin merkezinin hareketlerini gösteren bir yol verir. Farklı izleme seçenekleri izleme seçeneğinde ayarlanmalıdır. İzlemeyi kolaylaştırmak için birbirlerinden yeterince uzak olan izole mitokondrilerin seçimini tercih edin. Yalnızca tüm sıra boyunca sürekli olarak izlenebilen nesneleri saklayın. Kötü kalite takibi nedeniyle aykırılıkları kaldırmak için aynı şekilde devam edin. Sonuç olarak, bu bölümde analiz edilen nesne kümesi statik morfolojik analizler için analiz edilenden farklıdır ve genellikle daha küçük olacaktır.
5. Veri dönüşümü, normalleşme ve istatistiksel analiz
NOT: Esas olarak mitokondrilerin yüksek heterojenliği nedeniyle, üretilen veriler genellikle normal olmayan bir dağılım vardır.
- İşlemeden önce ölçümleri el ile günlüğe kaydedin.
- Her analiz ve zaman dilimi için, elde edilen verileri referans alımında elde edilenlerin ortalamasına göre manuel olarak normalleştirin.
- Ek olarak, örneğin bir tedavinin etkisini değerlendirmek için bir kontrol durumuna ikinci /çift normalleştirmeyi düşünün.
- Ardından, iki yönlü eşleştirilen bir ANOVA kullanarak istatistiksel analiz yapın. Burada GraphPad Prizma V8 kullanıldı.
Sonuçlar
LV-G1-MitoTimer ile enfekte olan astrositlerin birincil kültürü tipik mitokondriyal ağlar sergiledi. Tedaviden önce, LV-G1-MitoTimer'ı ifade eden astrositler heterojen mitokondriyal boyutunu ve çeşitli yeşil /kırmızı floresan yoğunluklarını göstermiştir (Şekil 3, Şekil 4ve Video 1). LV-G1-MitoTimer'ı ifade eden astrosit kültürlerinin mitokondriyal sistemi H2 0 2 (10μM) ile inkübasyondan önce ve sonra izlendi. Yukarıda açıklanan farklı mitokondriyal özellikler 12 saat (her 3 saat) üzerinden hesaplanmış ve normalleştirilmiştir (hücreye göre hücre). Morfolojik düzeyde (Şekil 3B), H 2 O2'ninetkileri yaklaşık6 saat içinde görünmeye başlar. Gerçekten de, mitokondriler parçalıydı (uzunluk, yüzey alanı ve uzama faktörünün azalması). Bu parçalanma tedaviden 12 saat sonra daha da belirgindir. Çapların, genişliklerin ve küreselliğin azalmadığını unutmayın. Redoks durumu ve ciro ile ilgili olarak (Şekil 3C), H 2 O2tedavisinden sonra3 saat, yeşil mitokondrilerin oranı astrositlerde artmıştır (mitokondriyal biyogenezde hızlı bir artışın sonucudur). 6 saat'te, yeşil/ kırmızı oranı taban çizgisi seviyelerine geri döndü, ancak tamamen kırmızı mitokondri sayısı bazal seviyelerden önemli ölçüde arttı. 12 saat sonra, H 2 O2'ninoksidatif tedavisinin sonuçları görülebilir ve kırmızı puncta oranında ve sayısında önemli bir artışa neden oldu. Dinamikler ve hareketlilik ile ilgili olarak (Şekil 3D), tedaviden sonra 3 saat, tüm kriterler geçici olarak artırıldı. Uzun vadede (12 saat), mitokondri daha yavaş ve daha kısa mesafelerde hareket etti.
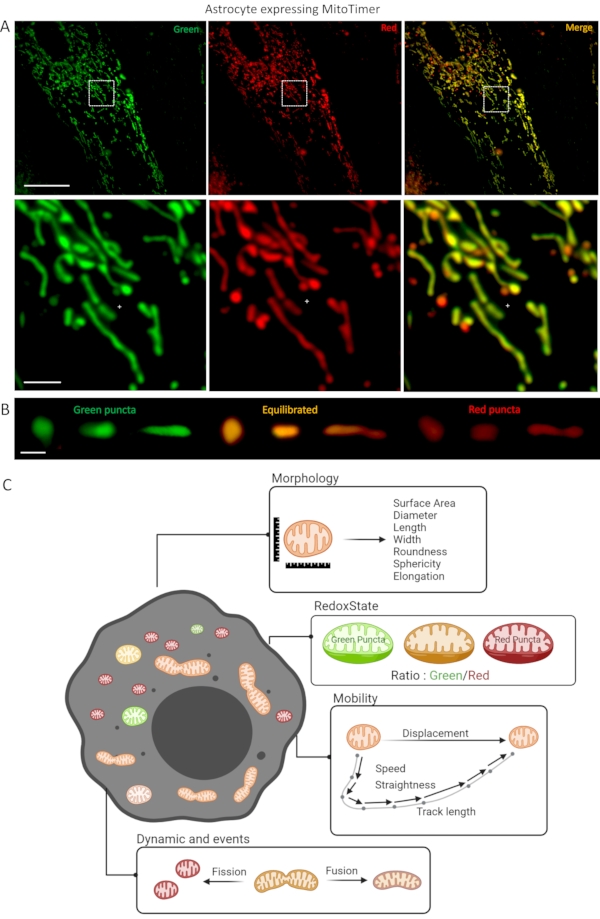
Şekil 1: LV-G1-MitoTimer biyosensörünü ifade eden astrosit kültürü. (A) LV-G1-MitoTimer'ı ifade eden astrositlerin konfokal fotoğrafları. (B) Farklı parçalanma seviyelerine sahip azaltılmış (yeşil) dengeli (turuncu) ve oksitlenmiş (kırmızı) mitokondrilerin konfokal fotoğraflarının seçimi. (C) LV-G1-MitoTimer ifade eden bir astrositte analiz için mevcut farklı kriterlerin özet diyagramı. Ölçek çubuğu: (A) Üst panel: 50 μm, alt panel: 10 μm, (B) 1 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
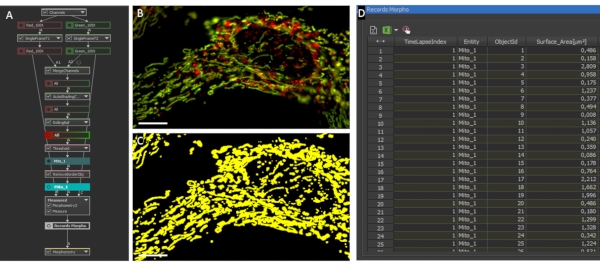
Şekil 2: Mitokondriyal morfoloji ve oran analizi. (A) Bireysel mitokondriyal morfoloji ve oranın analizi için GA3 komut dosyasına genel bakış. (B) GA3 komut dosyası ile analiz edilen LV-G1-MitoTimer ifade eden bir astrositin ilk fotoğrafları. (C) Astrositlerin mitokondriyal sistemi için oluşturulan ikili maskeler örneği. Ölçek çubuğu: 10 μm (B-C). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
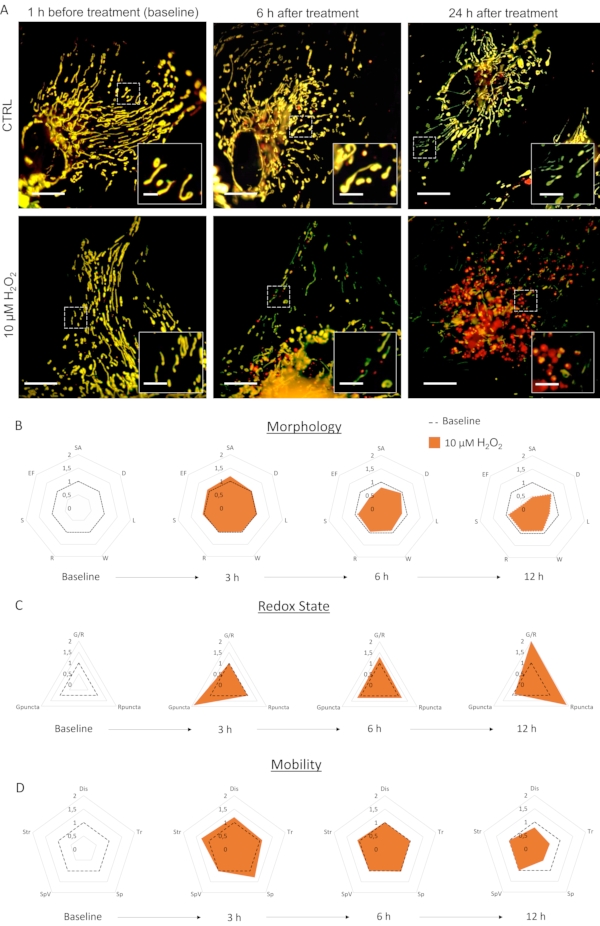
Şekil 3: H 2 O2'ninastrositlerin mitokondriyal sistemi üzerindeki etkileri. (A) LV-G1-MitoTimer'ı ifade eden astrositlerin fotoğrafları 1 saat önce ve 6 saat, PBS (CTRL) ve 10 μM H 2 O 2 ile tedaviden sonra24saat . (B) Mitokondriyal morfolojinin radar çizelgeleri, (C) redoks durumu ve cirosu ve (D) baz çizgisi sırasında astrositler üzerinde değerlendirilen hareketlilik kriterleri ve H 2 O 2 tedavisinden sonra 3 h, 6 h ve12h. SA: Yüzey alanı; D: Çap; L: Uzunluk; W: Genişlik; R: Yuvarlaklık; S: Küresellik; EF: Uzama faktörü (=L/W); G/R: Bireysel kırmızı/yeşil oran; Gpuncta: Yeşil puncta mitokondri yüzdesi; Rpuncta: Kırmızı puncta mitokondri yüzdesi; Dis: Yer değiştirme; Tr: Parça Uzunluğu; Sp ve SpV: Hız ve hız farkı; Str: Düzlük. Ölçek çubuğu: 20 μm (A) ve 2,5 μm (inset). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
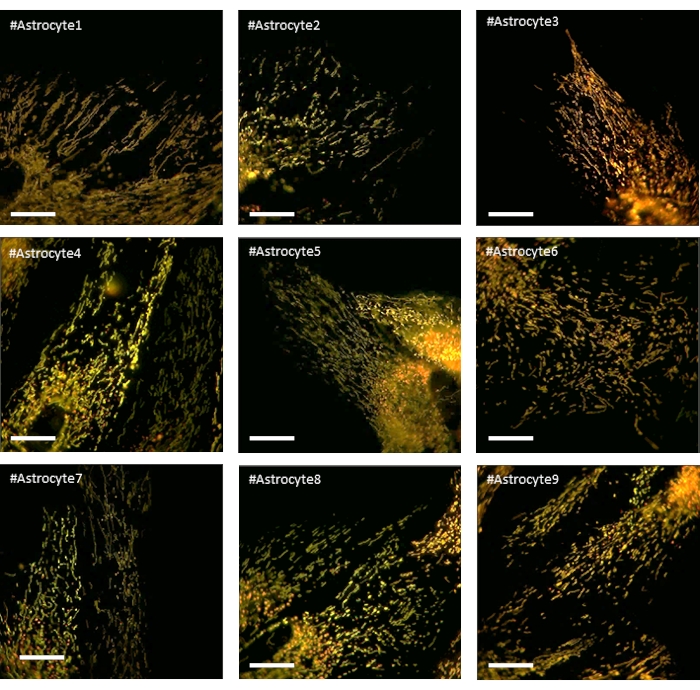
Şekil 4: LV-G1-MitoTimer'ı ifade eden ve taban çizgisi sırasında homojen ve dengeli bir mitokondriyal ağ gösteren astrositlerin fotoğrafları. Ölçek çubuğu: 20 μm Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Video 1: H2O2 tedavisinin kültürlü astrositlerin mitokondriyal sistemi üzerindeki etkisi. H 2O 2tedavisinden önce astrositik mitokondri (taban çizgisi), ayrıcaH2 O 2 tedavisinden sonra tedavi edilmeyen kontrol hücresine kıyasla 6 h ve24 saat. Bu Dosyayı indirmek için lütfen tıklayınız.
| Morfoloji kriterleri | Aralık | Açıklamalar | ||
| Yüzey Alanı (SA) | 0,5–4 μm2 | Bu kriterler mitokondrilerin parçalı-uzun özellikleri hakkında bilgi verir. Genellikle aynı yönde gelişirler. Parçalı mitokondriler yüzey alanı, çapı, uzunluğu ve uzama faktörü azalırken yuvarlaklık, küresellik ve genişlik değişmemiş veya arttırılabilir. | ||
| Çap (D) | 0,5–1,5 μm | |||
| Uzunluk (L) | 0,5–5 μm | |||
| Genişlik (W) | 0,5–2 μm | |||
| Yuvarlaklık (R) | 0–1 | |||
| Küresellik (S) | 0–1 | |||
| Uzama faktörü (EF = L/W) | 1–10 | |||
Tablo 1: Mitokondriyal morfoloji için seçilen parametrelerin özeti.
| Redox Durumu ölçütleri | Aralık | Açıklamalar | ||
| Bireysel oran (G/R) | 0–10 | Oran, redoks durumunun sonucunu gösterir. Hücredeki mitokondrilerin genel durumu ve yaşı hakkında bilgi verir. Bu oranın biyogenez dengesi ve mitokondrilerin bozulması ve oksitlenmiş mitokondrilerin azaltılmış mitokondri ile fizyon / füzyonu olduğunu göz önünde bulundurmak önemlidir. Bu nedenle, yeşil ve kırmızı puncta sayısının değerlendirilmesi, sonuçların yorumlandırılmasına güçlü bir şekilde yardımcı olabilir. Yeşil puncta mitokondri, yeşilin yoğunluğu kırmızının 10 katı olduğunda belirlenir. Kırmızı puncta mitokondri, kırmızının yoğunluğu yeşilden 10 kat daha fazla olduğunda belirlenir. Bir astrositin redoks durumu, o hücrenin tüm mitokondri oranlarının ortalamasıdır. | ||
| Yeşil puncta mitokondri yüzdesi (Gpuncta) | 0%–100% | |||
| Kırmızı puncta mitokondri yüzdesi (Rpuncta) | 0%–100% | |||
Tablo 2: Mitokondriyal redoks durumu için seçilen parametrelerin özeti.
| Hareketlilik kriterleri | Aralık | Açıklamalar | ||
| Yer Değiştirme (Dis) | 0–10 μm | Bu özellikler birlikte ağın genel hareketlilik dinamiklerini bilgilendirir. Sabit mitokondriler kısa yer değiştirme ve pist uzunluğunu düşük bir hızda görüntüler. Öte yandan, salınımlı parçacıklar, iz uzunluğu ve deplasmanı (düşük düzlükle sonuçlanır) ve statiklere göre artan bir hız arasında bir farkla ayırt edilebilir. | ||
| Parça Uzunluğu (Tr) | 0–10 μm | |||
| Hız ve hız farkı (Sp ve SpV) | 0–1,5 μm/s ± 0,2 μm/s | |||
| Düzlük | 0–1 | |||
| (Str = yer değiştirme/iz uzunluğu) | ||||
Tablo 3: Mitokondriyal hareketlilik için seçilen parametrelerin özeti.
Ek Kodlama Dosyası 1: Bireysel mitokondriyal morfolojinin analizi için GA3 komut dosyası. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Burada, kültürlü bir astrositte mitokondriyal sistemin dinamiklerini ve cirosunu uzunlamasına takip etmek için yeni bir yöntem önerildi. Sabit bir hücre grubu veya bir seferde tek bir hücre üzerinde zaman atlamalı bir yaklaşımın aksine (literatürde en sık kullanılan)24,25, araştırmacılar aynı bireysel hücrelerde birkaç gün boyunca mitokondriyal sistemin evrimini takip edebilir. Yüksek düzeyde ışığa maruz kalmanın gerekli olduğu ve birçok hücrenin seçiminin daha az uygulanabilir olduğu tek bir canlı görüntülemenin aksine, önerilen yöntem, bu mikroskopun bir kuyunun farklı alanlarında birkaç farklı hücreyi görüntüleme ve bunları yeniden görüntülemek için çeşitli zaman noktalarında aynı hücrelere geri dönme yeteneğinden yararlanır. Her bir ilgi hücresi üzerinde ölçülen her kriter için gerçekleştirilen bir taban çizgisine normalleşme sayesinde, mitokondriyal sistemin karmaşıklığını dikkate alır ve tedavinin her hücre üzerindeki etkisini kendi temel görüntüsüne göre araştırır. Mikroskopun bu tür görüntülemeyi bir seferde 16 kuyuda otonom olarak yapabilmesi (kuyu başına 5 hücre görüntüleme), farklı günlerde çeşitli koşulları görüntülemenin getirdiği deneysel değişkenlik olmadan mitokondriyal sistemin heterojenliğinin analiz sırasında uygun şekilde dikkate alınmasını sağlar.
Kültürlerin kalitesi, LV-G1-MitoTimer biyosensörünü ifade eden viral enfeksiyon seviyeleri, mikroskop ve hedeflerin türü ve uygun hücrelerin seçimi, bu protokolde mümkün olduğunca tutarlı kalması gereken kritik değişkenlerdir. Hücre yoğunlukları, vektörün türü ve viral titreler soruya göre uyarlanabilir. Önceki çalışma LV-G1-MitoTimer ifadesinin mitokondriyal fonksiyon vedinamikler 21 , 22,26,27için zararlı sonuçları olmadığını gösterse de, konsantrasyonun hücreler için toksik olmadığını doğrulamak önemlidir (örneğin, kontroldeki toplam hücre sayısını iyi kontrol etmek). Tek bir odak düzlemi kullanıldığından, astrositler: (1) mümkün olduğunca düz, (2) diğer etiketli hücrelerden izole edilmiş (tabakta yer değiştirme durumunda analizi basitleştirmek için) ve (3) yüksek floresan seviyelerine sahip olmalıdır. Kültürdeki hücreler morfolojide oldukça değişken olabildiği için mitokondriyal sistem oldukça heterojen olabilir. Bu bağlamda, ROI'leri (tüm hücreyi değil) analiz etmek, perinükleer bölgeler gibi bazı sorunlu bölgeleri telafi eder ve değişkenliği azaltır. Taban çizgisini nispeten benzer hücreler üzerinde yapmak ve mümkün olduğunca çok hücreyi örneklamak önemlidir. Sonuç olarak, yüksek içerik toplama ve analiz mikroskopları idealdir. Bu boyuna izleme sırasında, biyosensör ağartmasını önlemek için hücreleri ışığa aşırı maruz etmemek de önemlidir.
Bu görüntüleme yöntemi karmaşıklıkları olmadan değildir ve protokol boyunca, mikroskopla önceki testler sırasında yapılan sorun gidermeyi dikkate alan birkaç not dahil edilir. Örneğin, kullanılan plaka kaplama seçimi hedeflenen teste bağlıdır, ancak astrosit birincil kültürler için en uygun seçimler için öneriler dahil edilmiştir. Ayrıca, hücreler arası değişkenlik nedeniyle durum başına en az 5 hücre üzerinde görüntü alımı yapılmalıdır. Daha spesifik olarak, temel görüntülemede seçilen bazı hücreler ölecek, bazıları atanan görüntü alma alanının çerçevesinden çıkacak ve bazıları morfolojilerini değiştirerek mitokondrilerin analizde bireyselleştirilmesini çok zorlaştıracaktır. Başlangıçtan itibaren birçok hücrenin görüntülenmesi, deneyin sonunda analiz edilebilecek kadar büyük bir hücre örnek boyutunun olasılığını artırır. Bu görüntüleme tekniğinin daha karmaşık yönlerine ek olarak, bu tür görüntüleme ve analizlerden kimlerin yararlanabileceği konusunda bazı düpedüz sınırlamalar vardır. Görüntü alımının otomatizasyondan tam olarak yararlanabilmek için, kullanılan mikroskop, görüntüler arasındaki zaman aralıklarının hızını (yani, bu protokoldeki her 3 sn) işleyebilen ve her görüntü alınmadan önce sürekli olarak söz konusu hücreye odaklanabilen bir otomatik odaklama sistemine sahip olmalıdır. Ayrıca, tüm görüntü alma işlemini otomatikleştiren JOBS yazılımı olmadan, bu yöntem, her hücreyi uygun zaman noktasında el ile bulmayı ve görüntülemeyi gerektireceğinden, görüntülenen hücre sayısına bağlı olarak zorlu ve potansiyel olarak imkansız hale gelir. Son olarak, bu görüntüleme yöntemi fotobleaching sorununa karşı bağışık değildir. Bu nedenle, her uzun vadeli satın alma yöntemide olduğu gibi, fotobleachinge daha az duyarlı floresan belirteçlerin seçilmesi ve bu sorunu mümkün olduğunca önlemek için görüntü alımının uyarılması önemlidir.
Bu teknik, şu anda çok önemli bir şekilde kullanılan diğerlerinden farklıdır. Diğer hızlandırılmış çalışmaların aksine, bu teknik tüm zaman boyunca kuyuda aynı pozisyonda görüntüleme gerektirmez ve plakanın diğer alanları görüntülemek için manuel hareketini gerektirmez. Bu, araştırmacılara birçok hücreyi bir 24 saat diliminde birçok koşulda görüntüleyebilme olanağı sağlar. Sonuç olarak, bu görüntüleme ve analizi her kuyudaki birçok hücre üzerinde yapma yeteneği, büyük bir hücre grubunu geniş bir şekilde inceleyerek elde edeceğiniz aynı popülasyon bilgilerini verirken, ayrıca görüntülenmiş her hücreden belirli önlemler sağlar. Bu yönteme ilişkin bazı özellikler diğer görüntü alma yöntemleri için geçerli olmayabilir (yukarıda özetlenmiştir), faydalar, edinimden sonra mümkün olan analiz türüyle ilgili komplikasyonlardan daha ağır basar. Bu teknik, araştırmacıların mitokondriyal sistem üzerindeki çeşitli tedavilerin ve dolayısıyla kültürlü astrositler üzerindeki kesin sonuçlarını görmelerini sağlar.
Ayrıca, bu yöntem mitokondriyal davranış ve belirli bağlamlardaki rollerle ilgili birçok farklı bilimsel soruya göre son derece özelleştirilebilir. Burada özetlenen protokol özellikle kültürlü astrositlerle ilgilidir. Bununla birlikte, diğer birçok hücre tipi kullanılabilir ve test edilebilen tedaviler sadece araştırılan sorularla sınırlıdır. Bu tür görüntüleme, mitokondriyal davranışın kolektif bilgisini ve anlayışını, mitokondriyal disfonksiyona yol açan altta kalan mekanizmaları ve birçok patolojinin farklı hücre türlerinde bulunan doğuştan gelen dinamikler üzerindeki etkilerini ilerletme potansiyeline sahiptir.
Açıklamalar
Yazarlar rakip çıkarlar beyan etmemektedir.
Teşekkürler
Bu çalışma, K.R. ve Lozan Üniversite Hastanesi'ne (CHUV) verilen bir Synapsis Vakfı bursu ile desteklendi. Yazarlar nikon'a yardımları için teşekkür eder, özellikle J. Gannevat'a.
Malzemeler
| Name | Company | Catalog Number | Comments |
| µ-Slide 8 Well | IBIDI | 80807 | |
| 19 G needle | Plexus SANTE | PL001213 | |
| 21 G needle | Plexus SANTE | PL000142 | |
| 25 G needle | Plexus SANTE | PL000133 | |
| Bovin Serum Albumin | LIFE TECH | 15260037 | |
| Camera | HAMAMATSU | ORCA-flash4.0 V3 - C13440-20CU | |
| DMEM, high glucose, GlutaMAX(TM) | THERMOFISHER | 61965059 | |
| Glutamax Supplement | THERMOFISHER | 35050061 | |
| Horse Serum | SIGMA | 16050122 | |
| Lens | Nikon Instruments | CFI Plan Fluor 100x Oil | |
| Light Engines | LUMENCOR | SPECTRA X | |
| Linear-encoded motorized platine | Nikon Instruments | N/A | |
| Microscope | Nikon Instruments | ECLIPSE Ti2-E MICROSCOPE INVERSE | |
| Microscope Stage Incubator with 3-channel manual gas mixer and gas bubbler/ humidity module | OKOLAB | H201-NIKON-TI-S-ER | |
| PBS 1x liquid | THERMOFISHER | 20012068 | |
| Penicillin-Streptomycin | SIGMA | 15140122 | |
| Petri dishes 100 mm | SIGMA | P5731 | |
| Petri dishes 35 mm | SIGMA | CLS430165 | |
| Pregnant Rats | CHARLES RIVERS | 3 | |
| Software Nikon NIS-HC | Nikon Instruments | NIS-Elements HC | |
| Sofware Prism | GraphPad | V8.02 | |
| Stericup 500 mL | MERCK MILLIPORE | 10412701 |
Referanslar
- Ballabh, P., Braun, A., Nedergaard, M. The blood-brain barrier: An overview: Structure, regulation, and clinical implications. Neurobiology of Disease. 16 (1), 1-13 (2004).
- Allen, N. J., Eroglu, C. Cell biology of astrocyte-synapse interactions. Neuron. 96 (3), 697-708 (2017).
- Bernardinelli, Y., Muller, D., Nikonenko, I. Astrocyte-synapse structural plasticity. Neural Plasticity. 2014, 232105 (2014).
- Benarroch, E. E. Neuron-astrocyte interactions: Partnership for normal function and disease in the central nervous system. Mayo Clinic Proceedings. 80 (10), 1326-1338 (2005).
- MacVicar, B. A., Choi, H. B. Astrocytes provide metabolic support for neuronal synaptic function in response to extracellular K+. Neurochemical Research. 42 (9), 2588-2594 (2017).
- Song, H., Stevens, C. F., Gage, F. H. Astroglia induce neurogenesis from adult neural stem cells. Nature. 417 (6884), 39-44 (2002).
- Christopherson, K. S., et al. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120 (3), 421-433 (2005).
- Volterra, A., Liaudet, N., Savtchouk, I. Astrocyte Ca2+ signalling: An unexpected complexity. Nature Reviews Neuroscience. 15 (5), 327-335 (2014).
- Huntington, T. E., Srinivasan, R. Astrocytic mitochondria in adult mouse brain slices show spontaneous calcium influx events with unique properties. Cell Calcium. 96, 102383 (2021).
- Kofuji, P., Newman, E. A. Potassium buffering in the central nervous system. Neuroscience. 129 (4), 1045-1056 (2004).
- Ridet, J. L., Malhotra, S. K., Privat, A., Gage, F. H. Reactive astrocytes: Cellular and molecular cues to biological function. Trends in Neurosciences. 20 (12), 570-577 (1997).
- Liddelow, S. A., Barres, B. A. Reactive astrocytes: Production, function, and therapeutic potential. Immunity. 46 (6), 957-967 (2017).
- Young, A., Gill, R., Mailloux, R. J. Protein S-glutathionylation: The linchpin for the transmission of regulatory information on redox buffering capacity in mitochondria. Chemico-Biological Interactions. , 151-162 (2019).
- Lackner, L. L. Shaping the dynamic mitochondrial network. BMC Biology. 12, 35 (2014).
- Willems, P. H. G. M., Rossignol, R., Dieteren, C. E. J., Murphy, M. P., Koopman, W. J. H. Redox homeostasis and mitochondrial dynamics. Cell Metabolism. 22 (2), 207-218 (2015).
- de Michele, R., Carimi, F., Frommer, W. B. Mitochondrial biosensors. International Journal of Biochemistry and Cell Biology. 48, 39-44 (2014).
- Terskikh, A., et al. "Fluorescent timer": Protein that changes color with time. Science. 290 (5496), 1585-1588 (2000).
- Rizzuto, R., et al. A gene specifying subunit VIII of human cytochrome c oxidase is localized to chromosome 11 and is expressed in both muscle and non-muscle tissues. Journal of Biological Chemistry. 264 (18), 10595-10600 (1989).
- Rizzuto, R., Brini, M., Pizzo, P., Murgia, M., Pozzan, T. Chimeric green fluorescent protein as a tool for visualizing subcellular organelles in living cells. Current Biology. 5 (6), 635-642 (1995).
- Ferree, A. W., et al. MitoTimer probe reveals the impact of autophagy, fusion, and motility on subcellular distribution of young and old mitochondrial protein and on relative mitochondrial protein age. Autophagy. 9 (11), 1887-1896 (2013).
- Hernandez, G., et al. MitoTimer: A novel tool for monitoring mitochondrial turnover. Autophagy. 9 (11), 1852-1861 (2013).
- Richetin, K., et al. Tau accumulation in astrocytes of the dentate gyrus induces neuronal dysfunction and memory deficits in Alzheimer's disease. Nature Neuroscience. 23 (12), 1567-1579 (2020).
- Merienne, N., et al. Gene transfer engineering for astrocyte-specific silencing in the CNS. Gene Therapy. 22 (10), 830-839 (2015).
- Sison, M., et al. 3D Time-lapse imaging and quantification of mitochondrial dynamics. Scientific Reports. 7, 43275 (2017).
- Miyazono, Y., Hirashima, S., Ishihara, N., Kusukawa, J., Nakamura, K. I., Ohta, K. Uncoupled mitochondria quickly shorten along their long axis to form indented spheroids, instead of rings, in a fission-independent manner. Scientific Reports. 8 (1), 350 (2018).
- Trudeau, K. M., Gottlieb, R. A., Shirihai, O. S. Measurement of mitochondrial turnover and life cycle using MitoTimer. Methods in Enzymology. 547, 21-38 (2014).
- Stotland, A., Gottlieb, R. A. α-MHC MitoTimer mouse: In vivo mitochondrial turnover model reveals remarkable mitochondrial heterogeneity in the heart. Journal of Molecular and Cellular Cardiology. 90, 53-58 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır