Method Article
Imagerie en direct du système mitochondrial dans les astrocytes en culture
Dans cet article
Résumé
Cet article décrit la méthode d’imagerie en accéléré mitochondrial des cultures d’astrocytes équipées du biocapteur MitoTimer et l’analyse multiparamétrique résultante de la dynamique mitochondriale, de la mobilité, de la morphologie, de la biogenèse, de l’état redox et du renouvellement.
Résumé
Bien qu’une grande attention ait été accordée aux altérations mitochondriales au niveau neuronal, des preuves récentes démontrent que la dynamique et la fonction mitochondriales dans les astrocytes sont impliquées dans la cognition. Cet article décrit la méthode d’imagerie time-lapse de cultures d’astrocytes équipées d’un biocapteur mitochondrial : MitoTimer. MitoTimer est un outil puissant et unique pour évaluer la dynamique mitochondriale, la mobilité, la morphologie, la biogenèse et l’état redox. Ici, les différentes procédures de culture, d’acquisition d’images et d’analyse mitochondriale ultérieure sont présentées.
Introduction
Les astrocytes sont des acteurs essentiels dans le maintien de l’homéostasie cérébrale. Ils sont peut-être les plus connus pour avoir des rôles structurels importants dans le cerveau, dans le cadre de la barrière hémato-encéphalique1 et en soutenant les neurones et les synapses dans tout le cerveau2. Le soutien astrocytaire des neurones est à la fois structurel3 et métabolique4,5,les astrocytes favorisant la neurogenèse et la synaptogenèse tout en fournissant des métabolites clés comme le lactate aux neurones actifs4,6,7. Au-delà du rôle de soutien structurel, les astrocytes sont des cellules actives qui participent à la signalisation et à la mise en mémoire tampon du Ca2+ (y compris les afflux spontanés mitochondriaux de Ca2+) 8,9,K+ tampon10, et peuvent s’adapter et réagir aux besoins du cerveau en période de blessure11,12 . Étant de telles cellules dynamiques, les astrocytes ont des besoins énergétiques robustes, ce qui nécessite un réseau mitochondrial efficace. Ces mitochondries ont également un rôle crucial dans la mise en mémoire tampon des espèces réactives excessives de l’oxygène (ROS)13. En plus de leurs rôles individuels ou locaux de production d’énergie et de tampon ROS, les mitochondries fonctionnent comme un réseau14. En ce sens, ils maintiennent l’équilibre entre les mitochondries fissionnelles et fusionnelles, représentant respectivement les mitochondries nouvelles/réduites et les mitochondries plus anciennes/oxydées15. L’état redox global d’une cellule peut être mesuré par l’état redox du réseau mitochondrial. En pathologie, il s’agit d’une information essentielle qui peut faire la lumière sur les cellules qui peuvent ne pas fonctionner de manière optimale.
Ces dernières années, de nombreux capteurs ont été développés pour étudier la dynamique et les fonctions des mitochondries dans les cellules. Par exemple, des capteurs mesurant l’échange d’énergie (ATP), l’état redox (NADH/NAD+,ROS) et la fonctionnalité enzymatique (cAMP, Ca2+,Zn2+)sont actuellement utilisés dans l’étude de la fonction mitochondriale16. Parmi eux, MitoTimer permet de suivre les changements de morphologie mitochondriale (taille, forme, surface), de mobilité (vitesse, déplacement) et de dynamique (événements de fusion et de fission), ainsi que le taux de renouvellement mitochondrial global et l’état redox. MitoTimer est une protéine fluorescente rouge mutante, drFP58317, avec un signal mitochondrial de la sous-unité VIII de la cytochrome c oxydasehumaine 18,19 pour visualiser les mitochondries nouvellement synthétisées en vert (488 nm) et les mitochondries oxydées en rouge (555 nm). L’utilisation du rapport de fluorescence vert (488 nm) et rouge (555 nm) permet d’évaluer simultanément les mitochondries individuelles, leur analyse morphologique, les événements de fusion / fission et l’historique de l’état redox20,21. Cette propriété unique peut être utilisée pour étudier de nombreuses questions scientifiques concernant les rôles physiologiques et pathologiques des mitochondries et est donc très prometteuse pour dévoiler les mécanismes sous-jacents de la dynamique mitochondriale dans de nombreux types de cellules différents.
Nous avons récemment développé un nouveau vecteur lentiviral (LV-G1-MitoTimer-MiR124T, ci-après appelé LV-G1-MitoTimer) pour étudier la dynamique et les fonctions des mitochondries spécifiquement dans les astrocytes in vitro et in vivo22. LV-G1-MitoTimer utilise une version tronquée du promoteur de la protéine acide fibrillaire gliale (GFAP) gfaABC1D, avec un amplificateur B3 (gfaABC1D(B3), ci-après appelé G1) combiné avec le système de détargeting neuronal miR124T précédemment décrit23. Il permet l’expression exclusive du biocapteur mitochondrial dans les astrocytes in vitro et in vivo22. Voici les différentes étapes pour effectuer une culture d’astrocytes hippocampiques de rat et les équiper du biocapteur LV-G1-MitoTimer, ainsi que les différentes étapes de microscopie pour suivre le comportement des mitochondries astrocytaires pendant plusieurs heures/jours consécutifs.
Protocole
Le présent protocole a été réalisé avec l’approbation d’un comité d’éthique (accord VD3602, Lausanne, Suisse) et suit les directives européennes pour l’utilisation des animaux.
1. Culture primaire d’astrocytes hippocampiques de rat
- Sacrifiez cinq ratons (Wistar IGS Rat) par décapitation au jour postnatal 1-2.
- Retirez le cerveau et conservez-le dans une boîte de Pétri contenant 5 mL de milieu astrocytaire frais (DMEM avec GlutaMAX complété par 1% de pénicilline / streptomycine et 10% de sérum de cheval frais).
- Isolez l’hippocampe. Dissocier dans 5 mL du milieu astrocytaire par trois passages à travers une aiguille de 21 G et trois passages à travers une aiguille de 25 G.
- Transférer les cellules dissociées dans un tube centrifuge de 15 mL et compter dans un hémocytomètre.
- Plaquer 20 000-25 000cellules/cm2 dans des boîtes multipuits (9,4 mm x 10,7 mm x 9,3 mm) et les stocker à 37 °C sous une atmosphère contenant 5 % de CO2 pour le reste de l’expérience.
- Remplacer entièrement le milieu à 3 jours in vitro (DIV3).
- À DIV8, ajouter 0,6 pg d’antigène p24 par cellule de vecteur lentiviral codant pour le biocapteur mitochondrial MitoTimer (LV-G1-MitoTimer22)dilué dans une solution saline tamponnée au phosphate (PBS + 0,01% BSA).
- À DIV9, laver avec du PBS stérile préchauffé 1x (37 °C) et ajouter un milieu astrocytaire frais.
- Au DIV11, effectuez 2 lavages avec du PBS stérile préchauffé 1x (37 °C) et ajoutez du milieu astrocytaire frais sans rouge phénolique.
REMARQUE: Le choix du revêtement dépend du dosage prévu. Comme revêtement standard pour la culture primaire d’astrocytes, il est recommandé d’utiliser 0,2 mg/mL de poly-D-lysine ou 8,7 μg/cm2 de matrice de membrane basale (p. ex. Matrigel). Pour visualiser le système mitochondrial des astrocytes, il est essentiel de travailler sur des cellules aplaties et étirées. Dans ce contexte, la combinaison de matrice de membrane basale sur des lames en U IBIDI est la plus appropriée. Il est également crucial de ne pas travailler avec le rouge phénol, qui est toxique pour la cellule sous exposition répétée à la lumière.
2. Surveillance à long terme du système mitochondrial.
- Évaluer le système mitochondrial astrocytaire au moins 3 à 5 jours après les infections lentivirales avec LV-G1-MitoTimer (pour permettre un niveau suffisant de fluorescence dans les mitochondries).
- Imagez les cellules avec un microscope inversé contrôlé par le logiciel d’acquisition et d’analyse et un module pour l’automatisation complète de l’acquisition.
REMARQUE : Reportez-vous à la Table des matériaux pour plus de détails sur le logiciel et le module utilisés dans cette étude. - Assurez-vous que le microscope est équipé d’un incubateur en cage (voir Tableau des matériaux)pour maintenir la culture d’astrocytes à 5 % de CO2 et 37 °C tout au long de l’expérience.
- Capturez des images de fluorescence en utilisant une excitation séquentielle à 490 nm (pour le canal vert) et 550 nm (pour le canal rouge) avec détection de signaux de fluorescence verts (500-540 nm pour le canal vert) et rouges (550-600 nm pour le canal rouge).
- Sélectionnez 5 astrocytes par puits avec un réseau mitochondrial exprimant des niveaux suffisants de LV-G1-MitoTimer en utilisant un grossissement de 40x. Prenez soin de sélectionner les astrocytes aussi plats et grands que possible et non situés dans des grappes de cellules (pour travailler sur des cellules individuelles).
- Enregistrez les coordonnées des 5 cellules sélectionnées dans un fichier xlm (map.xlm). Ce fichier map.xlm permet à l’utilisateur de revenir aux mêmes cellules au fil du temps.
- Acquérir des séquences d’images (1 image/s pendant 60 s) en utilisant un grossissement de 150x (objectif d’immersion dans l’huile 100x, grossissement intermédiaire 1,5x) pour chaque coordonnée.
- Répéter l’acquisition d’images (1 image/s pendant 60 s) pour les mêmes astrocytes 6 h, 12 h et 24 h après les traitements.
REMARQUE: Utilisez un microscope équipé d’un système de mise au point automatique rapide et efficace. Dans ce contexte, la solution matérielle appelée Perfect Focus System (PFS) a été utilisée. PFS utilise des capteurs de ligne LED et CCD proche infrarouge de 870 nm pour lutter contre les fluctuations de la mise au point axiale en temps réel lors d’investigations d’imagerie à long terme.
3. Analyse de la morphologie mitochondriale individuelle et du rapport LV-G1-MitoTimer
REMARQUE : NIS General Analysis 3 (GA3) de Nikon a été utilisé pour automatiser l’analyse morphométrique dans cette étude.
- Pour chaque séquence d’image (ligne de base, 6 h, 12 h, 24 h), sélectionnez la première image pour les couches rouges et vertes en cliquant sur Traitement ND > Sélectionner une image.
- Fusionnez les couches rouge et verte en sélectionnant Conversions > Canal de fusion.
- Pour corriger l’ombrage de l’image, sélectionnez Prétraitement > Correction automatique de l’ombrage.
- Appliquez l’algorithme Rolling Ball en sélectionnant Prétraitement > Rolling Ball.
- Pour générer des masques binaires pour chaque mitochondrie, sélectionnez Segmentation > Seuil.
- Supprimez tous les objets tronqués par la bordure en sélectionnant Traitement binaire > Toucher la bordure.
- Pour mesurer la surface, sélectionnez Mesure > Zone d’objet.
- Pour mesurer le diamètre, sélectionnez Mesure > Diamètre eq.
- Pour mesurer la longueur, sélectionnez Mesure > Longueur.
- Pour mesurer la largeur, sélectionnez Mesure > Largeur.
- Pour mesurer la rugosité, sélectionnez Mesure > Rugosité.
- Pour mesurer la circularité, sélectionnez Mesure > Circularité.
- Pour mesurer l’allongement, sélectionnez Mesure > Allongement.
- Composez un groupe (clic droit) avec la mesure ci-dessus et renommez-le en MorphoData.
- Mesurez l’intensité verte moyenne en sélectionnant Mesure > Intensité moyenne.
- Mesurez l’intensité rouge moyenne en sélectionnant Mesure > Intensité moyenne.
- Pour mesurer le rapport rouge/vert, sélectionnez Rapport > de mesure.
- Composez un groupe (clic droit) avec la mesure ci-dessus et renommez-le en RatioData.
- Exportez la table dans un fichier CSV en sélectionnant Référence > Table au format CSV.
- Enregistrez le script d’analyse GA3 en sélectionnant Enregistrer sous
REMARQUE : Une liste non exhaustive des critères utilisés dans cette procédure est résumée à la figure 1, au tableau 1et au tableau 2. Le fichier de script GA3 d’analyse est disponible en supplément (Fichier de codage supplémentaire 1 et Figure 2). Les seuils utilisés ont été adaptés pour individualiser autant de mitochondries que possible (en excluant les grands réseaux mitochondriaux si possible). Dans la mesure du possible, les réseaux mitochondriaux sont soit individualisés manuellement, soit exclus des analyses. En raison de la variabilité intercellulaire, effectuez ces analyses sur au moins 20 à 25 cellules par condition (avec un minimum de 50 mitochondries par cellule).
4. Analyse de la motilité mitochondriale
REMARQUE: En raison de la grande complexité des mouvements mitochondriaux, l’analyse manuelle de la motilité est préférable. Ici, le système NIS Element de Nikon a été utilisé pour suivre manuellement les mitochondries.
- Ouvrez le module de suivi dans NIS, sélectionnez Afficher > Analyse > Suivi.
- Cliquez sur Définir un nouveau retour sur investissement.
- Avec l’outil de détection automatique,sélectionnez 25 à 50 mitochondries sur la première image de la séquence d’images.
- Cliquez sur Suivre les retours sur investissement détectés automatiquement Analyser.
- Si nécessaire, supprimez les pistes de retour sur investissement incorrectes.
- Exportez la table dans un fichier CSV.
REMARQUE : Une liste non exhaustive des critères utilisés dans cette procédure est résumée à la figure 1 et au tableau 3. Une analyse de suivi donne généralement un chemin représentant les mouvements du centre de chaque objet suivi. Les différentes options de suivi doivent être définies dans l’option de suivi. Privilégier la sélection de mitochondries isolées qui sont suffisamment éloignées les unes des autres pour faciliter le suivi. Conservez uniquement les objets qui pourraient être suivis de manière cohérente sur l’ensemble de la séquence. Procédez de la même manière pour supprimer les valeurs aberrantes en raison d’un suivi de mauvaise qualité. Par conséquent, l’ensemble des objets analysés dans cette section est différent de celui analysé pour les analyses morphologiques statiques et sera généralement plus petit.
5. Transformation des données, normalisation et analyse statistique
NOTE: Principalement en raison de la grande hétérogénéité des mitochondries, les données générées ont souvent une distribution non normale.
- Enregistrez manuellement les mesures avant le traitement.
- Pour chaque analyse et chaque période, normaliser manuellement les données résultantes en fonction de celles obtenues dans l’acquisition de référence.
- De plus, considérons une deuxième/double normalisation à une condition de contrôle, par exemple, pour évaluer l’effet d’un traitement.
- Ensuite, effectuez une analyse statistique à l’aide d’une ANOVA appariée bidirectionnelle. Ici, GraphPad Prism V8 a été utilisé.
Résultats
La culture primaire d’astrocytes infectés par LV-G1-MitoTimer a présenté des réseaux mitochondriaux typiques. Avant le traitement, les astrocytes exprimant LV-G1-MitoTimer ont montré la taille mitochondriale hétérogène et diverses intensités de fluorescence vert/rouge (Figure 3, Figure 4et Vidéo 1). Le système mitochondrial des cultures d’astrocytes exprimant LV-G1-MitoTimer a été surveillé avant et après l’incubation avec H20 2 (10 μM). Les différentes caractéristiques mitochondriales décrites ci-dessus ont été calculées sur 12 h (toutes les 3 h) et normalisées (cellule par cellule) à leur état initial. Au niveau morphologique (Figure 3B), les effets deH2O2 commencent à être visibles vers 6 h. En effet, les mitochondries étaient fragmentées (diminution de la longueur, de la surface et du facteur d’allongement). Cette fragmentation est encore plus évidente 12 h après le traitement. Notez que les diamètres, les largeurs et la sphéricité n’ont pas été réduits. En ce qui concerne l’état redox et le renouvellement (Figure 3C), 3 h après le traitement H2O2, la proportion de mitochondries vertes a augmenté dans les astrocytes (conséquence d’une augmentation rapide de la biogenèse mitochondriale). À 6 h, le rapport vert/rouge est revenu aux niveaux de base, mais le nombre de mitochondries purement rouges a augmenté de manière significative par rapport aux niveaux basaux. Après 12 h, les conséquences du traitement oxydatif deH2O2 étaient visibles et ont entraîné une augmentation substantielle du rapport et du nombre de puncta rouges. Concernant la dynamique et la mobilité (Figure 3D), 3 h après le traitement, tous les critères ont été transitoirement augmentés. À plus long terme (12 h), les mitochondries se déplaçaient plus lentement et sur des distances plus courtes.
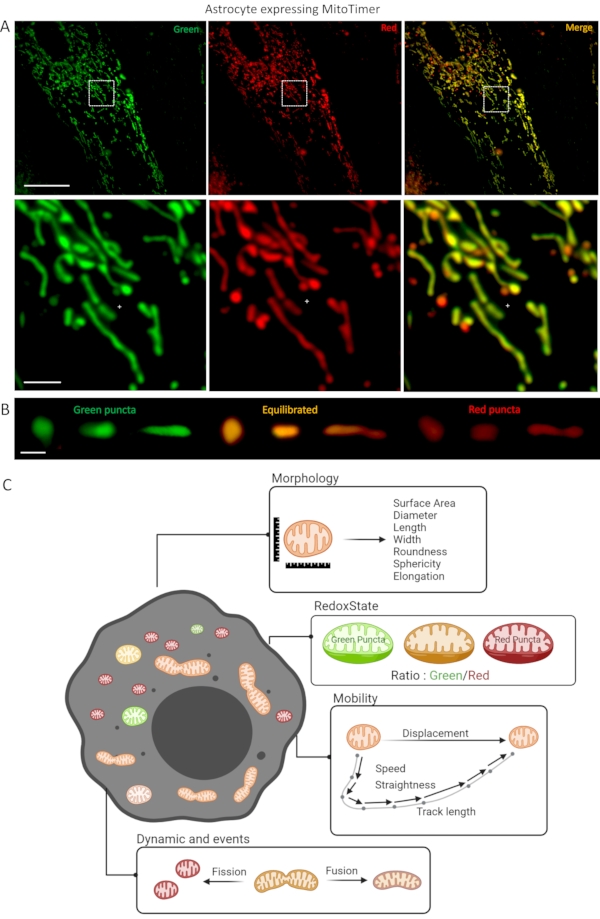
Figure 1: Culture d’astrocytes exprimant le biocapteur LV-G1-MitoTimer. (A) Photographies confocales d’astrocytes exprimant LV-G1-MitoTimer. (B) Sélection de photographies confocales de mitochondries réduites (vertes) équilibrées (orange) et oxydées (rouges) avec différents niveaux de fragmentation. (C) Schéma récapitulatif des différents critères disponibles pour l’analyse dans un astrocyte exprimant LV-G1-MitoTimer. Barre d’échelle: (A) Panneau supérieur: 50 μm, panneau inférieur: 10 μm, (B) 1 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
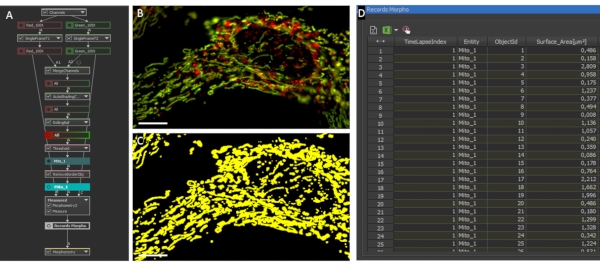
Figure 2: Morphologie mitochondriale et analyse des ratios. ( A )Aperçudu script GA3 pour l’analyse de la morphologie et du rapport mitochondriaux individuels. (B) Photographies initiales d’un astrocyte exprimant LV-G1-MitoTimer analysées avec le script GA3. (C) Exemple de masques binaires générés pour le système mitochondrial des astrocytes. Barre d’échelle : 10 μm (B-C). Veuillez cliquer ici pour voir une version agrandie de cette figure.
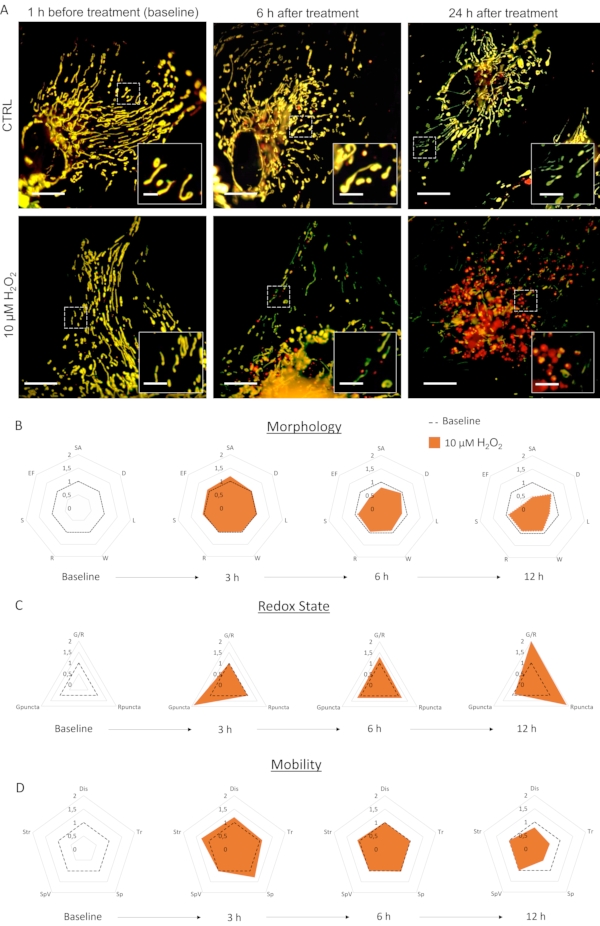
Figure 3: Les effets deH2O2 sur le système mitochondrial des astrocytes. (A) Photographies d’astrocytes exprimant LV-G1-MitoTimer 1 h avant et 6 h, 24 h après le traitement par PBS (CTRL) et 10 μM deH2O2. (B) Cartes radar de la morphologie mitochondriale,(C)état redox et renouvellement, et (D) critères de mobilité évalués sur les astrocytes au cours de la ligne de base et 3 h, 6 h et 12 h après le traitement H2O2. SA: Superficie; D: Diamètre; L: Longueur; W: Largeur; R: Rondeur; S: Sphéricité; EF : Facteur d’allongement (=L/W); G/R : Rapport individuel rouge/vert ; Gpuncta: Pourcentage de mitochondries vertes puncta; Rpuncta: Pourcentage de mitochondries rouges; Dis: Déplacement; Tr: Longueur de la piste; Sp et SpV: Vitesse et variance de vitesse; Str : Rectitude. Barre d’échelle : 20 μm (A) et 2,5 μm (encart). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 4: Photographies d’astrocytes exprimant LV-G1-MitoTimer et montrant un réseau mitochondrial homogène et équilibré au cours de la ligne de base. Barre d’échelle: 20 μm Veuillez cliquer ici pour voir une version plus grande de cette figure.
Vidéo 1 : Effet dutraitement H2O2 sur le système mitochondrial des astrocytes cultivés. Mitochondries astrocytaires avant le traitement H2O2 (baseline), ainsi que 6 h et 24 h après le traitement H2O2 par rapport à la cellule témoin non traitée. Veuillez cliquer ici pour télécharger ce fichier.
| Critères de morphologie | Gamme | Remarques | ||
| Superficie (SA) | 0,5–4 μm2 | Ces critères renseignent sur les caractéristiques fragmentées-allongées des mitochondries. Ils évoluent généralement dans la même direction. Les mitochondries fragmentées auront une surface, un diamètre, une longueur et un facteur d’allongement réduits, tandis que la rondeur, la sphéricité et la largeur peuvent être inchangées ou augmentées. | ||
| Diamètre (D) | 0,5 à 1,5 μm | |||
| Longueur (L) | 0,5–5 μm | |||
| Largeur (W) | 0,5–2 μm | |||
| Rondeur (R) | 0–1 | |||
| Sphéricité (S) | 0–1 | |||
| Facteur d’allongement (EF = L/W) | 1–10 | |||
Tableau 1 : Résumé des paramètres sélectionnés pour la morphologie mitochondriale.
| Critères de l’état redox | Gamme | Remarques | ||
| Rapport individuel (G/R) | 0–10 | Le rapport indique le résultat de l’état redox. Il informe sur l’état général et l’âge des mitochondries dans la cellule. Il est essentiel de considérer que ce rapport est l’équilibre de la biogenèse et de la dégradation des mitochondries et la fission/fusion des mitochondries oxydées avec des mitochondries réduites. Par conséquent, l’évaluation du nombre de ponctuations vertes et rouges peut aider puissamment à interpréter les résultats. Les mitochondries de puncta vertes sont déterminées lorsque l’intensité du vert est 10 fois supérieure à celle du rouge. Les mitochondries de puncta rouge sont déterminées lorsque l’intensité du rouge est 10 fois supérieure à celle du vert. L’état redox d’un astrocyte est la moyenne de tous les rapports mitochondriaux de cette cellule. | ||
| Pourcentage de mitochondries vertes (Gpuncta) | 0%–100% | |||
| Pourcentage de mitochondries rouges (Rpuncta) | 0%–100% | |||
Tableau 2 : Résumé des paramètres sélectionnés pour l’état redox mitochondrial.
| Critères de mobilité | Gamme | Remarques | ||
| Déplacement (Dis) | 0–10 μm | Ensemble, ces caractéristiques informent la dynamique générale de la motilité du réseau. Les mitochondries stationnaires affichent un déplacement court et une longueur de piste à faible vitesse. D’autre part, les particules oscillatoires peuvent être différenciées avec une différence entre la longueur et le déplacement de la voie (ce qui entraîne une faible rectitude) et une vitesse accrue par rapport à la statique. | ||
| Longueur de la piste (Tr) | 0–10 μm | |||
| Vitesse et variance de vitesse (Sp et SpV) | 0–1,5 μm/s ± 0,2 μm/s | |||
| Rectitude | 0–1 | |||
| (Str = déplacement/longueur de la voie) | ||||
Tableau 3 : Résumé des paramètres sélectionnés pour la mobilité mitochondriale.
Fichier de codage supplémentaire 1: Fichier de script GA3 pour l’analyse de la morphologie mitochondriale individuelle. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Ici, une nouvelle méthode pour suivre longitudinalement la dynamique et le renouvellement du système mitochondrial dans un astrocyte cultivé est proposée. Contrairement à une approche time-lapse sur un groupe fixe de cellules ou une cellule individuelle à la fois (le plus souvent utilisée dans la littérature)24,25,les chercheurs peuvent suivre l’évolution du système mitochondrial pendant plusieurs jours sur les mêmes cellules individuelles. Contrairement à l’imagerie en direct à puits unique où des niveaux élevés d’exposition à la lumière sont requis et où la sélection de nombreuses cellules individuelles est moins réalisable, la méthode proposée tire parti de la capacité de ce microscope à imager plusieurs cellules différentes dans différentes zones d’un puits et à revenir à ces mêmes cellules à différents moments pour les réimager. Grâce à la normalisation à une ligne de base réalisée pour chaque critère mesuré sur chaque cellule d’intérêt, il prend en compte la complexité du système mitochondrial et étudie l’effet du traitement sur chaque cellule par rapport à sa propre image de base. La capacité du microscope à effectuer de manière autonome ce type d’imagerie sur jusqu’à 16 puits à la fois (imagerie de 5 cellules par puits) permet de prendre en compte correctement l’hétérogénéité du système mitochondrial lors de l’analyse sans la variabilité expérimentale qui accompagne l’imagerie de diverses conditions à différents jours.
La qualité des cultures, les niveaux d’infections virales exprimant le biocapteur LV-G1-MitoTimer, le type de microscope et d’objectifs, ainsi que la sélection de cellules appropriées sont des variables critiques qui doivent rester aussi cohérentes que possible dans ce protocole. Les densités cellulaires, le type de vecteur et les titres viraux peuvent être adaptés en fonction de la question. Bien que des travaux antérieurs montrent que l’expression de LV-G1-MitoTimer n’a pas de conséquences délétères sur la fonction mitochondriale et la dynamique21,22, 26,27, il est essentiel de vérifier que la concentration n’est pas toxique pour les cellules (par exemple, en vérifiant bien le nombre total de cellules en contrôle). Comme un seul plan focal est utilisé, les astrocytes doivent être: (1) aussi plats que possible, (2) isolés d’autres cellules marquées (pour simplifier l’analyse en cas de déplacement dans la boîte), et (3) possédant des niveaux de fluorescence élevés. Comme les cellules en culture peuvent être très variables en morphologie, le système mitochondrial peut être très hétérogène. Dans ce contexte, l’analyse des ROI (et non de la cellule entière) compense certaines régions problématiques, telles que les régions périnucléaires, et diminue la variabilité. Il est essentiel de faire la ligne de base sur des cellules relativement similaires et d’échantillonner autant de cellules que possible. Par conséquent, les microscopes d’acquisition et d’analyse à haut contenu sont parfaitement adaptés. Au cours de cette surveillance longitudinale, il est également important de ne pas surexposer les cellules à la lumière pour éviter le blanchiment des biocapteurs.
Cette méthode d’imagerie n’est pas sans complexités, et tout au long du protocole, plusieurs notes sont incluses, qui prennent en compte le dépannage effectué lors de tests précédents avec le microscope. Par exemple, le choix du revêtement de plaque utilisé dépend du dosage prévu, mais des recommandations pour les choix les plus appropriés pour les cultures primaires d’astrocytes ont été incluses. De plus, l’acquisition d’images doit être effectuée sur au moins 5 cellules par condition en raison de la variabilité intercellulaire. Plus précisément, certaines cellules sélectionnées lors de l’imagerie de base mourront, certaines sortiront du cadre de la zone d’acquisition d’image assignée et d’autres modifieront leur morphologie, ce qui rendra les mitochondries très difficiles à individualiser dans l’analyse. L’imagerie de nombreuses cellules dès le début augmente la probabilité d’un échantillon suffisamment grand de cellules à analyser à la fin de l’expérience. En plus des aspects plus complexes de cette technique d’imagerie, il existe des limites absolues quant à savoir qui peut bénéficier de ce type d’imagerie et d’analyse. Afin de tirer pleinement parti de l’automatisation de l’acquisition d’images, le microscope utilisé doit disposer d’un système de mise au point automatique capable de gérer la vitesse des intervalles de temps entre les images (c’est-à-dire toutes les 3 s dans ce protocole) et de se concentrer systématiquement sur la cellule en question avant que chaque image ne soit prise. De plus, sans le logiciel JOBS, qui automatise l’ensemble du processus d’acquisition d’images, cette méthode devient ardue et potentiellement impossible en fonction du nombre de cellules imagées, car elle nécessiterait de trouver et d’imager manuellement chaque cellule à nouveau au moment approprié. Enfin, cette méthode d’imagerie n’est pas à l’abri de la question du photoblanchiment. Pour cette raison, comme pour toute méthode d’acquisition à long terme, il est important de choisir des marqueurs fluorescents moins sensibles au photoblanchiment et d’adapter l’acquisition d’images pour éviter ce problème autant que possible.
Cette technique diffère des autres actuellement utilisées de manière cruciale. Contrairement à d’autres études en accéléré, cette technique ne nécessite pas d’imagerie sur la même position dans le puits pendant tout le temps, ni un mouvement manuel de la plaque pour imager d’autres zones. Cela permet aux chercheurs d’imager de nombreuses cellules dans de nombreuses conditions en une seule période de 24 heures. Par conséquent, la capacité d’effectuer cette imagerie et cette analyse sur de nombreuses cellules dans chaque puits donne les mêmes informations de population que l’on obtiendrait en étudiant largement un grand groupe de cellules tout en fournissant des mesures spécifiques de chaque cellule imagée. Bien que certaines spécificités de cette méthode puissent ne pas s’appliquer à d’autres méthodes d’acquisition d’images (décrites ci-dessus), les avantages l’emportent sur les complications liées au type d’analyse possible après l’acquisition. Cette technique permet aux chercheurs de voir les ramifications exactes de divers traitements sur le système mitochondrial et, par conséquent, sur les astrocytes cultivés.
En outre, cette méthode est hautement personnalisable à de nombreuses questions scientifiques différentes concernant le comportement et les rôles mitochondriaux dans des contextes spécifiques. Ici, le protocole décrit traite spécifiquement des astrocytes cultivés. Cependant, de nombreux autres types de cellules peuvent être utilisés, et les traitements qui peuvent être testés ne sont limités que par les questions étudiées. Ce type d’imagerie a le potentiel de faire progresser la connaissance et la compréhension collectives du comportement mitochondrial, des mécanismes sous-jacents qui conduisent au dysfonctionnement mitochondrial et des effets de nombreuses pathologies sur la dynamique innée présente dans différents types de cellules.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Cette étude a été soutenue par une bourse de la Fondation Synapsis attribuée à K.R. et au CHUV . Les auteurs remercient Nikon pour leur aide, en particulier J. Gannevat.
matériels
| Name | Company | Catalog Number | Comments |
| µ-Slide 8 Well | IBIDI | 80807 | |
| 19 G needle | Plexus SANTE | PL001213 | |
| 21 G needle | Plexus SANTE | PL000142 | |
| 25 G needle | Plexus SANTE | PL000133 | |
| Bovin Serum Albumin | LIFE TECH | 15260037 | |
| Camera | HAMAMATSU | ORCA-flash4.0 V3 - C13440-20CU | |
| DMEM, high glucose, GlutaMAX(TM) | THERMOFISHER | 61965059 | |
| Glutamax Supplement | THERMOFISHER | 35050061 | |
| Horse Serum | SIGMA | 16050122 | |
| Lens | Nikon Instruments | CFI Plan Fluor 100x Oil | |
| Light Engines | LUMENCOR | SPECTRA X | |
| Linear-encoded motorized platine | Nikon Instruments | N/A | |
| Microscope | Nikon Instruments | ECLIPSE Ti2-E MICROSCOPE INVERSE | |
| Microscope Stage Incubator with 3-channel manual gas mixer and gas bubbler/ humidity module | OKOLAB | H201-NIKON-TI-S-ER | |
| PBS 1x liquid | THERMOFISHER | 20012068 | |
| Penicillin-Streptomycin | SIGMA | 15140122 | |
| Petri dishes 100 mm | SIGMA | P5731 | |
| Petri dishes 35 mm | SIGMA | CLS430165 | |
| Pregnant Rats | CHARLES RIVERS | 3 | |
| Software Nikon NIS-HC | Nikon Instruments | NIS-Elements HC | |
| Sofware Prism | GraphPad | V8.02 | |
| Stericup 500 mL | MERCK MILLIPORE | 10412701 |
Références
- Ballabh, P., Braun, A., Nedergaard, M. The blood-brain barrier: An overview: Structure, regulation, and clinical implications. Neurobiology of Disease. 16 (1), 1-13 (2004).
- Allen, N. J., Eroglu, C. Cell biology of astrocyte-synapse interactions. Neuron. 96 (3), 697-708 (2017).
- Bernardinelli, Y., Muller, D., Nikonenko, I. Astrocyte-synapse structural plasticity. Neural Plasticity. 2014, 232105 (2014).
- Benarroch, E. E. Neuron-astrocyte interactions: Partnership for normal function and disease in the central nervous system. Mayo Clinic Proceedings. 80 (10), 1326-1338 (2005).
- MacVicar, B. A., Choi, H. B. Astrocytes provide metabolic support for neuronal synaptic function in response to extracellular K+. Neurochemical Research. 42 (9), 2588-2594 (2017).
- Song, H., Stevens, C. F., Gage, F. H. Astroglia induce neurogenesis from adult neural stem cells. Nature. 417 (6884), 39-44 (2002).
- Christopherson, K. S., et al. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120 (3), 421-433 (2005).
- Volterra, A., Liaudet, N., Savtchouk, I. Astrocyte Ca2+ signalling: An unexpected complexity. Nature Reviews Neuroscience. 15 (5), 327-335 (2014).
- Huntington, T. E., Srinivasan, R. Astrocytic mitochondria in adult mouse brain slices show spontaneous calcium influx events with unique properties. Cell Calcium. 96, 102383 (2021).
- Kofuji, P., Newman, E. A. Potassium buffering in the central nervous system. Neuroscience. 129 (4), 1045-1056 (2004).
- Ridet, J. L., Malhotra, S. K., Privat, A., Gage, F. H. Reactive astrocytes: Cellular and molecular cues to biological function. Trends in Neurosciences. 20 (12), 570-577 (1997).
- Liddelow, S. A., Barres, B. A. Reactive astrocytes: Production, function, and therapeutic potential. Immunity. 46 (6), 957-967 (2017).
- Young, A., Gill, R., Mailloux, R. J. Protein S-glutathionylation: The linchpin for the transmission of regulatory information on redox buffering capacity in mitochondria. Chemico-Biological Interactions. , 151-162 (2019).
- Lackner, L. L. Shaping the dynamic mitochondrial network. BMC Biology. 12, 35 (2014).
- Willems, P. H. G. M., Rossignol, R., Dieteren, C. E. J., Murphy, M. P., Koopman, W. J. H. Redox homeostasis and mitochondrial dynamics. Cell Metabolism. 22 (2), 207-218 (2015).
- de Michele, R., Carimi, F., Frommer, W. B. Mitochondrial biosensors. International Journal of Biochemistry and Cell Biology. 48, 39-44 (2014).
- Terskikh, A., et al. "Fluorescent timer": Protein that changes color with time. Science. 290 (5496), 1585-1588 (2000).
- Rizzuto, R., et al. A gene specifying subunit VIII of human cytochrome c oxidase is localized to chromosome 11 and is expressed in both muscle and non-muscle tissues. Journal of Biological Chemistry. 264 (18), 10595-10600 (1989).
- Rizzuto, R., Brini, M., Pizzo, P., Murgia, M., Pozzan, T. Chimeric green fluorescent protein as a tool for visualizing subcellular organelles in living cells. Current Biology. 5 (6), 635-642 (1995).
- Ferree, A. W., et al. MitoTimer probe reveals the impact of autophagy, fusion, and motility on subcellular distribution of young and old mitochondrial protein and on relative mitochondrial protein age. Autophagy. 9 (11), 1887-1896 (2013).
- Hernandez, G., et al. MitoTimer: A novel tool for monitoring mitochondrial turnover. Autophagy. 9 (11), 1852-1861 (2013).
- Richetin, K., et al. Tau accumulation in astrocytes of the dentate gyrus induces neuronal dysfunction and memory deficits in Alzheimer's disease. Nature Neuroscience. 23 (12), 1567-1579 (2020).
- Merienne, N., et al. Gene transfer engineering for astrocyte-specific silencing in the CNS. Gene Therapy. 22 (10), 830-839 (2015).
- Sison, M., et al. 3D Time-lapse imaging and quantification of mitochondrial dynamics. Scientific Reports. 7, 43275 (2017).
- Miyazono, Y., Hirashima, S., Ishihara, N., Kusukawa, J., Nakamura, K. I., Ohta, K. Uncoupled mitochondria quickly shorten along their long axis to form indented spheroids, instead of rings, in a fission-independent manner. Scientific Reports. 8 (1), 350 (2018).
- Trudeau, K. M., Gottlieb, R. A., Shirihai, O. S. Measurement of mitochondrial turnover and life cycle using MitoTimer. Methods in Enzymology. 547, 21-38 (2014).
- Stotland, A., Gottlieb, R. A. α-MHC MitoTimer mouse: In vivo mitochondrial turnover model reveals remarkable mitochondrial heterogeneity in the heart. Journal of Molecular and Cellular Cardiology. 90, 53-58 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon