Method Article
Живая визуализация митохондриальной системы в культивируемых астроцитах
В этой статье
Резюме
В данной статье описан метод митохондриальной покадровой визуализации культур астроцитов, оснащенных биосенсором MitoTimer, и полученный в результате мультипараметрический анализ митохондриальной динамики, подвижности, морфологии, биогенеза, окислительно-восстановительного состояния и оборота.
Аннотация
Хотя большое внимание уделяется митохондриальным изменениям на нейронном уровне, последние данные показывают, что митохондриальная динамика и функция в астроцитах участвуют в познании. В данной статье описан метод покадровой визуализации культур астроцитов, оснащенных митохондриальным биосенсором: MitoTimer. MitoTimer является мощным и уникальным инструментом для оценки динамики митохондрий, подвижности, морфологии, биогенеза и окислительно-восстановительного состояния. Здесь представлены различные процедуры для культуры, получения изображений и последующего митохондриального анализа.
Введение
Астроциты являются критическими игроками в поддержании гомеостаза мозга. Они, пожалуй, наиболее известны тем, что играют значительную структурную роль в мозге, как часть гематоэнцефалического барьера1 и поддерживая нейроны и синапсы по всему мозгу2. Астроцитарная поддержка нейронов является как структурной3, так и метаболической4,5,причем астроциты способствуют нейрогенезу и синаптогенезу, а также обеспечивают ключевые метаболиты, такие как лактат, к активным нейронам4,6,7. Помимо роли структурной поддержки, астроциты являются активными клетками, которые принимают участие в передаче сигналов и буферизации Ca2 + (включая спонтанные митохондриальные ca2 + притоки)8,9,K+ буферизация10, и могут адаптироваться и реагировать на потребности мозга во время травмы11,12 . Будучи такими динамичными клетками, астроциты имеют высокие энергетические потребности, что требует эффективной митохондриальной сети. Эти митохондрии также играют решающую роль в буферизации избыточных активных форм кислорода (АФК)13. В дополнение к их индивидуальным или локальным ролям производства энергии и буферизации АФК, митохондрии функционируют как сеть14. В этом смысле они поддерживают равновесие между делящимися и сливающимися митохондриями, представляющими собой новые/восстановленные митохондрии и более старые/окисленные митохондрии соответственно15. Общее окислительно-восстановительное состояние клетки можно измерить по окислительно-восстановительному состоянию митохондриальной сети. В патологии это важная часть информации, которая может пролить свет на то, какие клетки могут функционировать не оптимально.
В последние годы было разработано множество датчиков для изучения динамики и функций митохондрий в клетках. Например, датчики, измеряющие энергообмен (АТФ), окислительно-восстановительное состояние (NADH/NAD+, ROS) и ферментативную функциональность (цАМФ, Ca2+,Zn 2+),в настоящее время используются при изучении митохондриальной функции16. Среди них MitoTimer позволяет отслеживать изменения морфологии митохондрий (размер, форма, площадь поверхности), подвижность (скорость, смещение) и динамику (события слияния и деления), а также общую скорость оборота митохондрий и окислительно-восстановительное состояние. MitoTimer представляет собой мутантный красный флуоресцентный белок, drFP58317,с митохондриальным сигналом от субъединицы VIII человеческой цитохром-с-оксидазы18,19 для визуализации вновь синтезированных митохондрий в зеленом цвете (488 нм) и окисленных митохондрий в красном (555 нм). Использование соотношения флуоресценции зеленого (488 нм) и красного (555 нм) позволяет одновременно оценивать отдельные митохондрии, анализ их морфологии, события слияния/деления и историю окислительно-восстановительных состояний20,21. Это уникальное свойство может быть использовано для исследования многих научных вопросов, касающихся физиологических и патологических ролей митохондрий, и поэтому является очень перспективным для раскрытия основных механизмов митохондриальной динамики во многих различных типах клеток.
Недавно мы разработали новый лентивирусный вектор (LV-G1-MitoTimer-MiR124T, далее называемый LV-G1-MitoTimer) для изучения динамики и функций митохондрий, особенно в астроцитах in vitro и in vivo22. LV-G1-MitoTimer использует усеченную версию промотора глиального фибриллярного кислого белка (GFAP) gfaABC1D, с усилителем B3 (gfaABC1D(B3), далее называемым G1) в сочетании с ранее описанной нейрональной системой детаргетингаmiR124T 23. Позволяет эксклюзивно экспрессировать митохондриальный биосенсор в астроцитах in vitro и in vivo22. Здесь представлены различные шаги по выполнению культуры астроцитов гиппокампа крыс и оснащению их биосенсором LV-G1-MitoTimer, а также различные этапы микроскопии для отслеживания поведения митохондрий астроцитов в течение нескольких последовательных часов / дней.
протокол
Настоящий протокол был выполнен с одобрения этического комитета (соглашение VD3602, Лозанна, Швейцария) и соответствует европейским руководящим принципам использования животных.
1. Первичная культура астроцитов гиппокампа крыс
- Приносят в жертву пять детенышей крыс (Wistar IGS Rat) путем обезглавливания на послеродовой день 1-2.
- Удалите мозг и держите его в чашке Петри, содержащей 5 мл свежей астроцитарной среды (DMEM с GlutaMAX, дополненным 1% пенициллина / стрептомицина и 10% свежей конской сывороткой).
- Выделяют гиппокамп. Диссоциируют в 5 мл астроцитарной среды тремя проходами через иглу 21 G и тремя проходами через иглу 25 G.
- Перенесите диссоциированные клетки в центрифужную трубку объемом 15 мл и посчитайте в гемоцитометре.
- Накладывайте 20 000-25 000 клеток/см2 в многоязычные тарелки (9,4 мм х 10,7 мм х 9,3 мм) и храните их при 37 °C в атмосфере, содержащей 5% CO2 до конца эксперимента.
- Замените среду полностью через 3 дня in vitro (DIV3).
- При DIV8 добавляют 0,6 пг антигена р24 на клетку лентивирусного вектора, кодирующего митохондриальный биосенсор MitoTimer (LV-G1-MitoTimer22),разбавленный в фосфатно-буферном физиологическом растворе (PBS + 0,01% BSA).
- При DIV9 промыть предварительно подогретым 1x стерильным PBS (37 °C) и добавить свежую астроцитарную среду.
- При DIV11 выполните 2 промывки с предварительно подогретым 1x стерильным PBS (37 °C) и добавьте свежую астроцитарную среду без фенолового красного цвета.
ПРИМЕЧАНИЕ: Выбор покрытия зависит от предполагаемого анализа. В качестве стандартного покрытия для первичной культуры астроцитов рекомендуется использовать 0,2 мг/мл поли-D-лизина или 8,7 мкг/см2 матрицы базальной мембраны (например, Матригеля). Чтобы визуализировать митохондриальную систему астроцитов, необходимо работать над уплощенными и растянутыми клетками. В этом контексте комбинация матрицы базальной мембраны на u-слайдах IBIDI является наиболее подходящей. Также крайне важно не работать с фенолом красным, который токсичен для клетки при многократном воздействии света.
2. Долгосрочный мониторинг митохондриальной системы.
- Оценить астроцитарную митохондриальную систему минимум через 3-5 дней после лентивирусных инфекций LV-G1-MitoTimer (чтобы обеспечить достаточный уровень флуоресценции в митохондриях).
- Изображение клеток с помощью инвертированного микроскопа, управляемого программным обеспечением для сбора и анализа, и модуля для полной автоматизации сбора.
ПРИМЕЧАНИЕ: Подробную информацию о программном обеспечении и модуле, используемых в данном исследовании, см. в Таблице материалов. - Убедитесь, что микроскоп оснащен клеточным инкубатором (см. Таблицу материалов)для поддержания культуры астроцитов при 5%CO2 и 37 °C на протяжении всего эксперимента.
- Захват флуоресцентных изображений с использованием последовательного возбуждения при 490 нм (для зеленого канала) и 550 нм (для красного канала) с обнаружением зеленых (500-540 нм для зеленого канала) и красных (550-600 нм для красного канала) флуоресцентных сигналов.
- Выберите 5 астроцитов на лунку с митохондриальной сетью, экспрессирующей достаточные уровни LV-G1-MitoTimer, используя увеличение 40x. Позаботьтесь о том, чтобы подобранные астроциты как можно более плоские и крупные, а не расположенные в скоплениях клеток (для работы на отдельных клетках).
- Сохраните координаты 5 выбранных ячеек в файле xlm (map.xlm). Этот map.xlm позволяет пользователю со временем возвращаться к тем же ячейкам.
- Получайте последовательности изображений (1 изображение/с в течение 60 с), используя увеличение 150x (100x масляный погружной объектив, 1,5x промежуточное увеличение) для каждой координаты.
- Повторное получение изображения (1 изображение/с в течение 60 с) для тех же астроцитов через 6 ч, 12 ч и 24 ч после лечения.
ПРИМЕЧАНИЕ: Используйте микроскоп, оснащенный быстрой и эффективной системой автофокусировки. В этом контексте было использовано аппаратное решение под названием Perfect Focus System (PFS). PFS использует ближние инфракрасные 870-нм светодиодные и ПЗС-датчики для борьбы с колебаниями осевой фокусировки в режиме реального времени во время долгосрочных исследований изображений.
3. Анализ индивидуальной морфологии митохондрий и соотношения LV-G1-MitoTimer
ПРИМЕЧАНИЕ: Общий анализ NIS 3 (GA3) от Nikon был использован для автоматизации морфометрического анализа в этом исследовании.
- Для каждой последовательности изображений (базовая линия, 6 ч, 12 ч, 24 ч) выберите первый кадр для красного и зеленого каналов, щелкнув ND Processing > Select Frame.
- Объедините красный и зеленый каналы, выбрав Конверсии > Объединить канал.
- Чтобы исправить затенение изображения, выберите Предварительная обработка > Автоматическая коррекция затенения.
- Примените алгоритм Rolling Ball, выбрав Предварительная обработка > Rolling Ball.
- Чтобы создать двоичные маски для каждой митохондрии, выберите Сегментация > Порог.
- Удалите все объекты, усеченные границей, выбрав Двоичная обработка > Касание границы.
- Чтобы измерить площадь поверхности, выберите Измерение > Область объекта.
- Чтобы измерить диаметр, выберите Измерение > Eq Diameter.
- Чтобы измерить длину, выберите Измерение > Длина.
- Чтобы измерить ширину, выберите Измерение > Ширина.
- Чтобы измерить шероховатость, выберите Измерение > Шероховатость.
- Чтобы измерить цикличность, выберите Измерение > Цикличность.
- Чтобы измерить относительное удлинение, выберите Измерение > Относительное удлинение.
- Составьте группу (щелкните правой кнопкой мыши) с приведенным выше измерением и переименуйте ее в MorphoData.
- Измерьте среднюю интенсивность зеленого цвета, выбрав Измерение > Средняя интенсивность.
- Измерьте среднюю интенсивность красного цвета, выбрав Измерение > Средняя интенсивность.
- Чтобы измерить соотношение красный/зеленый, выберите Измерение > Соотношение.
- Составьте группу (щелкните правой кнопкой мыши) с приведенным выше измерением и переименуйте ее в RatioData.
- Экспортируйте таблицу в CSV-файл, выбрав Reference > Table to CSV.
- Сохраните скрипт анализа GA3, выбрав Сохранить как
ПРИМЕЧАНИЕ: Неисчерпывающий перечень критериев, используемых в данной процедуре, приведен на рисунке 1, в таблице 1и таблице 2. Файл скрипта анализа GA3 доступен в дополнительном виде (Файл дополнительного кодирования 1 и рисунок 2). Используемые пороги были адаптированы для индивидуализации как можно большего количества митохондрий (исключая большие митохондриальные сети, где это возможно). Везде, где это возможно, митохондриальные сети либо индивидуализируются вручную, либо исключаются из анализа. Из-за межклеточной изменчивости выполняйте эти анализы по крайней мере на 20-25 клетках на каждое состояние (с минимум 50 митохондриями по клеткам).
4. Анализ моторики митохондрий
ПРИМЕЧАНИЕ: Из-за высокой сложности митохондриальных движений предпочтительнее ручной анализ моторики. Здесь система NIS Element от Nikon использовалась для ручного отслеживания митохондрий.
- Откройте модуль отслеживания в NIS, выберите Просмотр > Анализ > Отслеживание.
- Нажмите Определить новую рентабельность инвестиций.
- С помощью инструмента автоматического обнаружениявыберите 25-50 митохондрий на первом изображении последовательности изображений.
- Нажмите на Отслеживать автоопределенные ROI Analyze.
- При необходимости удалите неправильные дорожки ROI.
- Экспортируйте таблицу в CSV-файл.
ПРИМЕЧАНИЕ: Неисчерпывающий перечень критериев, используемых в данной процедуре, приведен на рисунке 1 и в таблице 3. Анализ отслеживания обычно дает путь, изображающий движения центра каждого отслеживаемого объекта. Различные параметры отслеживания должны быть установлены в параметре отслеживания. Отдавайте предпочтение выбору изолированных митохондрий, которые достаточно удалены друг от друга, чтобы облегчить отслеживание. Сохраняйте только те объекты, которые можно последовательно отслеживать на протяжении всей последовательности. Действуйте таким же образом, чтобы удалить выбросы из-за плохого отслеживания качества. Следовательно, набор объектов, анализируемых в этом разделе, отличается от того, который анализируется для статического морфологического анализа, и, как правило, будет меньше.
5. Преобразование, нормализация и статистический анализ данных
ПРИМЕЧАНИЕ: В основном из-за высокой гетерогенности митохондрий генерируемые данные часто имеют ненормальное распределение.
- Вручную регистрируйте и преобразуйте измерения перед обработкой.
- Для каждого анализа и временных рамок вручную нормализуйте полученные данные с помощью данных, полученных при эталонном сборе.
- Кроме того, рассмотрите вторую/двойную нормализацию контрольного состояния, например, для оценки эффекта от лечения.
- Затем выполните статистический анализ с использованием двустороннего сопоставления ANOVA. Здесь использовался GraphPad Prism V8.
Результаты
Первичная культура астроцитов, инфицированных LV-G1-MitoTimer, показала типичные митохондриальные сети. Перед лечением астроциты, экспрессирующие LV-G1-MitoTimer, показали гетерогенный размер митохондрий и различные интенсивности зеленой/красной флуоресценции(Рисунок 3, Рисунок 4и Видео 1). Митохондриальную систему культур астроцитов, экспрессирующих LV-G1-MitoTimer, контролировали до и после инкубации сН202 (10 мкМ). Различные митохондриальные особенности, описанные выше, были рассчитаны в течение 12 ч (каждые 3 ч) и нормализованы (клетка за клеткой) до их начального состояния. На морфологическом уровне(рис. 3В)эффектыН2О2 начинаютпроявляться примерно через 6 ч. Действительно, митохондрии были фрагментированы (уменьшение длины, площади поверхности и коэффициента удлинения). Эта фрагментация еще более очевидна через 12 ч после лечения. Обратите внимание, что диаметры, ширина и сферичность не были уменьшены. Что касается окислительно-восстановительного состояния и оборота(рисунок 3С),то через 3 ч послелечения Н2О2 доля зеленых митохондрий в астроцитах увеличилась (следствие быстрого увеличения митохондриального биогенеза). Через 6 ч соотношение зеленый/красный вернулось к исходным уровням, но количество чисто красных митохондрий значительно увеличилось по сравнению с базальными уровнями. Через 12 ч последствия окислительной обработкиH2O2 были заметны и привели к существенному увеличению соотношения и количества красных пункт. Что касается динамики и подвижности(рисунок 3D),то через 3 ч после лечения все критерии были временно повышены. В долгосрочной перспективе (12 ч) митохондрии двигались медленнее и на более короткие расстояния.
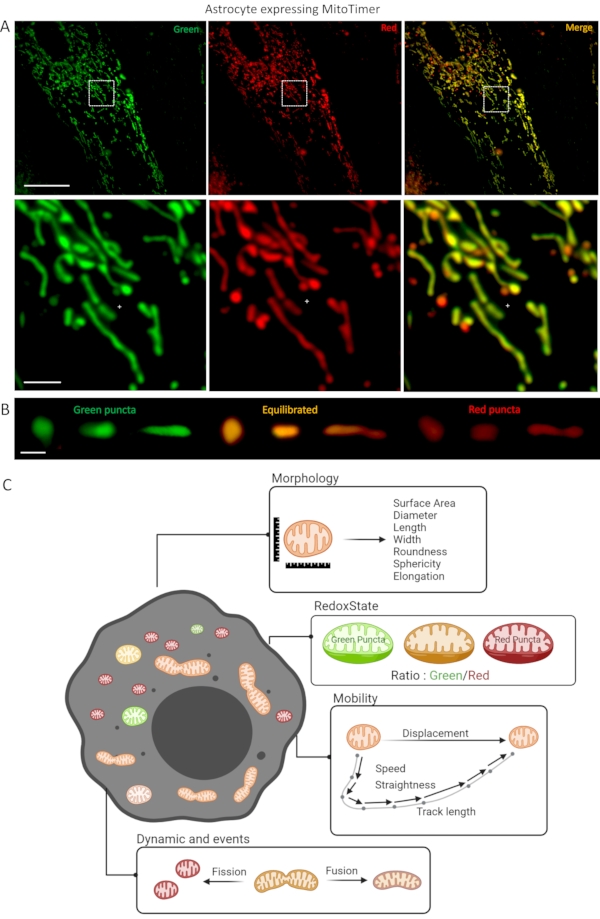
Рисунок 1:Культура астроцитов, экспрессирующая биосенсор LV-G1-MitoTimer. (A)Конфокальные фотографии астроцитов, экспрессирующих LV-G1-MitoTimer. (B)Выбор конфокальных фотографий восстановленных (зеленых) сбалансированных (оранжевый) и окисленных (красный) митохондрий с различными уровнями фрагментации. (C) Сводная диаграмма различных критериев, доступных для анализа в астроците, экспрессирующем LV-G1-MitoTimer. Шкала: (A) Верхняя панель: 50 мкм, нижняя панель: 10 мкм, (B) 1 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
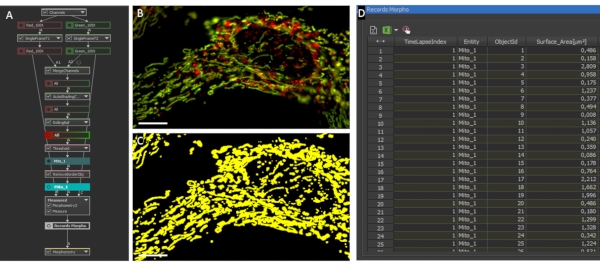
Рисунок 2:Митохондриальная морфология и анализ соотношений. (A) Обзор сценария GA3 для анализа индивидуальной морфологии и соотношения митохондрий. (B) Исходные фотографии астроцита, экспрессирующего LV-G1-MitoTimer, проанализированные с помощью скрипта GA3. (C) Пример бинарных масок, генерируемых для митохондриальной системы астроцитов. Шкала: 10 мкм (B-C). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
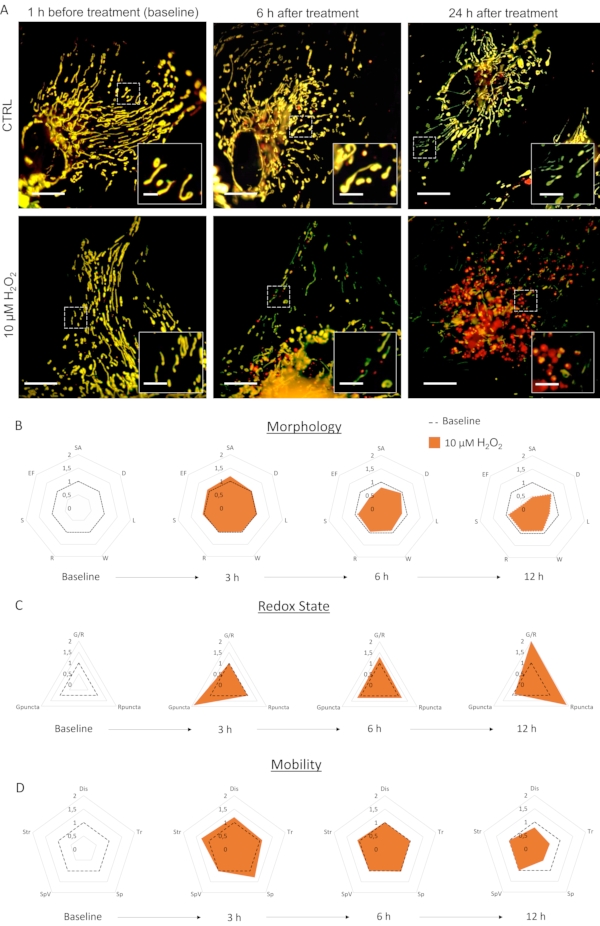
Рисунок 3:ВлияниеН2О2на митохондриальную систему астроцитов. (А)Фотографии астроцитов, экспрессирующих LV-G1-MitoTimer за 1 ч до и 6 ч, 24 ч после лечения PBS (CTRL) и 10 мкМH2O2. (B)Радиолокационные диаграммы морфологии митохондрий,(C)окислительно-восстановительного состояния и оборота и(D)критерии подвижности, оцениваемые на астроцитах в течение исходного уровня и через 3 ч, 6 ч и 12 ч послеобработки H2O2. SA: Площадь поверхности; D: Диаметр; L: Длина; W: Ширина; R: Округлость; S: Сферичность; EF: Коэффициент относительного удлинения (=Л/Вт); G/R: Индивидуальное соотношение красный/зеленый; Gpuncta: Процент зеленых митохондрий пункты; Rpuncta: Процент красных митохондрий пункты; Dis: Смещение; Tr: Длина трека; Sp и SpV: скорость и дисперсия скорости; Str: Прямолинейность. Шкала: 20 мкм (А) и 2,5 мкм (вставка). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок 4:Фотографии астроцитов, экспрессирующих LV-G1-MitoTimer и показывающих однородную и сбалансированную митохондриальную сеть во время исходного уровня. Шкала: 20 мкм Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Видео 1: Влияниелечения Н2О2 на митохондриальную систему культивируемых астроцитов. Астроцитарные митохондрии долечения Н2О2 (исходный уровень), а также 6 ч и 24 ч послелечения Н2О2 по сравнению с необработанной контрольной клеткой. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
| Критерии морфологии | Диапазон | Замечания | ||
| Площадь поверхности (SA) | 0,5–4 мкм2 | Эти критерии основаны на фрагментированно-удлиненных особенностях митохондрий. Они, как правило, развиваются в одном направлении. Фрагментированные митохондрии будут иметь уменьшенную площадь поверхности, диаметр, длину и коэффициент удлинения, в то время как округлость, сферичность и ширина могут быть неизменными или увеличенными. | ||
| Диаметр (D) | 0,5–1,5 мкм | |||
| Длина (L) | 0,5–5 мкм | |||
| Ширина (Ш) | 0,5–2 мкм | |||
| Округлость (R) | 0–1 | |||
| Сферичность (S) | 0–1 | |||
| Коэффициент относительного удлинения (EF = Л/Вт) | 1–10 | |||
Таблица 1: Сводка выбранных параметров митохондриальной морфологии.
| Критерии окислительно-восстановительного состояния | Диапазон | Замечания | ||
| Индивидуальное соотношение (G/R) | 0–10 | Соотношение указывает на результат окислительно-восстановительного состояния. Он информирует об общем состоянии и возрасте митохондрий в клетке. Важно учитывать, что это соотношение представляет собой баланс биогенеза и деградации митохондрий и деления/слияния окисленных митохондрий с восстановленными митохондриями. Поэтому оценка количества зеленых и красных пункт может мощно помочь интерпретировать результаты. Зеленые пунктные митохондрии определяются, когда интенсивность зеленого в 10 раз превышает интенсивность красного. Красные пунктные митохондрии определяются, когда интенсивность красного в 10 раз больше, чем у зеленого. Окислительно-восстановительное состояние астроцита является средним из всех соотношений митохондрий этой клетки. | ||
| Процент зеленых митохондрий пункты (Gpuncta) | 0%–100% | |||
| Процент митохондрий красной пункты (Rpuncta) | 0%–100% | |||
Таблица 2: Сводка выбранных параметров митохондриального окислительно-восстановительного состояния.
| Критерии мобильности | Диапазон | Замечания | ||
| Смещение (Dis) | 0–10 мкм | В совокупности эти особенности определяют общую динамику подвижности сети. Стационарные митохондрии показывают короткое смещение и длину пути с низкой скоростью. С другой стороны, колебательные частицы можно дифференцировать с разницей между длиной трека и смещением (что приводит к низкой прямолинейности) и повышенной скоростью по сравнению со статической. | ||
| Длина трека (Tr) | 0–10 мкм | |||
| Дисперсия скорости и скорости (Sp и SpV) | 0–1,5 мкм/с ± 0,2 мкм/с | |||
| Прямолинейность | 0–1 | |||
| (Str = смещение/длина пути) | ||||
Таблица 3: Сводка выбранных параметров митохондриальной подвижности.
Дополнительный кодирующий файл 1: Файл скрипта GA3 для анализа индивидуальной морфологии митохондрий. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Здесь предлагается новый метод продольного отслеживания динамики и оборота митохондриальной системы в культивируемом астроците. В отличие от покадрового подхода на фиксированной группе клеток или одной отдельной клетке за раз (чаще всего используется в литературе)24,25,исследователи могут следить за эволюцией митохондриальной системы в течение нескольких дней на одних и тех же отдельных клетках. В отличие от визуализации в реальном времени с одной лункой, где требуются высокие уровни воздействия света, а выбор многих отдельных клеток менее осуществим, предлагаемый метод использует способность этого микроскопа визуализировать несколько различных клеток в разных областях скважины и возвращаться к тем же клеткам в разные моменты времени для их повторного изображения. Благодаря нормализации исходного уровня, проводимого для каждого измеренного критерия для каждой интересующей клетки, он учитывает сложность митохондриальной системы и исследует влияние лечения на каждую клетку относительно ее собственного базового изображения. Способность микроскопа автономно выполнять этот тип визуализации на 16 скважинах одновременно (визуализация 5 клеток на лунку) позволяет правильно учитывать гетерогенность митохондриальной системы во время анализа без экспериментальной изменчивости, которая приходит с визуализацией различных состояний в разные дни.
Качество культур, уровни вирусных инфекций, экспрессирующих биосенсор LV-G1-MitoTimer, тип микроскопа и цели, а также выбор подходящих клеток являются критическими переменными, которые должны оставаться максимально последовательными в этом протоколе. Плотность клеток, тип вектора и вирусные титры могут быть адаптированы в соответствии с вопросом. Хотя предыдущая работа показывает, что экспрессия LV-G1-MitoTimer не имеет вредных последствий для митохондриальной функции и динамики21,22,26,27,важно убедиться, что концентрация не токсична для клеток (например, хорошо проверить общее количество клеток в контроле). В качестве единой фокальной плоскости астроциты должны быть: (1) как можно более плоскими, (2) изолированными от других меченых клеток (для упрощения анализа в случае смещения в чашке) и (3) обладающими высокими уровнями флуоресценции. Поскольку клетки в культуре могут сильно варьироваться по морфологии, митохондриальная система может быть очень гетерогенной. В этом контексте анализ ROI (а не всей ячейки) компенсирует некоторые проблемные области, такие как периноядерные области, и снижает изменчивость. Важно сделать базовую линию на относительно похожих клетках и взять образец как можно большего количества клеток. Следовательно, идеально подходят микроскопы для сбора и анализа высокого содержания. Во время этого продольного мониторинга также важно не подвергать клетки воздействию света, чтобы избежать отбеливания биосенсора.
Этот метод визуализации не лишен своих сложностей, и по всему протоколу включено несколько примечаний, которые учитывают устранение неполадок, выполненных во время предыдущих тестов с микроскопом. Например, выбор используемого пластинчатого покрытия зависит от предполагаемого анализа, но рекомендации по наиболее подходящим вариантам для первичных культур астроцитов были включены. Кроме того, получение изображения должно выполняться по крайней мере на 5 клетках на каждое состояние из-за межклеточной изменчивости. Более конкретно, некоторые клетки, выбранные при базовой визуализации, умрут, некоторые выйдут из рамки назначенной области получения изображения, а некоторые изменят свою морфологию, что делает митохондрии очень трудными для индивидуализации при анализе. Визуализация многих клеток с самого начала увеличивает вероятность достаточно большого размера выборки клеток для анализа в конце эксперимента. В дополнение к более сложным аспектам этого метода визуализации, существуют некоторые прямые ограничения в отношении того, кто может извлечь выгоду из этого типа визуализации и анализа. Чтобы в полной мере воспользоваться преимуществами автоматизации получения изображений, используемый микроскоп должен иметь систему автофокусировки, которая может обрабатывать скорость временных интервалов между изображениями (т. Е. Каждые 3 с в этом протоколе) и может последовательно фокусироваться на рассматриваемой ячейке перед каждым снимком. Кроме того, без программного обеспечения JOBS, которое автоматизирует весь процесс получения изображений, этот метод становится трудным и потенциально невозможным в зависимости от количества визуализируемых клеток, поскольку для этого потребуется ручной поиск и визуализация каждой клетки снова в соответствующий момент времени. Наконец, этот метод визуализации не застрахован от проблемы фотоотбеливания. По этой причине, как и при любом долгосрочном методе получения, важно выбирать флуоресцентные маркеры, которые менее восприимчивы к фотоотбеливанию, и адаптировать получение изображения, чтобы избежать этой проблемы, насколько это возможно.
Этот метод отличается от других, используемых в настоящее время решающим образом. В отличие от других покадровых исследований, этот метод не требует визуализации в одном и том же положении в скважине все время, а также не требует ручного движения пластины для изображения других областей. Это позволяет исследователям получать изображения многих клеток во многих условиях за один 24-часовой таймфрейм. Следовательно, способность проводить эту визуализацию и анализ на многих клетках в каждой лунке дает ту же популяционную информацию, которую можно было бы получить от широкого изучения большой группы клеток, дополнительно предоставляя конкретные меры из каждой изображенной клетки. Хотя некоторые особенности этого метода могут не применяться к другим методам получения изображений (описанным выше), преимущества перевешивают сложности с типом анализа, возможные после получения. Этот метод позволяет исследователям увидеть точные последствия различных методов лечения митохондриальной системы и, следовательно, культивируемых астроцитов.
Кроме того, этот метод легко настраивается на множество различных научных вопросов, касающихся митохондриального поведения и ролей в конкретных контекстах. Здесь изложенный протокол касается конкретно культивируемых астроцитов. Тем не менее, многие другие типы клеток могут быть использованы, и методы лечения, которые могут быть протестированы, ограничены только исследуемыми вопросами. Этот тип визуализации имеет потенциал для продвижения коллективных знаний и понимания митохондриального поведения, основных механизмов, которые приводят к митохондриальной дисфункции, и влияния многих патологий на врожденную динамику, присутствующую в различных типах клеток.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Это исследование было поддержано стипендией Synapsis Foundation, присужденной K.R. и Университетской больнице Лозанны (CHUV). Авторы благодарят Nikon за помощь, в частности J. Gannevat.
Материалы
| Name | Company | Catalog Number | Comments |
| µ-Slide 8 Well | IBIDI | 80807 | |
| 19 G needle | Plexus SANTE | PL001213 | |
| 21 G needle | Plexus SANTE | PL000142 | |
| 25 G needle | Plexus SANTE | PL000133 | |
| Bovin Serum Albumin | LIFE TECH | 15260037 | |
| Camera | HAMAMATSU | ORCA-flash4.0 V3 - C13440-20CU | |
| DMEM, high glucose, GlutaMAX(TM) | THERMOFISHER | 61965059 | |
| Glutamax Supplement | THERMOFISHER | 35050061 | |
| Horse Serum | SIGMA | 16050122 | |
| Lens | Nikon Instruments | CFI Plan Fluor 100x Oil | |
| Light Engines | LUMENCOR | SPECTRA X | |
| Linear-encoded motorized platine | Nikon Instruments | N/A | |
| Microscope | Nikon Instruments | ECLIPSE Ti2-E MICROSCOPE INVERSE | |
| Microscope Stage Incubator with 3-channel manual gas mixer and gas bubbler/ humidity module | OKOLAB | H201-NIKON-TI-S-ER | |
| PBS 1x liquid | THERMOFISHER | 20012068 | |
| Penicillin-Streptomycin | SIGMA | 15140122 | |
| Petri dishes 100 mm | SIGMA | P5731 | |
| Petri dishes 35 mm | SIGMA | CLS430165 | |
| Pregnant Rats | CHARLES RIVERS | 3 | |
| Software Nikon NIS-HC | Nikon Instruments | NIS-Elements HC | |
| Sofware Prism | GraphPad | V8.02 | |
| Stericup 500 mL | MERCK MILLIPORE | 10412701 |
Ссылки
- Ballabh, P., Braun, A., Nedergaard, M. The blood-brain barrier: An overview: Structure, regulation, and clinical implications. Neurobiology of Disease. 16 (1), 1-13 (2004).
- Allen, N. J., Eroglu, C. Cell biology of astrocyte-synapse interactions. Neuron. 96 (3), 697-708 (2017).
- Bernardinelli, Y., Muller, D., Nikonenko, I. Astrocyte-synapse structural plasticity. Neural Plasticity. 2014, 232105 (2014).
- Benarroch, E. E. Neuron-astrocyte interactions: Partnership for normal function and disease in the central nervous system. Mayo Clinic Proceedings. 80 (10), 1326-1338 (2005).
- MacVicar, B. A., Choi, H. B. Astrocytes provide metabolic support for neuronal synaptic function in response to extracellular K+. Neurochemical Research. 42 (9), 2588-2594 (2017).
- Song, H., Stevens, C. F., Gage, F. H. Astroglia induce neurogenesis from adult neural stem cells. Nature. 417 (6884), 39-44 (2002).
- Christopherson, K. S., et al. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120 (3), 421-433 (2005).
- Volterra, A., Liaudet, N., Savtchouk, I. Astrocyte Ca2+ signalling: An unexpected complexity. Nature Reviews Neuroscience. 15 (5), 327-335 (2014).
- Huntington, T. E., Srinivasan, R. Astrocytic mitochondria in adult mouse brain slices show spontaneous calcium influx events with unique properties. Cell Calcium. 96, 102383 (2021).
- Kofuji, P., Newman, E. A. Potassium buffering in the central nervous system. Neuroscience. 129 (4), 1045-1056 (2004).
- Ridet, J. L., Malhotra, S. K., Privat, A., Gage, F. H. Reactive astrocytes: Cellular and molecular cues to biological function. Trends in Neurosciences. 20 (12), 570-577 (1997).
- Liddelow, S. A., Barres, B. A. Reactive astrocytes: Production, function, and therapeutic potential. Immunity. 46 (6), 957-967 (2017).
- Young, A., Gill, R., Mailloux, R. J. Protein S-glutathionylation: The linchpin for the transmission of regulatory information on redox buffering capacity in mitochondria. Chemico-Biological Interactions. , 151-162 (2019).
- Lackner, L. L. Shaping the dynamic mitochondrial network. BMC Biology. 12, 35 (2014).
- Willems, P. H. G. M., Rossignol, R., Dieteren, C. E. J., Murphy, M. P., Koopman, W. J. H. Redox homeostasis and mitochondrial dynamics. Cell Metabolism. 22 (2), 207-218 (2015).
- de Michele, R., Carimi, F., Frommer, W. B. Mitochondrial biosensors. International Journal of Biochemistry and Cell Biology. 48, 39-44 (2014).
- Terskikh, A., et al. "Fluorescent timer": Protein that changes color with time. Science. 290 (5496), 1585-1588 (2000).
- Rizzuto, R., et al. A gene specifying subunit VIII of human cytochrome c oxidase is localized to chromosome 11 and is expressed in both muscle and non-muscle tissues. Journal of Biological Chemistry. 264 (18), 10595-10600 (1989).
- Rizzuto, R., Brini, M., Pizzo, P., Murgia, M., Pozzan, T. Chimeric green fluorescent protein as a tool for visualizing subcellular organelles in living cells. Current Biology. 5 (6), 635-642 (1995).
- Ferree, A. W., et al. MitoTimer probe reveals the impact of autophagy, fusion, and motility on subcellular distribution of young and old mitochondrial protein and on relative mitochondrial protein age. Autophagy. 9 (11), 1887-1896 (2013).
- Hernandez, G., et al. MitoTimer: A novel tool for monitoring mitochondrial turnover. Autophagy. 9 (11), 1852-1861 (2013).
- Richetin, K., et al. Tau accumulation in astrocytes of the dentate gyrus induces neuronal dysfunction and memory deficits in Alzheimer's disease. Nature Neuroscience. 23 (12), 1567-1579 (2020).
- Merienne, N., et al. Gene transfer engineering for astrocyte-specific silencing in the CNS. Gene Therapy. 22 (10), 830-839 (2015).
- Sison, M., et al. 3D Time-lapse imaging and quantification of mitochondrial dynamics. Scientific Reports. 7, 43275 (2017).
- Miyazono, Y., Hirashima, S., Ishihara, N., Kusukawa, J., Nakamura, K. I., Ohta, K. Uncoupled mitochondria quickly shorten along their long axis to form indented spheroids, instead of rings, in a fission-independent manner. Scientific Reports. 8 (1), 350 (2018).
- Trudeau, K. M., Gottlieb, R. A., Shirihai, O. S. Measurement of mitochondrial turnover and life cycle using MitoTimer. Methods in Enzymology. 547, 21-38 (2014).
- Stotland, A., Gottlieb, R. A. α-MHC MitoTimer mouse: In vivo mitochondrial turnover model reveals remarkable mitochondrial heterogeneity in the heart. Journal of Molecular and Cellular Cardiology. 90, 53-58 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены