Method Article
Live-imaging del sistema mitocondriale in astrociti in coltura
In questo articolo
Riepilogo
Questo articolo descrive il metodo per l'imaging time-lapse mitocondriale di colture di astrociti dotate di biosensore MitoTimer e la conseguente analisi multiparametrica della dinamica mitocondriale, della mobilità, della morfologia, della biogenesi, dello stato redox e del turnover.
Abstract
Mentre molta attenzione è stata data alle alterazioni mitocondriali a livello neuronale, prove recenti dimostrano che la dinamica e la funzione mitocondriale negli astrociti sono implicate nella cognizione. Questo articolo descrive il metodo per l'imaging time-lapse di colture di astrociti dotate di un biosensore mitocondriale: MitoTimer. MitoTimer è uno strumento potente e unico per valutare le dinamiche mitocondriali, la mobilità, la morfologia, la biogenesi e lo stato redox. Qui vengono presentate le diverse procedure per la coltura, le acquisizioni di immagini e la successiva analisi mitocondriale.
Introduzione
Gli astrociti sono attori critici nel mantenimento dell'omeostasi cerebrale. Sono forse più noti per avere ruoli strutturali significativi nel cervello, come parte della barrieraemato-encefalica 1 e sostenendo neuroni e sinapsi in tutto il cervello2. Il supporto astrocitario dei neuroni è sia strutturale3 che metabolico4,5, con astrociti che promuovono la neurogenesi e la sinaptogenesi fornendo anche metaboliti chiave come il lattato ai neuroni attivi4,6,7. Al di là del ruolo di supporto strutturale, gli astrociti sono cellule attive che prendono parte alla segnalazione e al buffering di Ca2+ (compresi gli afflussi spontanei mitocondriali di Ca2+) 8,9,K+ buffering10,e possono adattarsi e reagire ai bisogni del cervello in tempi di lesione11,12 . Essendo tali cellule dinamiche, gli astrociti hanno un robusto fabbisogno energetico, che richiede una rete mitocondriale efficiente. Questi mitocondri hanno anche un ruolo cruciale nel tamponare le specie reattive eccessive dell'ossigeno (ROS)13. Oltre ai loro ruoli individuali o locali di generazione di energia e buffering ROS, i mitocondri funzionano come una rete14. In questo senso, mantengono l'equilibrio tra mitocondri fissioning e fusioning, rappresentando mitocondri nuovi / ridotti e mitocondri più vecchi / ossidati, rispettivamente15. Lo stato redox complessivo di una cellula può essere misurato dallo stato redox della rete mitocondriale. In patologia, questa è un'informazione critica che può far luce su quali cellule potrebbero non funzionare in modo ottimale.
Negli ultimi anni, molti sensori sono stati sviluppati per studiare la dinamica e le funzioni dei mitocondri nelle cellule. Ad esempio, sensori che misurano lo scambio di energia (ATP), lo stato redox (NADH/NAD+,ROS) e la funzionalità enzimatica (cAMP, Ca2+,Zn 2+)sono attualmente utilizzati nello studio della funzione mitocondriale16. Tra questi, MitoTimer consente di seguire i cambiamenti nella morfologia mitocondriale (dimensioni, forma, superficie), mobilità (velocità, spostamento) e dinamica (eventi di fusione e fissione), nonché il tasso di turnover mitocondriale complessivo e lo stato redox. MitoTimer è una proteina fluorescente rossa mutante, drFP58317, con un segnale mitocondriale dalla subunità VIII della citocromo c ossidasiumana 18,19 per visualizzare i mitocondri appena sintetizzati in verde (488 nm) e i mitocondri ossidati in rosso (555 nm). L'utilizzo del rapporto di fluorescenza verde (488 nm) e rosso (555 nm) consente la valutazione simultanea dei singoli mitocondri, la loro analisi morfologica, gli eventi di fusione / fissione e la storia dello stato redox20,21. Questa proprietà unica può essere utilizzata per indagare molte questioni scientifiche riguardanti i ruoli fisiologici e patologici dei mitocondri ed è quindi molto promettente per svelare i meccanismi alla base della dinamica mitocondriale all'interno di molti diversi tipi di cellule.
Recentemente abbiamo sviluppato un nuovo vettore lentivirale (LV-G1-MitoTimer-MiR124T, di seguito chiamato LV-G1-MitoTimer) per studiare la dinamica e le funzioni dei mitocondri in particolare negli astrociti in vitro e in vivo22. LV-G1-MitoTimer utilizza una versione troncata del promotore della proteina acida fibrillare gliale (GFAP) gfaABC1D, con un potenziatore B3 (gfaABC1D(B3), di seguito chiamato G1) combinato con il sistema di detargeting neuronale miR124T precedentemente descritto23. Permette l'espressione esclusiva del biosensore mitocondriale negli astrociti in vitro e in vivo22. Qui sono presentati i diversi passaggi per eseguire una coltura di astrociti ippocampali di ratto e dotarli del biosensore LV-G1-MitoTimer, nonché i diversi passaggi di microscopia per seguire il comportamento dei mitocondri astrocitari per diverse ore / giorni consecutivi.
Protocollo
Il presente protocollo è stato eseguito con l'approvazione di un comitato etico (accordo VD3602, Losanna, Svizzera) e segue le linee guida europee per l'uso degli animali.
1. Coltura primaria di astrociti ippocampali di ratto
- Sacrificare cinque cuccioli di ratto (Wistar IGS Rat) per decapitazione al giorno postnatale 1-2.
- Rimuovere il cervello e tenerlo in una capsula di Petri contenente 5 ml di mezzo astrocitario fresco (DMEM con GlutaMAX integrato con 1% di penicillina / streptomicina e 10% di siero di cavallo fresco).
- Isolare l'ippocampo. Dissociarsi in 5 ml del mezzo astrocitico da tre passaggi attraverso un ago da 21 G e tre passaggi attraverso un ago da 25 G.
- Trasferire le cellule dissociate in un tubo di centrifuga da 15 ml e contare in un emocitometro.
- Piastra 20.000-25.000 celle/cm2 in piatti multiwell (9,4 mm x 10,7 mm x 9,3 mm) e conservali a 37 °C in un'atmosfera contenente il 5% di CO2 per il resto dell'esperimento.
- Sostituire completamente il mezzo a 3 giorni in vitro (DIV3).
- A DIV8, aggiungere 0,6 pg di antigene p24 per cellula di vettore lentivirale che codifica per il biosensore mitocondriale MitoTimer (LV-G1-MitoTimer22) diluito in soluzione salina tamponata con fosfato (PBS + 0,01% BSA).
- A DIV9, lavare con PBS sterile preriscaldato 1x (37 °C) e aggiungere un mezzo astrocitario fresco.
- A DIV11, eseguire 2 lavaggi con PBS sterile preriscaldato 1x (37 °C) e aggiungere un mezzo astrocitario fresco senza rosso fenolo.
NOTA: La scelta del rivestimento dipende dal test previsto. Come rivestimento standard per la coltura primaria di astrociti, si raccomanda di utilizzare 0,2 mg/mL di poli-D-lisina o 8,7 μg/cm2 di matrice di membrana basale (ad esempio, Matrigel). Per visualizzare il sistema mitocondriale degli astrociti, è essenziale lavorare su cellule appiattite e allungate. In questo contesto, la combinazione di matrice di membrana basale su vetrini iBIDI u è la più adatta. È anche fondamentale non lavorare con il rosso fenolo, che è tossico per la cellula sotto ripetuta esposizione alla luce.
2. Monitoraggio a lungo termine del sistema mitocondriale.
- Valutare il sistema mitocondriale astrocitico almeno 3-5 giorni dopo le infezioni lentivirali con LV-G1-MitoTimer (per consentire un livello sufficiente di fluorescenza nei mitocondri).
- Immagina le cellule con un microscopio invertito controllato dal software di acquisizione e analisi e un modulo per la completa automazione dell'acquisizione.
NOTA: fare riferimento alla Tabella dei materiali per i dettagli del software e del modulo utilizzato in questo studio. - Assicurarsi che il microscopio sia dotato di un incubatore a gabbia (vedi Tabella dei materiali)per mantenere la coltura di astrociti al 5% di CO2 e 37 °C durante l'esperimento.
- Cattura immagini a fluorescenza utilizzando l'eccitazione sequenziale a 490 nm (per canale verde) e 550 nm (per canale rosso) con rilevamento di segnali di fluorescenza verde (500-540 nm per canale verde) e rosso (550-600 nm per canale rosso).
- Selezionare 5 astrociti per pozzetto con una rete mitocondriale che esprima livelli sufficienti di LV-G1-MitoTimer utilizzando un ingrandimento di 40x. Fare attenzione a selezionare astrociti il più piatti e grandi possibile e non situati in gruppi di cellule (per lavorare su singole cellule).
- Salvare le coordinate delle 5 celle selezionate in un file xlm (map.xlm). Questo map.xlm consente all'utente di tornare alle stesse celle nel tempo.
- Acquisire sequenze di immagini (1 immagine/e per 60 s) utilizzando un ingrandimento di 150x (obiettivo di immersione in olio 100x, ingrandimento intermedio 1,5x) per ogni coordinata.
- Ripetere l'acquisizione dell'immagine (1 immagine/e per 60 s) per gli stessi astrociti 6 h, 12 h e 24 h dopo i trattamenti.
NOTA: Utilizzare un microscopio dotato di un sistema di messa a fuoco automatica veloce ed efficiente. In questo contesto, è stata utilizzata la soluzione hardware denominata Perfect Focus System (PFS). PFS utilizza sensori di linea LED e CCD a 870 nm nel vicino infrarosso per combattere le fluttuazioni assiali della messa a fuoco in tempo reale durante le indagini di imaging a lungo termine.
3. Analisi della morfologia mitocondriale individuale e del rapporto LV-G1-MitoTimer
NOTA: NIS General Analysis 3 (GA3) di Nikon è stato utilizzato per automatizzare l'analisi morfometrica in questo studio.
- Per ogni sequenza di immagini (baseline, 6 h, 12 h, 24 h), selezionare il primo fotogramma per i canali rosso e verde facendo clic su Elaborazione ND > Seleziona fotogramma.
- Unisci i canali rosso e verde selezionando Conversioni > Unisci canale.
- Per correggere l'ombreggiatura dell'immagine, selezionate Pre-elaborazione > Correzione automatica ombreggiatura.
- Applicare l'algoritmo Rolling Ball selezionando Preprocessing > Rolling Ball.
- Per generare maschere binarie per ogni mitocondrio, selezionare Segmentazione > Soglia.
- Rimuovere tutti gli oggetti troncati dal bordo selezionando Elaborazione binaria > Tocco bordo.
- Per misurare l'area della superficie, selezionate Misurazione > Area oggetto .
- Per misurare il diametro, selezionate Misura > Diametro Eq.
- Per misurare la lunghezza, selezionate Misura > Lunghezza.
- Per misurare la larghezza, selezionare Misura > Larghezza.
- Per misurare la rugosità, selezionate Misura > Rugosità.
- Per misurare la circolarità, selezionare Misurazione > Circolarità.
- Per misurare l'allungamento, selezionare Misurazione > Allungamento.
- Comporre un gruppo (fare clic con il pulsante destro del mouse) con la misurazione precedente e rinominarlo come MorphoData.
- Misurare l'intensità verde media selezionando Misurazione > Intensità media.
- Misurare l'intensità media in rosso selezionando Misurazione > Intensità media.
- Per misurare il rapporto rosso/verde, selezionate Misurazione rapporto >.
- Comporre un gruppo (fare clic con il pulsante destro del mouse) con la misurazione precedente e rinominarlo come RatioData.
- Esportare la tabella in un file CSV selezionando Reference > Table to CSV.
- Salvare lo script di analisi GA3 selezionando Salva con nome
NOTA: un elenco non esaustivo dei criteri utilizzati in questa procedura è riepilogato nella Figura 1, Tabella 1e Tabella 2. Il file di script GA3 di analisi è disponibile in versione supplementare (Supplemental Coding File 1 e Figure 2). Le soglie utilizzate sono state adattate per individualizzare il maggior numero possibile di mitocondri (escluse le grandi reti mitocondriali ove possibile). Ove possibile, le reti mitocondriali sono individualizzate manualmente o escluse dalle analisi. A causa della variabilità intercellulare, eseguire queste analisi su almeno 20-25 cellule per condizione (con un minimo di 50 mitocondri per cellula).
4. Analisi della motilità mitocondriale
NOTA: A causa dell'elevata complessità dei movimenti mitocondriali, è preferibile l'analisi manuale della motilità. Qui, il sistema NIS Element di Nikon è stato utilizzato per tracciare manualmente i mitocondri.
- Aprire il modulo di tracciamento in NIS, selezionare Visualizza analisi > > tracciamento.
- Fare clic su Definisci nuovo ROI.
- Con lo strumento di rilevamento automatico,selezionare 25-50 mitocondri nella prima immagine della sequenza di immagini.
- Fare clic su Traccia analisi ROI rilevati automaticamente.
- Se necessario, eliminare le tracce di ROI errate.
- Esportare la tabella in un file CSV.
NOTA: un elenco non esaustivo dei criteri utilizzati in questa procedura è riepilogato nella Figura 1 e nella Tabella 3. Un'analisi di tracciamento generalmente fornisce un percorso che raffigura i movimenti del centro di ogni oggetto tracciato. Le diverse opzioni di tracciamento devono essere impostate nell'opzione di tracciamento. Favorire la selezione di mitocondri isolati sufficientemente distanti tra loro per facilitare il tracciamento. Mantieni solo gli oggetti che potrebbero essere tracciati in modo coerente sull'intera sequenza. Procedi allo stesso modo per rimuovere i valori anomali dovuti al monitoraggio di cattiva qualità. Di conseguenza, l'insieme degli oggetti analizzati in questa sezione è diverso da quello analizzato per le analisi morfologiche statiche e sarà generalmente più piccolo.
5. Trasformazione dei dati, normalizzazione e analisi statistica
NOTA: Principalmente a causa dell'elevata eterogeneità dei mitocondri, i dati generati hanno spesso una distribuzione non normale.
- Eseguire manualmente la trasformazione delle misurazioni prima dell'elaborazione.
- Per ogni analisi e time frame, normalizzare manualmente i dati risultanti per mezzo di quelli ottenuti nell'acquisizione di riferimento.
- Inoltre, si consideri una seconda / doppia normalizzazione a una condizione di controllo, ad esempio, per valutare l'effetto di un trattamento.
- Quindi, eseguire analisi statistiche utilizzando un ANOVA bidirezionale abbinato. Qui è stato utilizzato GraphPad Prism V8.
Risultati
La coltura primaria di astrociti infetti da LV-G1-MitoTimer ha mostrato reti mitocondriali tipiche. Prima del trattamento, gli astrociti che esprimono LV-G1-MitoTimer hanno mostrato le dimensioni mitocondriali eterogenee e varie intensità di fluorescenza verde/rosso (Figura 3, Figura 4e Video 1). Il sistema mitocondriale delle colture di astrociti che esprimono LV-G1-MitoTimer è stato monitorato prima e dopo l'incubazione con H20 2 (10 μM). Le diverse caratteristiche mitocondriali sopra descritte sono state calcolate su 12 ore (ogni 3 ore) e normalizzate (cellula per cellula) al loro stato iniziale. A livello morfologico (Figura 3B), gli effetti di H2O2 iniziano ad essere visibili a circa 6 h. Infatti, i mitocondri erano frammentati (diminuzione della lunghezza, della superficie e del fattore di allungamento). Questa frammentazione è ancora più evidente 12 ore dopo il trattamento. Si noti che i diametri, le larghezze e la sfericità non sono stati ridotti. Per quanto riguarda lo stato redox e il turnover (Figura 3C), 3 ore dopo il trattamento con H2O2, la proporzione di mitocondri verdi è aumentata negli astrociti (conseguenza di un rapido aumento della biogenesi mitocondriale). A 6 ore, il rapporto verde/rosso è tornato ai livelli basali, ma il numero di mitocondri puramente rossi è aumentato significativamente rispetto ai livelli basali. Dopo 12 ore, le conseguenze del trattamento ossidativo di H2O2 erano visibili e hanno comportato un sostanziale aumento del rapporto e del numero di puncta rossi. Per quanto riguarda la dinamica e la mobilità (Figura 3D), 3 ore dopo il trattamento, tutti i criteri sono stati transitoriamente aumentati. A lungo termine (12 ore), i mitocondri si muovevano più lentamente e su distanze più brevi.
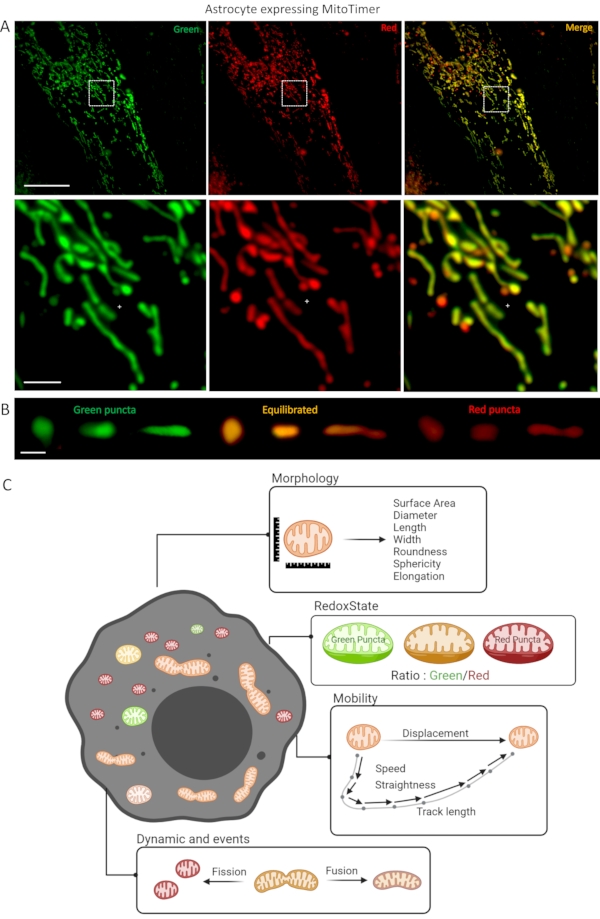
Figura 1: Coltura di astrociti che esprimono il biosensore LV-G1-MitoTimer. (A) Fotografie confocali di astrociti che esprimono LV-G1-MitoTimer. (B) Selezione di fotografie confocali di mitocondri ridotti (verdi) bilanciati (arancione) e ossidati (rosso) con diversi livelli di frammentazione. (C) Diagramma riassuntivo dei diversi criteri disponibili per l'analisi in un astrocita che esprime LV-G1-MitoTimer. Barra della scala: (A) Pannello superiore: 50 μm, pannello inferiore: 10 μm, (B) 1 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
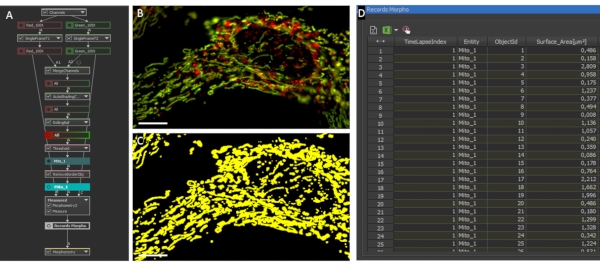
Figura 2: Morfologia mitocondriale e analisi del rapporto. (A) Panoramica dello script GA3 per l'analisi della morfologia e del rapporto mitocondriale individuale. (B) Fotografie iniziali di un astrocita che esprime LV-G1-MitoTimer analizzate con lo script GA3. (C) Esempio di maschere binarie generate per il sistema mitocondriale degli astrociti. Barra di scala: 10 μm (B-C). Fare clic qui per visualizzare una versione più grande di questa figura.
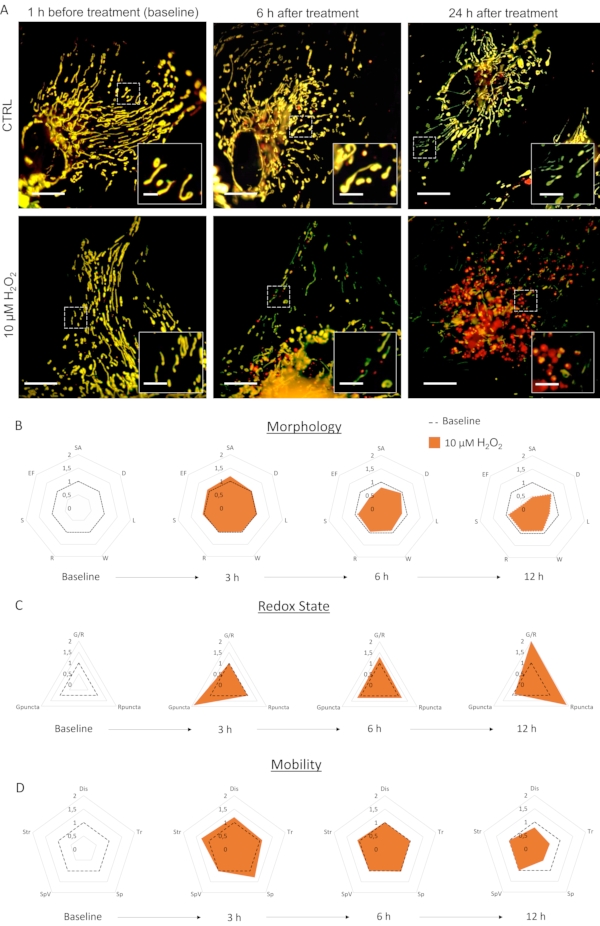
Figura 3: Gli effetti di H2O2 sul sistema mitocondriale degli astrociti. (A) Fotografie di astrociti che esprimono LV-G1-MitoTimer 1 h prima e 6 h, 24 h dopo il trattamento con PBS (CTRL) e 10 μM di H2O2. (B) Carte radar della morfologia mitocondriale, (C) stato redox e turnover, e (D) criteri di mobilità valutati sugli astrociti durante il basale e 3 ore, 6 ore e 12 ore dopo il trattamento con H2O2. SA: Superficie; D: Diametro; L: Lunghezza; W: Larghezza; R: Rotondità; S: Sfericità; EF: Fattore di allungamento (=L/W); G/R: Rapporto rosso/verde individuale; Gpuncta: Percentuale di mitocondri di puncta verde; Rpuncta: Percentuale di mitocondri di puncta rossa; Dis: Spostamento; Tr: Lunghezza della traccia; Sp e SpV: velocità e varianza di velocità; Str: Rettilineità. Barra di scala: 20 μm (A) e 2,5 μm (inserto). Fare clic qui per visualizzare una versione più grande di questa figura.
Figura 4: Fotografie di astrociti che esprimono LV-G1-MitoTimer e mostrano una rete mitocondriale omogenea ed equilibrata durante il basale. Barra della scala: 20 μm Fare clic qui per visualizzare una versione più grande di questa figura.
Video 1: Effetto deltrattamento H2O2 sul sistema mitocondriale degli astrociti in coltura. Mitocondri astrocitici prima del trattamento con H2O2 (basale), così come 6 ore e 24 ore dopo il trattamento con H2O2 rispetto alle cellule di controllo non trattate. Fare clic qui per scaricare questo file.
| Criteri morfologici | Gamma | Osservazioni | ||
| Superficie (SA) | 0,5–4 μm2 | Questi criteri informano sulle caratteristiche frammentate-allungate dei mitocondri. Generalmente si evolvono nella stessa direzione. I mitocondri frammentati avranno una diminuzione della superficie, del diametro, della lunghezza e del fattore di allungamento, mentre la rotondità, la sfericità e la larghezza possono essere invariate o aumentate. | ||
| Diametro (D) | 0,5–1,5 μm | |||
| Lunghezza (L) | 0,5–5 μm | |||
| Larghezza (W) | 0,5–2 μm | |||
| Rotondità (R) | 0–1 | |||
| Sfericità (S) | 0–1 | |||
| Fattore di allungamento (EF = L/W) | 1–10 | |||
Tabella 1: Riepilogo dei parametri selezionati per la morfologia mitocondriale.
| Criteri di stato redox | Gamma | Osservazioni | ||
| Rapporto individuale (G/R) | 0–10 | Il rapporto indica il risultato dello stato redox. Informa sullo stato generale e sull'età dei mitocondri nella cellula. È essenziale considerare che questo rapporto è l'equilibrio tra biogenesi e degradazione dei mitocondri e fissione/fusione di mitocondri ossidati con mitocondri ridotti. Pertanto la valutazione del numero di puncta verdi e rossi può aiutare potentemente a interpretare i risultati. I mitocondri del puncta verde sono determinati quando l'intensità del verde è 10 volte quella del rosso. I mitocondri del puncta rosso sono determinati quando l'intensità del rosso è 10 volte maggiore di quella del verde. Lo stato redox di un astrocita è la media di tutti i rapporti mitocondriali di quella cellula. | ||
| Percentuale di mitocondri di puncta verde (Gpuncta) | 0%–100% | |||
| Percentuale di mitocondri di puncta rosso (Rpuncta) | 0%–100% | |||
Tabella 2: Riepilogo dei parametri selezionati per lo stato redox mitocondriale.
| Criteri di mobilità | Gamma | Osservazioni | ||
| Spostamento (Dis) | 0–10 μm | Insieme, queste caratteristiche informano le dinamiche generali di motilità della rete. I mitocondri stazionari mostrano una breve cilindrata e una lunghezza del binario a bassa velocità. D'altra parte, le particelle oscillatorie possono essere differenziate con una differenza tra la lunghezza e la cilindrata della pista (con conseguente bassa rettilineità) e una maggiore velocità rispetto alla statica. | ||
| Lunghezza traccia (Tr) | 0–10 μm | |||
| Velocità e varianza di velocità (Sp e SpV) | 0–1,5 μm/s ± 0,2 μm/s | |||
| Dirittura | 0–1 | |||
| (Str = cilindrata/lunghezza del binario) | ||||
Tabella 3: Riepilogo dei parametri selezionati per la mobilità mitocondriale.
File di codifica supplementare 1: file di script GA3 per l'analisi della morfologia mitocondriale individuale. Fare clic qui per scaricare questo file.
Discussione
Qui, viene proposto un nuovo metodo per seguire longitudinalmente la dinamica e il turnover del sistema mitocondriale in un astrocita in coltura. A differenza di un approccio time-lapse su un gruppo fisso di cellule o una singola cellula alla volta (più spesso usato in letteratura)24,25, i ricercatori possono seguire l'evoluzione del sistema mitocondriale per diversi giorni sulle stesse singole cellule. A differenza dell'imaging dal vivo a singolo pozzo in cui sono richiesti alti livelli di esposizione alla luce e la selezione di molte singole cellule è meno fattibile, il metodo proposto sfrutta la capacità di questo microscopio di visualizzare diverse cellule in diverse aree di un pozzo e di tornare a quelle stesse cellule in vari punti temporali per ricrearle. Grazie alla normalizzazione a una linea di base effettuata per ogni criterio misurato su ciascuna cellula di interesse, tiene conto della complessità del sistema mitocondriale e indaga l'effetto del trattamento su ciascuna cellula rispetto alla propria immagine basale. La capacità del microscopio di eseguire autonomamente questo tipo di imaging su un massimo di 16 pozzetti alla volta (imaging di 5 cellule per pozzetto) consente di tenere adeguatamente conto dell'eterogeneità del sistema mitocondriale durante l'analisi senza la variabilità sperimentale che deriva dall'imaging di varie condizioni in giorni diversi.
La qualità delle colture, i livelli di infezioni virali che esprimono il biosensore LV-G1-MitoTimer, il tipo di microscopio e gli obiettivi, e la selezione di cellule adatte sono variabili critiche che devono rimanere il più coerenti possibile in questo protocollo. Le densità cellulari, il tipo di vettore e i titoli virali possono essere adattati in base alla domanda. Sebbene il lavoro precedente dimostri che l'espressione di LV-G1-MitoTimer non ha conseguenze deleterie per la funzione e la dinamica mitocondriale21,22,26,27,è essenziale verificare che la concentrazione non sia tossica per le cellule (ad esempio, controllando bene il numero totale di cellule in controllo). Poiché viene utilizzato un singolo piano focale, gli astrociti dovrebbero essere: (1) il più piatti possibile, (2) isolati da altre cellule marcate (per semplificare l'analisi in caso di spostamento nel piatto) e (3) in possesso di alti livelli di fluorescenza. Poiché le cellule in coltura possono essere altamente variabili nella morfologia, il sistema mitocondriale può essere altamente eterogeneo. In questo contesto, l'analisi dei ROI (e non dell'intera cellula) compensa alcune regioni problematiche, come le regioni perinucleari, e diminuisce la variabilità. È essenziale fare la linea di base su cellule relativamente simili e campionare il maggior numero possibile di cellule. Di conseguenza, i microscopi di acquisizione e analisi ad alto contenuto sono ideali. Durante questo monitoraggio longitudinale, è anche importante non sovraesporre le cellule alla luce per evitare lo sbiancamento del biosensore.
Questo metodo di imaging non è privo di complessità e, in tutto il protocollo, sono incluse diverse note, che tengono conto della risoluzione dei problemi eseguita durante i test precedenti con il microscopio. Ad esempio, la scelta del rivestimento della piastra utilizzato dipende dal test previsto, ma sono state incluse raccomandazioni per le scelte più adatte per le colture primarie di astrociti. Inoltre, l'acquisizione dell'immagine deve essere eseguita su almeno 5 cellule per condizione a causa della variabilità intercellulare. Più specificamente, alcune cellule selezionate al basale dell'imaging moriranno, alcune si sposteranno fuori dal frame dell'area di acquisizione dell'immagine assegnata e alcune cambieranno la loro morfologia, rendendo i mitocondri molto difficili da individuare in analisi. L'imaging di molte cellule fin dall'inizio aumenta la probabilità di un campione abbastanza grande di cellule da analizzare alla fine dell'esperimento. Oltre agli aspetti più complessi di questa tecnica di imaging, ci sono alcune limitazioni assolute per quanto riguarda chi può beneficiare di questo tipo di imaging e analisi. Per sfruttare appieno l'automatizzazione dell'acquisizione delle immagini, il microscopio utilizzato deve avere un sistema di messa a fuoco automatica in grado di gestire la velocità degli intervalli di tempo tra le immagini (cioè ogni 3 s in questo protocollo) e in grado di concentrarsi costantemente sulla cella in questione prima che ogni immagine venga scattata. Inoltre, senza il software JOBS, che automatizza l'intero processo di acquisizione delle immagini, questo metodo diventa arduo e potenzialmente impossibile a seconda del numero di celle da fotografare in quanto richiederebbe la ricerca manuale e l'imaging di ogni cella nel momento appropriato. Infine, questo metodo di imaging non è immune al problema del fotosbiancamento. Per questo motivo, come con qualsiasi metodo di acquisizione a lungo termine, è importante scegliere marcatori fluorescenti meno suscettibili al fotosbiancamento e personalizzare l'acquisizione delle immagini per evitare il più possibile questo problema.
Questa tecnica differisce dalle altre attualmente utilizzate in modo cruciale. A differenza di altri studi time-lapse, questa tecnica non richiede l'imaging sulla stessa posizione nel pozzo per tutto il tempo, né richiede il movimento manuale della piastra per visualizzare altre aree. Ciò consente ai ricercatori di visualizzare molte cellule in molte condizioni in un lasso di tempo di 24 ore. Di conseguenza, la capacità di eseguire questa imaging e analisi su molte cellule in ciascun pozzo fornisce le stesse informazioni sulla popolazione che si otterrebbero studiando ampiamente un ampio gruppo di cellule, fornendo inoltre misure specifiche da ciascuna cellula fotografata. Mentre alcune specificità di questo metodo potrebbero non applicarsi ad altri metodi di acquisizione delle immagini (descritti sopra), i benefici superano le complicazioni con il tipo di analisi possibile dopo l'acquisizione. Questa tecnica consente ai ricercatori di vedere le esatte ramificazioni di vari trattamenti sul sistema mitocondriale e, di conseguenza, sugli astrociti in coltura.
Inoltre, questo metodo è altamente personalizzabile per molte diverse domande scientifiche riguardanti il comportamento mitocondriale e i ruoli in contesti specifici. Qui il protocollo delineato si occupa specificamente degli astrociti in coltura. Tuttavia, molti altri tipi di cellule possono essere utilizzati e i trattamenti che possono essere testati sono limitati solo dalle domande oggetto di indagine. Questo tipo di imaging ha il potenziale per far progredire la conoscenza collettiva e la comprensione del comportamento mitocondriale, dei meccanismi sottostanti che portano alla disfunzione mitocondriale e degli effetti di molte patologie sulle dinamiche innate presenti in diversi tipi di cellule.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Questo studio è stato supportato da una borsa di studio della Fondazione Synapsis assegnata a K.R. e all'Ospedale universitario di Losanna (CHUV). Gli autori ringraziano Nikon per il loro aiuto, in particolare J. Gannevat.
Materiali
| Name | Company | Catalog Number | Comments |
| µ-Slide 8 Well | IBIDI | 80807 | |
| 19 G needle | Plexus SANTE | PL001213 | |
| 21 G needle | Plexus SANTE | PL000142 | |
| 25 G needle | Plexus SANTE | PL000133 | |
| Bovin Serum Albumin | LIFE TECH | 15260037 | |
| Camera | HAMAMATSU | ORCA-flash4.0 V3 - C13440-20CU | |
| DMEM, high glucose, GlutaMAX(TM) | THERMOFISHER | 61965059 | |
| Glutamax Supplement | THERMOFISHER | 35050061 | |
| Horse Serum | SIGMA | 16050122 | |
| Lens | Nikon Instruments | CFI Plan Fluor 100x Oil | |
| Light Engines | LUMENCOR | SPECTRA X | |
| Linear-encoded motorized platine | Nikon Instruments | N/A | |
| Microscope | Nikon Instruments | ECLIPSE Ti2-E MICROSCOPE INVERSE | |
| Microscope Stage Incubator with 3-channel manual gas mixer and gas bubbler/ humidity module | OKOLAB | H201-NIKON-TI-S-ER | |
| PBS 1x liquid | THERMOFISHER | 20012068 | |
| Penicillin-Streptomycin | SIGMA | 15140122 | |
| Petri dishes 100 mm | SIGMA | P5731 | |
| Petri dishes 35 mm | SIGMA | CLS430165 | |
| Pregnant Rats | CHARLES RIVERS | 3 | |
| Software Nikon NIS-HC | Nikon Instruments | NIS-Elements HC | |
| Sofware Prism | GraphPad | V8.02 | |
| Stericup 500 mL | MERCK MILLIPORE | 10412701 |
Riferimenti
- Ballabh, P., Braun, A., Nedergaard, M. The blood-brain barrier: An overview: Structure, regulation, and clinical implications. Neurobiology of Disease. 16 (1), 1-13 (2004).
- Allen, N. J., Eroglu, C. Cell biology of astrocyte-synapse interactions. Neuron. 96 (3), 697-708 (2017).
- Bernardinelli, Y., Muller, D., Nikonenko, I. Astrocyte-synapse structural plasticity. Neural Plasticity. 2014, 232105 (2014).
- Benarroch, E. E. Neuron-astrocyte interactions: Partnership for normal function and disease in the central nervous system. Mayo Clinic Proceedings. 80 (10), 1326-1338 (2005).
- MacVicar, B. A., Choi, H. B. Astrocytes provide metabolic support for neuronal synaptic function in response to extracellular K+. Neurochemical Research. 42 (9), 2588-2594 (2017).
- Song, H., Stevens, C. F., Gage, F. H. Astroglia induce neurogenesis from adult neural stem cells. Nature. 417 (6884), 39-44 (2002).
- Christopherson, K. S., et al. Thrombospondins are astrocyte-secreted proteins that promote CNS synaptogenesis. Cell. 120 (3), 421-433 (2005).
- Volterra, A., Liaudet, N., Savtchouk, I. Astrocyte Ca2+ signalling: An unexpected complexity. Nature Reviews Neuroscience. 15 (5), 327-335 (2014).
- Huntington, T. E., Srinivasan, R. Astrocytic mitochondria in adult mouse brain slices show spontaneous calcium influx events with unique properties. Cell Calcium. 96, 102383 (2021).
- Kofuji, P., Newman, E. A. Potassium buffering in the central nervous system. Neuroscience. 129 (4), 1045-1056 (2004).
- Ridet, J. L., Malhotra, S. K., Privat, A., Gage, F. H. Reactive astrocytes: Cellular and molecular cues to biological function. Trends in Neurosciences. 20 (12), 570-577 (1997).
- Liddelow, S. A., Barres, B. A. Reactive astrocytes: Production, function, and therapeutic potential. Immunity. 46 (6), 957-967 (2017).
- Young, A., Gill, R., Mailloux, R. J. Protein S-glutathionylation: The linchpin for the transmission of regulatory information on redox buffering capacity in mitochondria. Chemico-Biological Interactions. , 151-162 (2019).
- Lackner, L. L. Shaping the dynamic mitochondrial network. BMC Biology. 12, 35 (2014).
- Willems, P. H. G. M., Rossignol, R., Dieteren, C. E. J., Murphy, M. P., Koopman, W. J. H. Redox homeostasis and mitochondrial dynamics. Cell Metabolism. 22 (2), 207-218 (2015).
- de Michele, R., Carimi, F., Frommer, W. B. Mitochondrial biosensors. International Journal of Biochemistry and Cell Biology. 48, 39-44 (2014).
- Terskikh, A., et al. "Fluorescent timer": Protein that changes color with time. Science. 290 (5496), 1585-1588 (2000).
- Rizzuto, R., et al. A gene specifying subunit VIII of human cytochrome c oxidase is localized to chromosome 11 and is expressed in both muscle and non-muscle tissues. Journal of Biological Chemistry. 264 (18), 10595-10600 (1989).
- Rizzuto, R., Brini, M., Pizzo, P., Murgia, M., Pozzan, T. Chimeric green fluorescent protein as a tool for visualizing subcellular organelles in living cells. Current Biology. 5 (6), 635-642 (1995).
- Ferree, A. W., et al. MitoTimer probe reveals the impact of autophagy, fusion, and motility on subcellular distribution of young and old mitochondrial protein and on relative mitochondrial protein age. Autophagy. 9 (11), 1887-1896 (2013).
- Hernandez, G., et al. MitoTimer: A novel tool for monitoring mitochondrial turnover. Autophagy. 9 (11), 1852-1861 (2013).
- Richetin, K., et al. Tau accumulation in astrocytes of the dentate gyrus induces neuronal dysfunction and memory deficits in Alzheimer's disease. Nature Neuroscience. 23 (12), 1567-1579 (2020).
- Merienne, N., et al. Gene transfer engineering for astrocyte-specific silencing in the CNS. Gene Therapy. 22 (10), 830-839 (2015).
- Sison, M., et al. 3D Time-lapse imaging and quantification of mitochondrial dynamics. Scientific Reports. 7, 43275 (2017).
- Miyazono, Y., Hirashima, S., Ishihara, N., Kusukawa, J., Nakamura, K. I., Ohta, K. Uncoupled mitochondria quickly shorten along their long axis to form indented spheroids, instead of rings, in a fission-independent manner. Scientific Reports. 8 (1), 350 (2018).
- Trudeau, K. M., Gottlieb, R. A., Shirihai, O. S. Measurement of mitochondrial turnover and life cycle using MitoTimer. Methods in Enzymology. 547, 21-38 (2014).
- Stotland, A., Gottlieb, R. A. α-MHC MitoTimer mouse: In vivo mitochondrial turnover model reveals remarkable mitochondrial heterogeneity in the heart. Journal of Molecular and Cellular Cardiology. 90, 53-58 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon