Method Article
Nano-Flow Sitometri ile Tek Hücre Dışı Vezikül Transmembran Protein Karakterizasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
En yeni nesil EV karakterizasyon araçları, aynı anda birden fazla parametre arasında tek EV analizi yapabilir. Nano-akış sitometrisi, etiketleme yapmadan 45 nm'den büyük tüm biyolojik parçacıkları ölçer ve çeşitli floresan etiketleme teknikleriyle alt popülasyonların spesifik özelliklerini tanımlar.
Özet
Tek parçacık karakterizasyonu, hücre dışı veziküller üzerine yapılan araştırmalar için giderek daha alakalı hale gelmiş, toplu analiz tekniklerinden ve birinci nesil parçacık analizinden nano-akış sitometrisi (nFCM) gibi kapsamlı çok parametreli ölçümlere ilerlemiştir. nFCM, nano-parçacık analizi için özel olarak tasarlanmış enstrümantasyonu kullanan ve boyama teknikleri kullanılarak ve kullanılmadan dakikada binlerce EV'nin karakterize edilmesini sağlayan bir akış sitometrisi şeklidir. Yüksek çözünürlüklü yan saçılma (SS) algılama, 45 nm'den büyük tüm biyolojik parçacıklar için boyut ve konsantrasyonun belirlenmesini sağlarken, eşzamanlı floresan (FL) algılama, etiketli belirteçlerin ve ilgili hedeflerin varlığını tanımlar. Etiketlenmiş alt popülasyonlar daha sonra parçacıkların / mL'nin nicel birimlerinde veya yan saçılma ile tanımlanan toplam parçacıkların bir yüzdesi olarak tanımlanabilir.
Burada, şartlandırılmış hücre kültürü ortamından (CCM) türetilen EV'ler, bir membranlı parçacıkları tanımlamak için hem bir lipit boyası hem de CD9, CD63 ve CD81 için spesifik antikorlar ortak EV belirteçleri olarak etiketlenir. Karşılaştırma malzemesi, bir konsantrasyon standardı ve silika nanosferlerin boyut standardı ile etiketli numune malzemesinin ölçümleri 1 dakikalık bir analizle analiz edilir. Yazılım daha sonra, etiketlerin her biri için pozitif olan parçacıkları belirlemeden önce, etiketlemeden bağımsız olarak tüm parçacıkların konsantrasyonunu ve boyut dağılım profilini ölçmek için kullanılır.
Eşzamanlı SS ve FL algılama, EV numunelerini kapsamlı ve nicel bir şekilde tanımlayan, hem harici hem de dahili birçok farklı EV kaynağı ve etiketleme hedefi ile esnek bir şekilde kullanılabilir.
Giriş
EV'ler nedir?
Hücre dışı veziküller (EV'ler), birçok normal hücresel ve doku aktivitesine entegre olan bir dizi hücre kaynaklı membranöz parçacık için ortak terimdir. Çok çeşitli bilimsel alanlar üzerindeki etkileri ve potansiyel klinik alaka düzeyleri, EV araştırmalarında ve endüstriyel ilgide bir büyümeye neden olmuştur1. Küçük EV (sEV) araştırması öncelikle eksozomlara, olgunlaşmadan önce erken endozomlarda oluşmaya başlayan ve çok veziküler cisimlerin (MVB) plazma zarına füzyonu yoluyla salınan 40-100 nm parçacıkların yanı sıra doğrudan plazma zarından tomurcuklanan mikro-parçacıklara odaklanmaktadır 80-1.000 nm parçacıklaroluşturur 2. Üçüncü bir EV popülasyonu apoptotik cisimlerdir, hücre ölümü sırasında oluşan 50-1.500 nm parçacıklar, diğer EV'lere göreceli oranlarının büyük ölçüde değişken olabileceği anlamına gelir3.
EV özellikleri, menşe hücrelerinde / dokularında meydana gelen değişiklikleri temsil edebileceğinden, teşhiste kullanılma potansiyeli vardır. Çeşitli 'omik' analizler, kan plazması/serumu, idrar, tükürük ve beyin omurilik sıvısı (BOS)4,5 gibi EV kaynaklarını kullanarak hastaların non-invaziv olarak değerlendirilmesine olanak sağlayabilecek hücre orijini ve hastalık durumu belirteçlerini tanımlamaya başlamıştır. EV ile ilgili bu yeniliklerin arkasındaki itici güç, önceki sınırlamaların üstesinden gelen yeni karakterizasyon teknikleridir.
Tek EV karakterizasyonuna duyulan ihtiyaç ve zorluklar
Tek EV karakterizasyonu, EV izolatlarının hem doğrulanması hem de tanımlanması için giderek daha önemli hale gelmekte ve ayrıca EV tabanlı tedavilerin ilerlemesi ve teşhisi için bu nanopartiküllerin temel özelliklerinin aydınlatılması6. EV kaynağına ve kullanım amacına bağlı olarak, genellikle EV'nin EV olmayan parçacıklara oranı veya EV'nin serbest proteine oranı olarak tanımlanan saflık analizi, çoklu analizlerden önemli miktarda veri gerektirebilir7.
EV yayınlarındaki parçacık sayımı ve boyutlandırma ölçümleri daha önce büyük ölçüde Nanopartikül izleme (NTA), dirençli darbe algılama (RPS) ve elektron mikroskobu (EM) 2'ye dayanıyordu. Standart NTA ve RPS, EV'leri EV olmayan parçacıklardan ayırt etme yeteneğinden yoksundur ve yavaş verim8 ve NTA 9,10,11 ile görülen uygun olmayan alt algılama sınırı gibi kendi uyarılarına sahiptir.
CD9, CD63 ve CD81 tetraspaninleri tarihsel olarak EV izolasyonlarında / preparatlarında EV'lerin varlığı için önemli tanımlayıcılar olmuştur. Genellikle, batı lekeleme (WB) ve nokta lekeleme teknikleri, bu proteinlerin hücre lizat12'ye kıyasla EV izolatlarında zenginleşmesini göstermek için kullanılır. Bununla birlikte, bu yöntemlere kantitatasyon eksikliği ve bu EV belirteçlerinin heterojenliği, hem EV alt popülasyonlarında hem de hücre, doku veya hastaya bağlı varyasyonlarda gösterilmesi, fiziksel ve fenotipik karakterizasyonu birleştiren gelişmiş analitik teknikleri teşvik etmektedir13.
Kapsamlı bir EV analiz tekniği olarak nano akış sitometrisi
Gerçek EV konsantrasyonlarının belirlenmesi, bozulmamış parçacıkların ve özellikle karmaşık parçacık izolatlarında, tüm EV'leri EV olmayan parçacıklardan ayırt ederken onları ayırt edebilen çözünürlüğe sahip evrensel bir işaretleyicinin tanımlanmasını gerektirir14.
Nano-akış sitometrisi (nFCM), 45-1.000 nm arasındaki parçacıkların etiketlenmemiş analizine izin verirken, aynı zamanda parçacık alt popülasyonlarını tanımlamak için floresan etiketleme ve algılama kullanan bir tekniktir. Geleneksel akış sitometrisinden önemli bir fark, nanopartikül analizine adanmış ekipmanların kullanılmasıdır ve en yüksek çözünürlük15'e izin verir. Küçük parçacık analizi için yeniden tasarlanan geleneksel akış enstrümantasyonunu kullanan EV analizi gelişiyor, ancak yine de 100 nm EV'ler16,17'< tespit etmek ve analiz etmek için çözünürlüğe ulaşmak için mücadele ediyor. Boncuk bazlı akış sitometrisi, EV analizi için sıklıkla kullanılan başka bir uyarlamadır, ancak bu, tek parçacık algılama olasılığını ortadan kaldırır ve yakalamaya dayalı önyargılargetirir 18.
EV analizi için yan saçılma (SS) kanalında ~45 nm algılama alt sınırından yararlanan nFCM, SS tetiklemeyi kullanır. Bu, 'önce parçacık' analizi olarak düşünülebilir, çünkü olayların floresan yoğunluğunun analizinden önce belirlenmiş bir eşiği aşan bir SS sinyali sağlaması gerektiği anlamına gelir. Bu, bozulmuş membran ve florofor agregasyonları gibi yanlış pozitifleri ortadan kaldırır ve analizi bozulmamış EV'ler15'e odaklar. SS ölçümleri ayrıca dört modlu silika nanosfer standardı19'a kıyasla bireysel parçacıkları boyutlandırmak için de kullanılır. Floresan ölçümleri, EV alt popülasyonlarını tanımlamak için partikül konsantrasyonunu, boyutlarını ve işaretleyicilerin veya diğer ilgi çekici hedeflerin varlığını tanımlamak için her parçacık için üç eşzamanlı ölçüm yapılmasına izin veren iki başka dedektörde daha alınır20.
Aşağıdaki deneyde, SS ve floresan (FL) ölçümleri, >45 nm parçacıklarını ölçmek, membran pozitif EV'lerin alt kümesini göstermek ve EV alt popülasyonlarında CD9, CD63, CD81 sunumunu tanımlamak için kullanılmıştır. Hem bu alt popülasyonların konsantrasyonu hem de SS tarafından ölçülen toplam parçacıkların bir parçası olarak oranları, boyut profilleri gibi tanımlanmıştır.
Protokol
1. nFCM cihazının kurulumu ve nFCM standartlarının ölçümleri
NOT: nFCM cihazının doğru hizalanmasını doğrulamak ve cihazlar arasında güçlü bir karşılaştırma sağlamak için numuneler için veri toplamaya başlamadan önce üç ölçüm yapılır. Bunlar konsantrasyon standardı / kalite kontrolü (QC), boyut standardı ve bir boşluktur.
- QC boncuklarını 1:100 damıtılmış suda uygun bir 0,6 μL tüpte seyreltin ve yükleme bölmesine yerleştirin.
- Numune Akışı açılır menüsünden, önceki numuneyi /temizleme solüsyonunu tamamen değiştirmek üzere QC numunesini sisteme 45 sn boyunca tanıtmak için Boosting'i seçin.
- Artırırken, lazer gücünü QC boncukları için "250 nm FL QC standardı" olarak önceden ayarlanmış şablona ayarlayın, örneğin, mavi lazer için 10/40 mW, kırmızı lazer için 20/50 mW,% 0,2 SS bozunumu ile.
- Sistem basıncını azaltmak için Aynı aşağı menüden örnekleme basıncı'nı seçin.
- Sabit bir basıncı korumak için otomatik örnekleme basıncını 1,0 kPa'ya ayarlayın.
- Edinme denetimlerinden Kayıt Süresi'ni seçerek 1 dakikalık analizi başlatın. Veriler, SS yoğunluğu ve seçilen FL yoğunluğu için bir günlük ölçeği gösteren nokta grafiği üzerinde çizilecektir.
- Dosyayı kaydetmeden önce dosya adını ve örnek seyreltmeyi ekleyin.
- Tüpü yükleme bölmesinden çıkarmak için boşalt'ı seçin. 150 μL temizleme çözeltisi ile değiştirin ve Boşalt'ı seçerek temizleme solüsyonunu çıkarmadan önce Güçlendirme'yi seçerek >30 sn boyunca temizleyin.
- 150 μL su içeren bir tüp kullanarak kılcal uçtaki fazla temizleme solüsyonunu çıkarın.
- Standart boncuk boyutunu 1:100 suda seyreltin ve numuneyi 45 sn artırmadan önce yükleme bölmesine 100 μL yükleyin.
- Lazer gücünü önceden ayarlanmış "S16 exo 68-155 nm" şablonuna ayarlayın. Bu ayar hem boyut standardı hem de EV'leri içeren örnekler < 200 nm içindir. Örneğin, mavi lazer için 15/40 mW, kırmızı lazer için 20/50 mW, %0,2 SS bozunumu ile.
- Örnekleme'yi seçin ve numuneyi daha önce olduğu gibi 1 dakika boyunca kaydetmeye devam edin.
- Üçüncü ölçümü bir su veya PBS numunesi ile gerçekleştirerek kaçışınızın boş bir ölçümünü oluşturun ve yazılım tarafından çıkarılacak yanlış pozitifleri belirleyin. Standart ölçümlerin girilmesi aşağıdaki bölümde açıklanmıştır.
2. Etiketlenmemiş bir numunenin partikül konsantrasyonunu belirleme ve PDF raporu oluşturma
- PBS'deki etiketsiz EV numunesini, nFCM analizi için uygun bir partikül konsantrasyon aralığına, 1 x 10 8- 5 x 108 partikül/mL olacak şekilde seyreltin. Seyreltilmiş numunenin 10-100 μL'sini yükleme bölmesine yükleyin.
- Partikül konsantrasyonu bilinmediğinde, EV numunesinin 1:100 seyreltilmesiyle başlayın. Numune konsantrasyonu, güçlendirme sırasında CCD kameradaki lazer noktasının boyutuna veya örnekleme sırasında Olay Patlaması İzlemesi'nin gözlemlenmesine göre hızlı bir şekilde yaklaştırılabilir.
- Örnekleme'yi seçmeden önce yüklenen numuneyi 45 sn artırın ve daha önce açıklandığı gibi kaydederek 1 dakika boyunca kaydedin.
- Bu verileri analiz etmeye başlamak için Edinme sekmesinden Analiz sekmesine geçin. Kaydedilen nfa dosyalarını açın.
- Doğru numune ölçümüne izin vermek için, numune ölçümünden önce alınan iki standart ölçümü kullanarak numune karşılaştırması ve boşluk için değerler ayarlayın.
- SS'den çapa dönüştürme için önce boyut standart dosyasını seçip eşik ayarlama aracını (otomatik eşik olarak da bilinir) kullanarak boyut standardı eğrisini oluşturun. Olay patlaması izlemesinde görülebilen eşik, bir olayın önemli olarak kabul edilmesi için gereken minimum sinyal yoğunluğunu tanımlar.
- Eşik ayarlandığında, x nokta grafiğini kontrol edin ve y parametreleri x ekseninde SS-H veya SS-A ve y ekseninde FITC-A şeklindedir.
- Standart eğri oluşturma aracını açın ve boyutlandırma şablonu olarak S16 exo 68-155 nm'yi seçin. Tepe SS yoğunluklarını 68, 91, 113 veya 155 nm çapında parçacık olarak tanımlamak için Zirveleri Bul'a tıklayın.
- Pencereyi kapatmadan önce SS çap eğrisinin 1'e yakın bir r değeriyle oluşturulup oluşturulmadığını kontrol edin.
- Kaydedilen dosyayı seçip STD Say'a tıklayarak konsantrasyon standardını ayarlayın. Standardın parçacık konsantrasyonunu girin.
- Standart bilgileri ayarladıktan sonra, EV örnek dosyasını seçin ve eşiği ayarlayın.
- Boş dosyayı seçin ve örnek sayısından kaldırılacak yanlış pozitiflerin sayısını belirlemek için Boş Ayarla'ya tıklayın. Bu, numunenizle aynı eşikle yapılmalıdır. EV örnek dosyasına dönün.
- PDF oluşturma aracını açın ve Boyutlandırma ve Konsantrasyon'u seçin. Numunenin seyreltmelerini girin. Numunenin konsantrasyonu ve parçacıkların boyut dağılımı gösterilir.
3. Örnek etiketleme
NOT: Süspansiyondaki partiküllerin kapsamlı bir analizi için aynı anda iki boyama stratejisi kullanılabilir. Etiketleme protokolleri genellikle yeni antikorlar veya örnek kaynaklar için optimizasyon gerektirir.
- EV numunesinin bir kısmını PBS'de 1.25 x 1010 partikül / mL konsantrasyonuna seyreltin. Seyreltilmiş EV numunesinin 8 μL'sini, 1 x 10 10 parçacık / mL'lik bir parçacık konsantrasyonu için 1 μL antikor ve1 μL boya ile inkübe edin (toplam parçacıklar 10 μL'de askıya alınmış 1 x 108 olacaktır). Bu örnekte antikor için inkübasyon oranı 1:50'dir (1:5 antikorun 1 μL'si).
- Optimizasyon sırasında üçten fazla farklı antikor veya boya konsantrasyonu kullanın, protokolün seçilen etiketin aşırı doygunluğu olmadan maksimum epitop bağlanmasına izin verdiğini gösteren verileri sağlamak için, düşük yoğunluklu floresan olaylarının tanımlanmasını bozabilir. Membran boyası için inkübasyon konsantrasyonu 40 nM'dir (1 μL 400 nM).
- 10 μL numuneyi 5 s vorteks ile karıştırın ve karanlıkta 30 dakika boyunca RT'de inkübe edin.
NOT: Denetimler için öneriler tartışmaya dahil edilmiştir. - Kuluçkayı takiben, etiketli numuneden 1 μL alın ve 0.6 mL'lik bir tüp içinde PBS'de 1:50 seyreltin.
- Numuneyi yükleme bölmesine yükleyin ve 45 sn'lik yükseltme basıncı uygulayın. Lazer ayarlarının doğru olduğundan ve uygun lenslerin yüklendiğinden emin olun.
- Örnekleme basıncına geçin ve Kayıt Süresi'ni seçin. 1 dakikalık alımın ardından, veri dosyasını adlandırın ve kaydedin.
- Numuneyi boşaltın ve temizleme çözeltisi ile değiştirin. Bir sonraki etiketli numuneyi yüklemeden önce bunu >30 sn artırın.
4. nFCM analizi-Alt popülasyon analizi için PDF oluşturma
- PDF oluşturmak için, daha önce yapılanla aynı standartları uygulayın; yalnızca boş ölçüm farklı şekilde ayarlanır.
- Örnek dosyayı seçin ve eşiği ayarlayın. Nokta grafiğinde, yeşil veya kırmızı kanaldan FL ölçümlerini göstermek için y eksenini değiştirin.
- Kare geçit aracını seçin ve FL+ popülasyonunun etrafına bir kare çizmek için sol tıklamayı kullanın.
- Boş ölçüm dosyasını açın ve örnek dosyaya dönmeden önce Boş Ayarla'ya tıklayın.
- PDF oluşturma aracını daha önce olduğu gibi açtığınızda, FL+ alt popülasyonu için boyut dağılımı, konsantrasyon ve yüzde (tüm SS+ olaylarıyla karşılaştırıldığında) tanımlanır.
- "Toplam, P1, P2 vb." olarak tanımlanan her bir ilgi alanı alt popülasyonu için tekrarlayın.
Sonuçlar
SW620 türevi EV'ler ve C2C12 türevi EV'ler hakkında tetraspanin sunumu
Çeşitli kaynaklardan EV'ler üzerindeki anahtar tetraspaninlerin CD9, CD63 ve CD81'in bolluğunun modern analizi, hem toplu analizlerde hem de EV alt popülasyonları21 hakkındaki sunumlarını analiz ederken varlıklarının aşırı değişkenliğini vurgulamıştır. Bu muhtemelen ESCRT'ye bağımlı ve bağımsız yollar22 gibi farklı biyogenez yolaklarının mevcudiyeti ile ilgilidir.
CD9, C2C12 EV'lerin en büyük yüzdesinde ~% 50 ile sunuldu, CD63 sunumu ise sadece ~% 30'da, Şekil 1'de sunuldu. Bir inkübasyonda üç anti-tetraspaninin tümü ile etiketleme yapıldığında, parçacıkların ~% 70'inin EV belirteçlerinden en az birini sunduğu gösterilmiştir. Tekrarlanan ölçümler, C2C12 EV'lerin CD9/63/81 etiketlemesi için ~% 3.8 ile en düşük standart sapmayı gösterirken, CD81 etiketli C2C12 EV'ler için ~% 8.1 idi.
SW620 türevi EV'ler farklı bir tetraspanin profili gösterdi ve en çok sunulan CD9 ~% 40 ile en az sunulan CD63 ~% 7 arasında çok daha büyük bir fark vardı. C2C12 EV'lere benzer şekilde, CD9, tetraspanin pozitif popülasyonunun çoğunda mevcuttu, çünkü CD9/63/81 kombine etiketlemesi, parçacıkların ~% 42'sini üç belirteçten en az birine sahip olarak tanımladı.
C2C12 türevi parçacıkların çoğunluğu, toplam SS + popülasyonu, medyan ~ 65 nm çapında 45-120 nm arasında değişiyordu. Şekil 1'de gösterilen tek tetraspanin etiketli EV-alt popülasyonlarının her biri için boyut profilleri birbirine benzer, toplam parçacık popülasyonuna kıyasla ~ 75-85 nm daha büyük bir medyan boyutu ve daha az <65 nm EV'yi gösterir.
SW620 türevi parçacıklar, medyan boyutu ~ 65 nm olan 45-160 nm arasında değişmekte ve çarpık bir dağılım göstermektedir. Tetraspanin etiketli EV'ler, bireysel tetraspanin pozitif alt popülasyonlar arasında benzer dağılımlarla 90-110 nm arasında daha normal bir dağılım ve daha büyük medyan çap göstermektedir.
En çok ve en az sunulan tetraspaninler bu iki hücre hattı için aynı olsa da, orantılı gösterimleri büyük ölçüde farklılık gösterir ve CD9 pozitifliğindeki farktan gözlemlenebilen tetraspaninlerin potansiyel birlikte sunumu ile CD9/63/81 pozitifliği arasında ilginç bir fark vardır.
EV membran etiketlemesinin antikor etiketleme ile birleştirilmesi
EV'lerin çift katmanlı membranı, protein agregaları ve lipit monolayers23 ile bazı LDL formları gibi benzer boyutlu EV olmayan parçacıklardan ayrım yapılmasına izin verebilecek daha genel bir etiketleme hedefi sağlar. Bu tip etiketlemenin özgüllüğü, EV araştırmalarında kullanılan bazı yaygın membran boyalarının EV olmayan parçacıklara da bağlandığı gösterildiğinden doğrulanmalıdır24.
Membran etiketlemesi tekrar tekrar C2C12 türevi EV'lerin ve SW620 EV'lerin ~% 80 pozitifliğini göstermiştir. SS yoğunluğu (SS-H), Şekil 2'de gösterilen hem C2C12 hem de SW620 sonuçlarının nokta grafiklerinde FITC yoğunluğu ile iyi bir korelasyon göstermektedir. SS yoğunluğu partikül boyutuna ve dolayısıyla membran yüzey alanına göre olduğu için bu beklenir.
Antikor etiketli EV'lerin çoğunluğu, tetraspanin pozitif yüzdelerine çok benzer çift pozitif yüzdeler (FITC + & APC +) gösteren membran etiketlemesi için de pozitifti. FITC vs APC nokta grafikleri, membran ve tetraspanin etiketlemesi arasında hafif bir korelasyon gösterirken, CD63 etiketlemesi membran etiketleme ile en zayıf korelasyonu gösteriyor gibi görünmektedir. Antikor etiketlemesi için pozitif, membran etiketlemesi için negatif olan az sayıda olay tespit edildi.
Yeniden üretilebilirlik, çift etiketleme verimliliği ve alternatif veri çıkışları
nFCM deneylerinin tasarımında önemli bir husus, florofor veya etiket etkileşimidir. Şekil 3a , antikor etiketlemesinin ek membran etiketlemesi ile ve olmadan tekrarlanmasının çok benzer % pozitiflik ölçümlerine yol açtığını göstermektedir. Özellikle, SW620 etiketlemesi iki ölçüm seti arasında çok az değişiklik gösterir. Bu, boya ve antikor bağlanması arasındaki sınırlı paraziti gösterir ve ayrıca EV etiketlemesini tekrarlarken iyi tekrarlanabilirliği vurgular.
Hem yan saçılma hem de floresan olmak üzere yoğunluk ölçümleri, ölçülen her bir parçacık için mükemmel olacak şekilde dışa aktarılabilir. Bundan, etiketli hedefimizin bolluğunun karşılaştırmalı yaklaşımlarını sağlamak için ortalama floresan yoğunluğu (MFI) ölçümleri oluşturabiliriz. C2C12 türevli EV'lerin floresan popülasyonları için MFI, CD9 + EV'ler için görülen ~ 850 MFI'ye kıyasla, sırasıyla ~ 550 ve ~ 600 MFI ölçümleri ile CD63 ve CD81'in biraz daha düşük sunumunu önermektedir. Bu örnekte MFI için ölçüm birimleri FL-A'dır ve floresan kalibrasyonuna karşı standartlaştırılmamıştır. Her üç antikorun da kullanımı, sadece CD9 etiketlemesinden çok daha büyük bir floresan ortaya çıkarmaz. Bu, SW620 MFI ölçümlerinden çok farklıdır; bu, her üç antikorun bir kokteylinin kullanılmasının, etiketli EV'ler için herhangi bir antikor etiketinin kullanımından daha büyük bir floresan sinyali sağladığını göstermektedir.
NanoFCM yazılımı tarafından üretilen boyut dağılımı histogramları da excel'e aktarılabilir ve böylece üçlü veri kümelerinin üst üste bindirilmesine izin verilir. Şekil 3'ün boyut dağılım profilleri Şekil 1'inkine benzer, ancak hata çubukları içerir. C2C12 türevi EV'lerdeki tetraspanin pozitif alt popülasyonlarının medyan EV boyutu, toplam parçacık popülasyonlarının 60 nm ortalamasından biraz daha büyük, yaklaşık 70 nm civarında bir medyan göstermektedir. Tetraspanin belirteçleri için pozitif olan SW620 EV'ler daha büyüktür ve ~ 100 nm'de zirveler gösterir.
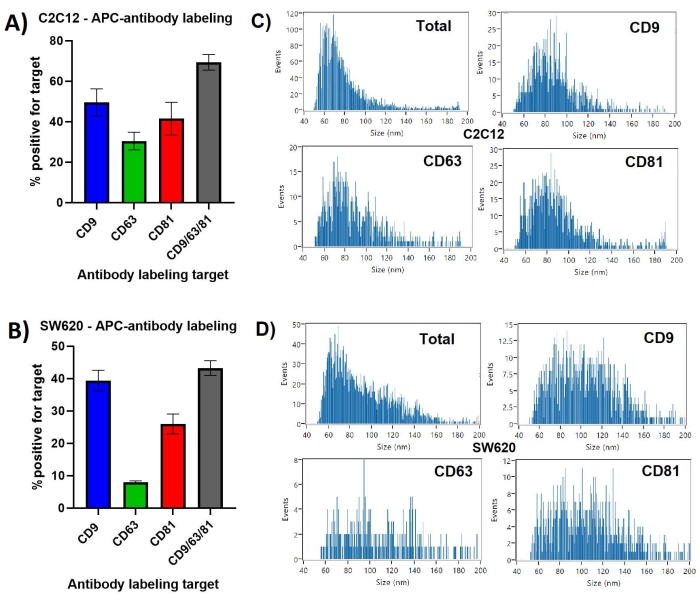
Şekil 1: Antikor etiketlemesi ile tanımlanan CD9, CD63, CD81 pozitif EV alt popülasyonları . (A) C2C12 türevi EV'ler için SS tarafından gözlemlenen toplam parçacıklara kıyasla etiketli EV'lerin yüzdesini gösteren çubuk grafik. (B) SW620 türevi EV'ler için SS tarafından gözlemlenen toplam parçacıklara kıyasla etiketli EV'lerin yüzdesini gösteren çubuk grafik. (C) C2C12 türevi EV'ler için temsili boyut dağıtım profilleri. Her histogram, üçlü veri kümelerinin ilk ölçümü için oluşturulan PDF'lerden alınır. (D) SW620 türevi EV'ler için temsili boyut dağıtım profilleri. Her histogram, üçlü veri kümelerinin ilk ölçümü için oluşturulan PDF'lerden alınır. Hata çubukları, aynı etiketli numunelerin üçlü ölçümlerinin standart sapmasını temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
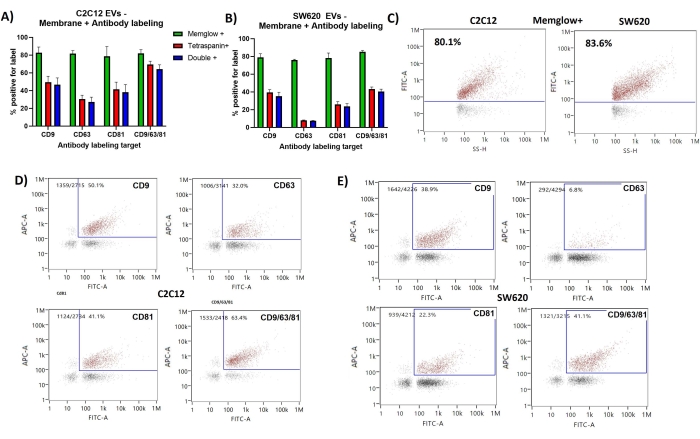
Şekil 2: EV alt popülasyonlarını sunan CD9, CD63, CD81'in membran etiketlemesi ve antikor etiketlemesi . (A) C2C12 EV'ler için Membran + % , tetraspanin + % ve çift + % gösteren çubuk grafik. (B) SW620 EV'ler için Membran+%, tetraspanin+% ve double+% değerlerini gösteren çubuk grafik. (C) Membran pozitif popülasyonu için geçit gösteren Temsili SS vs FITC nokta grafikleri. (D) C2C12'den çift pozitif EV'ler popülasyonu için geçit gösteren temsili FITC vs APC nokta grafikleri. (E) SW620'den EV'lerin çift pozitif popülasyonu için geçit gösteren temsili FITC vs APC nokta grafikleri. Hata çubukları, aynı etiketli numunelerin üçlü ölçümlerinin standart sapmasını temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
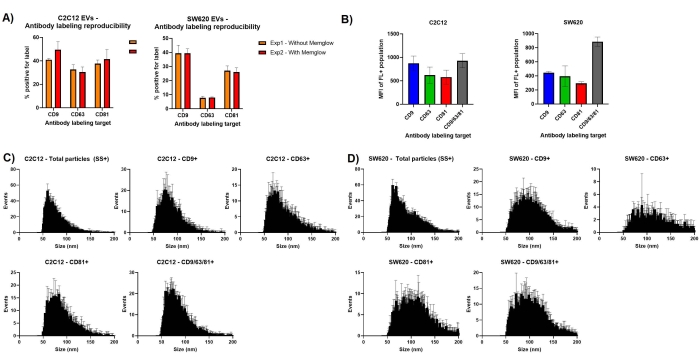
Şekil 3: Tekrarlanan ölçümlerdeki varyasyonun değerlendirilmesi . (A) Ek membran etiketlemeli ve ek membran etiketlemesi olmadan antikor etiketleme % pozitifliğini gösteren çubuk grafikler. (B) Kapılı EV alt kümeleri için ortalama floresan yoğunluk ölçümleri. (C) C2C12 EV'ler için üçlü veri kümeleri için ortalama boyut dağılımı histogramları. (D) SW620 EV'ler için üçlü veri kümeleri için ortalama boyut dağılımı histogramları. Hata çubukları, aynı etiketli numunelerin üçlü ölçümlerinin standart sapmasını temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Numune ve reaktif ayrıntıları
Floresan etiketlemenin gösterilmesi ve ardından nFCM analizi için ayrı hücre hatlarından iki EV izolatı seçildi. Her iki EV seti de PBS'de askıya alındı ve <3 ay boyunca -80 ° C'de saklandı, ancak diğer koşulların çoğu izolatlar arasında farklıydı. C2C12 fare miyoblast hücre hattı, iskelet kası hücrelerinin embriyonik bir öncüsünü temsil eder ve 2D kültürde yetiştirilir ve ultrasantrifüjleme ile EV izolasyonundan önce büyüme ortamını 72 saatten fazla şartlandırır. SW620 bir insan kolon adenokarsinom hücre hattıdır ve 7 hafta boyunca medyayı zenginleştiren ilkel bir biyoreaktörde yetiştirilmiş, boyut dışlama kromatografisi (SEC) ve sefaroz CL-2B kolonlarından salınan 7-9 fraksiyonları ile yapılan EV izolasyonu tek bir numunede birleştirilmiştir.
CCM'den izole edilen ve konsantre edilen EV'ler çalışmak için en kolay numune türleri olsa da, nFCM serum, plazma, idrar ve BOS gibi biyoakışkanlar dahil olmak üzere çoğu EV izolatına uygulanabilir. Bu örnek analizleri, tüm parçacıkların nFCM SS tespitinden yararlanarak NTA, TRPS ve diğer parçacık analizleri ile doğrulamaya izin verirken, floresan olarak etiketlenmiş EV alt popülasyonlarını nicel terimlerle ve toplamın bir oranında tanımlarken, çok parametreli parçacık analizinin tarafsız bir yaklaşımı için. Düşük kontamine protein gerektirme uyarısı ile arıtılmamış idrar ve EV'yle zenginleştirilmiş CCM gibi düşük işlenmiş numunelerin analizi de mümkündür.
Burada kullanılan membran boyasının, membran yüklemesi için lipofilik bir moiety ve plazma membranı25'te kalmak için bir hidrofilik boya ile lipit çift katmanına entegre edilmesi amaçlanmıştır. Şu anda mükemmel bir EV etiketleme boyası yoktur ve seçim yaparken EV'lere özgüllük, sabitleme veya geçirgenliğe uygunluk ve EV etiketleme26'nın verimliliği dahil olmak üzere çeşitli kriterler dikkate alınmalıdır.
Yüzeye maruz kalan epitopların floresan konjuge antikor etiketlemesinin, EV alt popülasyonlarını tanımlamak için etkili bir yöntem olduğu kanıtlanmıştır27. Protokol optimizasyonunun önemli bir yönü, etiketleme doygunluğunun, çevredeki tamponun floresan bağlanmamış antikor28 ile doldurulmasına izin vererek düşük floresan parçacıklarının algılanmasını engellemeden mevcut tüm epitoplara bağlanması ve aşılmamasıdır. Ek olarak, antikor etiketlemesi için maruz kalan bağlanma bölgelerinin mevcudiyeti potansiyel olarak çeşitli faktörlerden etkilenir. EV'lerin depolama koşullarının, EV'lerin29'un konsantrasyon ve boyut profillerini etkilediği gösterilmiştir ve gözlemler ayrıca antikor etiketleme30 üzerindeki etkileri de göstermektedir. Yüzey korona proteinlerinin varlığı, protein modifikasyonları ve izolasyon tekniklerinin etkileri de bazı durumlarda antikor etiketlemesi üzerinde etkilere sahip olabilir. Nihayetinde, floresan etiketlemenin kullanımı EV çalışmaları için daha yaygın hale geldikçe, çoklu analitik teknikler için deneysel tasarım ve optimizasyon daha rafine hale gelecektir.
Sonuçların doğruluğunu artırmak için, (1) PBS + boya kontrolü, nFCM analizinde SS + partikülleri olarak görünebilen bazı boyalarda misel veya agrega oluşumunu değerlendirmek için, (2) PBS + antikor kontrolü, agregalar oluşabilir, ancak genellikle SS tespiti için yeterli ışık saçmak için yeterince büyük olmasa da, (3) EV örneği + IgG antikor kontrolü, Akış sitometrisinde yaygın olan ve spesifik olmayan herhangi bir bağlanmayı tanımlamak için kullanılan, (4) EV olmayan parçacık numunesi + antikor / boya kontrolü - özellikle karmaşık parçacık numunelerinde EV'leri tanımlamaya ihtiyaç duyulduğunda önemlidir, saflaştırılmış düşük yoğunluklu lipoprotein (LDL) parçacıkları veya EV tükenmiş / ablatlanmış numuneler gibi kontroller seçici etiketlemeyi doğrulamak için negatif bir kontrol görevi görebilir, (5) pozitif kontrollerin tasarlanması zordur, ancak hücreler üzerinde bir antikorun doğrulanması yararlı bir kapsamdır.
EV'lerde tetraspaninlerin sunumu
Bu deneyin antikor ve membran etiketlemesi, nFCM analizi ile küçük bir zaman diliminde elde edilebilecek yüksek düzeyde nicel verileri göstermektedir. Partikül çapının/konsantrasyonunun temel fiziksel özelliklerinin membran ve/veya protein varlığının fenotipik ölçümleri ile eş zamanlı ölçümü, partikül izolasyonu içindeki alt popülasyonların üst düzey tanımlarına yol açar.
Önemli olarak, bu iki EV örneğinde üç 'anahtar' EV ile ilişkili tetraspanin, CD9, CD63, CD81'in değişen seviyeleri tanımlanmıştır. CD9, hem C2C12 türevi EV'ler hem de SW620 için EV'lerin en büyük oranında, CD81 ve CD63 sırasıyla ikinci ve en az sunulan proteinler olarak sunuldu.
Burada iki farklı hücre kaynağından EV'lerin tetraspanin profillerinde gözlenen bazı benzerliklere rağmen, CD9, CD63 ve CD81 seviyeleri hücre hattı ile hasta kaynaklı EV'ler31 arasında çok farklı olabilir.
İki EV örneği arasındaki CD63 ekspresyonundaki fark, özellikle 'EV-ness'in anahtar tanımlayıcılarının devam eden tartışmasıyla ilgilidir. CD63'ün SW620 EV'lerin sadece% ~ 8'inde sunumu bazıları tarafından beklenmeyen olsa da, CD63, boyut veya yoğunluk32 ile izole edilen farklı EV tiplerinin zayıf tanımlayıcısı olarak önerilmiştir ve tetraspanin negatif EV'ler, eksozom benzeri33 olarak tanımlansa bile, tanımlanmıştır.
Karmaşık partikül izolasyonları içinde EV'lerin tanımlanması
Hem hücre hattında hem de hasta kaynaklı EV'lerde EV tetraspanin profillerinin heterojenliği, EV'lerin tetraspanin bazlı yakalanmasına güvenmeye karşı uyarmakta ve yeni EV tanımlama yöntemlerine gelecekteki ihtiyacı vurgulamaktadır31. Belirli proteinlerden bağımsız EV etiketlemesi, EV özgüllüğünün çok yüksek olduğu kanıtlanabilirse, EV'leri benzer büyüklükteki EV olmayan parçacıklardan tanımlamak için oldukça faydalı olabilir. Bu, özellikle biyosıvı EV izolatları için geçerlidir, çünkü insan kan plazmasındaki EV'lerin konsantrasyonunun 10 10 parçacık / mL aralığında olduğu, lipoproteinlerin ise mL14,34 başına 1016'da ölçüldüğü öne sürülmüştür. EV zenginleştirme üzerine bile, tetraspanin belirteçleri ve / veya LDL belirteci ApoB için partikül pozitifliğini karşılaştıran çalışmalar, EV 35'e kıyasla Trombosit içermeyen plazma (PFP) örneklerinde ~ 50-100 kat daha fazla LDL bolluğu olduğunu göstermektedir.
Kullanılan izolasyon tekniği, çok düşük yoğunluklu lipoproteinler (VLDL), orta yoğunluklu lipoproteinler (IDL) ve LDL36 gibi birlikte izole edilmiş EV olmayan parçacıkların aralığını büyük ölçüde etkiler. EV'lere bağlı lipoprotein ko-izolatlarının tanımları da vardır, bu da potansiyel olarak önemli bir biyolojik rol oynarken, EV saf örneklerine ulaşmayı zorlu bir hedef haline getirir35.
Bu nedenle, saf fakat sınırlı bir EV'ler seçiminin izolasyonunu sağlamak yerine, bir numuneyi oluşturan parçacıkların tanımına daha fazla odaklanıldığı söylenebilir. Tetraspanin bolluğunu yığın halinde ve partikül sayımlarını ayrı ayrı ölçerek partiküllerin kapsamlı bir şekilde tanımlanması, özellikle biyoakışkan kaynaklarından36,37 EV konsantrasyonlarını doğru bir şekilde belirlemek için yetersiz olabilir. Alt popülasyonları katman tabanlı bir yaklaşımla tanımlamak, bu deneyde gösterildiği gibi belirli proteinleri sunan toplam parçacıkları, EV'leri ve EV'leri göstermek, nanopartikül karakterizasyonuna sağlam bir çözüm sağlayabilir. Bu, gelecekteki terapötik uygulamalar için tasarımlarla EV yüklemesini içeren projeler için geçerlidir20 ve CD63 + EV'lerin mitokondri38 gibi luminal kargo ile tanımlanması.
nFCM, EV analitiği repertuarında
nFCM EV analizinin gücü, verilerin en yaygın EV analizlerini doğrulayabilmesinin ve üzerine inşa edebilme ve fiziksel ve fenotipik veri kümeleri arasında köprüler oluşturabilmesidir. Bununla birlikte, bu, boyalar ve antikorlar gibi benzersiz etiketleme reaktifleri için sıklıkla optimize edilmesi gereken doğru etiketleme protokollerine dayanmaktadır. Doğru analiz için kilit bir kriter, floresan olmayan bir tamponda asılı duran etiketli parçacıklara sahip olmaktır; bu, aşırı bağlanmamış floroforun çıkarılmasına veya protokollerin epitop doygunluğunu aşmayacak şekilde iyileştirilmesine dayanır.
Karşılaştırma çalışmaları, EV'lerin nFCM boyutlandırmasının, EV boyut analizi10,39 için NTA'dan daha doğru olarak tanımlanan TRPS ve kriyo-TEM tekniklerine uygun veri sağladığını göstermiştir. Bununla birlikte, herhangi bir optik tabanlı yöntemde olduğu gibi, EV'ler için görülen heterojenik optik özelliklerin etkisi ve referans malzemenin optik özellikleri ile EV'ler arasındaki farklar, verileri yorumlarken kabul edilmelidir10.
Batı lekelenmesi, EV belirteçlerinin tanımlanması yoluyla EV zenginleştirmesini belirtmek için anahtar bir yöntem olmuştur40. Ancak, bu tür belirteçlerin parçacıklar üzerindeki varlığını gösterme arzusu, EV tabanlı akış sitometrik analizlerinde ilerlemelere yol açmıştır17. Bununla birlikte, sağlam veriler sağlamak için gerekli çözünürlükler şu anda hem dağınık hem de floresan ışık19 ile ilgili özel enstrümantasyon yoluyla en iyi şekilde elde edilmektedir.
nFCM, yan saçılma ölçümünü kullanarak, belirli belirteçlerle ilgisi olmayan tüm parçacıkları başlangıçta tanımlamak için tarafsız bir yaklaşım sunarak, NTA, RPS ve TEM1'in en yaygın teknikleriyle doğrulamaya izin verirken, aynı zamanda WB veya Elisa'ya benzer fenotipik ölçümleri nicel bir şekilde ekler.
Açıklamalar
A.L., B.P., D.A., R.L, R.T. NanoFCM çalışanlarıdır ve bu makaleye katkıları istihdamlarının bir parçası olarak yapılmıştır.
Teşekkürler
Owen Davies ve Nick Peake gruplarına materyal ve uzmanlık sağlamaya devam ettikleri için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| APC Anti-CD81 antibody (M38) | abcam | ab233259 | Anti-Human CD81 APC conjugated antibody |
| APC Anti-CD9 antibody (EM-04) | Abcam | ab82392 | Anti-mouse CD9 APC conjugated antibody |
| APC Anti-CD9 antibody (MEM-61), prediluted | abcam | ab82389 | Anti-Human CD9 APC conjugated antibody |
| APC anti-mouse CD63 antibody | biolegend | 143905 | Anti-Mouse CD63 APC conjugated antibody |
| APC anti-mouse/rat CD81 antibody | biolegend | 104909 | Anti-Mouse CD81 APC conjugated antibody |
| CD63 monoclonal antibody (MEM-259), APC | invitrogen Via Fisherscientific | A15712 | Anti-Human CD63 APC conjugated antibody |
| Celline AD1000 bioreactor | Merck | Z688037-5EA | |
| Cleaning solution | NanoFCM | 17159 | In house cleaning solution for nanoanalyser |
| EVs from C2C12 | Gifted | Mouse line | |
| EVs from SW620 | Gifted | Human line | |
| Memglow - Fluorogenic Membrane Probe | Cytoskeleton | MG01 | non toxic cell membrane dye |
| NanoAnalyzer | NanoFCM | nano-flow cytometer for measurement of single particles | |
| PBS, pH 7.2 | Gibco Via Fisherscientific | 12549079 | Salt solution for dilution of samples and antibodies |
| Snaplock Microtubes, 0.60mL | Axygen Via Fisherscientific | 11371944 | Tubes required to load sample into nanoanalyser |
Referanslar
- Couch, Y., et al. A brief history of nearly EV-erything - The rise and rise of extracellular vesicles. Journal of Extracellular Vesicles. 10 (14), 12144(2021).
- Doyle, L. M., Wang, M. Z. Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosome isolation and analysis. Cells. 8 (7), 727(2019).
- Grant, L. R., Milic, I., Devitt, A. Apoptotic cell-derived extracellular vesicles: structure-function relationships. Biochemical Society Transactions. 47 (2), 509-516 (2019).
- Rontogianni, S., et al. Proteomic profiling of extracellular vesicles allows for human breast cancer subtyping. Communications Biology. 2, 325(2019).
- Sahoo, S., et al. Therapeutic and diagnostic translation of extracellular vesicles in cardiovascular diseases. Circulation. 143 (14), 1426-1449 (2021).
- Chiang, C. -Y., Chen, C. Toward characterizing extracellular vesicles at a single-particle level. Journal of Biomedical Science. 26 (1), 9(2019).
- Karimi, N., et al. Detailed analysis of the plasma extracellular vesicle proteome after separation from lipoproteins. Cellular and Molecular Life Sciences. 75 (15), 2873-2886 (2018).
- Akers, J. C., et al. Comparative analysis of technologies for quantifying Extracellular Vesicles (EVs) in Clinical Cerebrospinal Fluids (CSF). PLOS ONE. 11 (2), 0149866(2016).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8 (1), 1596016(2019).
- Vogel, R., et al. Measuring particle concentration of multimodal synthetic reference materials and extracellular vesicles with orthogonal techniques: Who is up to the challenge. Journal of Extracellular Vesicles. 10 (3), 12052(2021).
- Van Der Pol, E., et al. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. Journal of Thrombosis and Haemostasis. 12 (7), 1182-1192 (2014).
- Hartjes, T. A., Mytnyk, S., Jenster, G. W., Van Steijn, V., Van Royen, M. E. Extracellular vesicle quantification and characterization: Common methods and emerging approaches. Bioengineering. 6 (1), 7(2019).
- Zhao, Z., Wijerathne, H., Godwin, A. K., Soper, S. A. Isolation and analysis methods of extracellular vesicles (EVs). Extracellular Vesicles and Circulating Nucleic Acids. 2, 80-103 (2021).
- Johnsen, K. B., Gudbergsson, J. M., Andresen, T. L., Simonsen, J. B. What is the blood concentration of extracellular vesicles? Implications for the use of extracellular vesicles as blood-borne biomarkers of cancer. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1871 (1), 109-116 (2019).
- Zhu, S., et al. Light-scattering detection below the level of single fluorescent molecules for high-resolution characterization of functional nanoparticles. ACS Nano. 8 (10), 10998-11006 (2014).
- Van Der Pol, E., et al. Standardization of extracellular vesicle measurements by flow cytometry through vesicle diameter approximation. Journal of Thrombosis and Haemostasis. 16 (6), 1236-1245 (2018).
- Lucchetti, D., et al. Measuring extracellular vesicles by conventional flow cytometry: dream or reality. International Journal of Molecular Sciences. 21 (17), 6257(2020).
- Suárez, H., et al. A bead-assisted flow cytometry method for the semi-quantitative analysis of Extracellular Vesicles. Scientific Reports. 7 (1), 11271(2017).
- Tian, Y., et al. Protein profiling and sizing of extracellular vesicles from colorectal cancer patients via flow cytometry. ACS Nano. 12 (1), 671-680 (2018).
- Silva, A. M., et al. Quantification of protein cargo loading into engineered extracellular vesicles at single-vesicle and single-molecule resolution. Journal of Extracellular Vesicles. 10 (10), 12130(2021).
- Dragovic, R. A., Southcombe, J. H., Tannetta, D. S., Redman, C. W. G., Sargent, I. L. Multicolor flow cytometry and nanoparticle tracking analysis of extracellular vesicles in the plasma of normal pregnant and pre-eclamptic women. Biology of Reproduction. 89 (6), 151(2013).
- Teng, F., Fussenegger, M. Shedding light on extracellular vesicle biogenesis and bioengineering. Advanced Science. 8 (1), 2003505(2021).
- Laulagnier, K., et al. Mast cell- and dendritic cell-derived exosomes display a specific lipid composition and an unusual membrane organization. Biochemical Journal. 380, 161-171 (2004).
- Simonsen, J. B. Pitfalls associated with lipophilic fluorophore staining of extracellular vesicles for uptake studies. Journal of Extracellular Vesicles. 8 (1), 1582237(2019).
- Collot, M., et al. MemBright: A family of fluorescent membrane probes for advanced cellular imaging and neuroscience. Cell Chemical Biology. 26 (4), 600-614 (2019).
- Takov, K., Yellon, D. M., Davidson, S. M. Confounding factors in vesicle uptake studies using fluorescent lipophilic membrane dyes. Journal of Extracellular Vesicles. 6 (1), 1388731(2017).
- Tian, Y., et al. Quality and efficiency assessment of six extracellular vesicle isolation methods by nano-flow cytometry. Journal of Extracellular Vesicles. 9 (1), 1697028(2020).
- Mondal, A., Ashiq, K. A., Phulpagar, P., Singh, D. K., Shiras, A. Effective visualization and easy tracking of extracellular vesicles in glioma cells. Biological Procedures Online. 21, 4(2019).
- Gelibter, S., et al. The impact of storage on extracellular vesicles: A systematic study. Journal of Extracellular Vesicles. 11 (2), 12162(2022).
- Jayachandran, M., Miller, V. M., Heit, J. A., Owen, W. G. Methodology for isolation, identification and characterization of microvesicles in peripheral blood. Journal of Immunological Methods. 375 (1-2), 207-214 (2012).
- Mizenko, R. R., et al. Tetraspanins are unevenly distributed across single extracellular vesicles and bias sensitivity to multiplexed cancer biomarkers. Journal of Nanobiotechnology. 19 (1), 250(2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences of the United States of America. 113 (8), 968-977 (2016).
- Laulagnier, K., et al. Amyloid precursor protein products concentrate in a subset of exosomes specifically endocytosed by neurons. Cellular and Molecular Life Sciences. 75 (4), 757-773 (2018).
- Simonsen, J. B. What are we looking at? Extracellular vesicles, lipoproteins, or both. Circulation Research. 121 (8), 920-922 (2017).
- Sódar, B. W., et al. Low-density lipoprotein mimics blood plasma-derived exosomes and microvesicles during isolation and detection. Scientific Reports. 6, 24316(2016).
- Brennan, K., et al. A comparison of methods for the isolation and separation of extracellular vesicles from protein and lipid particles in human serum. Scientific Reports. 10 (1), 103(2020).
- Welton, J. L., Webber, J. P., Botos, L. -A., Jones, M., Clayton, A. Ready-made chromatography columns for extracellular vesicle isolation from plasma. Journal of Extracellular Vesicles. 4, 27269(2015).
- Peruzzotti-Jametti, L., et al. Neural stem cells traffic functional mitochondria via extracellular vesicles. PLOS Biology. 19 (4), 3001166(2021).
- Arab, T., et al. Characterization of extracellular vesicles and synthetic nanoparticles with four orthogonal single-particle analysis platforms. Journal of Extracellular Vesicles. 10 (6), 12079(2021).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır