Method Article
Характеристика одноклеточного везикулярного трансмембранного белка с помощью нанопоточной цитометрии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Последнее поколение инструментов для определения характеристик электромобилей способно проводить анализ одного электромобиля по нескольким параметрам одновременно. Нанопоточная цитометрия измеряет все биологические частицы размером более 45 нм без маркировки и идентифицирует специфические характеристики субпопуляций с помощью различных методов флуоресцентной маркировки.
Аннотация
Характеристика отдельных частиц становится все более актуальной для исследований внеклеточных везикул, переходя от методов объемного анализа и анализа частиц первого поколения к комплексным многопараметрическим измерениям, таким как нанопоточная цитометрия (nFCM). nFCM - это форма проточной цитометрии, которая использует приборы, специально разработанные для анализа наночастиц, что позволяет характеризовать тысячи электромобилей в минуту как с использованием методов окрашивания, так и без них. Обнаружение бокового рассеяния с высоким разрешением (SS) позволяет определить размер и концентрацию для всех биологических частиц размером более 45 нм, в то время как одновременное обнаружение флуоресценции (FL) идентифицирует наличие меченых маркеров и целей, представляющих интерес. Меченые субпопуляции затем могут быть описаны в количественных единицах частиц/мл или в процентах от общего числа частиц, идентифицированных боковым рассеянием.
Здесь EV, полученные из кондиционированных клеточных культур (CCM), маркируются как липидным красителем, чтобы идентифицировать частицы с мембраной, так и антителами, специфичными для CD9, CD63 и CD81 в качестве общих маркеров EV. Измерения материала сравнения, эталон концентрации и стандарт размера наносфер кремнезема, а также маркированного материала образца анализируются в 1-минутном анализе. Затем программное обеспечение используется для измерения концентрации и профиля распределения по размеру всех частиц, независимо от маркировки, прежде чем определить частицы, которые являются положительными для каждой из меток.
Одновременное обнаружение SS и FL может быть гибко использовано со многими различными источниками EV и целями маркировки, как внешними, так и внутренними, описывая образцы EV всеобъемлющим и количественным образом.
Введение
Что такое электромобили?
Внеклеточные везикулы (EV) являются собирательным термином для ряда клеточных мембранных частиц, интегральных для многих нормальных клеточных и тканевых активностей. Их влияние на широкий спектр научных областей и их потенциальная клиническая значимость привели к росту исследований в области электромобилей и промышленного интереса1. Малые исследования EV (sEV) в основном сосредоточены на экзосомах, частицах 40-100 нм, которые начинают образование в ранних эндосомах до созревания и высвобождаются путем слияния многовезикулярных тел (MVB) с плазматической мембраной, а также микровезикул, которые формируются непосредственно из плазматической мембраны, образуя частицы 80-1000 нм2. Третья популяция EV - это апоптотические тела, частицы 50-1 500 нм, образующиеся во время гибели клеток, что означает, что их относительная пропорция к другим EV может сильно варьироваться3.
Поскольку характеристики EV могут представлять собой изменения, происходящие в их клетке / ткани происхождения, существует потенциал для их использования в диагностике. Различные «омические» анализы начали выявлять маркеры клеточного происхождения и болезненного состояния, что может позволить проводить неинвазивную оценку пациентов с использованием источников EV, таких как плазма крови / сыворотка, моча, слюна и спинномозговая жидкость (CSF) 4,5. Движущей силой этих инноваций, связанных с электромобилями, являются новые методы характеристики, которые преодолевают предыдущие ограничения.
Необходимость и проблемы, связанные с характеристикой одного электромобиля
Одиночная характеристика EV становится все более важной как для валидации, так и для описания изолятов EV, а также для выяснения ключевых особенностей этих наночастиц для прогрессирования терапии и диагностики на основе EV6. В зависимости от источника EV и предполагаемого использования, анализ чистоты, часто описываемый как отношение EV к не-EV частицам или как EV к свободному белку, может потребовать значительных объемов данных из множественной аналитики7.
Подсчет частиц и измерения размеров в публикациях EV ранее в значительной степени полагались на отслеживание наночастиц (NTA), резистивное импульсное зондирование (RPS) и электронную микроскопию (EM)2. Стандартные NTA и RPS не имеют возможности отличать EV от частиц, не относящихся к EV, и имеют свои собственные предостережения, такие как медленная пропускная способность8 и неподходящий нижний предел обнаружения, наблюдаемый с NTA 9,10,11.
Тетраспанины CD9, CD63 и CD81 исторически были важными идентификаторами присутствия EV в изоляциях / препаратах EV. Обычно методы западного блоттинга (WB) и точечного блоттинга используются для демонстрации обогащения этих белков в изолятах EV по сравнению с клеточным лизатом12. Однако отсутствие количественного определения этих методов и гетерогенность этих маркеров EV, касающихся как отображения в субпопуляциях EV, так и вариаций, связанных с клетками, тканями или пациентами, способствует передовым аналитическим методам, которые объединяют физическую и фенотипическую характеристику13.
Нанопоточная цитометрия как комплексный метод анализа ЭЛЕКТРОМОБИЛей
Определение истинных концентраций EV требует идентификации неповрежденных частиц и универсального маркера, особенно в сложных изолятах частиц, с разрешением, способным обнаруживать все EV, отличая их от частиц14, не относящихся к EV.
Нанопоточная цитометрия (nFCM) - это метод, который позволяет проводить немаркированный анализ частиц размером от 45 до 1000 нм, одновременно используя флуоресцентную маркировку и обнаружение для идентификации субпопуляций частиц. Ключевым отличием от обычной проточной цитометрии является использование оборудования, предназначенного для анализа наночастиц, что позволяет получить наибольшее разрешение15. Анализ EV, в котором используются обычные приборы потока, перепрофилированные для анализа мелких частиц, улучшается, но все еще изо всех сил пытается достичь разрешения для обнаружения и анализа <100 нм EV16,17. Проточная цитометрия на основе шариков является дополнительной адаптацией, часто используемой для анализа EV, но это устраняет возможность обнаружения отдельных частиц и вводит смещения на основе захвата18.
Извлекая выгоду из нижнего предела обнаружения ~ 45 нм в канале бокового рассеяния (SS) для анализа EV, nFCM использует триггер SS. Это можно рассматривать как анализ «сначала частица», поскольку это означает, что события должны обеспечивать сигнал SS, превышающий установленный порог перед анализом интенсивности флуоресценции. Это удаляет ложные срабатывания, такие как деградированные мембранные и флуорофорные агрегации, и фокусирует анализ на неповрежденных EV15. Измерения SS также используются для определения размера отдельных частиц по сравнению с четырехмодальным стандартом наносферы кремнезема19. Измерения флуоресценции проводятся на двух дополнительных детекторах, что позволяет проводить три одновременных измерения для каждой частицы для описания концентрации частиц, размеров и присутствия маркеров или других целей, представляющих интерес, с целью идентификации субпопуляцийEV 20.
В следующем эксперименте измерения SS и флуоресцентных (FL) используются для измерения частиц >45 нм, демонстрации подмножества мембранных положительных EV и идентификации представления CD9, CD63, CD81 на субпопуляциях EV. Описываются как концентрация этих субпопуляций, так и их соотношение как части общих частиц, измеренных SS, а также их профили размеров.
протокол
1. Настройка прибора nFCM и измерения стандартов nFCM
ПРИМЕЧАНИЕ: Перед началом сбора данных для образцов проводятся три измерения для проверки правильности выравнивания прибора nFCM и обеспечения точного сравнения между приборами. Это стандарт концентрации / контроль качества (QC), стандарт размера и заготовка.
- Разбавьте шарики контроля качества 1:100 в дистиллированной воде в соответствующей трубке объемом 0,6 мкл и поместите в загрузочный отсек.
- В раскрывающемся меню Поток образцов выберите Ускорение, чтобы ввести образец контроля качества в систему на 45 с, чтобы полностью заменить предыдущий образец/чистящий раствор.
- При усилении установите мощность лазера на предустановленный шаблон для шариков QC «стандарт FL QC 250 нм», например, 10/40 мВт для синего лазера, 20/50 мВт для красного лазера, с распадом SS 0,2%.
- Выберите давление отбора проб в том же меню внизу, чтобы уменьшить давление в системе.
- Установите автоматическое давление отбора проб на 1,0 кПа для поддержания постоянного давления.
- Начните 1-минутный анализ, выбрав Время записи в элементах управления приобретением. Данные будут нанесены на точечную диаграмму, показывающую логарифмическую шкалу интенсивности SS и выбранную интенсивность FL.
- Вставьте имя файла и образец разбавления перед сохранением файла.
- Выберите выгрузку, чтобы удалить трубу из загрузочного отсека. Замените 150 мкл чистящего раствора и очистите в течение >30 с, выбрав Boosting перед удалением чистящего раствора, выбрав Разгрузить.
- Удалите излишки чистящего раствора из кончика капилляра с помощью трубки, содержащей 150 мкл воды.
- Разбавьте стандартные шарики размера 1:100 в воде и загрузите 100 мкл в загрузочный отсек, прежде чем увеличивать образец в течение 45 с.
- Установите мощность лазера на предустановленный шаблон "S16 exo 68-155 нм". Этот параметр предназначен как для стандартного размера, так и для образцов, содержащих электромобили < 200 нм. Например, 15/40 мВт для синего лазера, 20/50 мВт для красного лазера, с распадом SS 0,2%.
- Выберите Выборка и приступайте к записи сэмпла в течение 1 мин, как и раньше.
- Выполните третье измерение с помощью образца воды или PBS, чтобы создать пустое измерение вашего элюента, выявив ложные срабатывания для удаления программным обеспечением. Ввод стандартных измерений описан в следующем разделе.
2. Определение концентрации частиц в немаркированном образце и создание отчета в формате PDF
- Разбавьте немаркированный образец EV в PBS до подходящего диапазона концентраций частиц для анализа nFCM, 1 x 108- 5 x 108 частиц/мл. Загрузите 10-100 мкл разбавленного образца в загрузочный отсек.
- Когда концентрация частиц неизвестна, начните с разбавления образца EV в соотношении 1:100. Концентрация образца может быть быстро аппроксимирована размером лазерного пятна на ПЗС-камере во время ускорения или путем наблюдения следа всплеска событий во время отбора проб.
- Увеличьте загруженный образец в течение 45 с, прежде чем выбрать Выборка , и записывайте в течение 1 минуты, сохраняя, как описано выше.
- Чтобы начать анализ этих данных, перейдите с вкладки Получение на вкладку Анализ . Откройте сохраненные файлы nfa.
- Чтобы обеспечить точное измерение образца, используйте два стандартных измерения, проведенных до измерения образца, чтобы установить значения для сравнения образцов, а также заготовку.
- Создайте стандартную кривую размера для преобразования SS в диаметр, сначала выбрав стандартный файл размера и используя инструмент установки пороговых значений (также известный как автоматическое пороговое значение). Пороговое значение, видимое в трассировке всплеска события, определяет минимальную интенсивность сигнала, необходимую для того, чтобы событие считалось значимым.
- Установив пороговое значение, проверьте, что параметры точечного графика x и y — SS-H или SS-A на оси x и FITC-A на оси y.
- Откройте стандартный инструмент генерации кривых и выберите S16 exo 68-155 нм в качестве шаблона размера. Нажмите «Найти пики», чтобы определить пиковые интенсивности SS как частицу диаметром 68, 91, 113 или 155 нм.
- Перед закрытием окна проверьте, сгенерирована ли кривая SS to diameter со значением r, близким к 1.
- Установите стандарт концентрации, выбрав сохраненный файл и щелкнув Count STD. Введите концентрацию частиц стандарта.
- Задав стандартную информацию, выберите файл образца EV и установите пороговое значение.
- Выберите пустой файл и нажмите « Установить пустой », чтобы определить количество ложных срабатываний для удаления из счетчика образцов. Это должно быть сделано с тем же пороговым значением, что и ваш образец. Вернитесь к файлу образца EV.
- Откройте инструмент создания PDF и выберите «Размер и концентрация». Введите разбавления образца. Показана концентрация образца и распределение частиц по размерам.
3. Маркировка образцов
ПРИМЕЧАНИЕ: Две стратегии окрашивания могут быть использованы одновременно для всестороннего анализа частиц в суспензии. Протоколы маркировки часто требуют оптимизации для новых антител или источников образцов.
- Разбавить часть образца EV до концентрации 1,25 х 1010 частиц/мл в PBS. Инкубировать 8 мкл разбавленного образца EV с 1 мкл антитела и 1 мкл красителя для концентрации частиц 1 х 1010 частиц/мл (общее количество частиц составит 1 х 108 суспендированных в 10 мкл). Инкубационное соотношение для антитела составляет 1:50 (1 мкл 1:5 антитела) в этом случае.
- Используйте более трех различных концентраций антител или красителя во время оптимизации, чтобы предоставить данные, указывающие на то, что протокол позволяет обеспечить максимальное связывание эпитопа без перенасыщения выбранной метки, что может ухудшить идентификацию событий флуоресценции низкой интенсивности. Инкубационная концентрация мембранного красителя составляет 40 нМ (1 мкл 400 нМ).
- Смешайте образец объемом 10 мкл путем вихря в течение 5 с и инкубируйте на RT в течение 30 мин в темноте.
ПРИМЕЧАНИЕ: В обсуждение включены рекомендации по мерам контроля. - После инкубации берут 1 мкл меченого образца и разбавляют 1:50 в PBS в пробирке объемом 0,6 мл.
- Загрузите образец в загрузочный отсек и примените давление наддува в течение 45 с. Убедитесь, что настройки лазера верны и соответствующие линзы загружены.
- Переключитесь на давление отбора проб и выберите Время записи. После получения за 1 минуту назовите файл данных и сохраните.
- Выгрузите образец и замените его чистящим раствором. Увеличьте его на >30 с перед загрузкой следующего помеченного образца.
4. анализ nFCM-генерация PDF для анализа субпопуляций
- Для генерации PDF применяйте те же стандарты, что и ранее; только пустое измерение будет установлено по-другому.
- Выберите образец файла и задайте пороговое значение. На точечном графике измените ось Y, чтобы отобразить измерения FL из зеленого или красного канала.
- Выберите инструмент квадратного затвора и щелкните левой кнопкой мыши, чтобы нарисовать квадрат вокруг популяции FL+.
- Откройте пустой файл измерения и нажмите «Установить пустой», прежде чем вернуться к файлу образца.
- Откройте инструмент создания PDF, как и раньше, и для подпопуляции FL+ будут определены распределение размеров, концентрация и процент (по сравнению со всеми событиями SS+).
- Повторите для каждой субпопуляции интереса, обозначенной как «Всего, P1, P2 и т. Д.».
Результаты
Презентация тетраспанина на электромобилях, полученных из SW620, и ev, полученных из C2C12
Современный анализ обилия ключевых тетраспанинов CD9, CD63 и CD81 на электромобилях из различных источников выявил крайнюю изменчивость их присутствия, как в объемном анализе, так и при анализе их представления о субпопуляциях EV21. Это, вероятно, связано с наличием различных путей биогенеза, таких как ESCRT-зависимые и независимые пути22.
CD9 был представлен на наибольшем проценте электромобилей C2C12 на уровне ~50%, а презентация CD63 - только на ~30%, на рисунке 1. Когда маркировку проводили всеми тремя антитетраспанинами в одной инкубации, было показано, что ~70% частиц представляют, по меньшей мере, один из маркеров EV. Повторные измерения показали самое низкое стандартное отклонение для маркировки CD9/63/81 электромобилей C2C12 на уровне ~ 3,8%, в то время как это было ~ 8,1% для CD81 с маркировкой C2C12 EV.
Электромобили, полученные из SW620, показали другой профиль тетраспанина, с гораздо большей разницей между наиболее представленным CD9 на ~ 40% и наименее представленным CD63 на ~ 7%. Подобно C2C12 EV, CD9 присутствовал на большинстве тетраспанин-положительной популяции, поскольку комбинированная маркировка CD9/63/81 идентифицировала ~ 42% частиц как имеющих, по крайней мере, один из трех маркеров.
Большинство частиц, полученных из C2C12, общая популяция SS+, варьировались в размерах от 45 до 120 нм, со средним диаметром ~ 65 нм. Профили размеров для каждого из одиночных тетраспанинов, меченных EV-субпопуляциями, показанные на рисунке 1, аналогичны друг другу, показывая больший медианный размер ~ 75-85 нм и меньше <65 нм EV по сравнению с общей популяцией частиц.
Производные частицы SW620 варьировались между 45-160 нм со средним размером ~ 65 нм, показывая искаженное распределение. Тетраспанин, меченый EV, показывает более нормальное распределение и больший медианный диаметр между 90-110 нм, с аналогичным распределением между отдельными тетраспанин-положительными субпопуляциями.
В то время как наиболее и наименее представленные тетраспаны одинаковы для этих двух клеточных линий, их пропорциональное представление сильно отличается, и существует интересная разница между потенциальным совместным представлением тетраспанинов, наблюдаемым из разницы в позитивности CD9 и позитивностью CD9/63/81.
Сочетание маркировки мембраны EV с маркировкой антител
Двухслойная мембрана EV обеспечивает более общую мишень для маркировки, которая может позволить проводить различие между частицами аналогичного размера, не относящимися к EV, такими как белковые агрегаты и некоторые формы ЛПНП с липидными монослоями23. Специфичность этого типа маркировки должна быть подтверждена, поскольку было показано, что некоторые распространенные мембранные красители, используемые в исследованиях EV, связываются с частицами, не относящимися к EV, а также24.
Мембранная маркировка неоднократно показывала ~ 80% позитивности электромобилей, полученных из C2C12, и EV SW620. Интенсивность SS (SS-H) показывает хорошую корреляцию с интенсивностью FITC на точечных графиках результатов C2C12 и SW620, показанных на рисунке 2. Это ожидается, поскольку интенсивность SS зависит от размера частиц и, следовательно, площади поверхности мембраны.
Большинство ev, меченных антителами, также были положительными для мембранной маркировки, показывая двойной положительный процент (FITC + и APC +), очень похожий на положительный процент тетраспанина. Точечные графики FITC и APC показывают небольшую корреляцию между маркировкой мембраны и тетраспанина с маркировкой CD63, которая, по-видимому, показывает самую слабую корреляцию с мембранной маркировкой. Было обнаружено несколько событий, которые были положительными для маркировки антител, но отрицательными для мембранной маркировки.
Воспроизводимость, эффективность двойной маркировки и альтернативные выходы данных
Важным соображением при разработке экспериментов nFCM является флуорофор или интерактивность меток. На рисунке 3а показано, что повторение маркировки антител с дополнительной мембранной маркировкой и без нее приводит к очень похожим измерениям % положительности. В частности, маркировка SW620 показывает очень мало различий между двумя наборами измерений. Это показывает ограниченную интерференцию между связыванием красителя и антител, а также подчеркивает хорошую воспроизводимость при повторении маркировки EV.
Измерения интенсивности, как бокового рассеяния, так и флуоресценции, могут быть экспортированы, чтобы превзойти для каждой отдельной измеренной частицы. Исходя из этого, мы можем генерировать измерения средней интенсивности флуоресценции (MFI), чтобы обеспечить сравнительные приближения к изобилию нашей меченой цели. MFI для флуоресцентных популяций электромобилей, полученных из C2C12, предполагают несколько более низкое представление CD63 и CD81 с измерениями MFI ~ 550 и ~ 600 соответственно, по сравнению с ~ 850 MFI, наблюдаемым для CD9 + EV. Единицами измерения для МФО в данном случае являются FL-A и не стандартизированы по флуоресцентной калибровке. Использование всех трех антител не вызывает гораздо большей флуоресценции, чем просто маркировка CD9. Это сильно отличается от измерений SW620 MFI, которые показывают, что использование коктейля из всех трех антител обеспечивает больший флуоресцентный сигнал для меченых EV, чем использование любой отдельной метки антитела.
Гистограммы распределения по размерам, созданные программным обеспечением NanoFCM, также могут быть экспортированы в Excel, что позволяет накладывать тройные наборы данных. Профили распределения размеров на рисунке 3 аналогичны профилям на рисунке 1 , но содержат полосы ошибок. Медианный размер EV тетраспанин-положительных субпопуляций в ev, полученных C2C12, показывает медиану около 70 нм, что немного больше, чем среднее значение 60 нм от общей популяции частиц. SW620 EV положительные для маркеров тетраспанина больше, показывая пики при ~ 100 нм.
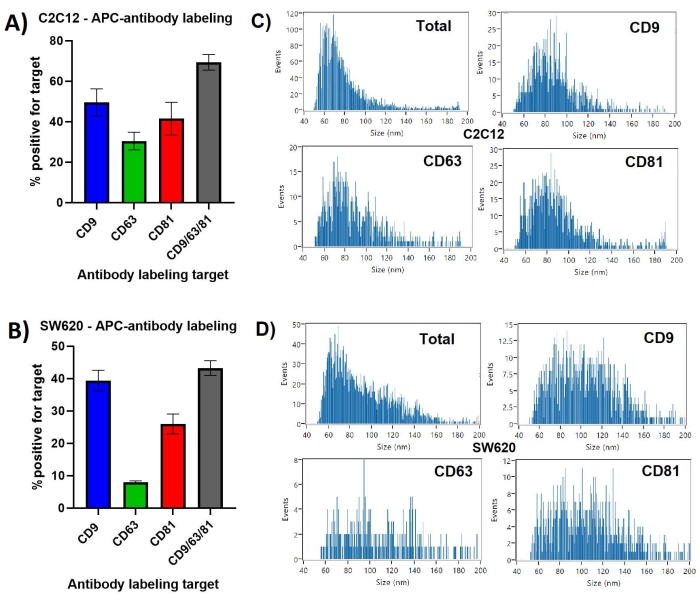
Рисунок 1: CD9, CD63, CD81 положительные субпопуляции EV, идентифицированные маркировкой антител. (A) Гистограмма, показывающая процент меченых EV по сравнению с общими частицами, наблюдаемыми SS для EV, полученных из C2C12. (B) Линейчатая диаграмма, показывающая процентное соотношение меченых EV по сравнению с общим количеством частиц, наблюдаемых SS для электромобилей, полученных из SW620. (C) Репрезентативные профили распределения размеров для электромобилей, производных от C2C12. Каждая гистограмма берется из PDF-файлов, созданных для первого измерения тройных наборов данных. (D) Репрезентативные профили распределения размеров для электромобилей, производных от SW620. Каждая гистограмма берется из PDF-файлов, созданных для первого измерения тройных наборов данных. Полосы погрешностей представляют собой стандартное отклонение трех измерений одних и тех же маркированных образцов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
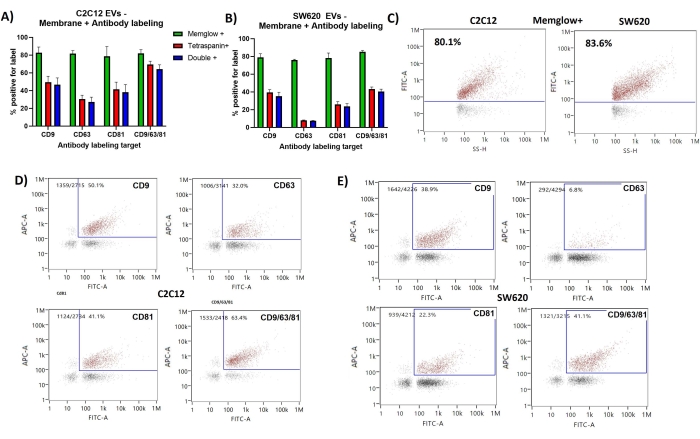
Рисунок 2: Мембранная маркировка и маркировка антител CD9, CD63, CD81, представляющих субпопуляции EV. (A) Гистограмма, показывающая Membrane+ %, тетраспанин + % и double + % для C2C12 EV. (B) Линейчатая диаграмма, показывающая Мембрана+%, тетраспанин+ % и двойной+ % для электромобилей SW620. (C) Репрезентативные точечные графики SS и FITC, показывающие разрыв для популяции, положительной на мембране. (D) Репрезентативные диаграммы FITC против APC, показывающие двукратное положительное количество электромобилей от C2C12. (E) Репрезентативные точечные графики FITC и APC, показывающие двойную положительную популяцию электромобилей из SW620. Полосы погрешностей представляют собой стандартное отклонение трех измерений одних и тех же маркированных образцов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
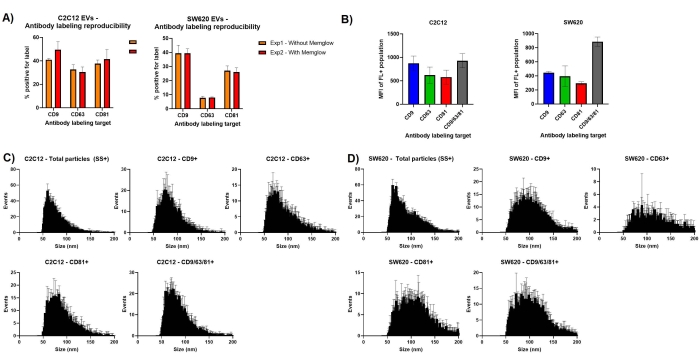
Рисунок 3: Оценка вариаций в повторных измерениях. (A) Гистограммы, показывающие% положительности маркировки антител с дополнительной мембранной маркировкой и без нее. (B) Измерения средней интенсивности флуоресценции для закрытых подмножеств EV. (C) Гистограммы усредненного распределения по размерам для тройных наборов данных для электромобилей C2C12. (D) Усредненные гистограммы распределения по размерам для тройных наборов данных для электромобилей SW620. Полосы погрешностей представляют собой стандартное отклонение трех измерений одних и тех же маркированных образцов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Детали образцов и реагентов
Два изолята EV из отдельных клеточных линий были выбраны для демонстрации флуоресцентной маркировки и последующего анализа nFCM. Оба набора EV были приостановлены в PBS и хранились при -80 ° C в течение <3 месяцев, но большинство других условий отличались между изолятами. Клеточная линия миобласта мыши C2C12 представляет собой эмбриональный предшественник клеток скелетных мышц и была выращена в 2D-культуре, обусловливая питательную среду в течение 72 ч до выделения EV ультрацентрифугированием. SW620 представляет собой клеточную линию аденокарциномы толстой кишки человека и был выращен в рудиментарном биореакторе, обогащающем среду в течение 7 недель, с изоляцией EV, проводимой с помощью эксклюзионной хроматографии (SEC) и фракций 7-9 элюированных из колонок сефарозы CL-2B, объединенных в один образец.
В то время как ev, выделенные и концентрированные из CCM, являются самыми простыми типами образцов для работы, nFCM применим к большинству изолятов EV, включая биожидкости, такие как сыворотка, плазма, моча и CSF. Эти анализы образцов выигрывают от обнаружения nFCM SS всех частиц, что позволяет подтверждать их анализом NTA, TRPS и другими частицами, описывая флуоресцентно меченые субпопуляции EV в количественном выражении, а также долю от общего числа, для непредвзятого подхода к анализу многопараметрических частиц. Анализ образцов с низкой степенью обработки также возможен, таких как неочищенная моча и обогащенный EV CCM с оговоркой о необходимости низкого содержания загрязняющего белка.
Мембранный краситель, используемый здесь, предназначен для интеграции в липидный бислой, с липофильным фрагментом для мембранной нагрузки и гидрофильным красителем для пребывания в плазматической мембране25. В настоящее время не существует идеального красителя для маркировки электромобилей, и при выборе необходимо учитывать несколько критериев, включая специфичность для электромобилей, пригодность с фиксацией или проникновением и эффективность маркировкиEV 26.
Флуоресцентная конъюгированная маркировка антител поверхностных эпитопов оказалась эффективным методом идентификации субпопуляций EV27. Ключевым аспектом оптимизации протокола является соблюдение и не превышение точки насыщения маркировки для связывания со всеми доступными эпитопами без ингибирования обнаружения частиц с низкой флуоресценцией, позволяя заполнению окружающего буфера флуоресцентным несвязанным антителом28. Кроме того, наличие открытых сайтов связывания для маркировки антител потенциально зависит от нескольких факторов. Было показано, что условия хранения EV влияют на профили концентрации и размера EV29 с наблюдениями, также указывающими на влияние на маркировку антител30. Присутствие поверхностных белков короны, модификации белка и влияние методов выделения также могут оказывать влияние на маркировку антител в некоторых случаях. В конечном счете, поскольку использование флуоресцентной маркировки становится все более распространенным для исследований электромобилей, экспериментальное проектирование и оптимизация для нескольких аналитических методов станут более совершенными.
Для повышения точности результатов могут быть включены несколько контрольных элементов, таких как (1) контроль PBS + красителя, для оценки образования мицелл или агрегатов в некоторых красителях, которые могут появляться в виде частиц SS + в анализе nFCM, (2) PBS + контроль антител, агрегаты могут возникать, хотя часто недостаточно большие, чтобы рассеивать достаточно света для обнаружения SS, (3) образец EV + контроль антител IgG, распространенный в проточной цитометрии и используемый для идентификации любого неспецифического связывания, (4) образец частиц без EV + контроль антител / красителя - особенно важен при необходимости идентификации EV в сложных образцах частиц, такие элементы контроля, как очищенные частицы липопротеинов низкой плотности (ЛПНП) или образцы с обедненными / абляционными образцами EV, могут выступать в качестве отрицательного контроля для проверки селективной маркировки, (5) положительные контрольные элементы управления трудно спроектировать, но валидация антитела на клетках является полезным включением.
Презентация тетраспанинов на электромобилях
Маркировка антител и мембран этого эксперимента демонстрирует высокий уровень количественных данных, которые могут быть получены в небольшой промежуток времени путем анализа nFCM. Одновременное измерение ключевых физических атрибутов диаметра/концентрации частиц с фенотипическими измерениями присутствия мембраны и/или белка приводит к высокоуровневым описаниям субпопуляций в изоляции частиц.
Важно отметить, что различные уровни трех «ключевых» тетраспанинов, связанных с EV, CD9, CD63, CD81, были идентифицированы в этих двух образцах EV. CD9 был представлен на наибольшей доле EV как для EV, полученных из C2C12, так и для SW620, причем CD81 и CD63 являются вторыми и наименее представленными белками соответственно.
Несмотря на некоторые сходства, наблюдаемые здесь в тетраспаниновых профилях EV из двух очень разных клеточных источников, уровни CD9, CD63 и CD81 могут сильно различаться между клеточной линией и полученными от пациента EV31.
Разница в выражении CD63 между двумя образцами EV особенно актуальна для продолжающегося обсуждения ключевых идентификаторов «EV-ness». В то время как представление CD63 только в ~ 8% электромобилей SW620 может быть неожиданным для некоторых, CD63 был предложен в качестве плохого идентификатора различных типов EV, выделенных по размеру или плотности32, и тетраспанин отрицательные EV были идентифицированы, даже если они описаны как экзосомоподобные33.
Идентификация электромобилей в сложных изоляциях частиц
Гетерогенность профилей тетраспанина EV, как в клеточной линии, так и в EV, полученных от пациентов, предостерегает от зависимости от захвата EV на основе тетраспанина и подчеркивает будущую потребность в новых методах идентификации EV31. Маркировка EV независимо от конкретных белков может оказаться очень полезной для идентификации EV из частиц аналогичного размера, не относящихся к EV, если можно доказать, что специфичность EV очень высока. Это особенно верно для изолятов биожидких EV, поскольку было высказано предположение, что концентрация EV в плазме крови человека находится в диапазоне 1010 частиц / мл, в то время как липопротеины измеряются на уровне 1016 на мл14,34. Даже при обогащении EV исследования, сравнивающие положительность частиц для маркеров тетраспанина и / или маркера ЛПНП ApoB, предполагают ~ 50-100 раз большее содержание ЛПНП в образцах плазмы без тромбоцитов (PFP) по сравнению с EV35.
Используемый метод изоляции значительно влияет на диапазон совместно изолированных частиц, не связанных с EV, таких как липопротеины очень низкой плотности (VLDL), липопротеины средней плотности (IDL) иLDL 36. Существуют также описания коизолятов липопротеинов, связанных с EV, которые, хотя потенциально играют важную биологическую роль, делают достижение чистых образцов EV сложной целью35.
Поэтому можно утверждать, что больше внимания следует уделять описанию частиц, составляющих образец, а не достижению изоляции чистого, но ограниченного выбора электромобилей. Достижение всестороннего описания частиц путем измерения содержания тетраспанина в объеме и количества частиц по отдельности может быть недостаточным для точного определения концентраций EV, особенно из источников биотекучейжидкости 36,37. Идентификация субпопуляций в многоуровневом подходе, показывающая общие частицы, EV и EV, представляющие определенные белки, как показано в этом эксперименте, может обеспечить надежное решение для характеристики наночастиц. Это относится к проектам, связанным с загрузкой электромобилей с конструкциями для будущих терапевтических применений20 и идентификацией CD63 + EV с просветным грузом, таким как митохондрии38.
nFCM в репертуаре EV аналитики
Сильной стороной анализа nFCM EV является то, как данные могут подтверждать и основываться на наиболее распространенных анализах EV и формировать мосты между физическими и фенотипическими наборами данных. Тем не менее, это основано на точных протоколах маркировки, которые часто необходимо оптимизировать для уникальных реагентов маркировки, таких как красители и антитела. Ключевым критерием для точного анализа является наличие меченых частиц, взвешенных в нефлуоресцентном буфере, который опирается либо на удаление избытка несвязанного флуорофора, либо на уточнение протоколов, чтобы не превышать насыщение эпитопом.
Сравнительные исследования показали, что nFCM калибровка электромобилей обеспечивает данные в соответствии с TRPS и крио-ТЭМ, методами, которые описываются как более точные, чем NTA для анализа размера EV10,39. Однако, как и в случае с любым оптическим методом, влияние гетерогенных оптических свойств, наблюдаемых для электромобилей, и различия между оптическими свойствами эталонного материала и ev должны быть признаны при интерпретации данных10.
Вестерн-блоттинг был ключевым методом для индикации обогащения EV путем идентификации маркеровEV 40. Но желание продемонстрировать присутствие таких маркеров на частицах привело к прогрессу в цитометрическом анализе потока на основеEV17. Однако необходимые разрешения для предоставления надежных данных в настоящее время лучше всего достигаются с помощью специальных приборов в отношении как рассеянного, так и флуоресцентного света19.
nFCM обеспечивает непредвзятый подход к первоначальному описанию всех частиц, не имеющих отношения к конкретным маркерам, с использованием измерения бокового рассеяния, что позволяет подтвердить наиболее распространенные методы NTA, RPS и TEM1, одновременно добавляя фенотипические измерения, аналогичные WB или Elisa в количественном виде.
Раскрытие информации
A.L., B.P., D.A., R.L, R.T являются сотрудниками NanoFCM, и их вклад в эту статью был сделан в рамках их занятости.
Благодарности
Мы хотели бы поблагодарить группы Оуэна Дэвиса и Ника Пика за то, что они продолжают предоставлять материалы и опыт.
Материалы
| Name | Company | Catalog Number | Comments |
| APC Anti-CD81 antibody (M38) | abcam | ab233259 | Anti-Human CD81 APC conjugated antibody |
| APC Anti-CD9 antibody (EM-04) | Abcam | ab82392 | Anti-mouse CD9 APC conjugated antibody |
| APC Anti-CD9 antibody (MEM-61), prediluted | abcam | ab82389 | Anti-Human CD9 APC conjugated antibody |
| APC anti-mouse CD63 antibody | biolegend | 143905 | Anti-Mouse CD63 APC conjugated antibody |
| APC anti-mouse/rat CD81 antibody | biolegend | 104909 | Anti-Mouse CD81 APC conjugated antibody |
| CD63 monoclonal antibody (MEM-259), APC | invitrogen Via Fisherscientific | A15712 | Anti-Human CD63 APC conjugated antibody |
| Celline AD1000 bioreactor | Merck | Z688037-5EA | |
| Cleaning solution | NanoFCM | 17159 | In house cleaning solution for nanoanalyser |
| EVs from C2C12 | Gifted | Mouse line | |
| EVs from SW620 | Gifted | Human line | |
| Memglow - Fluorogenic Membrane Probe | Cytoskeleton | MG01 | non toxic cell membrane dye |
| NanoAnalyzer | NanoFCM | nano-flow cytometer for measurement of single particles | |
| PBS, pH 7.2 | Gibco Via Fisherscientific | 12549079 | Salt solution for dilution of samples and antibodies |
| Snaplock Microtubes, 0.60mL | Axygen Via Fisherscientific | 11371944 | Tubes required to load sample into nanoanalyser |
Ссылки
- Couch, Y., et al. A brief history of nearly EV-erything - The rise and rise of extracellular vesicles. Journal of Extracellular Vesicles. 10 (14), 12144(2021).
- Doyle, L. M., Wang, M. Z. Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosome isolation and analysis. Cells. 8 (7), 727(2019).
- Grant, L. R., Milic, I., Devitt, A. Apoptotic cell-derived extracellular vesicles: structure-function relationships. Biochemical Society Transactions. 47 (2), 509-516 (2019).
- Rontogianni, S., et al. Proteomic profiling of extracellular vesicles allows for human breast cancer subtyping. Communications Biology. 2, 325(2019).
- Sahoo, S., et al. Therapeutic and diagnostic translation of extracellular vesicles in cardiovascular diseases. Circulation. 143 (14), 1426-1449 (2021).
- Chiang, C. -Y., Chen, C. Toward characterizing extracellular vesicles at a single-particle level. Journal of Biomedical Science. 26 (1), 9(2019).
- Karimi, N., et al. Detailed analysis of the plasma extracellular vesicle proteome after separation from lipoproteins. Cellular and Molecular Life Sciences. 75 (15), 2873-2886 (2018).
- Akers, J. C., et al. Comparative analysis of technologies for quantifying Extracellular Vesicles (EVs) in Clinical Cerebrospinal Fluids (CSF). PLOS ONE. 11 (2), 0149866(2016).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8 (1), 1596016(2019).
- Vogel, R., et al. Measuring particle concentration of multimodal synthetic reference materials and extracellular vesicles with orthogonal techniques: Who is up to the challenge. Journal of Extracellular Vesicles. 10 (3), 12052(2021).
- Van Der Pol, E., et al. Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy, flow cytometry, nanoparticle tracking analysis, and resistive pulse sensing. Journal of Thrombosis and Haemostasis. 12 (7), 1182-1192 (2014).
- Hartjes, T. A., Mytnyk, S., Jenster, G. W., Van Steijn, V., Van Royen, M. E. Extracellular vesicle quantification and characterization: Common methods and emerging approaches. Bioengineering. 6 (1), 7(2019).
- Zhao, Z., Wijerathne, H., Godwin, A. K., Soper, S. A. Isolation and analysis methods of extracellular vesicles (EVs). Extracellular Vesicles and Circulating Nucleic Acids. 2, 80-103 (2021).
- Johnsen, K. B., Gudbergsson, J. M., Andresen, T. L., Simonsen, J. B. What is the blood concentration of extracellular vesicles? Implications for the use of extracellular vesicles as blood-borne biomarkers of cancer. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1871 (1), 109-116 (2019).
- Zhu, S., et al. Light-scattering detection below the level of single fluorescent molecules for high-resolution characterization of functional nanoparticles. ACS Nano. 8 (10), 10998-11006 (2014).
- Van Der Pol, E., et al. Standardization of extracellular vesicle measurements by flow cytometry through vesicle diameter approximation. Journal of Thrombosis and Haemostasis. 16 (6), 1236-1245 (2018).
- Lucchetti, D., et al. Measuring extracellular vesicles by conventional flow cytometry: dream or reality. International Journal of Molecular Sciences. 21 (17), 6257(2020).
- Suárez, H., et al. A bead-assisted flow cytometry method for the semi-quantitative analysis of Extracellular Vesicles. Scientific Reports. 7 (1), 11271(2017).
- Tian, Y., et al. Protein profiling and sizing of extracellular vesicles from colorectal cancer patients via flow cytometry. ACS Nano. 12 (1), 671-680 (2018).
- Silva, A. M., et al. Quantification of protein cargo loading into engineered extracellular vesicles at single-vesicle and single-molecule resolution. Journal of Extracellular Vesicles. 10 (10), 12130(2021).
- Dragovic, R. A., Southcombe, J. H., Tannetta, D. S., Redman, C. W. G., Sargent, I. L. Multicolor flow cytometry and nanoparticle tracking analysis of extracellular vesicles in the plasma of normal pregnant and pre-eclamptic women. Biology of Reproduction. 89 (6), 151(2013).
- Teng, F., Fussenegger, M. Shedding light on extracellular vesicle biogenesis and bioengineering. Advanced Science. 8 (1), 2003505(2021).
- Laulagnier, K., et al. Mast cell- and dendritic cell-derived exosomes display a specific lipid composition and an unusual membrane organization. Biochemical Journal. 380, 161-171 (2004).
- Simonsen, J. B. Pitfalls associated with lipophilic fluorophore staining of extracellular vesicles for uptake studies. Journal of Extracellular Vesicles. 8 (1), 1582237(2019).
- Collot, M., et al. MemBright: A family of fluorescent membrane probes for advanced cellular imaging and neuroscience. Cell Chemical Biology. 26 (4), 600-614 (2019).
- Takov, K., Yellon, D. M., Davidson, S. M. Confounding factors in vesicle uptake studies using fluorescent lipophilic membrane dyes. Journal of Extracellular Vesicles. 6 (1), 1388731(2017).
- Tian, Y., et al. Quality and efficiency assessment of six extracellular vesicle isolation methods by nano-flow cytometry. Journal of Extracellular Vesicles. 9 (1), 1697028(2020).
- Mondal, A., Ashiq, K. A., Phulpagar, P., Singh, D. K., Shiras, A. Effective visualization and easy tracking of extracellular vesicles in glioma cells. Biological Procedures Online. 21, 4(2019).
- Gelibter, S., et al. The impact of storage on extracellular vesicles: A systematic study. Journal of Extracellular Vesicles. 11 (2), 12162(2022).
- Jayachandran, M., Miller, V. M., Heit, J. A., Owen, W. G. Methodology for isolation, identification and characterization of microvesicles in peripheral blood. Journal of Immunological Methods. 375 (1-2), 207-214 (2012).
- Mizenko, R. R., et al. Tetraspanins are unevenly distributed across single extracellular vesicles and bias sensitivity to multiplexed cancer biomarkers. Journal of Nanobiotechnology. 19 (1), 250(2021).
- Kowal, J., et al. Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes. Proceedings of the National Academy of Sciences of the United States of America. 113 (8), 968-977 (2016).
- Laulagnier, K., et al. Amyloid precursor protein products concentrate in a subset of exosomes specifically endocytosed by neurons. Cellular and Molecular Life Sciences. 75 (4), 757-773 (2018).
- Simonsen, J. B. What are we looking at? Extracellular vesicles, lipoproteins, or both. Circulation Research. 121 (8), 920-922 (2017).
- Sódar, B. W., et al. Low-density lipoprotein mimics blood plasma-derived exosomes and microvesicles during isolation and detection. Scientific Reports. 6, 24316(2016).
- Brennan, K., et al. A comparison of methods for the isolation and separation of extracellular vesicles from protein and lipid particles in human serum. Scientific Reports. 10 (1), 103(2020).
- Welton, J. L., Webber, J. P., Botos, L. -A., Jones, M., Clayton, A. Ready-made chromatography columns for extracellular vesicle isolation from plasma. Journal of Extracellular Vesicles. 4, 27269(2015).
- Peruzzotti-Jametti, L., et al. Neural stem cells traffic functional mitochondria via extracellular vesicles. PLOS Biology. 19 (4), 3001166(2021).
- Arab, T., et al. Characterization of extracellular vesicles and synthetic nanoparticles with four orthogonal single-particle analysis platforms. Journal of Extracellular Vesicles. 10 (6), 12079(2021).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены