Method Article
Sıvı Kromatografisi-Tandem Kütle Spektrometrisi ile Gözyaşı Proteomiği için Bir Protein Süspansiyonu-Tutucu Numune Hazırlama
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, Schirmer şeritlerini kullanarak gözyaşı örneklerini toplamak için bir yöntemi ve non-invaziv gözyaşı proteini biyobelirteçlerini keşfetmek için entegre bir kantitatif iş akışını açıklar. Süspansiyon yakalama numunesi hazırlama iş akışı, hızlı ve sağlam gözyaşı numunesi hazırlama ve kütle spektrometrik analizine olanak tanıyarak standart çözelti içi prosedürlere göre daha yüksek peptit geri kazanım verimi ve protein tanımlaması sağlar.
Özet
Gözyaşı sıvısı, non-invaziv olarak toplanabilen, kolay erişilebilir biyosıvılardan biridir. Gözyaşı proteomikleri, çeşitli oküler hastalıklar ve durumlar için biyobelirteçleri keşfetme potansiyeline sahiptir. Süspansiyon yakalama kolonunun, aşağı akış proteomik analizinin geniş uygulaması için verimli ve kullanıcı dostu bir numune hazırlama iş akışı olduğu bildirilmiştir. Ancak, bu strateji insan gözyaşı proteomunun analizinde iyi çalışılmamıştır. Mevcut protokol, biyoinformatik analizle birleştirildiğinde hastalık biyobelirteçleri ve izleme hakkında bilgi sağlayan kütle spektrometrisi kullanılarak non-invaziv gözyaşı proteini biyobelirteç araştırması için klinik insan gözyaşı örneklerinden saflaştırılmış peptitlere kadar entegre bir iş akışını açıklamaktadır. Bir protein süspansiyonu yakalama numune preparatı uygulandı ve insan gözyaşı sıvısı analizi için evrensel, optimize edilmiş bir numune preparatı olarak hızlı, tekrarlanabilir ve kullanıcı dostu prosedürlerle gözyaşı proteomunun keşfi gösterildi. Özellikle, süspansiyon yakalama prosedürü, peptit geri kazanımı, protein tanımlaması ve daha kısa numune hazırlama süresi açısından çözelti içi numune hazırlamadan daha iyi performans gösterdi.
Giriş
Gözyaşı proteomikleri, oküler ve sistemik durumun patogenezine erişmek ve ayrıca Schirmer şeritleri kullanılarak non-invaziv gözyaşı örneği toplamanın avantajından yararlanmak içinoküler hastalıklar ve durumlar 1,2,3,4,5,6 için potansiyel biyobelirteçleri keşfetmeye dikkat çekmiştir. Yeni nesil kütle spektrometrisinin teknolojik ilerlemesi, mikrolitre ölçekli gözyaşlarında geçmişte mümkün olmayan doğruluk ve hassasiyetle protein miktar tayinini mümkün kılmıştır. Numune hazırlama yöntemleri henüz standartlaştırılmamıştır. Gözyaşı proteini biyobelirteç araştırmalarında klinik uygulamanın başarısı için sağlam ve standartlaştırılmış bir numune hazırlama iş akışı şarttır. Süspansiyon yakalama (S-Trap) numune hazırlama iş akışı, yakın zamanda geniş aşağı akış proteomik analizi için etkili ve hassas bir numune hazırlama yöntemi olarak rapor edilmiştir 7,8. Yine de, bu strateji, insan gözyaşı proteomunun analizinde iyi rapor edilmemiştir, enzimatik sindirim etkinliği ve kütle spektrometrik analizi ile daha fazla sayıda protein tanımlaması açısından filtre destekli numune hazırlama (FASP) ve çözelti içi sindirimden daha iyi performans göstermiştir9. S-Trap tabanlı yaklaşım, retina dokusu 10, formalinle sabitlenmiş, parafine gömülü (FFPE) doku 11, hücreler 12, mikroorganizma13 ve sıvı biyopsilerin14,15 hazırlanmasında gösterilmiştir.
Bu protokol, hızlı, tekrarlanabilir ve sağlam bir teknik stratejiye sahip non-invaziv bir gözyaşı proteini biyobelirteç panelinin keşfi için klinik örneklerden enzimatik olarak sindirilmiş proteine kadar entegre bir nicel iş akışını tanımlar. Kısaca, gözyaşı sıvısı standart bir Schirmer şeridi kullanılarak toplandı ve oda sıcaklığında protein otolizini önlemek için hemen oftalmik bir çerçeve ısıtıcısı ile kurutuldu. Gömülü toplam proteinler, üreticinin önerisine göre% 5 sodyum dodesil sülfat (SDS) lizis tamponu kullanılarak ekstrakte edildi ve ardından protein tahlili ölçümü yapıldı. Ekstrakte edilen lizat daha sonra ditiyotreitol (DTT) ile standart indirgeme ve iyodoasetamid (IAA) ile alkilasyona tabi tutuldu.
Fosforik asit ile asitleştirildikten sonra, agrega proteinlerine %90 metanol ve 100 mM trietilamonyum bikarbonat (TEAB) içeren süspansiyon tutucu kolon protein çökeltme tamponu ilave edildi. Numune daha sonra yeni bir süspansiyon tutucu mikro kolona aktarıldı. 1 saat boyunca 47 ° C'de 1:25 oranında (a/a, tripsin: protein) sıralama dereceli tripsin ile yapılan enzimatik sindirim. Elde edilen peptitler daha sonra santrifüjleme yoluyla, sırayla 50 mM TEAB, %0.2 sulu formik asit (FA) ve %0.2 FA içeren %50 asetonitril (ACN) ile ayrıştırıldı. Ayrıştırılan peptitler vakumla kurutuldu ve% 0.1 FA'da sulandırıldı. Peptit konsantrasyonu ölçüldü ve kütle spektrometrik analizi için 0.5 μg/μL'ye ayarlandı.
Protokol
Denekler çalışmaya katılmadan önce yazılı bilgilendirilmiş onam verdiler. Çalışma, Hong Kong Politeknik Üniversitesi İnsan Etik Komitesi tarafından onaylandı ve Helsinki Bildirgesi'nin ilkelerine bağlı kaldı.
1. İnsan gözyaşı sıvısının Schirmer şeridi ile toplanması
- Numune kontaminasyonunu önlemek için eldiven giyin ve sterilize edin.
- İç ambalajın sağlam, steril ve son kullanma tarihinin geçmemiş olduğunu kontrol edin.
- Schirmer şeridinin üst kısmını, şeridin yarım daire ucunun yanında gösterildiği gibi 0 mm işaretinde hafifçe içe doğru bükün (Şekil 1).
- Şeridin ucunu tutarak şeridi iç ambalajdan çıkarın ve 0 ila 25 mm arasındaki numune toplama alanıyla doğrudan temastan kaçının.
- Denekten yerleştirilecek şeridin konumundan başka bir yere bakmasını isteyin.
- Alt göz kapağını yavaşça aşağı çekin ve şeridin ucunu lateral kantus bölgesinin yakınındaki alt fornikse asın (Şekil 2). Aynı işlemi diğer gözde de tekrarlayın.
- Tahrişi en aza indirmek için denekten göz kapaklarını nazikçe kapatmasını isteyin.
- Yaklaşık 5 dakika boyunca gözyaşı sıvısı toplandı veya tercihen 15-20 mm gözyaşı örneği alındı.
- Denekten her iki gözünü de açmasını, alt göz kapağını nazikçe aşağı çekmesini ve şeritleri konudan çıkarmasını isteyin.
- Schirmer şeridindeki hidratlı uzunluğu inceleyin ve toplanan miktarı mm cinsinden kaydedin.
- Sıvı tamamen kuruyana kadar şeridi standart, temiz bir çerçeve ısıtıcısıyla kurutun.
NOT: Filtre kağıdını kömürleştirebilecek aşırı ısınmadan kaçınılmalıdır. - Her kurutulmuş Schirmer şeridini etiketli bir kriyotüpe yerleştirin ve daha fazla işleme kadar tercihen karanlıkta serin ve kuru bir yerde saklayın.
2. Kimyasalların ve reaktiflerin hazırlanması
- Lizis Tamponu (%5 SDS, 50 mM TEAB, pH 7.5), 20 mL
- 1 mL 1 M TEAB ve 80 μL %12 fosforik asit pipetleyin. Kabarcıkları çıkarmak için kısaca girdap ve sonikate. Deiyonize su ile 20 mL'ye kadar doldurun.
- 1 g SDS tartın ve çözünene kadar salınımlı çözeltiye ekleyin.
- Protein Çökeltme Tamponu (%90 metanol, 100 mM TEAB, pH 7.1), 10 mL
- 893 μL 1 M TEAB ve 92 μL deiyonize su ekleyin.
- Çözeltiye ağırlıkça 15 μL %85 fosforik asit ve 9 mL metanol ekleyin ve kısaca girdap yapın.
- Sindirim Tamponu (50 mM TEAB), 1 mL
- 50 μL 1 M TEAB ekleyin ve 1 mL'ye kadar deiyonize su ekleyin.
- 200 mM ditiyotreitol (DTT) çözeltisi, 500 μL
- 15 mg DTT tartılır ve 500 μL deiyonize suda çözülür; kısaca girdap.
NOT: Kullanmadan önce hazırlayın.
- 15 mg DTT tartılır ve 500 μL deiyonize suda çözülür; kısaca girdap.
- 400 mM iyodoasetamid (IAA) çözeltisi, 200 μL
- 15 mg IAA ağırlığında ve 200 μL deiyonize suda çözülür; kısaca girdap. NOT: Kullanmadan önce hazırlayın ve ışıktan kaçının.
- %0,2 formik asit, %50 asetonitril, 10 mL
- Deiyonize suda 10 mL %50 asetonitril hazırlayın.
- 20 μL formik asit ekleyin ve kısaca girdap yapın.
- % 0.2 formik asit çözeltisi, 10 mL
- 10 mL deiyonize suya 20 μL formik asit ekleyin ve kısaca girdap yapın.
- % 0.1 formik asit çözeltisi, 10 mL
- 10 mL deiyonize suya 10 μL formik asit ekleyin; kısaca girdap.
3. Schirmer şeridinde protein ekstraksiyonu
- Konjonktival dokuların temiz paslanmaz çelik makasla temasından kaynaklanan olası kontaminasyonu gidermek için ön ucu şeridin 0 mm işaretinin ötesinde kesin ve atın.
- Şeridi 1 mm aralıklarla 1.5 mL'lik bir mikrosantrifüj tüpüne kesin (Şekil 3).
- Mikrosantrifüj tüpüne 100 μL lizis tamponu ekleyin ve bir termomikserde 1 saat oda sıcaklığında 1.000 rpm'de girdap yapın.
- Kısa bir süre santrifüjleyin ve süpernatanı yeni bir 1.5 mL mikrosantrifüj tüpüne aktarın.
- Şeritleri temiz forseps kullanarak 200 μL'lik pipet uçlarına taşıyın. Uçları tutucu ile adım 3.4'ten itibaren aynı tüpe yerleştirin ve şerit üzerinde kalan numunenin maksimum geri kazanımı için 4.000 × g'da oda sıcaklığında 1 dakika daha santrifüjleyin.
- Bikinkoninik asit (BCA) veya uyumlu protein tahlili kullanarak protein konsantrasyonunu ölçün.
4. Süspansiyon tutucu numune hazırlama
- Protein tahlili sonucuna göre numuneleri 50 μg proteine normalleştirin.
- 20 mM DTT'lik bir nihai konsantrasyona 1:10 oranında 200 mM DTT (v/h, DTT: numune) ekleyin ve 95 °C'de 10 dakika inkübe edin.
- Protein çözeltisini oda sıcaklığına soğutun.
- 40 mM IAA'lık bir nihai konsantrasyona 1:10 oranında (h/h, IAA: numune) 400 mM IAA ekleyin ve karanlıkta oda sıcaklığında 10 dakika inkübe edin.
- %1.2 fosforik asidin nihai konsantrasyonuna 1:10 (h/h, asit: numune) oranında %12 sulu fosforik asit ekleyin ve kısaca girdap yapın.
- 1:6 oranında protein bağlayıcı tampon ekleyin (v/h, örnek: tampon) ve kısaca girdap yapın.
NOT: Bu adımda, kolloidal protein partikülü oluşturulmalıdır ve protein miktarı yeterliyse çözelti yarı saydam görünecektir. - Süspansiyon Tutucu Mikro Döndürme Kolonu kapağını açın ve akışı toplamak için döndürme kolonunu 2 mL'lik bir mikrosantrifüj tüpüne monte edin.
- Kolona 200 μL'ye kadar asitlendirilmiş protein lizat karışımı ekleyin.
- Kolonu 20 saniye boyunca 4.000 × g'da santrifüjleyin. Protein partikülleri hapsedildi; Örnekler sütuna yüklenene kadar tekrarlayın.
- 150 μL protein bağlayıcı tampon ekleyin ve askıdaki proteini yıkamak için 20 saniye boyunca 4.000 × g'da santrifüjleyin. 3x tekrarlayın.
- Süspansiyon Tutucu Mikro Kolonu yeni bir 1.5 mL mikrosantrifüj tüpüne monte edin.
- Spin kolonunun içindeki filtreye 1:25 oranında proteaz içeren 20 μL 50mM TEAB sindirim tamponu ekleyin (a/a, tripsin: protein) filtre ile sindirim solüsyonu arasındaki kabarcıkları ve hava boşluğunu önleyin.
- Buharlaşmayı önlemek için Süspansiyon Tutucu Mikro Döndürme Sütununu kapatın. Bir termomikserde 47 °C'de 1 saat inkübe edin; Sindirim sırasında sallamayın veya girdap yapmayın.
- 20 saniye boyunca 4.000 × g'da merkezkaç kuvveti ile 40 μL 50 mM TEAB ile elute peptitler.
- 40 μL% 0.2 FA ekleyin ve 20 saniye boyunca 4.000 × g'da santrifüjleyin.
- 35 μL %0.2 FA, %50 asetonitril ekleyin ve 20 saniye boyunca 4.000 × g'da santrifüjleyin.
- Havuz üç elüasyon yapar ve bir vakum santrifüjü ile kurutur.
- Daha fazla analize kadar -80 °C ultra düşük sıcaklıktaki dondurucuda saklayın. NOT: Protokol burada duraklatılabilir.
5. Kütle spektrometrisi analizi için peptitleri sulandırın
- Numuneyi 12 μL% 0.1 FA, vorteks ve santrifüj ile kısaca sulandırın.
- Peptit konsantrasyonunu bir Peptit Test Kiti ile ölçün.
- Peptit konsantrasyonunu% 0.1 FA'da 0.5 μg / μL'ye normalleştirin.
- Peptit karışımını bir otomatik örnekleyici şişesine aktarın ve kütle spektrometrisi analizi için hazır hale getirin.
6. Sıvı Kromatografisi-Tandem Kütle Spektrometrisi ile Numune Alımı
- İzokratik yükleme tamponu (% 0.1 FA,% 5 ACN) ile 3 μg peptidi, 15 dakika boyunca 2 μL / dak'lık bir akış hızında bir tuzak kolonuna (C18, 5 μm, 100 μm, 20 mm) yükleyin.
- Peptitleri, 155 dakikalık bir ayırma gradyanında 350 nL / dak'lık bir akış hızında ters fazlı bir nano analitik kolon (C18, 5 μm, 100 μm, 300 mm) kullanarak fraksiyonlayın. Suda %0,1 formik asit (h/v), %5 ACN (h/v) karışımından oluşan mobil faz A ve suda %0,1 FA (h/v), %98 ACN (h/v) içeren mobil faz B kullanın. Aşağıdaki gradyanı kullanın: 0-0,5 dk: %5 B, 0,5-90 dk: %10 B, 90-120 dk: %20 B, 120-130 dk: %28 B, 130-135 dk: %45 B, 135-141 dk: %80 B, 141-155 dk: %5 B.
- 350 ila 1800 m/z arasında bir TOF-MS tarama aralığıyla, 250 ms'lik bir biriktirme süresi ve 18 s'lik bir dinamik hedef dışlama süresiyle veriye bağlı toplama (DDA) gerçekleştirin. Ardından, +2 ila +4 arasında bir şarj durumuna sahip MS/MS sinyali için 125 cps eşiği ile döngü başına ilk 50 öncü için 50 ms'lik bir biriktirme süresiyle yüksek hassasiyet modunda 100 ila 1.800 m/z'de bir MS/MS taraması gerçekleştirin.
- Ham verileri, referans verilen yazılımla veya diğer uyumlu motorlarla genel olarak erişilebilen UniProt veritabanından FASTA'daki bir referans veritabanıyla analiz edin.
Sonuçlar
Bu protokol, kütle spektrometrisi analizi için müteakip numune hazırlamadan önce oda sıcaklığında kuru olarak saklanan Schirmer Şeritleri ile gözyaşı numunesi alınmasına izin verir. Süspansiyon tutuculu mikro kolonlu filtre destekli numune hazırlama (FASP) iş akışı, gece boyunca inkübasyon gerektiren günler içinde yaygın olarak benimsenen çözelti içi parçalama prosedürlerine kıyasla saatler içinde hızlı numune hazırlamaya olanak sağladı. Peptit geri kazanım verimi, standart çözelti içi sindirim protokolünden önemli ölçüde daha yüksekti (p < 0.001) ve %7'< bir varyasyon katsayısında iyi tekrarlanabilirlik ile. Çözelti içi prosedürlerle hazırlanan örneklerde %74.2 ± %5.0 peptit geri kazanımı ve %52.8 ± %1.6 peptit geri kazanımı ile altı teknik kopyada bir gözyaşı numunesi havuzu tekrarlandı. Protein miktarı 36.3 μg olan havuzlanmış bir gözyaşı numunesi Schirmer şeridine çivilendi ve daha önce tarif edildiği gibi ekstrakte edildi, proteinin ekstraksiyon verimliliği% 81 idi (29.5 ± 6.8 μg, ortalama ± SD).
Her iki iş akışı da MS'ye 3 μg peptit yükledi ve DDA araması, süspansiyon yakalama grubunda ve çözelti içi grupta sırasıyla% 1 FDR'de toplam 1.183 ± 118 protein (5.757 ± 537 farklı peptit) ve 874 ± 70 protein (4.400 ± 328 peptit) verdi. PANTHER sınıflandırma sistemi kullanılarak gen ontolojisinin (GO) analizi, her iki yaklaşım için de çok benzer proteomlar ortaya çıkardı ve bunların ana moleküler işlevleri bağlanma, katalitik aktivite ve moleküler fonksiyon regülasyonu oldu (Şekil 4).

Şekil 1: Uygulamadan önce Schirmer şeridinin üst kısmını 0 mm işaretinde bükün. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
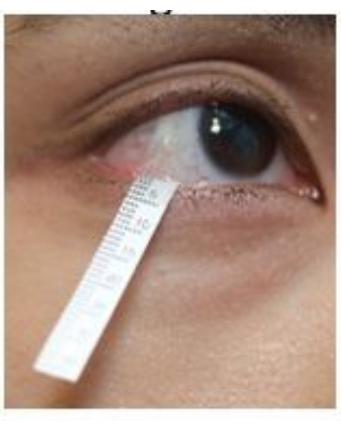
Şekil 2: Gözyaşı toplama sırasında Schirmer şeridinin konumu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
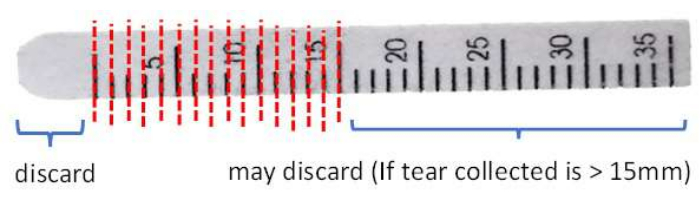
Şekil 3: Protein ekstraksiyonundan önce Schirmer şerit işlemenin gösterimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
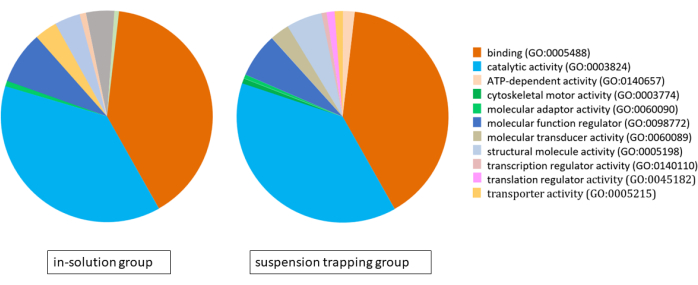
Şekil 4: PANTHER sınıflandırma sistemi kullanılarak çözelti içi iş akışı ve süspansiyon yakalama iş akışı kullanılarak tanımlanan proteomlar için gen ontolojisi analizini gösteren pasta grafiği. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu yöntemi kullanarak doğru sonuçlar elde etmek için, numune kontaminasyonunu önlemek için gözyaşı numunesi alımından tüm prosedürlerde elektriksiz tek kullanımlık eldivenler giyilmelidir. Mikro eğirme kolonları kullanarak her adımda filtre ve numune çözeltisi arasında kabarcık ve hava boşluklarından kaçınmak önemlidir. Numune hacmi kolonların kapasitesinden büyükse, işlemin tekrarlanması önerilir. Bu protokolün, hazırlık süresi, protein geri kazanımı ve toplam protein tanımlaması açısından geleneksel çözelti içi protokolden daha verimli olduğu kanıtlanmıştır. Bunun nedeni, büyük ölçüde, aseton çökeltme, sindirim ve temizleme (tuzdan arındırma) gibi birden fazla aktarım adımını içeren çözelti içi yöntemin aksine, numunelerin aynı kolon üzerinde gerekli prosedürlerin çoğundan geçmesidir ve bu da elde edilen verilerde değişiklik olasılığını artırır.
Mikrokapiler yöntem16,17 ile toplanan gözyaşı örneklerine ek olarak, süspansiyon tutuculu mikro kolonlu bu FASP iş akışı, minimum malzeme hazırlığı ve izlenecek kullanıcı dostu adımlarla Schirmer şeritleri kullanılarak toplanan gözyaşı numunesi hazırlığına hızlı ve sağlam bir şekilde olanak tanıyan alternatif bir numune hazırlama yöntemi sağlar. Bu, çözelti içi prosedürler üzerinde MS tarafından geliştirilmiş peptit geri kazanımı ve protein tanımlaması ile çoklu oküler hastalıklar veya durumlar arasında büyük kohort çalışmaları için tekrarlanabilir gözyaşı örneği hazırlanmasına izin verir. Bu güvenilir süreç, araştırma ve diğer klinik amaçlar için gözyaşı biyobelirteç örneklerinin hazırlanmasında düzenli olarak kullanılabilir. En önemlisi, yerinde toplama için minimum personel eğitimi gerektirir ve numunelerin dondurucuda saklanması ihtiyacını ortadan kaldırır. Protein otolizini ve bozulmasını en aza indirmek için numuneler yerinde kurutulur. Bu nedenle, bu, mikro kılcal tüplerin kullanılmasının aksine, aşağı akış analizini kolaylaştırmak için posta yoluyla uygun sevkiyata izin verir.
Açıklamalar
Yazarların beyan edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma InnoHK girişimi ve Hong Kong Özel İdari Bölge Hükümeti tarafından desteklenmiştir; SHARP Vision Araştırma Merkezi; ve Hong Kong Politeknik Üniversitesi'ndeki Çin Tıbbı İnovasyon Araştırma Merkezi (RCMI).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 9 mm Plastic Screw Thread Vials | Thermo Scientific | C4000-11 | |
| Acetonitrile, LCMS Grade | Anaqua | AC-1026 | |
| Centrifuge MiniSpin plus | Eppendorf | 5453000097 | |
| DL-dithiothreitol (DTT), BioUltra | Sigma-Aldrich | 43815 | |
| Eppendorf Safe-Lock Tubes, 1.5 mL | Eppendorf | 30120086 | |
| Formic acid, ACS reagent, ≥96% | Sigma-Aldrich | 695076 | |
| Frame Heater OPTIMONSUN Electronic | Breitfeld & Schliekert GmbH | 1203166 | |
| Iodoacetamide (IAA), BioUltra | Sigma-Aldrich | I1149 | |
| Methanol, HPLC Grade | Anaqua | MA-1292 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes, 2 mL | Thermo Fisher Scientific | 368632 | |
| Phosphoric acid, 85 wt.% in H2O | Sigma-Aldrich | 345245 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Fisher Scientific | 23275 | |
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Fisher Scientific | A53225 | |
| Quadrupole Time-of-Flight Mass Spectrometry | Sciex | TripleTOF 6600 | |
| Schirmer Ophthalmic Strips | Entod Research Cell UK Ltd | I-DEW Tearstrips | |
| S-Trap Micro Column | Protifi | C02-micro-80 | |
| SureSTART 9 mm Screw Caps | Thermo Scientific | CHSC9-40 | |
| Triethylammonium bicarbonate (TEAB), 1 M | Sigma-Aldrich | 18597 | |
| Ultra-performance Liquid Chromatography | Eksigent | NanoLC 400 | |
| UltraPure Sodium dodecyl sulfate (SDS) | Thermo Fisher Scientific | 15525017 |
Referanslar
- Ma, J. Y. W., Sze, Y. H., Bian, J. F., Lam, T. C. Critical role of mass spectrometry proteomics in tear biomarker discovery for multifactorial ocular diseases (Review). International Journal of Molecular Medicine. 47 (5), 83 (2021).
- Tse, J. S. H., et al. Integrating clinical data and tear proteomics to assess efficacy, ocular surface status, and biomarker response after orthokeratology lens wear. Translational Vision Science & Technology. 10 (11), 18 (2021).
- Cheung, J. K., et al. Human tear proteome dataset in response to daily wear of water gradient contact lens using SWATH-MS approach. Data in Brief. 36, 107120 (2021).
- Tse, J. S., et al. Data on assessment of safety and tear proteome change in response to orthokeratology lens - Insight from integrating clinical data and next generation proteomics. Data in Brief. 29, 105186 (2020).
- Zhan, X., Li, J., Guo, Y., Golubnitschaja, O. Mass spectrometry analysis of human tear fluid biomarkers specific for ocular and systemic diseases in the context of 3P medicine. The EPMA Journal. 12 (4), 449-475 (2021).
- Ponzini, E., et al. Mass spectrometry-based tear proteomics for noninvasive biomarker discovery. Mass Spectrometry Reviews. 41 (5), 842-860 (2022).
- HaileMariam, M., et al. S-Trap, an ultrafast sample-preparation approach for shotgun proteomics. Journal of Proteome Research. 17 (9), 2917-2924 (2018).
- Ding, H., et al. Urine proteomics: evaluation of different sample preparation workflows for quantitative, reproducible, and improved depth of analysis. Journal of Proteome Research. 19 (4), 1857-1862 (2020).
- Ludwig, K. R., Schroll, M. M., Hummon, A. B. Comparison of in-solution, FASP, and S-Trap based digestion methods for bottom-up proteomic studies. Journal of Proteome Research. 17 (7), 2480-2490 (2018).
- Sze, Y. H., et al. High-pH reversed-phase fractionated neural retina proteome of normal growing C57BL/6 mouse. Scientific Data. 8 (1), 27 (2021).
- Marchione, D. M., et al. HYPERsol: High-quality data from archival FFPE tissue for clinical proteomics. Journal of Proteome Research. 19 (2), 973-983 (2020).
- Chhuon, C., et al. A sensitive S-Trap-based approach to the analysis of T cell lipid raft proteome. Journal of Lipid Research. 61 (11), 1512-1523 (2020).
- Hayoun, K., et al. Evaluation of sample preparation methods for fast proteotyping of microorganisms by tandem mass spectrometry. Frontiers in Microbiology. 10, 1985 (2019).
- Templeton, E. M., et al. Comparison of SPEED, S-Trap, and in-solution-based sample preparation methods for mass spectrometry in kidney tissue and plasma. International Journal of Molecular Sciences. 24 (7), 6290 (2023).
- Ding, Z., Wang, N., Ji, N., Chen, Z. S. Proteomics technologies for cancer liquid biopsies. Molecular Cancer. 21 (1), 53 (2022).
- Nättinen, J., Aapola, U., Jylhä, A., Vaajanen, A., Uusitalo, H. Comparison of capillary and Schirmer strip tear fluid sampling methods using SWATH-MS proteomics approach. Translational Vision Science & Technology. 9 (3), 16 (2020).
- Bachhuber, F., Huss, A., Senel, M., Tumani, H. Diagnostic biomarkers in tear fluid: from sampling to preanalytical processing. Scientific Reports. 11 (1), 10064 (2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır