Method Article
Una preparazione del campione di intrappolamento della sospensione proteica per la proteomica lacrimale mediante cromatografia liquida-spettrometria di massa tandem
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive un metodo per la raccolta di campioni lacrimale utilizzando strisce di Schirmer e un flusso di lavoro quantitativo integrato per la scoperta di biomarcatori non invasivi delle proteine lacrimali. Il flusso di lavoro di preparazione dei campioni per intrappolamento in sospensione consente una preparazione rapida e robusta dei campioni di lacrime e l'analisi spettrometrica di massa, con conseguenti rese di recupero dei peptidi e identificazione delle proteine più elevate rispetto alle procedure standard in soluzione.
Abstract
Il liquido lacrimale è uno dei biofluidi facilmente accessibili che possono essere raccolti in modo non invasivo. La proteomica lacrimale ha il potenziale per scoprire biomarcatori per diverse malattie e condizioni oculari. La colonna di intrappolamento in sospensione è stata segnalata per essere un flusso di lavoro efficiente e facile da usare per la preparazione dei campioni per l'ampia applicazione dell'analisi proteomica a valle. Tuttavia, questa strategia non è stata ben studiata nell'analisi del proteoma lacrimale umano. Il presente protocollo descrive un flusso di lavoro integrato da campioni clinici di lacrime umane a peptidi purificati per la ricerca non invasiva di biomarcatori di proteine lacrimali utilizzando la spettrometria di massa, che fornisce approfondimenti sui biomarcatori di malattia e sul monitoraggio in combinazione con l'analisi bioinformatica. È stata applicata una preparazione del campione per l'intrappolamento delle sospensioni proteiche che ha dimostrato la scoperta del proteoma lacrimale con procedure rapide, riproducibili e di facile utilizzo, come preparazione del campione universale e ottimizzata per l'analisi del liquido lacrimale umano. In particolare, la procedura di intrappolamento in sospensione ha superato la preparazione del campione in soluzione in termini di recupero dei peptidi, identificazione delle proteine e tempi di preparazione del campione più brevi.
Introduzione
La proteomica lacrimale ha ricevuto attenzione per esplorare potenziali biomarcatori per le malattie oculari e le condizioni 1,2,3,4,5,6, per accedere alla patogenesi della condizione oculare e sistemica, nonché per sfruttare il vantaggio della raccolta non invasiva di campioni di lacrime utilizzando le strisce di Schirmer. Il progresso tecnologico della spettrometria di massa di nuova generazione ha permesso la quantificazione delle proteine in lacrime su scala microlitrimetrica con accuratezza e precisione non possibili in passato. I metodi di preparazione dei campioni non sono ancora standardizzati. Un flusso di lavoro di preparazione dei campioni solido e standardizzato è essenziale per il successo dell'applicazione clinica nella ricerca sui biomarcatori delle proteine lacrimali. Il flusso di lavoro di preparazione dei campioni per intrappolamento in sospensione (S-Trap) è stato recentemente segnalato come un metodo di preparazione del campione efficace e sensibile per un'ampia analisi proteomica a valle 7,8. Tuttavia, questa strategia non è stata ben riportata nell'analisi del proteoma lacrimale umano, ha superato la preparazione del campione assistita da filtro (FASP) e la digestione in soluzione in termini di efficienza di digestione enzimatica e il maggior numero di proteine identificate mediante analisi spettrometrica di massa9. L'approccio basato su S-Trap è stato dimostrato nella preparazione di tessuto retinico 10, tessuto fissato in formalina, incluso in paraffina (FFPE) 11, cellule 12, microrganismi13 e biopsie liquide14,15.
Questo protocollo descrive un flusso di lavoro quantitativo integrato dai campioni clinici alla proteina digerita enzimaticamente per la scoperta di un pannello di biomarcatori di proteine lacrimali non invasivo con una strategia tecnica rapida, riproducibile e robusta. In breve, il liquido lacrimale è stato raccolto utilizzando una striscia di Schirmer standard e immediatamente essiccato con un riscaldatore oftalmico per prevenire l'autolisi delle proteine a temperatura ambiente. Le proteine totali incorporate sono state estratte utilizzando un tampone di lisi di sodio dodecilsolfato (SDS) al 5% secondo il suggerimento del produttore, seguito dalla misurazione del saggio proteico. Il lisato estratto è stato poi sottoposto a riduzione standard con ditiotreitolo (DTT) e alchilazione con iodoacetammide (IAA).
Dopo l'acidificazione con acido fosforico, alle proteine aggregate è stato aggiunto un tampone di precipitazione proteica della colonna di intrappolamento in sospensione contenente il 90% di metanolo e 100 mM di bicarbonato di trietilammonio (TEAB). Il campione è stato quindi trasferito in una nuova microcolonna di intrappolamento in sospensione. Digestione enzimatica con tripsina sequenziata in rapporto 1:25 (p/p, tripsina: proteina) a 47 °C per 1 h. I peptidi risultanti sono stati quindi eluiti tramite centrifugazione, in sequenza con 50 mM di TEAB, 0,2% di acido formico acquoso (FA) e 50% di acetonitrile (ACN) contenente lo 0,2% di FA. I peptidi eluiti sono stati essiccati sotto vuoto e ricostituiti in FA allo 0,1 %. La concentrazione del peptide è stata misurata e regolata a 0,5 μg/μL per l'analisi spettrometrica di massa.
Protocollo
I soggetti hanno fornito il consenso informato scritto prima di partecipare allo studio. Lo studio è stato approvato dal Comitato Etico Umano dell'Università Politecnica di Hong Kong e ha aderito ai principi della Dichiarazione di Helsinki.
1. Raccolta del liquido lacrimale umano con la striscia di Schirmer
- Indossare guanti e disinfettare per evitare la contaminazione del campione.
- Verificare che la confezione interna sia integra, sterile e non scaduta.
- Piegare leggermente la parte superiore della striscia di Schirmer verso l'interno in corrispondenza del segno di 0 mm, come indicato vicino alla punta a semicerchio della striscia (Figura 1).
- Rimuovere la striscia dalla confezione interna tenendola per l'estremità ed evitare il contatto diretto con l'area di raccolta del campione da 0 a 25 mm.
- Chiedi al soggetto di distogliere lo sguardo dalla posizione della striscia da posizionare.
- Abbassare delicatamente la palpebra inferiore e agganciare l'estremità della striscia nel fornice inferiore vicino alla regione laterale del canto (Figura 2). Ripetere la stessa procedura sull'altro occhio.
- Chiedi al soggetto di chiudere delicatamente le palpebre per ridurre al minimo l'irritazione.
- Raccogliere il liquido lacrimale per circa 5 minuti o preferibilmente è stato raccolto un campione lacrimale di 15-20 mm.
- Chiedi al soggetto di aprire entrambi gli occhi, abbassa delicatamente la palpebra inferiore e rimuovi le strisce dal soggetto.
- Ispezionare la lunghezza idratata sulla striscia di Schirmer e registrare la quantità raccolta in mm.
- Asciugare la striscia con un riscaldatore per telaio standard e pulito fino a quando il fluido non è completamente asciutto.
NOTA: Evitare il riscaldamento eccessivo che potrebbe potenzialmente carbonizzare la carta da filtro. - Inserire ogni striscia di Schirmer essiccata in un criotubo etichettato e conservarlo preferibilmente in un luogo fresco e asciutto al buio fino a un'ulteriore lavorazione.
2. Preparazione di prodotti chimici e reagenti
- Tampone di lisi (5% SDS, 50 mM TEAB, pH 7,5), 20 mL
- Pipettare 1 mL di TEAB 1 M e 80 μL di acido fosforico al 12%. Vorticare e sonicare brevemente per rimuovere le bolle. Rabboccare fino a 20 mL con acqua deionizzata.
- Pesare 1 g di SDS e aggiungerlo alla soluzione con oscillazione fino a quando non si è sciolto.
- Tampone di precipitazione proteica (90% metanolo, 100 mM TEAB, pH 7,1), 10 mL
- Aggiungere 893 μL di TEAB 1 M e 92 μL di acqua deionizzata.
- Aggiungere 15 μL di acido fosforico all'85% in peso e 9 mL di metanolo alla soluzione e vorticare brevemente.
- Tampone di digestione (50 mM TEAB), 1 mL
- Aggiungere 50 μL di 1 M TEAB e rabboccare fino a 1 mL con acqua deionizzata.
- Soluzione 200 mM di ditiotreitolo (DTT), 500 μL
- Pesare 15 mg di DTT e sciogliere in 500 μL di acqua deionizzata; vortice brevemente.
NOTA: Preparare prima dell'uso.
- Pesare 15 mg di DTT e sciogliere in 500 μL di acqua deionizzata; vortice brevemente.
- Soluzione di iodoacetammide (IAA) 400 mM, 200 μL
- Pesare 15 mg di IAA e sciogliere in 200 μL di acqua deionizzata; vortice brevemente. NOTA: Preparare prima dell'uso ed evitare la luce.
- 0,2% acido formico, 50% acetonitrile, 10 mL
- Preparare 10 mL di acetonitrile al 50% in acqua deionizzata.
- Aggiungere brevemente 20 μL di acido formico e vortice.
- Soluzione di acido formico allo 0,2%, 10 mL
- Aggiungere 20 μL di acido formico a 10 mL di acqua deionizzata e vorticare brevemente.
- Soluzione di acido formico allo 0,1%, 10 mL
- Aggiungere 10 μL di acido formico a 10 mL di acqua deionizzata; vortice brevemente.
3. Estrazione di proteine nella striscia di Schirmer
- Tagliare ed eliminare l'estremità anteriore oltre il segno di 0 mm della striscia per rimuovere la potenziale contaminazione dovuta al contatto dei tessuti congiuntivali con forbici pulite in acciaio inossidabile.
- Tagliare la striscia a intervalli di 1 mm in una provetta per microcentrifuga da 1,5 mL (Figura 3).
- Aggiungere 100 μL di tampone di lisi alla provetta per microcentrifuga e vorticare a 1.000 giri/min, a temperatura ambiente per 1 ora in un termomiscelatore.
- Centrifugare brevemente e trasferire il surnatante in una nuova provetta per microcentrifuga da 1,5 mL.
- Spostare le strisce nei puntali per pipette da 200 μL utilizzando una pinza pulita. Inserire i puntali nella stessa provetta del passaggio 3.4 con il supporto e centrifugare a temperatura ambiente a 4.000 × g per 1 minuto per ottenere il massimo recupero del campione rimanente sulla striscia.
- Misurare la concentrazione proteica utilizzando l'acido bicinchoninico (BCA) o un test proteico compatibile.
4. Preparazione del campione per intrappolamento in sospensione
- Normalizzare i campioni a 50 μg di proteine in base al risultato del test proteico.
- Aggiungere 200 mM DTT in un rapporto di 1:10 (v/v, DTT: campione) a una concentrazione finale di 20 mM DTT e incubare a 95 °C per 10 min.
- Raffreddare la soluzione proteica a temperatura ambiente.
- Aggiungere 400 mM di IAA in un rapporto di 1:10 (v/v, IAA: campione) a una concentrazione finale di 40 mM di IAA e incubare al buio a temperatura ambiente per 10 minuti.
- Aggiungere brevemente il 12% di acido fosforico acquoso in un rapporto di 1:10 (v/v, acido: campione) fino a una concentrazione finale di acido fosforico all'1,2% e vortice.
- Aggiungere il tampone legante le proteine in un rapporto di 1:6 (v/v, campione: tampone) e vorticare brevemente.
NOTA: In questa fase, dovrebbe essere formato il particolato proteico colloidale e la soluzione apparirà traslucida se la quantità di proteine è sufficiente. - Aprire la colonna di filatura micro per intrappolamento in sospensione e assemblare la colonna di rotazione su una provetta per microcentrifuga da 2 mL per raccogliere il flusso.
- Aggiungere fino a 200 μL di miscela di lisato proteico acidificato nella colonna.
- Centrifugare la colonna a 4.000 × g per 20 s. Le particelle proteiche sono rimaste intrappolate; Ripetere l'operazione fino a quando i campioni non vengono caricati nella colonna.
- Aggiungere 150 μL di tampone legante le proteine e centrifugare a 4.000 × g per 20 secondi per lavare la proteina in sospensione. Ripeti 3 volte.
- Assemblare la microcolonna per intrappolamento in sospensione su una nuova provetta per microcentrifuga da 1,5 mL.
- Aggiungere 20 μL di tampone di digestione TEAB da 50 mM contenente proteasi in un rapporto di 1:25 (p/p, tripsina: proteina) sul filtro all'interno della colonna di rotazione, evitando bolle e traferro tra il filtro e la soluzione di digestione.
- Chiudere la colonna di microrotazione per intrappolare le sospensioni per evitare l'evaporazione. Incubare a 47 °C per 1 h in termomiscelatore; Non agitare o vorticare durante la digestione.
- Eluire i peptidi con 40 μL di TEAB 50 mM per forza centrifuga a 4.000 × g per 20 s.
- Aggiungere 40 μL di FA allo 0,2% e centrifugare a 4.000 × g per 20 s.
- Aggiungere 35 μL di FA allo 0,2%, acetonitrile al 50% e centrifugare a 4.000 × g per 20 s.
- Raggruppare tre eluati e asciugare con una centrifuga sottovuoto.
- Conservare a -80 °C in congelatore a bassissima temperatura fino a nuova analisi. NOTA: Il protocollo può essere messo in pausa qui.
5. Ricostituire i peptidi per l'analisi di spettrometria di massa
- Ricostituire brevemente il campione con 12 μL di FA allo 0,1%, vortice e centrifuga.
- Misurare la concentrazione di peptidi con un kit di analisi peptidica.
- Normalizzare la concentrazione peptidica a 0,5 μg/μL in FA allo 0,1%.
- Trasferire la miscela peptidica in una fiala per autocampionatore e prepararla per l'analisi con spettrometria di massa.
6. Acquisizione del campione mediante cromatografia liquida-spettrometria di massa tandem
- Caricare 3 μg del peptide con tampone di carico isocratico (0,1% FA, 5% ACN) su una colonna trappola (C18, 5 μm, 100 μm, 20 mm) a una velocità di flusso di 2 μL/min per 15 min.
- Frazionare i peptidi utilizzando una colonna analitica nano in fase inversa (C18, 5 μm, 100 μm, 300 mm) a una velocità di flusso di 350 nL/min in un gradiente di separazione di 155 min. Utilizzare la fase mobile A comprendente una miscela di acido formico allo 0,1% (v/v), 5% ACN (v/v) in acqua e fase mobile B contenente lo 0,1% di FA (v/v), il 98% di ACN (v/v) in acqua. Utilizzare il seguente gradiente: 0-0,5 min: 5% B, 0,5-90 min: 10% B, 90-120 min: 20% B, 120-130 min: 28% B, 130-135 min: 45% B, 135-141 min: 80% B, 141-155 min: 5% B.
- Eseguire l'acquisizione dipendente dai dati (DDA) con un intervallo di scansione TOF-MS compreso tra 350 e 1800 m/z con un tempo di accumulo di 250 ms e un tempo di esclusione dinamica del target di 18 s. Quindi, eseguire una scansione MS/MS da 100 a 1.800 m/z in modalità ad alta sensibilità con un tempo di accumulo di 50 ms per i primi 50 precursori per ciclo con una soglia di 125 cps per il segnale MS/MS con uno stato di carica da +2 a +4.
- Analizza i dati grezzi con il software di riferimento o altri motori compatibili con un database di riferimento in FASTA dal database UniProt accessibile al pubblico.
Risultati
Questo protocollo consente la raccolta di campioni di lacrime con strisce di Schirmer che vengono conservate asciutte a temperatura ambiente prima della successiva preparazione del campione per l'analisi di spettrometria di massa. Il flusso di lavoro FASP (Filter-Aided Sample Preparation) con microcolonna di intrappolamento delle sospensioni ha consentito una rapida preparazione del campione in poche ore, rispetto alle procedure di digestione in soluzione comunemente adottate nei giorni che richiedono un'incubazione notturna. La resa di recupero dei peptidi è risultata significativamente più elevata (p < 0,001) rispetto al protocollo standard di digestione in soluzione e con una buona riproducibilità a un coefficiente di variazione (%CV) < 7%. Un pool di campioni di lacrime è stato ripetuto in sei repliche tecniche con un recupero peptidico del 74,2 ± 5,0% e un recupero peptidico del 52,8 ± dell'1,6% in campioni preparati con procedure in soluzione. Un campione lacrimale aggregato con una quantità proteica di 36,3 μg è stato aggiunto sulla striscia di Schirmer ed estratto come descritto in precedenza, l'efficienza di estrazione della proteina è stata dell'81% (29,5 ± 6,8 μg, media ± DS).
Entrambi i flussi di lavoro hanno caricato 3 μg di peptidi sul MS e la ricerca DDA ha prodotto un totale di 1.183 ± 118 proteine (5.757 ± 537 peptidi distinti) e 874 ± 70 proteine (4.400 ± 328 peptidi) all'1% FDR rispettivamente nel gruppo di intrappolamento della sospensione e nel gruppo in soluzione. L'analisi dell'ontologia genica (GO) utilizzando il sistema di classificazione PANTHER ha rivelato proteomi molto simili per entrambi gli approcci, con il legame, l'attività catalitica e la regolazione della funzione molecolare come principali funzioni molecolari (Figura 4).

Figura 1: Piegare la parte superiore della striscia di Schirmer in corrispondenza del segno di 0 mm prima dell'applicazione. Fare clic qui per visualizzare una versione più grande di questa figura.
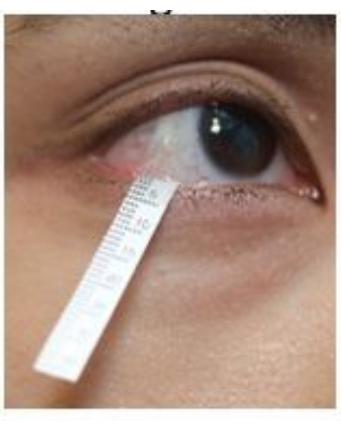
Figura 2: Posizione della striscia di Schirmer durante la raccolta delle lacrime. Fare clic qui per visualizzare una versione più grande di questa figura.
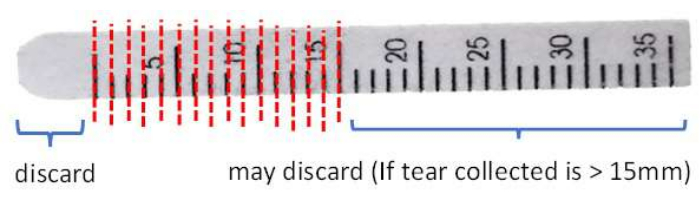
Figura 3: Illustrazione della manipolazione della striscia di Schirmer prima dell'estrazione delle proteine. Fare clic qui per visualizzare una versione più grande di questa figura.
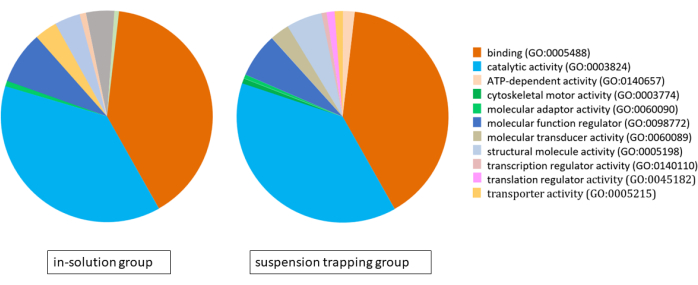
Figura 4: Grafico a torta che illustra l'analisi dell'ontologia genica per i proteomi identificati utilizzando il flusso di lavoro in-solution e il flusso di lavoro di intrappolamento in sospensione, utilizzando il sistema di classificazione PANTHER. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Per ottenere risultati accurati utilizzando questo metodo, è necessario indossare guanti monouso privi di potenza in tutte le procedure dalla raccolta del campione lacrimale per evitare la contaminazione del campione. È importante evitare bolle e traferri d'aria tra il filtro e la soluzione del campione in ogni fase utilizzando colonne microrotanti. Se il volume del campione è superiore alla capacità delle colonne, si consiglia di ripetere il processo. Questo protocollo ha dimostrato di essere più efficiente del tradizionale protocollo in soluzione in termini di tempo di preparazione, recupero delle proteine e identificazione totale delle proteine. Ciò è dovuto in gran parte al fatto che i campioni vengono sottoposti alla maggior parte delle procedure richieste sulla stessa colonna, a differenza del metodo in soluzione che prevede più fasi di trasferimento come la precipitazione dell'acetone, la digestione e la pulizia (desalinizzazione), che aumenta la probabilità di variazioni nei dati risultanti.
Oltre ai campioni di lacrime raccolti con il metodo microcapillare16,17, questo flusso di lavoro FASP con microcolonna di intrappolamento in sospensione fornisce un metodo alternativo di preparazione del campione che consente una preparazione rapida e robusta del campione lacrimale raccolto utilizzando le strisce di Schirmer, con una preparazione minima del materiale e passaggi facili da seguire. Ciò consente una preparazione riproducibile del campione lacrimale per studi di coorte di grandi dimensioni su più malattie o condizioni oculari con un migliore recupero dei peptidi e l'identificazione delle proteine da parte della SM rispetto alle procedure in soluzione. Questo processo affidabile può essere utilizzato regolarmente nella preparazione di campioni di biomarcatori lacrimali per la ricerca e altri scopi clinici. Ancora più importante, richiede una formazione minima del personale per la raccolta in loco e annulla la necessità di conservare i campioni in un congelatore. I campioni vengono essiccati in loco per ridurre al minimo l'autolisi e la degradazione delle proteine. Pertanto, ciò consente una comoda spedizione per posta per facilitare l'analisi a valle, al contrario dell'utilizzo di tubi micro-capillari.
Divulgazioni
Gli autori non hanno conflitti di interesse da dichiarare.
Riconoscimenti
Questo lavoro è stato sostenuto dall'iniziativa InnoHK e dal governo della regione amministrativa speciale di Hong Kong; Centro di Ricerca per la Visione SHARP; e il Centro di Ricerca per l'Innovazione della Medicina Cinese (RCMI) presso l'Università Politecnica di Hong Kong.
Materiali
| Name | Company | Catalog Number | Comments |
| 9 mm Plastic Screw Thread Vials | Thermo Scientific | C4000-11 | |
| Acetonitrile, LCMS Grade | Anaqua | AC-1026 | |
| Centrifuge MiniSpin plus | Eppendorf | 5453000097 | |
| DL-dithiothreitol (DTT), BioUltra | Sigma-Aldrich | 43815 | |
| Eppendorf Safe-Lock Tubes, 1.5 mL | Eppendorf | 30120086 | |
| Formic acid, ACS reagent, ≥96% | Sigma-Aldrich | 695076 | |
| Frame Heater OPTIMONSUN Electronic | Breitfeld & Schliekert GmbH | 1203166 | |
| Iodoacetamide (IAA), BioUltra | Sigma-Aldrich | I1149 | |
| Methanol, HPLC Grade | Anaqua | MA-1292 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes, 2 mL | Thermo Fisher Scientific | 368632 | |
| Phosphoric acid, 85 wt.% in H2O | Sigma-Aldrich | 345245 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Fisher Scientific | 23275 | |
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Fisher Scientific | A53225 | |
| Quadrupole Time-of-Flight Mass Spectrometry | Sciex | TripleTOF 6600 | |
| Schirmer Ophthalmic Strips | Entod Research Cell UK Ltd | I-DEW Tearstrips | |
| S-Trap Micro Column | Protifi | C02-micro-80 | |
| SureSTART 9 mm Screw Caps | Thermo Scientific | CHSC9-40 | |
| Triethylammonium bicarbonate (TEAB), 1 M | Sigma-Aldrich | 18597 | |
| Ultra-performance Liquid Chromatography | Eksigent | NanoLC 400 | |
| UltraPure Sodium dodecyl sulfate (SDS) | Thermo Fisher Scientific | 15525017 |
Riferimenti
- Ma, J. Y. W., Sze, Y. H., Bian, J. F., Lam, T. C. Critical role of mass spectrometry proteomics in tear biomarker discovery for multifactorial ocular diseases (Review). International Journal of Molecular Medicine. 47 (5), 83 (2021).
- Tse, J. S. H., et al. Integrating clinical data and tear proteomics to assess efficacy, ocular surface status, and biomarker response after orthokeratology lens wear. Translational Vision Science & Technology. 10 (11), 18 (2021).
- Cheung, J. K., et al. Human tear proteome dataset in response to daily wear of water gradient contact lens using SWATH-MS approach. Data in Brief. 36, 107120 (2021).
- Tse, J. S., et al. Data on assessment of safety and tear proteome change in response to orthokeratology lens - Insight from integrating clinical data and next generation proteomics. Data in Brief. 29, 105186 (2020).
- Zhan, X., Li, J., Guo, Y., Golubnitschaja, O. Mass spectrometry analysis of human tear fluid biomarkers specific for ocular and systemic diseases in the context of 3P medicine. The EPMA Journal. 12 (4), 449-475 (2021).
- Ponzini, E., et al. Mass spectrometry-based tear proteomics for noninvasive biomarker discovery. Mass Spectrometry Reviews. 41 (5), 842-860 (2022).
- HaileMariam, M., et al. S-Trap, an ultrafast sample-preparation approach for shotgun proteomics. Journal of Proteome Research. 17 (9), 2917-2924 (2018).
- Ding, H., et al. Urine proteomics: evaluation of different sample preparation workflows for quantitative, reproducible, and improved depth of analysis. Journal of Proteome Research. 19 (4), 1857-1862 (2020).
- Ludwig, K. R., Schroll, M. M., Hummon, A. B. Comparison of in-solution, FASP, and S-Trap based digestion methods for bottom-up proteomic studies. Journal of Proteome Research. 17 (7), 2480-2490 (2018).
- Sze, Y. H., et al. High-pH reversed-phase fractionated neural retina proteome of normal growing C57BL/6 mouse. Scientific Data. 8 (1), 27 (2021).
- Marchione, D. M., et al. HYPERsol: High-quality data from archival FFPE tissue for clinical proteomics. Journal of Proteome Research. 19 (2), 973-983 (2020).
- Chhuon, C., et al. A sensitive S-Trap-based approach to the analysis of T cell lipid raft proteome. Journal of Lipid Research. 61 (11), 1512-1523 (2020).
- Hayoun, K., et al. Evaluation of sample preparation methods for fast proteotyping of microorganisms by tandem mass spectrometry. Frontiers in Microbiology. 10, 1985 (2019).
- Templeton, E. M., et al. Comparison of SPEED, S-Trap, and in-solution-based sample preparation methods for mass spectrometry in kidney tissue and plasma. International Journal of Molecular Sciences. 24 (7), 6290 (2023).
- Ding, Z., Wang, N., Ji, N., Chen, Z. S. Proteomics technologies for cancer liquid biopsies. Molecular Cancer. 21 (1), 53 (2022).
- Nättinen, J., Aapola, U., Jylhä, A., Vaajanen, A., Uusitalo, H. Comparison of capillary and Schirmer strip tear fluid sampling methods using SWATH-MS proteomics approach. Translational Vision Science & Technology. 9 (3), 16 (2020).
- Bachhuber, F., Huss, A., Senel, M., Tumani, H. Diagnostic biomarkers in tear fluid: from sampling to preanalytical processing. Scientific Reports. 11 (1), 10064 (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon