Method Article
액체 크로마토그래피-탠덤 질량분석법에 의한 눈물 단백질체학을 위한 단백질 현탁액 포획 시료 전처리
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜은 Schirmer 스트립을 사용하여 눈물 샘플을 수집하는 방법과 비침습적 눈물 단백질 바이오마커를 발견하기 위한 통합 정량 워크플로우를 설명합니다. 현탁액 포획 시료 전처리 워크플로우는 빠르고 강력한 눈물 시료 전처리 및 질량 분석 분석을 가능하게 하여 표준 용액 내 절차보다 더 높은 펩타이드 회수율과 단백질 식별을 가능하게 합니다.
초록
눈물액은 비침습적으로 채취할 수 있는 쉽게 접근할 수 있는 생체액 중 하나입니다. 눈물 단백질체학은 여러 안과 질환 및 상태에 대한 바이오마커를 발견할 수 있는 잠재력을 가지고 있습니다. 현탁액 포획 컬럼은 다운스트림 단백질체 분석의 광범위한 응용 분야를 위한 효율적이고 사용자 친화적인 시료 전처리 워크플로우로 보고되었습니다. 그러나 이 전략은 인간의 눈물 단백질체 분석에서 잘 연구되지 않았습니다. 본 프로토콜은 생물정보학 분석과 결합될 때 질병 바이오마커 및 모니터링에 대한 통찰력을 제공하는 질량분석법을 사용하여 비침습적 눈물 단백질 바이오마커 연구를 위한 임상 인간 눈물 샘플에서 정제된 펩타이드에 이르는 통합 워크플로우를 설명합니다. 단백질 현탁액 포획 시료 전처리가 적용되어 인간 누액 분석을 위한 보편적이고 최적화된 시료 전처리로서 빠르고 재현 가능하며 사용자 친화적인 절차를 통해 눈물 단백질체의 발견을 입증했습니다. 특히, 현탁액 포획 절차는 펩타이드 회수, 단백질 식별 및 시료 전처리 시간 단축 측면에서 용액 내 시료 전처리보다 성능이 뛰어났습니다.
서문
눈물 단백질체학은 안구 질환 및 상태 1,2,3,4,5,6에 대한 잠재적인 바이오마커를 탐색하고, 안구 및 전신 상태의 발병 기전에 접근하고, Schirmer 스트립을 사용한 비침습적 눈물 샘플 수집의 이점을 활용하기 위해 주목을 받았습니다. 차세대 질량분석법의 기술 발전으로 과거에는 불가능했던 정확도와 정밀성으로 마이크로리터 단위의 눈물에서 단백질 정량화가 가능해졌습니다. 시료 전처리 방법은 아직 표준화되지 않았습니다. 강력하고 표준화된 시료 전처리 워크플로우는 눈물 단백질 바이오마커 연구에서 성공적인 임상 적용에 필수적입니다. 현탁액 트래핑(S-Trap) 시료 전처리 워크플로우는 최근 광범위한 다운스트림 단백질체 분석을 위한 효과적이고 민감한 시료 전처리 방법으로 보고되었습니다 7,8. 그러나 이 전략은 인간 눈물 단백질체의 분석에서 잘 보고되지 않았으며, 효소 분해 효율 및 질량 분석9에 의한 더 많은 단백질 식별 측면에서 필터 보조 시료 전처리(filter-aided sample preparation, FASP) 및 용액 내 분해(in-solution digestion)를 능가했다. S-Trap 기반 접근법은 망막 조직 10, 포르말린 고정, 파라핀 포매(FFPE) 조직11, 세포 12, 미생물 13 및 액체 생검 14,15의 준비에서 입증되었습니다.
이 프로토콜은 빠르고 재현 가능하며 강력한 기술 전략을 통해 비침습적 눈물 단백질 바이오마커 패널을 발견하기 위해 임상 샘플에서 효소로 소화된 단백질에 이르는 통합 정량 워크플로우를 설명합니다. 간단히 말해서, 표준 Schirmer 스트립을 사용하여 최루액을 수집하고 실온에서 단백질 자가 분해를 방지하기 위해 안과 프레임 히터로 즉시 건조했습니다. 제조업체의 제안에 따라 5% 소듐 도데실 설페이트(SDS) 용해 완충액을 사용하여 임베디드 총 단백질을 추출한 후 단백질 분석 측정을 수행했습니다. 그런 다음 추출된 용해물을 디티오트레이톨(DTT)로 표준 환원하고 요오드아세트아미드(IAA)로 알킬화했습니다.
인산으로 산성화한 후, 90% 메탄올 및 100mM 트리에틸암모늄 중탄산염(TEAB)을 함유하는 현탁액 포획 컬럼 단백질 침전 완충액을 응집체 단백질에 첨가하였다. 그런 다음 샘플을 새로운 현탁액 트래핑 마이크로 컬럼으로 옮겼습니다. 47°C에서 1시간 동안 1:25 비율(w/w, 트립신: 단백질)의 시퀀싱 등급 트립신을 사용한 효소 분해. 생성된 펩타이드는 50mM TEAB, 0.2% 포름산 수용성(FA) 및 0.2% FA를 함유하는 50% 아세토니트릴(ACN)로 순차적으로 원심분리를 통해 용출되었습니다. 용출된 펩타이드를 진공 건조시키고 0.1% FA로 재구성하였다. 펩타이드 농도를 측정하고 질량 분석 분석을 위해 0.5μg/μL로 조정했습니다.
프로토콜
피험자는 연구에 참여하기 전에 서면 동의서를 제공했습니다. 이 연구는 홍콩 폴리테크닉 대학의 인간 윤리 위원회의 승인을 받았으며 헬싱키 선언의 원칙을 고수했습니다.
1. Schirmer 스트립을 사용한 인체 눈물액 수집
- 장갑을 끼고 소독하여 샘플 오염을 방지하십시오.
- 내부 포장이 손상되지 않고 멸균되어 있으며 만료되지 않았는지 확인하십시오.
- 스트립의 반원 끝 근처에 표시된 대로 Schirmer 스트립의 상단을 0mm 표시에서 약간 안쪽으로 구부립니다(그림 1).
- 스트립의 끝을 잡고 내부 패키지에서 스트립을 제거하고 0-25mm의 샘플 수집 영역과의 직접적인 접촉을 피하십시오.
- 피험자에게 놓을 스트립의 위치에서 시선을 돌리도록 요청합니다.
- 아래 눈꺼풀을 부드럽게 아래로 당기고 스트립의 끝을 외안각 영역 근처의 아래쪽 눈꺼풀에 겁니다(그림 2). 반대쪽 눈에도 같은 절차를 반복합니다.
- 피험자에게 자극을 최소화하기 위해 눈꺼풀을 부드럽게 닫도록 요청하십시오.
- 약 5분 동안 눈물액을 채취하거나 바람직하게는 15-20mm의 눈물 샘플을 채취하였다.
- 피험자에게 두 눈을 뜨고 아래 눈꺼풀을 부드럽게 아래로 당겨 피사체에서 스트립을 제거하도록 요청합니다.
- Schirmer 스트립의 수화 길이를 검사하고 수집된 양을 mm 단위로 기록합니다.
- 유체가 완전히 마를 때까지 표준 깨끗한 프레임 히터로 스트립을 건조시킵니다.
알림: 잠재적으로 여과지를 탄화시킬 수 있는 과도한 가열은 피해야 합니다. - 건조된 각 Schirmer 스트립을 라벨이 부착된 극저온 튜브에 삽입하고 추가 처리가 될 때까지 어두운 곳에서 서늘하고 건조한 곳에 보관하는 것이 좋습니다.
2. 화학 물질 및 시약의 준비
- 용해 완충액(5% SDS, 50mM TEAB, pH 7.5), 20mL
- 피펫 1mL 1m TEAB 및 80μL의 12% 인산. 거품을 제거하기 위해 잠시 소용돌이치고 초음파 처리합니다. 탈이온수로 최대 20mL를 채우십시오.
- SDS 1g의 무게를 달고 용해될 때까지 진동하면서 용액에 첨가합니다.
- 단백질 침전 완충액(90% 메탄올, 100mM TEAB, pH 7.1), 10mL
- 893μL의 1M TEAB와 92μL의 탈이온수를 추가합니다.
- 15μL의 85wt% 인산과 9mL의 메탄올을 용액에 넣고 소용돌이칩니다.
- 분해 완충액(50mM TEAB), 1mL
- 50μL의 1M TEAB를 넣고 최대 1mL의 탈이온수를 추가합니다.
- 200mM 디티오트레이톨(DTT) 용액, 500μL
- 15mg의 DTT를 칭량하고 500μL의 탈이온수에 녹입니다. 소용돌이를 간략히.
알림: 사용하기 전에 준비하십시오.
- 15mg의 DTT를 칭량하고 500μL의 탈이온수에 녹입니다. 소용돌이를 간략히.
- 400mM 요오드아세트아미드(IAA) 용액, 200μL
- 15mg의 IAA를 계량하고 200μL의 탈이온수에 용해시킵니다. 소용돌이를 간략히. 알림: 사용하기 전에 준비하고 빛을 피하십시오.
- 0.2% 포름산, 50% 아세토니트릴, 10mL
- 탈이온수에 50% 아세토니트릴 10mL를 준비합니다.
- 20μL의 포름산과 와류를 짧게 추가합니다.
- 0.2% 포름산 용액, 10mL
- 탈이온수 10mL에 포름산 20μL를 넣고 잠시 와류합니다.
- 0.1% 포름산 용액, 10mL
- 10mL의 탈이온수에 10μL의 포름산을 추가합니다. 소용돌이를 간략히.
3. Schirmer 지구에 있는 단백질 적출
- 스트립의 0mm 표시 이상으로 앞쪽 끝을 자르고 폐기하여 결막 조직과 깨끗한 스테인리스 스틸 가위의 접촉으로 인한 잠재적인 오염을 제거합니다.
- 스트립을 1mm 간격으로 1.5mL 미세 원심분리 튜브로 자릅니다(그림 3).
- 100μL의 용해 완충액을 마이크로 원심분리기 튜브에 추가하고 1,000rpm에서 실온에서 1시간 동안 와류합니다.
- 잠시 원심분리하고 상층액을 새로운 1.5mL 미세 원심분리기 튜브로 옮깁니다.
- 깨끗한 집게를 사용하여 스트립을 200μL 피펫 팁으로 옮깁니다. 홀더가 있는 3.4단계의 동일한 튜브에 팁을 넣고 스트립에 남아 있는 샘플을 최대한 회수하기 위해 4,000× g 의 실온에서 1분 동안 원심분리기를 사용합니다.
- 비신코닌산(BCA) 또는 호환 가능한 단백질 분석을 사용하여 단백질 농도를 측정합니다.
4. 현탁액 포집 시료 전처리
- 단백질 분석 결과에 따라 샘플을 50μg의 단백질로 정규화합니다.
- 20mM DTT의 최종 농도에 1:10(v/v, DTT: 샘플)의 비율로 200mM DTT를 첨가하고 95°C에서 10분 동안 배양합니다.
- 단백질 용액을 실온으로 식힙니다.
- 40mM IAA의 최종 농도에 1:10(v/v, IAA: 샘플)의 비율로 400mM IAA를 첨가하고 실온의 어두운 곳에서 10분 동안 배양합니다.
- 12% 인산 수성산을 1:10의 비율로 첨가(v/v, 산: 샘플)하여 최종 농도 1.2% 인산과 와류를 짧게 첨가합니다.
- 단백질 결합 완충액을 1:6(v/v, 시료: 완충액)의 비율로 첨가하고 잠시 와류시킵니다.
참고: 이 단계에서는 콜로이드 단백질 미립자가 형성되어야 하며 단백질 양이 충분하면 용액이 반투명하게 나타납니다. - Suspension Trapping Micro Spin Column의 뚜껑을 열고 스핀 컬럼을 2mL 마이크로 원심분리기 튜브에 조립하여 플로우스루를 수집합니다.
- 최대 200μL의 산성화된 단백질 용해물 혼합물을 컬럼에 추가합니다.
- 컬럼을 4,000× g 에서 20초 동안 원심분리합니다. 단백질 미립자가 갇혔습니다. 샘플이 컬럼에 로드될 때까지 반복합니다.
- 150μL의 단백질 결합 완충액을 추가하고 4,000× g 에서 20초 동안 원심분리하여 부유 단백질을 세척합니다. 3회 반복합니다.
- Suspension Trapping Micro Column을 새로운 1.5mL 마이크로 원심분리 튜브에 조립합니다.
- 프로테아제가 함유된 50mM TEAB 분해 완충액 20μL를 스핀 컬럼 내부의 필터에 1:25(w/w, 트립신: 단백질)의 비율로 추가하여 필터와 분해 용액 사이의 기포와 에어 갭을 방지합니다.
- 증발을 방지하기 위해 Suspension Trapping Micro Spin Column을 캡핑합니다. 47°C에서 열혼합기에서 1시간 동안 배양합니다. 소화 중에 흔들거나 소용돌이치지 마십시오.
- 40 μL의 50 mM TEAB로 펩타이드를 4,000 × g 의 원심력으로 20 초 동안 용리시킵니다.
- 40μL의 0.2% FA를 추가하고 4,000× g 에서 20초 동안 원심분리합니다.
- 35μL의 0.2% FA, 50% 아세토니트릴을 넣고 4,000× g 에서 20초 동안 원심분리기를 추가합니다.
- 용출액 3개를 풀링하고 진공 원심분리기로 건조시킵니다.
- 추가 분석이 있을 때까지 -80°C 초저온 냉동고에서 보관하십시오. 참고: 여기에서 프로토콜을 일시 중지할 수 있습니다.
5. 질량 분석 분석을 위한 펩타이드 재구성
- 0.1% FA의 12μL, 와류로 샘플을 재구성하고 원심분리기를 짧게 재구성합니다.
- 펩타이드 Assay Kit로 펩타이드 농도를 측정합니다.
- 0.1% FA에서 펩타이드 농도를 0.5μg/μL로 정규화합니다.
- 펩타이드 혼합물을 자동 시료 주입기 바이알로 옮기고 질량 분석 준비를 합니다.
6. 액체 크로마토그래피-탠덤 질량분석법에 의한 시료 수집
- 등용매 로딩 버퍼(0.1% FA, 5% ACN)가 있는 펩타이드 3μg을 트랩 컬럼(C18, 5μm, 100μm, 20mm)에 15분 동안 2μL/분의 유속으로 로드합니다.
- 역상 나노 분석 컬럼(C18, 5μm, 100μm, 300mm)을 사용하여 155분 분리 그래디언트에서 350nL/분의 유속으로 펩타이드를 분획합니다. 물에 0.1% 포름산(v/v), 5% ACN(v/v)의 혼합물로 구성된 이동상 A와 물에 0.1% FA(v/v), 98% ACN(v/v)을 포함하는 이동상 B를 사용합니다. 다음 그라데이션을 사용하십시오 : 0-0.5 분 : 5 % B, 0.5-90 분 : 10 % B, 90-120 분 : 20 % B, 120-130 분 : 28 % B, 130-135 분 : 45 % B, 135-141 분 : 80 % B, 141-155 분 : 5 % B.
- 누적 시간 250ms, 동적 표적 제외 시간 18초로 TOF-MS 스캔 범위가 350 - 1800m/z 사이인 데이터 종속 수집(DDA)을 수행합니다. 그런 다음 고감도 모드에서 100 - 1,800m/z에서 +2 - +4의 충전 상태를 가진 MS/MS 신호에 대해 임계값 125cps의 임계값으로 사이클당 상위 50개 전구체에 대해 50ms의 누적 시간으로 MS/MS 스캔을 수행합니다.
- 공개적으로 액세스할 수 있는 UniProt 데이터베이스에서 FASTA의 참조 데이터베이스를 사용하여 참조된 소프트웨어 또는 기타 호환 엔진으로 원시 데이터를 분석합니다.
결과
이 프로토콜은 질량 분석 분석을 위한 후속 시료 준비 전에 실온에서 건조하게 보관되는 Schirmer Strip을 사용하여 눈물 시료를 수집할 수 있습니다. 현탁액 포집 마이크로 컬럼을 사용하는 필터 지원 시료 전처리(FASP) 워크플로우는 일반적으로 채택되는 용액 내 분해 절차가 며칠 동안 밤새 배양되어야 하는 것과 비교하여 몇 시간 만에 빠른 시료 전처리를 가능하게 했습니다. 펩타이드 회수율은 표준 용액 내 분해 프로토콜보다 훨씬 높았고(p < 0.001) 변동 계수(%CV) < 7%에서 재현성이 우수했습니다. 용액 내 절차로 준비된 샘플에서 74.2 ± 5.0%의 펩타이드 회수율과 52.8 ± 1.6%의 펩타이드 회수율로 6개의 기술 반복실험에서 눈물 샘플 풀을 반복했습니다. 단백질량이 36.3μg인 풀링된 눈물 샘플을 쉬르머 스트립 상에 스파이크하고, 앞서 설명한 바와 같이 추출하였는데, 단백질의 추출 효율은 81%(29.5 ± 6.8μg, 평균 ± SD)였다.
두 워크플로우 모두 MS에 3μg의 펩타이드를 로드했으며, DDA 검색은 현탁액 포획 그룹 및 용액 내 그룹에서 각각 1% FDR에서 총 1,183개 ± 118개 단백질(5,757개 ± 537개 개별 펩타이드)과 874개 ± 70개 단백질(4,400개 ± 328개 펩타이드)을 산출했습니다. PANTHER 분류 시스템을 사용한 유전자 온톨로지(GO) 분석 결과, 결합, 촉매 활성 및 분자 기능 조절이 주요 분자 기능인 두 접근 방식 모두에서 매우 유사한 단백질체가 밝혀졌습니다(그림 4).

그림 1: 적용하기 전에 Schirmer 스트립의 상단을 0mm 표시에서 구부립니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
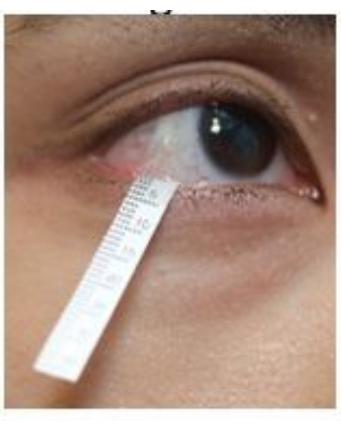
그림 2: 눈물 수집 중 Schirmer 스트립의 위치. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
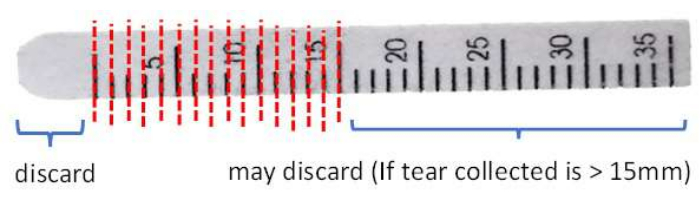
그림 3: 단백질 추출 전 Schirmer 스트립 취급 그림. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
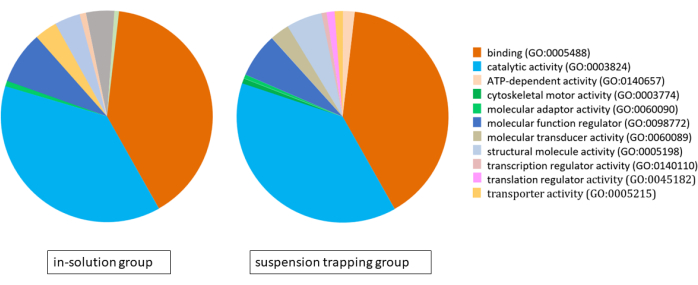
그림 4: PANTHER 분류 시스템을 사용하여 용액 내 워크플로우 및 현탁액 트래핑 워크플로우를 사용하여 식별된 단백질체에 대한 유전자 온톨로지 분석을 보여주는 파이 차트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 방법을 사용하여 정확한 결과를 얻으려면 시료 오염을 방지하기 위해 눈물 시료 채취의 모든 절차에서 전원이 필요 없는 일회용 장갑을 착용해야 합니다. 마이크로 스피닝 컬럼을 사용하여 각 단계에서 필터와 샘플 용액 사이의 기포와 에어 갭을 방지하는 것이 중요합니다. 샘플 부피가 컬럼의 용량보다 크면 프로세스를 반복하는 것이 좋습니다. 이 프로토콜은 준비 시간, 단백질 회수 및 총 단백질 식별 측면에서 기존의 용액 내 프로토콜보다 더 효율적인 것으로 입증되었습니다. 이는 주로 아세톤 침전, 분해 및 세척(탈염)과 같은 여러 이송 단계를 포함하는 용액 내 분석법과 달리 샘플이 동일한 컬럼에서 필요한 대부분의 절차를 거치기 때문에 결과 데이터가 변동될 가능성이 높기 때문입니다.
미세모세관 분석법(16,17)으로 수집된 눈물 샘플 외에도, 현탁액 포집 마이크로 컬럼을 사용하는 이 fasp 워크플로우는 최소한의 재료 준비와 사용자 친화적인 단계로 Schirmer 스트립을 사용하여 수집된 빠르고 강력한 눈물 샘플 준비를 가능하게 하는 대체 샘플 준비 방법을 제공합니다. 이를 통해 여러 안과 질환 또는 질환에 걸친 대규모 코호트 연구를 위한 재현 가능한 눈물 샘플 준비가 가능하며, 용액 내 절차에 비해 MS에 의한 펩타이드 회수 및 단백질 식별이 개선됩니다. 이 신뢰할 수 있는 공정은 연구 및 기타 임상 목적을 위한 눈물 바이오마커 샘플 준비에 정기적으로 활용될 수 있습니다. 가장 중요한 것은 현장 수집을 위한 최소한의 직원 교육이 필요하며 냉동고에 샘플을 보관할 필요가 없다는 것입니다. 시료는 단백질 자가분해 및 분해를 최소화하기 위해 현장에서 건조됩니다. 따라서 우편으로 편리하게 배송할 수 있어 마이크로 모세관 튜브를 사용하는 것과는 달리 다운스트림 분석을 용이하게 할 수 있습니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 작업은 InnoHK 이니셔티브와 홍콩 특별 행정구 정부의 지원을 받았습니다. SHARP Vision 연구 센터; 홍콩 폴리테크닉 대학교(Hong Kong Polytechnic University)의 중국 의학 혁신 연구 센터(RCMI)가 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| 9 mm Plastic Screw Thread Vials | Thermo Scientific | C4000-11 | |
| Acetonitrile, LCMS Grade | Anaqua | AC-1026 | |
| Centrifuge MiniSpin plus | Eppendorf | 5453000097 | |
| DL-dithiothreitol (DTT), BioUltra | Sigma-Aldrich | 43815 | |
| Eppendorf Safe-Lock Tubes, 1.5 mL | Eppendorf | 30120086 | |
| Formic acid, ACS reagent, ≥96% | Sigma-Aldrich | 695076 | |
| Frame Heater OPTIMONSUN Electronic | Breitfeld & Schliekert GmbH | 1203166 | |
| Iodoacetamide (IAA), BioUltra | Sigma-Aldrich | I1149 | |
| Methanol, HPLC Grade | Anaqua | MA-1292 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes, 2 mL | Thermo Fisher Scientific | 368632 | |
| Phosphoric acid, 85 wt.% in H2O | Sigma-Aldrich | 345245 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Fisher Scientific | 23275 | |
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Fisher Scientific | A53225 | |
| Quadrupole Time-of-Flight Mass Spectrometry | Sciex | TripleTOF 6600 | |
| Schirmer Ophthalmic Strips | Entod Research Cell UK Ltd | I-DEW Tearstrips | |
| S-Trap Micro Column | Protifi | C02-micro-80 | |
| SureSTART 9 mm Screw Caps | Thermo Scientific | CHSC9-40 | |
| Triethylammonium bicarbonate (TEAB), 1 M | Sigma-Aldrich | 18597 | |
| Ultra-performance Liquid Chromatography | Eksigent | NanoLC 400 | |
| UltraPure Sodium dodecyl sulfate (SDS) | Thermo Fisher Scientific | 15525017 |
참고문헌
- Ma, J. Y. W., Sze, Y. H., Bian, J. F., Lam, T. C. Critical role of mass spectrometry proteomics in tear biomarker discovery for multifactorial ocular diseases (Review). International Journal of Molecular Medicine. 47 (5), 83(2021).
- Tse, J. S. H., et al. Integrating clinical data and tear proteomics to assess efficacy, ocular surface status, and biomarker response after orthokeratology lens wear. Translational Vision Science & Technology. 10 (11), 18(2021).
- Cheung, J. K., et al. Human tear proteome dataset in response to daily wear of water gradient contact lens using SWATH-MS approach. Data in Brief. 36, 107120(2021).
- Tse, J. S., et al. Data on assessment of safety and tear proteome change in response to orthokeratology lens - Insight from integrating clinical data and next generation proteomics. Data in Brief. 29, 105186(2020).
- Zhan, X., Li, J., Guo, Y., Golubnitschaja, O. Mass spectrometry analysis of human tear fluid biomarkers specific for ocular and systemic diseases in the context of 3P medicine. The EPMA Journal. 12 (4), 449-475 (2021).
- Ponzini, E., et al. Mass spectrometry-based tear proteomics for noninvasive biomarker discovery. Mass Spectrometry Reviews. 41 (5), 842-860 (2022).
- HaileMariam, M., et al. S-Trap, an ultrafast sample-preparation approach for shotgun proteomics. Journal of Proteome Research. 17 (9), 2917-2924 (2018).
- Ding, H., et al. Urine proteomics: evaluation of different sample preparation workflows for quantitative, reproducible, and improved depth of analysis. Journal of Proteome Research. 19 (4), 1857-1862 (2020).
- Ludwig, K. R., Schroll, M. M., Hummon, A. B. Comparison of in-solution, FASP, and S-Trap based digestion methods for bottom-up proteomic studies. Journal of Proteome Research. 17 (7), 2480-2490 (2018).
- Sze, Y. H., et al. High-pH reversed-phase fractionated neural retina proteome of normal growing C57BL/6 mouse. Scientific Data. 8 (1), 27(2021).
- Marchione, D. M., et al. HYPERsol: High-quality data from archival FFPE tissue for clinical proteomics. Journal of Proteome Research. 19 (2), 973-983 (2020).
- Chhuon, C., et al. A sensitive S-Trap-based approach to the analysis of T cell lipid raft proteome. Journal of Lipid Research. 61 (11), 1512-1523 (2020).
- Hayoun, K., et al. Evaluation of sample preparation methods for fast proteotyping of microorganisms by tandem mass spectrometry. Frontiers in Microbiology. 10, 1985(2019).
- Templeton, E. M., et al. Comparison of SPEED, S-Trap, and in-solution-based sample preparation methods for mass spectrometry in kidney tissue and plasma. International Journal of Molecular Sciences. 24 (7), 6290(2023).
- Ding, Z., Wang, N., Ji, N., Chen, Z. S. Proteomics technologies for cancer liquid biopsies. Molecular Cancer. 21 (1), 53(2022).
- Nättinen, J., Aapola, U., Jylhä, A., Vaajanen, A., Uusitalo, H. Comparison of capillary and Schirmer strip tear fluid sampling methods using SWATH-MS proteomics approach. Translational Vision Science & Technology. 9 (3), 16(2020).
- Bachhuber, F., Huss, A., Senel, M., Tumani, H. Diagnostic biomarkers in tear fluid: from sampling to preanalytical processing. Scientific Reports. 11 (1), 10064(2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유