Method Article
Préparation d’échantillons de piégeage de suspension de protéines pour la protéomique lacrymale par chromatographie liquide et spectrométrie de masse en tandem
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit une méthode de collecte d’échantillons de larmes à l’aide de bandelettes de Schirmer et un flux de travail quantitatif intégré pour la découverte de biomarqueurs non invasifs de la protéine lacrymale. Le flux de travail de préparation des échantillons par piégeage en suspension permet une préparation rapide et robuste des échantillons lacrymaux et une analyse par spectrométrie de masse, ce qui se traduit par des rendements de récupération des peptides et une identification des protéines plus élevés que les procédures standard en solution.
Résumé
Le liquide lacrymal est l’un des biofluides facilement accessibles qui peuvent être collectés de manière non invasive. La protéomique lacrymale a le potentiel de découvrir des biomarqueurs pour plusieurs maladies et affections oculaires. La colonne de piégeage en suspension s’est avérée être un flux de travail efficace et convivial pour la préparation d’échantillons pour une large application de l’analyse protéomique en aval. Pourtant, cette stratégie n’a pas été bien étudiée dans l’analyse du protéome lacrymal humain. Le présent protocole décrit un flux de travail intégré allant des échantillons cliniques de larmes humaines aux peptides purifiés pour la recherche non invasive de biomarqueurs de protéines lacrymales à l’aide de la spectrométrie de masse, qui fournit des informations sur les biomarqueurs et la surveillance de la maladie lorsqu’elle est combinée à l’analyse bioinformatique. Une préparation d’échantillons de piégeage de suspension protéique a été appliquée et a démontré la découverte du protéome lacrymal avec des procédures rapides, reproductibles et conviviales, en tant que préparation d’échantillon universelle et optimisée pour l’analyse du liquide lacrymal humain. En particulier, la procédure de piégeage en suspension a surpassé la préparation d’échantillons en solution en termes de récupération de peptides, d’identification des protéines et de temps de préparation des échantillons plus court.
Introduction
La protéomique lacrymale a fait l’objet d’une attention particulière pour explorer les biomarqueurs potentiels des maladies et affections oculaires 1,2,3,4,5,6, pour accéder à la pathogenèse de l’affection oculaire et systémique, ainsi que pour exploiter l’avantage de la collecte non invasive d’échantillons de larmes à l’aide de bandelettes de Schirmer. Les progrès technologiques de la spectrométrie de masse de nouvelle génération ont permis de quantifier les protéines dans les larmes à l’échelle du microlitre avec une exactitude et une précision qui n’étaient pas possibles dans le passé. Les méthodes de préparation des échantillons ne sont pas encore normalisées. Un flux de travail robuste et standardisé de préparation des échantillons est essentiel pour le succès de l’application clinique dans la recherche sur les biomarqueurs de la protéine lacrymale. Le processus de préparation d’échantillons par piégeage en suspension (S-Trap) a récemment été présenté comme une méthode de préparation d’échantillons efficace et sensible pourl’analyse protéomique en aval 7,8. Pourtant, cette stratégie n’a pas été bien rapportée dans l’analyse du protéome lacrymal humain, a surpassé la préparation d’échantillons assistée par filtre (FASP) et la digestion en solution en termes d’efficacité de digestion enzymatique et le plus grand nombre d’identifications de protéines par analyse par spectrométrie de masse9. L’approche basée sur le piège en S a été démontrée dans la préparation de tissus rétiniens 10, de tissus fixés au formol et enrobés de paraffine (FFPE) 11, de cellules 12, de micro-organismes 13 et de biopsies liquides 14,15.
Ce protocole décrit un flux de travail quantitatif intégré allant des échantillons cliniques aux protéines digérées par voie enzymatique pour la découverte d’un panel de biomarqueurs de protéines lacrymales non invasives avec une stratégie technique rapide, reproductible et robuste. Brièvement, le liquide lacrymal a été recueilli à l’aide d’une bandelette de Schirmer standard et immédiatement séché à l’aide d’un cadre chauffant ophtalmique pour empêcher l’autolyse des protéines à température ambiante. Les protéines totales incorporées ont été extraites à l’aide d’un tampon de lyse à 5 % de dodécylsulfate de sodium (SDS) selon la suggestion du fabricant, suivie d’une mesure par dosage des protéines. Le lysat extrait a ensuite subi une réduction standard avec du dithiothréitol (DTT) et une alkylation avec de l’iodoacétamide (IAA).
Après acidification avec de l’acide phosphorique, un tampon de précipitation protéique de colonne de piégeage en suspension contenant 90 % de méthanol et 100 mM de bicarbonate de triéthylammonium (TEAB) a été ajouté aux protéines agrégées. L’échantillon a ensuite été transféré dans une nouvelle micro-colonne de piégeage en suspension. Digestion enzymatique avec trypsine de séquençage dans un rapport de 1 :25 (p/p, trypsine : protéine) à 47 °C pendant 1 h. Les peptides obtenus ont ensuite été élués par centrifugation, séquentiellement avec 50 mM de TEAB, 0,2 % d’acide formique aqueux (FA) et 50 % d’acétonitrile (ACN) contenant 0,2 % d’AF. Les peptides élués ont été séchés sous vide et reconstitués à 0,1 % d’AG. La concentration peptidique a été mesurée et ajustée à 0,5 μg/μL pour l’analyse par spectrométrie de masse.
Protocole
Les sujets ont fourni un consentement éclairé écrit avant de participer à l’étude. L’étude a été approuvée par le Comité d’éthique humaine de l’Université polytechnique de Hong Kong et a adhéré aux principes de la Déclaration d’Helsinki.
1. Collecte de liquide lacrymal humain avec une bandelette de Schirmer
- Portez des gants et désinfectez pour éviter la contamination de l’échantillon.
- Vérifiez que l’emballage intérieur est intact, stérile et non périmé.
- Pliez légèrement le haut de la bande Schirmer vers l’intérieur au repère 0 mm, comme indiqué près de l’extrémité en demi-cercle de la bande (Figure 1).
- Retirez la bandelette de l’emballage intérieur en tenant l’extrémité de la bandelette et évitez tout contact direct avec la zone de prélèvement de l’échantillon de 0 à 25 mm.
- Demandez au sujet de détourner le regard de la position de la bande à placer.
- Abaissez doucement la paupière inférieure et accrochez l’extrémité de la bandelette dans le fornix inférieur près de la région latérale du canthus (Figure 2). Répétez la même procédure sur l’autre œil.
- Demandez au sujet de fermer doucement les paupières pour minimiser l’irritation.
- Prélever du liquide lacrymal pendant environ 5 minutes ou, de préférence, un échantillon de larme de 15 à 20 mm a été prélevé.
- Demandez au sujet d’ouvrir les deux yeux, abaissez doucement la paupière inférieure et retirez les bandes du sujet.
- Inspectez la longueur hydratée sur la bande de Schirmer et notez la quantité collectée en mm.
- Séchez la bande avec un radiateur de cadre standard et propre jusqu’à ce que le liquide soit complètement sec.
REMARQUE : Une chaleur excessive qui pourrait potentiellement carboniser le papier filtre doit être évitée. - Insérez chaque bandelette de Schirmer séchée dans un cryotube étiqueté et conservez-la de préférence dans un endroit frais et sec à l’obscurité jusqu’à ce que le traitement se poursuive.
2. Préparation des produits chimiques et des réactifs
- Tampon de lyse (5 % SDS, 50 mM TEAB, pH 7,5), 20 mL
- Pipeter 1 mL de TEAB 1 M et 80 μL d’acide phosphorique à 12 %. Vortex et sonique brièvement pour éliminer les bulles. Complétez jusqu’à 20 ml avec de l’eau déminéralisée.
- Peser 1 g de SDS et l’ajouter à la solution en oscillant jusqu’à dissolution.
- Tampon de précipitation protéique (90 % de méthanol, 100 mM de TEAB, pH 7,1), 10 mL
- Ajouter 893 μL de TEAB 1 M et 92 μL d’eau déminéralisée.
- Ajouter 15 μL d’acide phosphorique à 85 % en poids et 9 mL de méthanol à la solution et au vortex brièvement.
- Tampon de digestion (50 mM TEAB), 1 mL
- Ajouter 50 μL de TEAB 1 M et compléter jusqu’à 1 mL avec de l’eau déminéralisée.
- 200 mM de solution de dithiothréitol (DTT), 500 μL
- Peser 15 mg de DTT et dissoudre dans 500 μL d’eau déminéralisée ; vortex brièvement.
REMARQUE : Préparer avant utilisation.
- Peser 15 mg de DTT et dissoudre dans 500 μL d’eau déminéralisée ; vortex brièvement.
- Solution d’iodoacétamide (IAA) à 400 mM, 200 μL
- Peser 15 mg d’AIA et dissoudre dans 200 μL d’eau déminéralisée ; vortex brièvement. REMARQUE : Préparez avant utilisation et évitez la lumière.
- 0,2 % d’acide formique, 50 % d’acétonitrile, 10 mL
- Préparer 10 mL d’acétonitrile à 50 % dans de l’eau déminéralisée.
- Ajouter 20 μL d’acide formique et le vortex brièvement.
- Solution d’acide formique à 0,2 %, 10 mL
- Ajouter 20 μL d’acide formique à 10 mL d’eau déminéralisée et tourbillonner brièvement.
- Solution d’acide formique à 0,1 %, 10 mL
- Ajouter 10 μL d’acide formique à 10 mL d’eau déminéralisée ; vortex brièvement.
3. Extraction de protéines en bandelette de Schirmer
- Coupez et jetez l’extrémité avant au-delà de la marque 0 mm de la bande pour éliminer la contamination potentielle due au contact des tissus conjonctivaux avec des ciseaux en acier inoxydable propres.
- Coupez la bande par intervalles de 1 mm dans un tube de microcentrifugation de 1,5 ml (figure 3).
- Ajouter 100 μL de tampon de lyse dans le tube de microcentrifugation et le vortex à 1 000 tr/min, à température ambiante pendant 1 h dans un thermomélangeur.
- Centrifuger brièvement et transférer le surnageant dans un nouveau tube de microcentrifugation de 1,5 ml.
- Déplacez les bandelettes dans des pointes de pipette de 200 μL à l’aide d’une pince propre. Placez les embouts dans le même tube que celui de l’étape 3.4 avec support et centrifugez à température ambiante à 4 000 × g pendant 1 minute supplémentaire pour une récupération maximale de l’échantillon restant sur la bandelette.
- Mesurez la concentration en protéines à l’aide de l’acide bicinchoninique (BCA) ou d’un dosage de protéines compatibles.
4. Préparation de l’échantillon par piégeage en suspension
- Normaliser les échantillons à 50 μg de protéines en fonction du résultat de l’analyse des protéines.
- Ajouter 200 mM de TNT dans un rapport de 1 :10 (v/v, TNT : échantillon) à une concentration finale de 20 mM de TNT et incuber à 95 °C pendant 10 min.
- Refroidir la solution protéique à température ambiante.
- Ajouter 400 mM d’AIA dans un rapport de 1 :10 (v/v, IAA : échantillon) à une concentration finale de 40 mM d’AIA et incuber dans l’obscurité à température ambiante pendant 10 min.
- Ajouter 12 % d’acide phosphorique aqueux dans un rapport de 1 :10 (v/v, acide : échantillon) à une concentration finale de 1,2 % d’acide phosphorique et vortex brièvement.
- Ajouter le tampon de liaison aux protéines dans un rapport de 1 :6 (v/v, échantillon : tampon) et le vortex brièvement.
REMARQUE : Dans cette étape, des particules de protéines colloïdales doivent être formées et la solution apparaîtra translucide si la quantité de protéines est suffisante. - Décapsulez la colonne de micro-centrifugation de piégeage de suspension et assemblez la colonne de centrifugation sur un tube de microcentrifugation de 2 ml pour recueillir l’écoulement.
- Ajouter jusqu’à 200 μL de mélange de lysat de protéines acidifiées dans la colonne.
- Centrifuger la colonne à 4 000 × g pendant 20 s. Les particules de protéines ont été piégées ; Répétez l’opération jusqu’à ce que les échantillons soient chargés dans la colonne.
- Ajouter 150 μL de tampon de liaison protéique et centrifuger à 4 000 × g pendant 20 s pour laver la protéine en suspension. Répétez 3 fois.
- Assemblez la micro-colonne de piégeage de suspension sur un nouveau tube de microcentrifugation de 1,5 ml.
- Ajouter 20 μL de tampon de digestion TEAB 50mM contenant de la protéase dans un rapport de 1 :25 (p/p, trypsine : protéine) sur le filtre à l’intérieur de la colonne de centrifugation, en évitant les bulles et l’espace d’air entre le filtre et la solution de digestion.
- Bouchez la colonne de micro-essorage de piégeage de la suspension pour éviter l’évaporation. Incuber à 47 °C pendant 1 h dans un thermomélangeur ; Ne pas secouer ou vortex pendant la digestion.
- Peptides élués avec 40 μL de 50 mM TEAB par force centrifuge à 4 000 × g pendant 20 s.
- Ajouter 40 μL d’AG à 0,2 % et centrifuger à 4 000 × g pendant 20 s.
- Ajouter 35 μL d’AG à 0,2 %, 50 % d’acétonitrile et centrifuger à 4 000 × g pendant 20 s.
- Mettez en piscine trois éluats et séchez-les à l’aide d’une centrifugeuse sous vide.
- Conserver au congélateur à ultra-basse température de -80 °C jusqu’à une analyse plus approfondie. REMARQUE : Le protocole peut être mis en pause ici.
5. Reconstituer les peptides pour l’analyse par spectrométrie de masse
- Reconstituer l’échantillon avec 12 μL d’AG à 0,1 %, vortex et centrifuger brièvement.
- Mesurez la concentration peptidique à l’aide d’un kit de dosage peptidique.
- Normaliser la concentration peptidique à 0,5 μg/μL dans 0,1 % d’AG.
- Transférez le mélange peptidique dans un flacon d’échantillonneur automatique et préparez-le pour l’analyse par spectrométrie de masse.
6. Acquisition d’échantillons par chromatographie en phase liquide et spectrométrie de masse en tandem
- Charger 3 μg du peptide avec tampon de charge isocratique (0,1 % FA, 5 % ACN) dans une colonne piège (C18, 5 μm, 100 μm, 20 mm) à un débit de 2 μL/min pendant 15 min.
- Fractionner les peptides à l’aide d’une nano colonne analytique en phase inverse (C18, 5 μm, 100 μm, 300 mm) à un débit de 350 nL/min dans un gradient de séparation de 155 min. Utiliser la phase mobile A comprenant un mélange de 0,1 % d’acide formique (v/v), 5 % d’ACN (v/v) dans l’eau et la phase mobile B contenant 0,1 % d’AG (v/v), 98 % d’ACN (v/v) dans l’eau. Utilisez le gradient suivant : 0-0,5 min : 5 % B, 0,5-90 min : 10 % B, 90-120 min : 20 % B, 120-130 min : 28 % B, 130-135 min : 45 % B, 135-141 min : 80 % B, 141-155 min : 5 % B.
- Effectuez une acquisition dépendante des données (DDA) avec une plage de balayage TOF-MS comprise entre 350 et 1800 m/z avec un temps d’accumulation de 250 ms et un temps d’exclusion dynamique de la cible de 18 s. Ensuite, effectuez un balayage MS/MS à 100 à 1 800 m/z en mode haute sensibilité avec un temps d’accumulation de 50 ms pour les 50 premiers précurseurs par cycle avec un seuil de 125 cps pour un signal MS/MS avec un état de charge de +2 à +4.
- Analysez les données brutes à l’aide du logiciel référencé ou d’autres moteurs compatibles avec une base de données de référence en FASTA à partir de la base de données UniProt accessible au public.
Résultats
Ce protocole permet de prélever des échantillons de larmes avec des bandelettes de Schirmer qui sont stockées au sec à température ambiante avant d’être ensuite préparées pour l’analyse par spectrométrie de masse. Le flux de travail de préparation d’échantillons assisté par filtre (FASP) avec micro-colonne de piégeage en suspension a permis une préparation rapide des échantillons en quelques heures, par rapport aux procédures de digestion en solution couramment adoptées en quelques jours qui nécessitent une incubation nocturne. Le rendement de récupération des peptides était significativement plus élevé (p < 0,001) que le protocole standard de digestion en solution et avec une bonne reproductibilité à un coefficient de variation (%CV) < 7%. Un pool d’échantillons de larmes a été répété dans six répétitions techniques avec une récupération peptidique de 74,2 ± 5,0 % et une récupération peptidique de 52,8 ± 1,6 % dans des échantillons préparés avec des procédures en solution. Un échantillon lacrymal groupé contenant une quantité de protéines de 36,3 μg a été enrichi sur la bandelette de Schirmer et extrait comme décrit précédemment, l’efficacité d’extraction de la protéine était de 81 % (29,5 ± 6,8 μg, moyenne ± écart-type).
Les deux flux de travail ont chargé 3 μg de peptides sur la MS, et la recherche DDA a donné un total de 1 183 ± 118 protéines (5 757 ± 537 peptides distincts) et 874 ± 70 protéines (4 400 ± 328 peptides) à 1 % de FDR dans le groupe de piégeage en suspension et le groupe en solution, respectivement. L’analyse de l’ontologie des gènes (GO) à l’aide du système de classification PANTHER a révélé des protéomes très similaires pour les deux approches, la liaison, l’activité catalytique et la régulation de la fonction moléculaire étant leurs principales fonctions moléculaires (Figure 4).

Figure 1 : Pliez le haut de la bande de Schirmer au repère 0 mm avant l’application. Veuillez cliquer ici pour voir une version agrandie de cette figure.
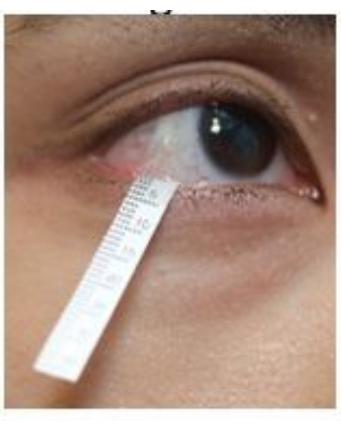
Figure 2 : Position de la bande de Schirmer lors du prélèvement des larmes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
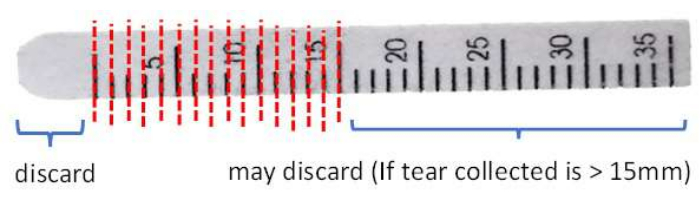
Figure 3 : Illustration de la manipulation de la bandelette de Schirmer avant l’extraction des protéines. Veuillez cliquer ici pour voir une version agrandie de cette figure.
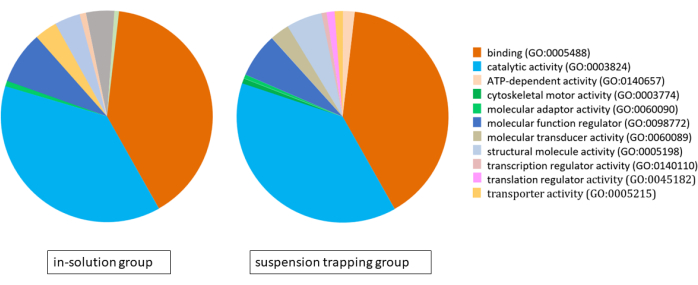
Figure 4 : Diagramme circulaire illustrant l’analyse de l’ontologie des gènes pour les protéomes identifiés à l’aide du flux de travail en solution et du processus de piégeage en suspension, à l’aide du système de classification PANTHER. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Pour obtenir des résultats précis en utilisant cette méthode, des gants jetables sans électricité doivent être portés dans toutes les procédures de prélèvement d’échantillons de larmes afin d’éviter la contamination de l’échantillon. Il est important d’éviter les bulles et les espaces d’air entre le filtre et la solution d’échantillon à chaque étape en utilisant des colonnes de micro-rotation. Si le volume d’échantillon est supérieur à la capacité des colonnes, il est recommandé de répéter le processus. Ce protocole s’est avéré plus efficace que le protocole traditionnel en solution en termes de temps de préparation, de récupération des protéines et d’identification des protéines totales. Cela s’explique en grande partie par le fait que les échantillons subissent la plupart des procédures requises sur la même colonne, contrairement à la méthode en solution qui implique plusieurs étapes de transfert telles que la précipitation de l’acétone, la digestion et le nettoyage (dessalage), ce qui augmente la probabilité de variations dans les données résultantes.
En plus des échantillons de larmes prélevés avec la méthode microcapillaire16,17, ce flux de travail FASP avec micro-colonne de piégeage en suspension fournit une méthode alternative de préparation des échantillons qui permet une préparation rapide et robuste des échantillons de larmes collectés à l’aide de bandelettes Schirmer, avec une préparation minimale du matériau et des étapes conviviales à suivre. Cela permet de préparer des échantillons de larmes reproductibles pour de grandes études de cohorte portant sur plusieurs maladies ou affections oculaires avec une récupération améliorée des peptides et une identification des protéines par MS par rapport aux procédures en solution. Ce procédé fiable peut être utilisé régulièrement dans la préparation d’échantillons de biomarqueurs lacrymaux à des fins de recherche et à d’autres fins cliniques. Plus important encore, il nécessite une formation minimale du personnel pour le prélèvement sur place et élimine le besoin de stockage des échantillons dans un congélateur. Les échantillons sont séchés sur place afin de minimiser l’autolyse et la dégradation des protéines. Par conséquent, cela permet une expédition pratique par la poste pour faciliter l’analyse en aval, par opposition à l’utilisation de micro-tubes capillaires.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Ce travail a été soutenu par l’initiative InnoHK et le gouvernement de la Région administrative spéciale de Hong Kong. Centre de recherche sur la vision SHARP ; et le Centre de recherche pour l’innovation en médecine chinoise (RCMI) de l’Université polytechnique de Hong Kong.
matériels
| Name | Company | Catalog Number | Comments |
| 9 mm Plastic Screw Thread Vials | Thermo Scientific | C4000-11 | |
| Acetonitrile, LCMS Grade | Anaqua | AC-1026 | |
| Centrifuge MiniSpin plus | Eppendorf | 5453000097 | |
| DL-dithiothreitol (DTT), BioUltra | Sigma-Aldrich | 43815 | |
| Eppendorf Safe-Lock Tubes, 1.5 mL | Eppendorf | 30120086 | |
| Formic acid, ACS reagent, ≥96% | Sigma-Aldrich | 695076 | |
| Frame Heater OPTIMONSUN Electronic | Breitfeld & Schliekert GmbH | 1203166 | |
| Iodoacetamide (IAA), BioUltra | Sigma-Aldrich | I1149 | |
| Methanol, HPLC Grade | Anaqua | MA-1292 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes, 2 mL | Thermo Fisher Scientific | 368632 | |
| Phosphoric acid, 85 wt.% in H2O | Sigma-Aldrich | 345245 | |
| Pierce Quantitative Colorimetric Peptide Assay | Thermo Fisher Scientific | 23275 | |
| Pierce Rapid Gold BCA Protein Assay Kit | Thermo Fisher Scientific | A53225 | |
| Quadrupole Time-of-Flight Mass Spectrometry | Sciex | TripleTOF 6600 | |
| Schirmer Ophthalmic Strips | Entod Research Cell UK Ltd | I-DEW Tearstrips | |
| S-Trap Micro Column | Protifi | C02-micro-80 | |
| SureSTART 9 mm Screw Caps | Thermo Scientific | CHSC9-40 | |
| Triethylammonium bicarbonate (TEAB), 1 M | Sigma-Aldrich | 18597 | |
| Ultra-performance Liquid Chromatography | Eksigent | NanoLC 400 | |
| UltraPure Sodium dodecyl sulfate (SDS) | Thermo Fisher Scientific | 15525017 |
Références
- Ma, J. Y. W., Sze, Y. H., Bian, J. F., Lam, T. C. Critical role of mass spectrometry proteomics in tear biomarker discovery for multifactorial ocular diseases (Review). International Journal of Molecular Medicine. 47 (5), 83 (2021).
- Tse, J. S. H., et al. Integrating clinical data and tear proteomics to assess efficacy, ocular surface status, and biomarker response after orthokeratology lens wear. Translational Vision Science & Technology. 10 (11), 18 (2021).
- Cheung, J. K., et al. Human tear proteome dataset in response to daily wear of water gradient contact lens using SWATH-MS approach. Data in Brief. 36, 107120 (2021).
- Tse, J. S., et al. Data on assessment of safety and tear proteome change in response to orthokeratology lens - Insight from integrating clinical data and next generation proteomics. Data in Brief. 29, 105186 (2020).
- Zhan, X., Li, J., Guo, Y., Golubnitschaja, O. Mass spectrometry analysis of human tear fluid biomarkers specific for ocular and systemic diseases in the context of 3P medicine. The EPMA Journal. 12 (4), 449-475 (2021).
- Ponzini, E., et al. Mass spectrometry-based tear proteomics for noninvasive biomarker discovery. Mass Spectrometry Reviews. 41 (5), 842-860 (2022).
- HaileMariam, M., et al. S-Trap, an ultrafast sample-preparation approach for shotgun proteomics. Journal of Proteome Research. 17 (9), 2917-2924 (2018).
- Ding, H., et al. Urine proteomics: evaluation of different sample preparation workflows for quantitative, reproducible, and improved depth of analysis. Journal of Proteome Research. 19 (4), 1857-1862 (2020).
- Ludwig, K. R., Schroll, M. M., Hummon, A. B. Comparison of in-solution, FASP, and S-Trap based digestion methods for bottom-up proteomic studies. Journal of Proteome Research. 17 (7), 2480-2490 (2018).
- Sze, Y. H., et al. High-pH reversed-phase fractionated neural retina proteome of normal growing C57BL/6 mouse. Scientific Data. 8 (1), 27 (2021).
- Marchione, D. M., et al. HYPERsol: High-quality data from archival FFPE tissue for clinical proteomics. Journal of Proteome Research. 19 (2), 973-983 (2020).
- Chhuon, C., et al. A sensitive S-Trap-based approach to the analysis of T cell lipid raft proteome. Journal of Lipid Research. 61 (11), 1512-1523 (2020).
- Hayoun, K., et al. Evaluation of sample preparation methods for fast proteotyping of microorganisms by tandem mass spectrometry. Frontiers in Microbiology. 10, 1985 (2019).
- Templeton, E. M., et al. Comparison of SPEED, S-Trap, and in-solution-based sample preparation methods for mass spectrometry in kidney tissue and plasma. International Journal of Molecular Sciences. 24 (7), 6290 (2023).
- Ding, Z., Wang, N., Ji, N., Chen, Z. S. Proteomics technologies for cancer liquid biopsies. Molecular Cancer. 21 (1), 53 (2022).
- Nättinen, J., Aapola, U., Jylhä, A., Vaajanen, A., Uusitalo, H. Comparison of capillary and Schirmer strip tear fluid sampling methods using SWATH-MS proteomics approach. Translational Vision Science & Technology. 9 (3), 16 (2020).
- Bachhuber, F., Huss, A., Senel, M., Tumani, H. Diagnostic biomarkers in tear fluid: from sampling to preanalytical processing. Scientific Reports. 11 (1), 10064 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon