Method Article
Kombinatoryal Fiş Üretimi için İki Katmanlı Mikroakışkan Cihaz
Bu Makalede
Özet
Yağda su emülsiyonlarında (tapalar) kombinatoryal kütüphanelerin üretimi için polidimetilsiloksan (PDMS) bazlı iki katmanlı bir cihazın imalatı burada sunulmaktadır. Fiş üretimini otomatikleştirmek için gerekli donanım ve yazılım protokolde detaylandırılmıştır ve kantitatif bir floresan fiş kütüphanesinin üretimi de gösterilmiştir.
Özet
Damlacık mikroakışkanları, kimyasal olarak farklı nanolitre bölmelerde çok sayıda reaksiyonun yürütülmesine izin veren çok yönlü bir araçtır. Bu tür sistemler, tek hücrelerin inkübasyonundan PCR reaksiyonlarının uygulanmasına, genomikten kimyasal senteze kadar çeşitli biyokimyasal reaksiyonları kapsüllemek için kullanılmıştır. Mikroakışkan kanalların düzenleyici valflerle bağlanması, açılmaları ve kapanmaları üzerinde kontrol sağlar, böylece benzersiz bileşimlere sahip bir damlacık popülasyonundan oluşan büyük ölçekli kombinatoryal kütüphanelerin hızlı üretimini sağlar. Bu yazıda, tapa adı verilen yağda su emülsiyonlarının kombinatoryal kütüphanelerini oluşturmak için kullanılabilen, basınçla çalışan, PDMS tabanlı iki katmanlı bir mikroakışkan cihazın üretimi ve çalıştırılması için protokoller sunulmaktadır. Yazılım programlarını ve mikroakışkan donanımı birleştirerek, cihazdaki istenen sıvıların akışı, kombinatoryal fiş kütüphaneleri oluşturmak ve bileşen fiş popülasyonlarının bileşimini ve miktarını kontrol etmek için kontrol edilebilir ve manipüle edilebilir. Bu protokoller, özellikle kanser hastası biyopsilerinden elde edilen hücrelerdeki ilaç yanıtını incelemek için kombinatoryal ekranlar oluşturma sürecini hızlandıracaktır.
Giriş
Mikroakışkanlar, mikrokanallardaki küçük miktarlardaki sıvıların manipülasyonuna izinverir 1. Tipik mikroakışkan cihazların çalışma ölçeği, kimyasal ve biyolojik reaksiyonların minyatürleştirilmesine izin veren ve böylece bu tür reaksiyonların nispeten küçük miktarlarda reaktiflerle gerçekleştirilmesini sağlayan onlarca ila yüzlerce mikrometredir. Başlangıçta, mikroakışkan cihazlar silikon2 ve cam3 gibi malzemelerle üretildi. Hala kullanımda olmalarına rağmen4, solvent uyumluluğu, yüksek üretim maliyeti ve sıvı akışı 5,6 kontrollerinin entegrasyonundaki zorluklar gibi bazı sorunlar ortaya çıkarmaktadırlar. Yumuşak litografi olarak adlandırılan PDMS tabanlı üretim metodolojileri, cihazların7 hızlı prototiplenmesi için ucuz bir alternatif ve karmaşık çokkatmanlı cihazlar 8 üretmek için bir yol sunar. PDMS cihazlarına valflerin ve pompaların eklenmesi, 9,10 cihazlarındaki sıvıların yönlendirilmesini ve hızını kontrol etme yeteneği sağlar. Mikro valfleri geri dönüşümlü veya geri dönüşümsüz bir şekilde tasarlamak ve harekete geçirmek için çeşitli yöntemler geliştirilmiştir - örneğin, termal olarak çalıştırılan11 silikon ve alüminyumdan yapılmış bimetalik valfler veya bir silikon nitrür membranı12 saptırmak için bir elektrokimyasal reaksiyondan üretilen gazı kullanarak. Gu ve ark. akışı düzenlemek için mikro kanallara basınç uygulamak için bir Braille ekranının mekanik pimlerinin kullanımını göstermektedir13. Popülerlik kazanan bir mikro valf seti, Stephen Quake14 grubunun öncülük ettiği pnömatik PDMS tabanlı valflerdir. Tipik olarak, bu tür valfler iki ortogonal mikro kanaldan oluşur - bir akış kanalı ve bir kontrol kanalı. Kontrol kanalının basınçlandırılması üzerine, ince bir PDMS membranı akış kanalına sapar, onu kapatır ve böylece sıvı akışını kesintiye uğratır. Basıncı düşürüldükten sonra, membran gevşer, böylece akış kanalını açar ve sıvı akışının yeniden başlamasına izin verir. PDMS valfleri böylece sağlam ve geri dönüşümlü bir şekilde akış regülasyonuna izin verir, çünkü kontrol kanalı birden çok kez basınçlandırılabilir ve basınçsız hale getirilebilir15. Ek olarak, bu tür valfler basınç uygulanarak harekete geçirilebildiğinden, dijital kontrol ve otomasyon için yollar açarlar16. Ayrıca, aynı malzemeden oldukları için, yumuşak litografi teknikleri 8,17,18 kullanılarak PDMS tabanlı cihazların imalatına sorunsuz bir şekilde entegre edilebilirler. Bu özellikler, PDMS valflerini mikroakışkan cihazlarda akış regülasyonu için çekici bir seçim haline getirir. Thorsen ve ark. yirmi kontrol kanalı ile yaklaşık bin giriş akış kanalını ele almak için bir akışkan çoklayıcı - bir pnömatik valf dizisi - tasarlamak için bu tür valflerin prensibini kullandı19. Bu ilke, sıvıları çip içi mikroakışkan kemostatlara seçici olarak yönlendirmek için genişletilmiştir, böylece her reaktörde 20,21,22,23 aynı anda benzersiz reaksiyonlar gerçekleştirilebilir. Bununla birlikte, bu tür mikro reaktörler, sınırlı reaktiflerin kullanımını optimize etmede yararlı olsa da, çoklu reaksiyonları paralelleştiremez ve yüksek verimli çalışmalar için yeterli değildir.
Damlacık mikroakışkanları, mikroakışkan cihazlarda karışmayan, çok fazlı sıvı akışının manipülasyonu yoluyla damlacıkların üretimini içeren bir mikroakışkan alt kategorisidir24. Damlacık oluşumu, karışmayan bir sıvının eklenmesiyle sürekli bir sıvının parçalanmasını içerir, bu da arayüzey enerjisindeki kararsızlık ve bir emülsiyon oluşumu nedeniyle bir sıkışma ile sonuçlanır25. Yüzey aktif maddeler, arayüzey enerjilerini stabilize ederek emülsiyonlar mikrokanaldan ayrıldığında yuvarlak damlacıkların oluşumuna yardımcı olur26. Tıkaç adı verilen daha büyük damlacıklar daha az kararlıdır ve her iki tarafta bir veya daha fazla karışmayan sıvı ile aralıklı bir dizi sulu bölme olarak bir tutma bölmesinde (bir boru uzunluğu gibi) toplanabilir27. Minyatürleştirme ve bölümlere ayırmaya ek olarak, damlacık mikroakışkanları, her biri bir nanoreaktör28 görevi gören çok sayıda monodispers damlacık üretilebildiğinden, biyolojik reaksiyonların artan verimini de sunar. Damlacıklar, bir kez üretildikten sonra,bölme 29,30, füzyon31,32, sıralama33,34 ve daha yüksek dereceli yapılarabirleştirme 35,36 gibi daha ileri manipülasyonlara da tabi tutulabilir. Damlacık mikroakışkanları, PCR37'den tek hücreli transkriptomiklere38, ilaç keşfinden 39,40'a kadar virolojiye 41'e, yeni nesil dizilemeden 42'ten kimyasal senteze43'e kadar birçok bilimsel alanda ve teknolojide devrim yarattı.
PDMS tabanlı yumuşak litografi ve mikro valflerin damlacık teknolojisi ile entegrasyonu, mikro kanallardaki sıvı akışının düzenlenmesine ve ardından damlacık içerikleri üzerinde kontrole izin veren güçlü bir kombinasyondur. Kanalların açılıp kapanmasına bağlı olarak, her biri belirli bir bileşime sahip farklı damlacık popülasyonları üretmek mümkündür. Böyle bir platform, biyokimyasal reaksiyonları minyatürleştirebilir, bölümlere ayırabilir ve paralelleştirebilir ve bu nedenle kombinatoryal tarama için yararlı bir teknik olabilir44. Kombinatoryal tarama, bilinen bileşime sahip bireysel popülasyonlardan oluşan kütüphaneler üretmek için seçilen reaktiflerin on binlerce kombinasyonunu oluşturmak için yüksek verimli bir yöntemdir. Bakteriyel büyüme inhibisyonu için ilaçlar ve antibiyotikler arasındaki sinerjik etkileri keşfetmek için kombinatoryal tarama kullanılmıştır45. Kanser tedavisi alanında, belirli bir hasta için anti-kanser ilaçlarının kombinasyonlarını test etmek ve böylece kişiselleştirilmiş tedaviyi ilerletmek için kombinatoryal tarama kullanılmıştır46,47. Mathur ve ark. yüksek verimli ilaç taramasında transkriptom değişikliklerini değerlendirmek için kombinatoryal bir DNA barkodlama yaklaşımını entegre ederek bu teknolojiyi geliştirmişlerdir48. Bu nedenle, kombinatoryal tarama güçlü ancak yeni ortaya çıkan bir teknolojidir ve bu tür tarama prosedürlerini yürütmek ve kolaylaştırmak için çeşitli mikroakışkan teknolojilerin geliştirilmesine ihtiyaç vardır.
Bu el yazmasının amacı, yağda su tapalarının kombinatoryal bir kütüphanesi oluşturabilen iki katmanlı bir mikroakışkan cihazın üretimi için eksiksiz bir protokol seti sunmak ve böyle bir cihazın çalışması için gereken donanım ve yazılımı tanımlamaktır. Sıvı akışı, basınç kontrollü PDMS tabanlı pnömatik valfler kullanılarak düzenlenir ve bunlar da özel bir LabVIEW programı tarafından kontrol edilir. Cihazdaki reaktiflerin akışı, piyasada bulunan basınç pompaları kullanılarak sağlanır. Her biri sulu bir reaktif içeren üç girişin içeriğinden bir tapanın oluşturulduğu sekiz girişli bir prototip sunulmaktadır. Sulu faz, sürekli bir yağ fazı ile buluşur ve tapalar, 0.33 Hz frekanslı bir T-bağlantısında üretilir. Sistemin işleyişi, üç farklı floresan tıkaç popülasyonu içeren nicel bir kütüphane üretilerek gösterilmiştir. Bu teknoloji ve protokol seti, yüksek verimli tarama amaçları için kombinatoryal kütüphanelerin üretimini hızlandırmaya yardımcı olacaktır.
Protokol
1. Yumuşak litografi
NOT: Mikroakışkan cihaz, akış katmanı ve kontrol katmanı olmak üzere iki katmandan oluşur (Şekil 1A) ve her katman, sırasıyla pozitif ve negatif bir fotorezist kullanılarak ayrı ayrı desenli gofretlerden kalıplanır (Fotorezist ve geliştiricilerin ayrıntıları için Malzeme Tablosuna bakın).
- Akış katmanı için gofret imalatını aşağıda açıklandığı gibi gerçekleştirin.
- Bir silikon gofreti (100 mm çap, <1-0-0> odaklı, 525) gece boyunca (12-16 saat) 250 °C'de kurutun.
- Döndürme kaplamaya geçmeden önce gofretin soğumasını bekleyin. Gofretin merkezine 3-4 mL pozitif fotorezist uygulayın.
- 45 μm'lik bir özellik yüksekliği elde etmek için 1400 rpm'de (344 rpm/s) 40 s döndürün.
- 450 °C /s oranında 35 °C'den 105 °C'ye yükselen bir sıcaklık rampası kullanarak bir ocak gözü üzerinde yumuşak pişirin. Bu adım, doğrudan teması önlemek ve fotorezistin kabarcıklanmasını en aza indirmek için mikrofiber dokular üzerinde de gerçekleştirilebilir. Gofretleri ocak gözünden çıkarın ve mikrofiber dokular üzerinde soğumaya bırakın.
- Akış katmanına (emülsiyon tarafı aşağı) karşılık gelen fotomaskeyi (ticari olarak üretilen) direnç kaplı silikon gofret üzerine yerleştirin ve toplam 200 mJ/cm2 maruziyete ulaşılana kadar 10 mW/cm2'de bir UV lambası altında maruz bırakın.
- Plakalar üzerinde sırasıyla 65 dakika ve 95 dakika boyunca maruziyet sonrası pişirme yapmak için biri 1 °C'de diğeri 7 °C'de olmak üzere iki ocak gözü kullanın.
- Gofret'i, pozitif fotorezist için geliştiriciyle dolu bir Petri kabına aktararak geliştirin. Petri kabını, gofret tamamen suya batırılmış halde bir tezgah üstü çalkalayıcı üzerinde sallayarak çalkalayın ve gofret tamamen gelişene ve özellikler net bir şekilde görülebilene kadar geliştirici solüsyonunu periyodik olarak yenileyin.
- Gofretten kalan direnci durulamak için demineralize su kullanın ve kanalların içinde herhangi bir kalıntı olup olmadığını stereo mikroskop altında kontrol edin. Gofreti geliştirici çözeltisine geri döndürerek veya geliştiriciyi bir mikropipet ile gofrete dikkatlice ekleyerek kalıntıları çıkarın. Tamamlandığında, gofretleri bir nitrojen püskürtme tabancası kullanarak kurutun.
- Gofret'i 25 dakika boyunca 110 °C'ye ayarlanmış bir ocak gözüne yerleştirerek yeniden akıtın. Bu işlem yuvarlatılmış özelliklerle sonuçlanır.
- Adım 1.3'te ayrıntılı olarak açıklandığı gibi gofretin silanizasyonuna devam edin.
NOT: Heksametildisilazan (HMDS) buhar biriktirme, direnç ile yonga plakası arasındaki yapışmayı iyileştirmek için direncin uygulanmasından önce silikon gofretler üzerinde de gerçekleştirilebilir.
- Kontrol katmanı için Gofret imalatını aşağıda açıklandığı gibi gerçekleştirin.
- Başka bir silikon gofret alın ve 15 dakika boyunca 110 °C'ye ayarlanmış bir ocak gözüne koyarak kurutun.
- Gofretleri çıkarın ve sıkma kaplamasına devam etmeden önce oda sıcaklığına soğumasını bekleyin.
- Gofretin merkezine 5 mL negatif fotorezist uygulayın.
- 40 μm'lik bir özellik yüksekliği elde etmek için aşağıdaki sıkma protokolünü kullanın: 500 rpm'de 5 sn (100 rpm/s hızlanma), 1400 rpm'de (300 rpm/s) 33 sn ve son olarak 300 rpm/s'de 5 s için 0 rpm'ye yavaşlayın.
- Sırasıyla 1 dakika ve 15 dakika boyunca 65 °C ve 95 °C'ye ayarlanmış iki ayrı ocak gözü kullanarak yumuşak pişirin. Gofretleri ocak gözünden çıkarın ve mikrofiber dokular üzerinde soğumaya bırakın.
- Kontrol katmanına (emülsiyon tarafı aşağı) karşılık gelen fotomaskeyi (ticari olarak üretilen) direnç kaplı gofret üzerine yerleştirin ve gofreti, toplam 250 mJ/cm2 maruziyete ulaşılana kadar 15 mW/cm2'ye ayarlanmış bir UV lambasının altına maruz bırakın.
- Biri 65 °C'de ve diğeri 95 °C'de olmak üzere iki ocak gözü kullanın ve gofretin maruziyetten sonra sırasıyla 2 dakika ve ardından 5 dakika pişirin. Gofretleri ocak gözünden çıkarın ve mikrofiber dokular üzerinde soğumaya bırakın.
- Gofret'i 4 dakika boyunca negatif fotorezist için geliştirici ile dolu bir Petri kabına aktararak geliştirin. Geliştiriciyi yenileyin ve işleme 4 dakika daha devam edin.
- Artık fotorezisti çıkarmak için gofretleri izopropanol ile durulayın ve gofretin kanalların içinde herhangi bir kalıntı olup olmadığını kontrol etmek için bir stereo mikroskop kullanın.
- Gofreti geliştirici çözeltisine geri döndürerek veya geliştiriciyi bir mikropipet ile gofrete dikkatlice ekleyerek kalıntıları çıkarın. Tamamlandığında, gofretleri bir nitrojen püskürtme tabancası kullanarak kurutun.
- Tamamen geliştikten sonra, gofreti 10 dakika boyunca 95 °C'ye ayarlanmış bir ocak gözüne yerleştirerek fotorezisti sert bir şekilde pişirin.
- Adım 1.3'te ayrıntılı olarak açıklandığı gibi silanizasyona devam edin.
- Silanizasyonu aşağıda açıklandığı gibi gerçekleştirin.
- Gofret'i bir desikatöre yerleştirin. Kurutucuya bir cam şişe yerleştirin ve 4-5 damla 1,1,3,3 tetrametildisiloksan ekleyin.
DİKKAT: 1,1,3,3 tetrametildisiloksan toksik değildir ancak yanıcıdır. Diğer silanlar kullanılabilir, ancak toksik olabilirler. Laboratuvar önlüğü, gözlük ve nitril eldiven gibi gerekli Kişisel Koruyucu Donanımları (KKD) giyerken çeker ocakta silanizasyon yapılması tavsiye edilir. - Vakumu 15 dakika çekin ve silanın gofret üzerinde birikmesini sağlamak için kurutucuyu 12-16 saat kapatın.
- Kurutucuyu açın ve cam şişeyi atın. Gofretleri temiz bir Petri kabına yerleştirin.
- Gofret'i bir desikatöre yerleştirin. Kurutucuya bir cam şişe yerleştirin ve 4-5 damla 1,1,3,3 tetrametildisiloksan ekleyin.
- Mikroakışkan cihaz imalatını aşağıda açıklandığı gibi gerçekleştirin.
NOT: Aşağıdaki protokol önceki çalışmalardan uyarlanmıştır23.- Biri akış katmanı, diğeri kontrol katmanı için olmak üzere iki ayrı PDMS çözümü hazırlayın. Her çözelti için, PDMS kitinin baz maddesini ve sertleştirici maddesini bir beherde karıştırın ve bir karıştırma çubuğu kullanarak karıştırın. Kontrol tabakası 10 g baz ajan ve 0.5 g kürleme ajanı (20:1 oran) gerektirirken, akış tabakası 40 g baz ajan ve 8 g kürleme ajanı (5:1 oran) gerektirir.
- Çözeltiler gazsız olana kadar PDMS çözeltilerini bir desikatörde gazdan arındırın.
- Silanize akış tabakası gofretini folyo ile kaplı bir Petri kabına yerleştirin ve karşılık gelen PDMS solüsyonunu gofretin üzerine dökün. Petri kabını desikatöre geri yerleştirin ve gazı daha fazla gidermek için vakumu çekin (yaklaşık 20 dakika).
- Silanize kontrol katmanı gofretini karşılık gelen PDMS çözeltisi ile döndürün. Gofretin ortasına 3-4 mL solüsyon dökün ve 408 rpm/s'de 1500 rpm'de 20 saniye döndürün. Gofretleri 20 dakika boyunca kapalı bir Petri kabında düz bir yüzeye yerleştirin.
- Hem akış hem de kontrol katmanlarını 80 °C'de 18-20 dakika fırına yerleştirin. Kürlenip kürlenmediklerini kontrol etmek için iki katmanı periyodik olarak izleyin. Katmanlar, dövülebilir ancak biraz yapışkan olacak kadar sert olduklarında hazırdır, çünkü bu, iki katman arasındaki bağı geliştirir.
- Akış katmanı gofret üzerindeki cihazların her birinin etrafındaki PDMS'yi bir neşter ile kesin. Özelliklere çok yakın kesmediğinizden ve özellik ile PDMS'nin kenarları arasında yaklaşık 2 cm boşluk bıraktığınızdan emin olun. Silikon gofretten ayrıldıktan sonra, herhangi bir toz kirlenmesini önlemek için PDMS bloğunu özellik tarafında bantla kapatın.
- Tüm PDMS blokları kesildikten sonra, gözle kaba bir hizalama yaparak bunları ilgili kontrol katmanı gofretine tek tek yerleştirin.
- Tüm bloklar kontrol katmanındaki karşılık gelen alanlarına yerleştirildikten sonra, hizalamayı tamamlamak için kontrol vanaları ilgili akış kanalları üzerinde üst üste gelecek şekilde blokların her birinin konumunu ayarlayın. Bu aynı zamanda bir stereo mikroskop yardımıyla da gerçekleştirilebilir.
- Basınç uygulayarak iki katman arasındaki hava ceplerini çıkarın. Hava cebi bir özelliğin üzerinde veya yakınındaysa, basınç uygularken kanalları daraltmamaya dikkat edin.
- Cihazları 80 °C fırına koyun ve 12-16 saat yapışmaya bırakın. İki katman arasındaki bağı iyileştirmek için cihazların her birine 100 g ağırlık yerleştirin.
- Gofret'i çıkarın ve her bir cihazı ayrı ayrı kesin. Cihazları kontrol katmanı gofretinden soyun ve özellik tarafını bantla kapatın.
- Her bir cihazı, özellik tarafı yukarı bakacak şekilde bir kesme matı üzerine yerleştirin ve özellik tarafı yukarı bakacak şekilde 0.75 mm'lik bir biyopsi zımbası kullanarak sekiz akış katmanı girişi, sekiz kontrol katmanı kanal girişi, yağ girişi ve çıkışın her biri için bir delik açın.
- Plazma asher'ı bir mikroskop lamı ve bant çıkarılmış ve özellik tarafı yukarı bakacak şekilde tek bir cihazla yükleyin. Oksijen plazma külleme işlemini 20 s'lik bir süre boyunca 30 W gücünde gerçekleştirin.
- Külleme tamamlanır tamamlanmaz cihazı ve cam sürgüyü çıkarın ve cihazı, özellik tarafı aşağı bakacak şekilde sürgünün üzerine yerleştirin. PDMS ve cam arasındaki yapışma çıplak gözle hemen görülebilmelidir. Havayı dışarı atmak için hava cepleri olan tüm bölgelere baskı uygulayın.
- PDMS'nin cama yapışmasını iyileştirmek için cihazları, üzerinde bir ağırlık olacak şekilde 60 dakika boyunca 110 °C'ye ayarlanmış bir ocak gözüne yerleştirin.
2. Donanım kurulumu
NOT: Mikroakışkan cihaza yapılan bağlantıların bir şeması Şekil 1B'de gösterilmiştir ve gerekli donanım kullanılarak böyle bir şemanın gerçekleştirilmesi Şekil 2'de gösterilmiştir.
- Pnömatik valfleri aşağıda açıklandığı gibi ayarlayın.
NOT: Çip üzerindeki bir PDMS valfini düzenleyen her kontrol kanalı, sırayla tek bir solenoid valf tarafından kontrol edilir. Burada sunulan prototip sekiz kontrol kanalından oluşur (Şekil 1A) ve bu nedenle sekiz solenoid valf gereklidir.- Solenoid valfler, özel bir LabVIEW yazılım programı (Ana Arayüz Programı; Şekil 3 ve Ek Dosya 1, Ek Dosya 2, Ek Dosya 3, Ek Dosya 4). Bu program, MODBUS komutlarını bir TCP bağlantısı (Ek Dosya 5, Ek Dosya 6) üzerinden bir WAGO denetleyicisine gönderir. WAGO cihazını bir ethernet kablosu kullanarak LabVIEW programı ile bilgisayara bağlayın. Solenoid valfleri sırayla WAGO kontrol cihazındaki bağlantı noktalarına bağlamaya devam edin. Daha ayrıntılı bir açıklama için lütfen daha önce açıklanan protokollerebakın 23.
- Solenoid valf dizisini 1/4 inç boru kullanarak bir basınçlı hava kaynağına bağlayın ve valf dizisinin basıncını 3,5 bar'a ayarlayın. Bu sistemde, 9-16 ile işaretlenmiş sekiz valf kullanılmıştır.
- Basınç regülatörlerini aşağıda açıklandığı gibi ayarlayın.
NOT: Sıvı akışını kontrol etmek için piyasada bulunan bir basınç pompası kullanılır (Şekil 2). Cihazdaki sekiz sulu girişi ve iki yağ girişini barındırmak için sekiz portlu ve dört portlu bir pompa seti kullanıldı. Her portun basıncı, üreticiler tarafından sağlanan yazılım aracılığıyla düzenlenir.- Sağlanan basıncın pompanın izin verdiği maksimum basıncı aşmadığından emin olarak basınç pompasını bir basınçlı hava kaynağına bağlayın (hem sekiz portlu hem de dört portlu kontrolörler için 2,2 bar).
- Basınç pompalarını bir USB konektörü kullanarak bir bilgisayara bağlayın.
- Pompalar açıldıktan sonra, ilgili yazılımda görünür olmalıdırlar. Pompaları kurarken basınçları sıfıra ayarlayın.
- Kontrolörlerdeki 3 dişi luer kilidi çıkış bağlantı noktasının her birine 3/12 inç dikenli konektöre bir erkek luer bağlayın.
- Dikene bir parça yumuşak boru (OD: 3 mm, ID: 1 mm, L: 15 cm) bağlayın. Yumuşak borunun diğer ucuna 3/32 inç dikenli konektöre başka bir erkek luer bağlayın.
- Barb konektörüne bir luer saplaması (23 G, 0.5 inç) bağlayın. Bu noktada basınç regülatörü kurulur ve kullanıma hazır hale gelir.
3. Mikroakışkan cihaz kurulumu
- Kontrol kanalı borusunu aşağıda açıklandığı gibi bağlayın (Şekil 2).
- Her kontrol kanalı için bir uzunlukta PoliTetraFloroEtilen (PTFE) boru kesin (OD: 0,042 inç, ID: 0,022 inç). 23 G, 0.5 inç luer saplamanın pimini bir ucuna yerleştirin.
- Luer saplamasını bir erkek luer'e dikenli naylon konektörde 3/32'ye bağlayın. Konektörün dikenini uzun bir poliüretan boruya yerleştirin (OD: 4 mm, ID: 2.5 mm). Poliüretan borunun diğer ucunu doğrudan bir solenoid valfe bağlayın.
- Bir şırıngayı suyla doldurun ve sonunda 23 G, 0.5 inç luer saplaması bağlayın.
- PTFE tüpünün serbest ucunu bu şırıngaya bağlayın ve tüpün yaklaşık yarısına kadar su enjekte edin.
- Boruyu şırıngadan ayırın ve borunun serbest ucunu ilgili kontrol kanalının delinmiş bir deliğine sokun (Şekil 1A-C 1-8). Her kontrol kanalı ilgili solenoid valfe bağlanana kadar tekrarlayın.
NOT: Bu yazıda, solenoid valfler 9-16, sırasıyla C1 ila C8'e karşılık gelen kontrol kanallarına bağlanmıştır. Bunlar herhangi bir şekilde bağlanabilse de, özellikle Ana Arayüz programını çalıştırırken bağlantıların sırasını ve sırasını hatırlamak önemlidir. - Tüm solenoid valfleri açmak için Ana Arayüz programını (Şekil 3) kullanın (Tüm kontrol kanallarını basınçlandırın). Bu, sıvıyı borudan mikroakışkan cihazın kontrol kanallarına itecek ve böylece onu dolduracaktır. Basınçlı ve basınçsız vanaların bir örneği Şekil 4'te gösterilmiştir.
- Reaktifleri bağlayın ve cihazı aşağıda açıklandığı gibi astarlayın.
- Ana Arayüz programındaki Tüm Kontrol Kanallarını Basınçlandırın düğmesine basarak tüm kontrol kanallarının basınçlandırıldığından emin olun (Şekil 3).
- Sulu reaktiflerin her biri için, pompaları mikroakışkan cihaz girişlerinin girişlerine bağlamak için yeterince uzun bir PTFE boru segmenti (OD: 0.042 inç, ID: 0.022 inç) kesin. Borulardan birini adım 2.2.6'daki luer saplamasına bağlayın.
- Bir şırıngayı gerekli reaktifle doldurun ve sonunda 23 G, 0.5 inç luer saplaması bağlayın.
- Reaktifi, boru dolana kadar ilgili PTFE tüpüne enjekte edin. Reaktifin pompa setindeki çıkış portuna girmemesine dikkat edin.
- Borunun serbest ucunu mikroakışkan çipteki karşılık gelen bir girişe yerleştirin.
- Sağlanan yazılımı kullanarak giriş sulu reaktiflerinin her birine 400 mbar'lık bir basınç uygulayın.
- Tüm reaktiflerin cihazın T-bağlantısına ulaştığından emin olmak için Ana Arayüz programını (Şekil 3) kullanarak kontrol kanallarının basıncını ayrı ayrı sırayla boşaltın. Gerekirse, kutudaki programdaki ilgili düğmelere basarak tek tek vanaları çalıştırın Kontrol Kanalları Manuel Basınçlandırma.
- Yağ reaktifleri için 3.2.3 ila 3.2.5 arasındaki adımları tekrarlayın. Giriş yağı reaktiflerinin her birine 400 mbar'lık bir basınç uygulayın.
- Cihazdaki tüm hava çıkana kadar Tüm Kontrol Kanallarının Basıncını Boşalt (Şekil 3) düğmesine basarak tüm kontrol kanallarının basıncını aynı anda boşaltın. Bu çıplak gözle veya mikroskop altında gözlemlenebilir.
- Tüm Kontrol Kanallarını Basınçlandırın düğmesine basarak tüm kontrol kanallarını basınçlandırın (Şekil 3). Bu aşamada, tüm reaktifler bağlanmış ve cihaz astarlanmış ve kullanıma hazır hale getirilmiştir.
- Deneyi aşağıda açıklandığı gibi programlayın ve yürütün.
- Üretilecek her bir fiş popülasyonunun bileşimini, sırasını ve kopyalarını, Ana Arayüz programındaki Otomatik Deney için girdi görevi gören Ek Dosya 7'de gösterildiği gibi bir .csv dosyasında kodlayın (Şekil 3). Gerekli kontrol kanallarını, bir girişe karşılık gelen bir girişin açık olması gerekiyorsa 0 ve kapatılması gerekiyorsa 1 ile işaretleyin. .csv dosyasındaki her satır, ayrı bir fiş popülasyonuna karşılık gelir.
- Experiment File (Deney Dosyası) sekmesindeki Folder (Klasör) butonuna tıklayarak .csv Ana Arayüz programına yükleyiniz.
- Deney yinelemeleri (verilen fiş dizisinin kaç kez üretildiğini belirlemek için), Basınçsızlaştırma süresi (giriş kanallarının ne kadar süreyle açık olması gerektiğini ve karşılık gelen kontrol kanalının milisaniye cinsinden basınçsızlaştırılması gerektiğini belirlemek için), Basınçlandırma süresi (fiş popülasyonu dizileri arasında girişlerin ne kadar süreyle kapatılması gerektiğini milisaniye cinsinden belirlemek için) gibi ilgili alanları programa girin.
- Barkod Girişleri (3 kanala kadar) bölümünde barkod üretimine karşılık gelen giriş kanal(lar)ını ve açık kalmaları gereken süreyi seçin (Barkodlama Süresi (ms)). Alternatif olarak, bu barkodlar Ek Dosya 7'de gösterildiği gibi giriş .csv dosyasına da sabit kodlanabilir.
- Giriş yağı reaktiflerinin basıncını 200 mbar'a düşürün.
- Fişleri toplamak için prize istenen uzunlukta bir PTFE boru (OD: 0.042 inç, ID: 0.022 inç) bağlayın. Düzgün tapa üretimini sağlamak için, toplama için tapalarla önceden doldurulmuş yaklaşık 100 cm'lik borular kullanın. Bu, borudaki tapaların toplanmasıyla uygulanan çıkıştaki basınç farkını nötralize etmek içindir.
- Programı başlatmak ve üretimi takmak için Deneyi Çalıştır'a basın.
- Veri kaydını ve analizini aşağıda açıklandığı gibi gerçekleştirin (bkz. Şekil 5).
NOT: Bu bölüm özellikle floresan fişleri analiz etmek için bir yöntemi özetlemektedir. Oluşturulan fişlerin yapısına bağlı olarak, bu bölüm gerektiği gibi değiştirilebilir.- Bir şırıngayı yağla (mineral yağ veya florlu yağ) doldurun ve sonunda 23 G 0.5 inç luer saplaması bağlayın. Şırıngayı bir pompaya sabitleyin.
- Doldurulmuş toplama borusunun uçlarından birini şırınga üzerindeki luer saplamasına bağlayın. Doldurulmuş toplama borusunun diğer ucunu bir mikroskobun objektif merceğinin üzerine yapıştırın.
- Borunun ucunun altına, hedefin yakınına bir atık haznesi yerleştirin.
- Mikroskobu borunun belirli bir bölgesine odaklayın ve istenen kanal(lar)da floresan kaydedecek şekilde ayarlayın.
- Pompayı 50 μL/dk'lık bir akış hızına ayarlayın.
- Floresan kanalın videosunu bir .avi dosyası olarak kaydedin.
- .avi dosyasının karesi başına önceden tanımlanmış bir ilgi alanındaki (ROI) ortalama floresansı çıkarmak için sağlanan python komut dosyasını (Ek Dosya 8) kullanarak .avi dosyasını analiz edin (bunun bir örneği Ek Dosya 9'da verilmiştir).
- Koşulları ayıklamak ve ham verileri ve tepe yüksekliklerini çizmek için sağlanan özelleştirilmiş R betiğini (Ek Dosya 10) kullanın.
NOT: Bu yazıda analiz için Ek Dosya 10'daki R betiği kullanılmıştır. Bu komut dosyasında verileri kesmek, barkodları kullanarak koşulları algılamak ve tek tek fişler ve çizim için tepe yüksekliklerini analiz etmek için kullanılan özel yapım R işlevleri Ek Dosya 11'de verilmiştir.
Sonuçlar
Mikroakışkan çipin en önemli özelliklerinden biri PDMS valfleridir ve sıvı akışını düzenleme yetenekleri, cihazın operasyonel paradigmasını etkilediği için karakterize edilmiştir. Bu amaçla, giriş kanallarından damıtılmış suyun akış hızı (ticari bir akış hızı sensörü kullanılarak ölçülen), PDMS valflerini periyodik olarak basınçlandırırken (2000 ms için 3,5 bar) ve basınçsızlaştırırken (1000 ms) farklı giriş basınçlarının bir fonksiyonu olarak kaydedilmiştir (Şekil 6A). Vanalar harekete geçirildiğinde akış hızının sıfıra düşmesi ile gösterildiği gibi, vanaların yaklaşık 800 mbar giriş basıncına kadar sıvı akışını düzenleyebildiği görülmüştür (Şekil 6 B-D). Bu, kanalların içindeki reaktiflerin akışını düzenlemek için bu tür PDMS tabanlı valflerin kullanımını doğrular. Ayrıca, 1200 mbar'da, akış hızının sıfıra düşmemesiyle kanıtlandığı gibi, giriş basıncı vanaların akışı düzenlemesi için çok yüksektir (Şekil 6E). PDMS valflerinin basınçlandırma ve basınçsızlaştırma süresi değiştirilebilirken, mevcut basınçlandırma (2000 ms) ve basınçsızlaştırma (1000 ms) koşullarına göre sıvı akışının değişim hızı hesaplanmıştır. 400 mbar'lık bir giriş basıncı için akış, sırasıyla 1,26 Hz ve 1,44 Hz hızında açılıp kapatılabilir (Şekil 6C).
Benzer bir kombinatoryal yüksek verimli mikroakışkan cihazın önceki yinelemeleri, her akış kanalına bağlı bir atık kanalıda içeriyordu 46,47. Bu cihazlar, sabit bir akış hızı rejiminde (reaktiflerin cihaza sabit basınç yerine sabit akış hızlarında enjekte edildiği) çalıştırıldı ve atık kanalları, herhangi bir basınç oluşumunu hafifletmek için karşılık gelen giriş kanalları kapatıldığında açılacak şekilde programlandı. Bu tür kanallar, yararlı olsa da, atık kanalının içeriği tıkaç oluşumuna katkıda bulunmadığından reaktif kaybına neden olur. Ayrıca, atık kanallarının açılıp kapanmasını düzenlemek için ek kontrol kanalları ve dolayısıyla ek pompalar da gereklidir. Burada sunulan prototipte, atık kanalları kaldırıldı ve reaktif israfının azaltılmasına ve tasarım ve operasyonel karmaşıklığın azaltılmasına izin veren operasyonel bir paradigma oluşturuldu. Bu, sulu reaktiflerin sabit akış hızı modunun aksine sabit basınç modunda enjekte edilmesini içerir. İki rejimi daha iyi anlamak için, valf çalıştırma sırasında kanallardaki basınç ve akış hızı arasındaki ilişki her durumda değerlendirildi (Şekil 6A'da gösterildiği gibi aynı kurulum kullanılarak), sonuçları Şekil 7'de gösterilmiştir. Şekil 7A'da, damıtılmış suyun akış hızı sabit bir basınçta (300 mbar) enjekte edilirken ölçülmüş ve vana aktivasyonu sırasında akış hızının sıfıra düştüğü ve vananın basıncının düşürülmesi ile akış hızının ön çalıştırma seviyelerine geri döndüğü gözlenmiştir. Bununla birlikte, damıtılmış suyun sabit bir akış hızında (2,5 μL/dak; Şekil 7B), valf aktivasyonu girişin tamamen kapanmasına neden olmadı - akış hızının sıfıra düşmemesiyle kanıtlandı - ve kanalda bir basınç birikmesi gözlendi. Bu, atık kanallarının açılmasıyla rahatlayan basınçtır. Sabit bir giriş basıncı rejimi, valf çalıştırıldığında cihazın geri basınç olmadan çalışmasına izin verdiğinden ve böylece atık kanallarına olan ihtiyacı ortadan kaldırdığından, bu rejim mikroakışkan çipin çalışması için benimsenmiştir.
Mikroakışkan cihazın işlevselliğini göstermek için, floresan tıkaçlardan oluşan kantitatif bir kombinatoryal kütüphane oluşturuldu. Cihazın sekiz girişine, üç sulu reaktif - dört girişte floresein (50 μM) (I1Ben3, Ben5, Ben7), üç girişte damıtılmış su (I4Ben6, Ben8), mavi renkli boya ile bir giriş (I2; barkod görevi görmek için) - ve iki yağ reaktifi - O girişlerinde florlu yağ (FC-40) ve mineral yağ (MO)1 ve O2, sırasıyla - fişe takıldı (Şekil 1A, Şekil 8A). Florlu yağ, sulu tapaların dağıldığı taşıyıcı faz görevi görür ve mineral yağ, tapa stabilitesine yardımcı olur ve tapa içeriğinin duvarlara yapışmasını en aza indirir, böylece tapalar arasındaki çapraz kontaminasyonu en aza indirir46. Tek bir tıkaç popülasyonunun bileşimine katkıda bulunan üç giriş ile bu konfigürasyon üç farklı floresan popülasyonu oluşturabilir: FFF - üç kanaldan floreseinden oluşur, FFW - iki kanaldan floreseinden oluşur ve bir kanaldan sudan oluşur ve FWW - bir kanaldan floresein ve iki kanaldan sudan oluşur. Bu kurulumla, FWW fişleri üretebilen 12 farklı koşul (üç girişin farklı bir kombinasyonu ile üretilen fiş popülasyonları), FFW fişleri üretebilen 18 farklı koşul ve FFF fişleri üretebilen dört farklı koşul vardır. Bu nedenle, çip, bu 34 farklı koşulu, her biri beş farklı çoğaltma fişi ve bunları ayıran beş kopya barkod fişi ile üretecek şekilde programlandı. Floresan tıkaç popülasyonlarının bir barkod popülasyonu, yani çıplak gözle görülebilen bir dizi renkli (ideal olarak floresan olmayan) tıkaç (bu durumda mavi boyaya karşılık gelen giriş kanallarının ve iki damıtılmış su kanalının açılmasıyla oluşturulur) ile serpiştirilmesi önerilir. Kullanıcının, fiş kırılması veya füzyon gibi sorunlar için fiş üretimini izlemesine olanak tanır ve fişlerin aşağı akış analizine yardımcı olur. Bu nedenle, toplam 340 fiş - farklı koşulları ayıran 170 deneysel fiş ve 170 barkodlama fişi - üretildi ve bir örneği PTFE boruda toplandı. Şekil 8B. Basınçsızlaştırma süresi ve basınçlandırma süresi sırasıyla 1000 ms ve 2000 ms olarak ayarlandı. Tıkaçların floresansı ve farklı deney koşulları içindeki ve arasındaki değişkenlikleri analiz edildi ve sonuçları şurada gösterildi: Şekil 8C,D. Şekil 8C Adım 3.4.6'da oluşturulan .avi dosyasının kare başına floresansını gösterir ve bu, dikkate alınan 34 deney koşulunu vurgular (mavi bir çizgi ile sınırlandırılmıştır). Bir koşul içindeki tepe noktalarının ortalama floresan değeri kırmızı ile gösterilir ve kesikli çizgiler o koşul içindeki standart hatayı gösterir. Her bir zirvede tespit edilen maksimum floresanstan temel floresansın çıkarılmasıyla elde edilen, her bir popülasyondaki tüm tıkaçların tepe noktalarının yükseklikleri şu şekilde çizildi: Şekil 8D. Her koşuldaki son tepe noktası, T-bağlantısındaki reaktiflerin birbirine karışması nedeniyle kontamine bir tıkaç olduğu için hesaplamalar için ihmal edildi (tapaların floresansı, tapa üretiminin ters sırasına göre kaydedildiğinden, üretim sırasında bir popülasyondaki ilk fiş, analiz sırasında bir popülasyondaki son fiştir). FWW fişlerinin yüksekliğinin yaklaşık üçte biri (ortalama = 40.9, standart sapma = 3.1) ve FFW fişlerinin yüksekliğinin yaklaşık üçte ikisi (ortalama = 78.4, standart sapma = 5) olduğu açıktı (ortalama = 117, standart sapma = 10). Bu sonuçlar, cihazın sağlamlığını ve işleyişini vurgulayan farklı FFF/FFW/FWW fiş popülasyonlarında beklenen floresan oranlarıyla eşleşir.
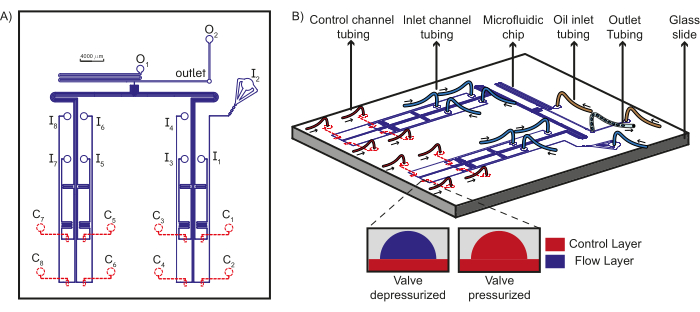
Şekil 1: Cihaz tasarımı ve mikroakışkan kurulumunun şeması. (A) Çipin akış katmanı mavi renkle gösterilir ve kontrol katmanı kırmızı ile gösterilir. Toplam sekiz benzersiz sulu reaktif, girişlerden (I1-8) T-bağlantısına doğru akabilir, burada çıkışta toplanan tapalar oluşturmak için yağ girişlerinden (O1-2) yağ fazlarıyla karşılaşırlar. Her giriş akış kanalı, benzersiz bir kontrol kanalının (C1-8) kontrolü altındadır. (B) Girişlere, kontrol kanallarına ve yağ reaktiflerine boru bağlantıları ile birlikte mikroakışkan çipin şeması, çıkış borusu ile birlikte gösterilmiştir. Oklar, borudaki sıvı akış yönünü gösterir. İç kısım, PDMS valflerinin çalışma prensibini gösterir. Kesikli çizgiler, kontrol katmanının akış katmanının altında olduğunu gösterir. Bu rakam Dubuc ve ark.49'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
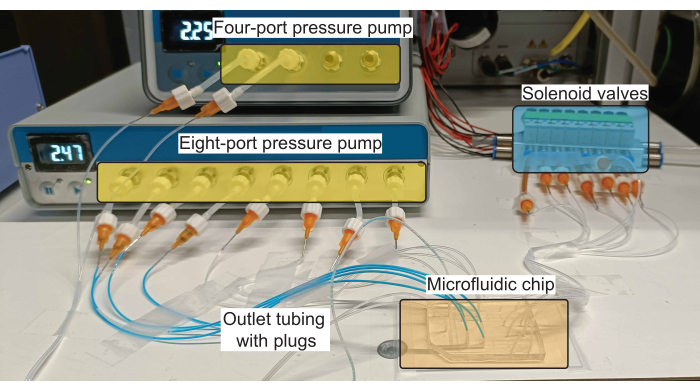
Şekil 2: Fiş üretimi için donanım kurulumunun şeması. Basınç pompaları, giriş kanallarındaki reaktiflerin (hem sulu hem de yağ) akışını kontrol eder ve solenoid valfler, PDMS valflerinin çalıştırılmasını kontrol eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Mikroakışkan cihazı kontrol etmek için ana arayüz programı. Bu özel yapım program, ayrı pnömatik valflerin (beyaz panel) manuel olarak basınçlandırılmasını sağlar. Ayrıca, istenen tapa popülasyonlarına ve valf basınçlandırma ve basınçsızlaştırma süreleri gibi gerekli parametrelere sahip bir .csv dosyasını kabul ettiği ve hangi kontrol kanallarının basınçlandırılıp basınçlandırılmadığı da dahil olmak üzere deney yürütme durumunu gerçek zamanlı olarak görüntülediği eksiksiz bir deneyin (mavi panel) yürütülmesine izin verir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Basınçla çalışan valf çalıştırma. (A) PDMS valfinin (yatay) basıncının düşürüldüğünü ve giriş kanalının (dikey) açık olduğunu ve (B) PDMS valfinin basınçlandırıldığını ve giriş kanalını kapattığını gösteren parlak alan mikroskobu görüntüleri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
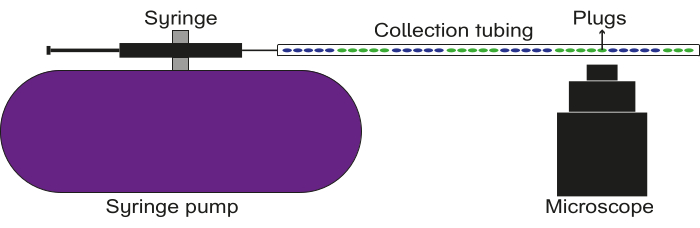
Şekil 5: Veri kayıt kurulumunun şeması. Toplama borusu, bir pompaya tutturulmuş yağ içeren bir şırıngaya bağlanır. Fişler toplama borusundan geçirilir ve görüntüler/videolar bir floresan mikroskobu kullanılarak yakalanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
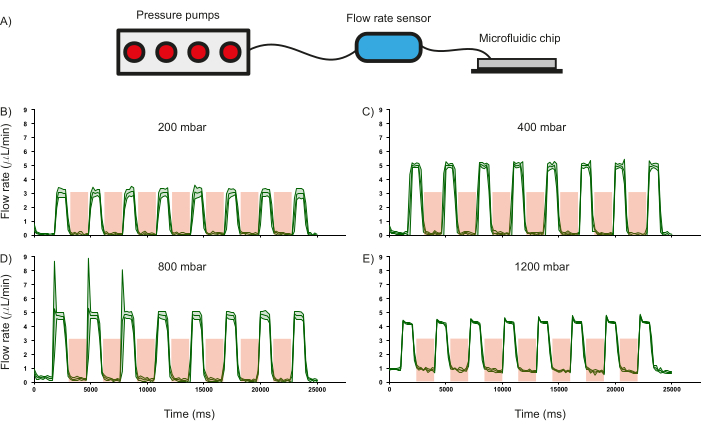
Şekil 6: Valf çalıştırmanın belirli bir giriş basıncındaki akış hızı üzerindeki etkisi. (A) Mikroakışkan kanallardaki akış hızını izlemek için kullanılan donanım kurulumunun şeması. (B) 200 mbar, (C) 400 mbar, (D) 800 mbar ve (E) 1200 mbar farklı giriş basınçlarında çalıştırıldığında kanallardaki akış hızının tepkisi. Valf çalıştırma süresi kırmızı gölgeli bölgede gösterilir. Tüm deneyler için damıtılmış su kullanılmıştır. Üç bağımsız ölçümün standart sapması yeşil gölgeli bölge ile gösterilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
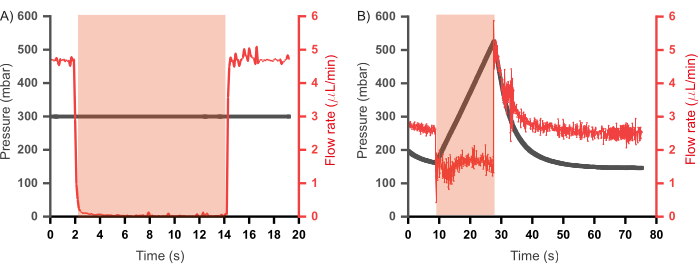
Şekil 7: Valf çalıştırıldığında giriş kanallarındaki reaktiflerin basıncı ve akış hızı arasındaki ilişki. (A) Sabit giriş basıncı rejiminde (300 mbar) valf, valf çalıştırıldığında akış hızı sıfıra düşer. (B) Sabit bir akış hızı rejiminde (2,5 μL/dak) valf çalıştırması, valf basıncı düşene kadar kanalda hızlı basınç oluşmasına neden olur. Valf çalıştırma süresi kırmızı gölgeli bölgede gösterilir. Tüm deneyler için damıtılmış su kullanılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
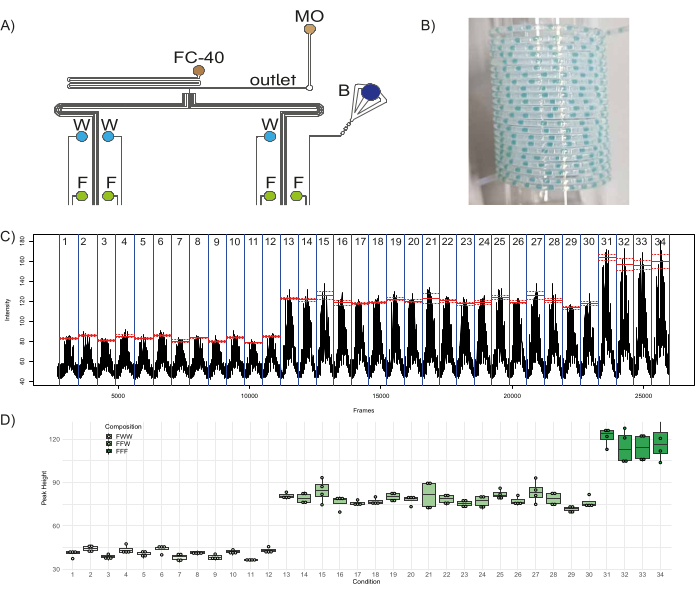
Şekil 8: Floresan tıkaç popülasyonlarının üretimi. (A) Farklı reaktiflerin cihaza bağlantısını gösteren deney düzeneğinin şeması. Kısaltmalar: F = Floresein, W = damıtılmış su, B = Mavi gıda boyası, FC-40 = florlu yağ ve MO = mineral yağ. (B) Tıkaç içeren toplama hortumunun örnek resmi. (C) Analizden elde edilen ham veriler, video dosyasının kare sayısına karşı belirli bir ilgi alanında (ROI) ölçülen ortalama floresan yoğunluğunu gösterir. Kırmızı çizgiler, her koşul için en yüksek floresan ortalamasını (üç girişin belirli bir kombinasyonu ile üretilen fiş popülasyonu) gösterir ve kesikli çizgiler karşılık gelen standart hatayı gösterir. (D) Farklı koşullarda tepe noktalarının yüksekliğinin kutu çizimleri. Noktalar tek tek tepe noktalarına karşılık gelir, her koşul için kutular, karşılık gelen tepe noktalarının dağılımının birinci ila üçüncü çeyreği arasında değişir ve medyan değer için kalın çizgi kullanılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: Cihazın çalışması için ana arayüz programı. Kontrol kanallarının manuel olarak basınçlandırılması ve sekiz girişli cihazda otomatik bir deney yapılması için kontrol arayüzü. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 2: Cihazın çalışması için alternatif ana arayüz programı. Sekiz girişli bir cihazı barkodlama işlevi olmadan çalıştırmak için kontrol arayüzü. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 3: Global değişkenlere sahip LabVIEW alt programı. Ana arayüz programının SubVI'sı, ana arayüz programındaki global değişkenlerin, yani kontrol kanallarının durumunu listelemek ve görüntülemek. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 4: Global değişkenlerin değerlerini kaydetmek için LabVIEW programı. Kullanıcının 30 saniyeden fazla hareketsiz kalması durumunda vanaların aynı durumunu korumak için kullanılacak olan, vanaların mevcut durumunu bir dizi olarak kaydeden ana arayüz programının SubVI'sı. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 5: İletim Kontrol Protokolü (TCP) LabVIEW programı. Ana arayüz programı ile WAGO kontrolörü arasındaki TCP bağlantısını sürdürmek için SubVI. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 6: TCP global değişkeni LabVIEW alt programı. TCP çıkış değişkenini saklamak için program. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 7: Otomatik deney yapmak için giriş. Bu yazıda ayrıntılı olarak açıklandığı gibi, kantitatif floresan tapalar üretmek için deneyler yapmak için fiş popülasyonlarının bileşimini, dizisini ve kopyalarını kodlayan .csv dosyası. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 8: Floresan tıkaç popülasyonunun analizi için Python komut dosyası. Fişlerin kaydından floresan değerlerini okumak için özel python komut dosyası (.avi dosyası). Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 9: Fişlerin floresan analizinin çıktısı. Fişlerin kaydından 5x5 ROI için floresan değerleri içeren Python betiğinden çıktı. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 10: Çıktı dosyasını okumak için R programı. Bu çalışmada çıkış floresan değerlerini okumak ve ham verileri, tepe yüksekliklerini ve standart sapmaları çizmek için kullanılan özel program. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 11: Floresan verileri analiz etmek ve çizmek için R fonksiyonları. 1 için kullanılan özel R işlevleri. Floresan değerlerin ham verilerini kesin, 2. Farklı deney koşullarını tanımlar, 3. Verilen koşullardan tepe noktalarını belirleyin, 4. ham verileri ve algılanan koşulların örtüştüğünü çizin ve 5. Belirlenen tepe noktalarını ve çakışan ham verileri çizin. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu yazıda, tapa adı verilen yağda su bölmelerinde kombinatoryal kitaplıkların otomatik olarak oluşturulması için PDMS tabanlı bir mikroakışkan cihazın üretimi ve çalıştırılması için bir dizi protokol sunulmuştur. Mikroakışkanların damlacık teknolojisi ile kombinasyonu, küçük miktarda reaktifi çok sayıda bölmede kapsüllemek için güçlü bir teknik sağlar, bu nedenle büyük ölçekli kombinatoryal tarama için yollar açar.
Daha önce, her biri kendi avantajları ve sınırlamaları olan mikroakışkanlar kullanarak kimyasal olarak farklı bölmeler oluşturmak için çeşitli teknolojiler tanımlanmıştır. Kulesa ve ark.50, mikrotitre plakaları kullanarak damlacıklar halinde barkodlu hücreleri kapsüllemek ve bu damlacıkları bir elektrik alanı kullanarak birleştirerek bir kombinatoryal kütüphane oluşturmak için bir strateji tanımladı. Böyle bir yaklaşım çok sayıda damlacık kombinasyonu oluşturabilse de, iş akışında manuel işleme adımlarına duyulan ihtiyaçla sınırlıdır. Tomasi ve ark.51 , sferoid (serbest yüzen hücre agregaları) içeren bir damlacığı bir uyaran damlacığı ile birleştirmek için bir mikroakışkan platform geliştirdi ve böylece küresel mikro çevrenin manipülasyonuna izin verdi. Bu yöntem, hücre-hücre etkileşimleri ve ilaçların etkisi gibi önemli olayların incelenmesine izin verir, ancak nispeten düşük verimdir. Eduati ve ark.46 ve Utharala ve ark.47 , otomatik bir şekilde yüksek verimli kombinatoryal kütüphaneler oluşturabilen mikroakışkan valf tabanlı bir platform geliştirdi. Bununla birlikte, bu çalışmalarda, valfler bir Braille cihazı kullanılarak çalıştırılır, bu da mikrovalf ile mikroakışkan çip arasında hantal hizalama adımları gerektirir. Bu belgede açıklanan sistemin önemli bir özelliği, giriş kanallarındaki sıvı akışını düzenlemek için pnömatik PDMS valflerinin uygulanmasıdır. Bu valfler PDMS tabanlı olduğundan, mikroakışkan çipin üretim adımlarına oldukça sorunsuz bir şekilde dahil edilebilirler. Ek olarak, harici bir gaz kaynağı aracılığıyla basınç uygulanarak harekete geçirilebildiklerinden, giriş kanallarındaki sıvıların akışını kontrol etmek için nispeten basit bir seçenektir. Son olarak, bu valflerin basınçlandırma ve basınçsızlaştırma süresi ve sırası programlanabilir, böylece farklı tapa popülasyonlarının üretimi yüksek verimli bir şekilde otomatikleştirilebilir. Bir diğer önemli özellik, reaktiflerin girişten enjeksiyonu için sabit basınç rejimlerinin kullanılmasıdır, bu da sabit bir akış hızı rejiminde ortaya çıkan herhangi bir basınç birikimini hafifletmek için atık kanallarının dahil edilmesinden vazgeçilmesine izin verir. Bu, cihaz tasarımını basitleştirir, atık kanalının valflerini kontrol etmek için ek valf ve donanım ihtiyacını azaltır ve reaktif israfını en aza indirir.
PDMS'li cihazların imalatı nispeten basit olsa da, bu tür cihazların uygulanması, pnömatik solenoid valfler (PDMS valflerinin çalıştırılmasını kontrol etmek için), basınç pompaları (giriş ve yağ reaktiflerinin akışını kontrol etmek için) ve yazılım programları (solenoid valfleri düzenlemek için) gibi kapsamlı donanım gereçlerinin kullanılmasını gerektirir. Önemli bir yatırımı temsil etseler de, böyle bir kurulum, cihazın başarılı bir şekilde çalışması için tutarlılık ve güvenilirlik sağlar. Ek olarak, bu protokolde özetlenen donanım bileşenleri ve mimarisi modüler bir şekilde kurulur. Bu nedenle, bazı modüller için maliyetleri azaltmak veya belirli bir ihtiyaca göre uyarlamak için alternatifler kullanılabilir. Örneğin, fayda, bütçe, kullanılabilirlik ve rahatlığa dayalı olarak kullanılabilecek çeşitli pompalar vardır 52,53,54. Hassas giriş reaktifleri23 için sıvı rezervuarları ve sıcaklık regülatörleri gibi ek bileşenler dahil edilebilir. Ayrıca, bu tasarım belirli bilimsel ihtiyaçları karşılamak için büyütülebilir veya küçültülebilir. Örneğin, bu yazıda, tapa üretmek için sekiz benzersiz reaktifin birleştirilmesine izin veren sekiz girişli bir prototip açıklanmaktadır. Bu, daha fazla sayıda girişe ve bunların daha büyük kombinasyonlarına izin veren 16 girişli bir cihaza yükseltilebilir. Sonuç olarak, girişleri ele almak için ekstra kontrol kanallarına ve solenoid valflere ihtiyaç duyacaktır, ancak böyle bir prototip, daha büyük ve daha çeşitli kombinatoryal kütüphanelerin oluşturulmasına izin verir. Son olarak, bu yazıda, her bir tıkaç popülasyonu, mikroakışkan cihazın sekiz sulu girişinden üçünün açılmasıyla üretilir. Böyle bir konfigürasyon için, yağ reaktifleri için yaklaşık 200 mbar ve sulu reaktifler için 400 mbar'lık bir basıncın, yalnızca valf aktivasyonu ile yönlendirilen bir tapa üretim rejimine karşılık geldiği gözlenmiştir. Yağ(lar)a daha yüksek basınçlar uygulandığında, bujilerin kopması gözlendi ve daha düşük basınçların uygulanması, bujilerin kaynaşmasına yol açtı. Tapa üretimi için en uygun basınç rejimi, bir tapa oluşumuna katkıda bulunan girişlerin sayısı, sıvıların doğası ve viskozitesi ve kanalların boyutları gibi çok çeşitli faktörlere bağlıdır ve gerektiğinde ve gerektiğinde optimize edilmelidir.
Sabit basınç rejiminde çalışmanın dezavantajlarından biri, farklı viskozitelere sahip sıvıların sabit basınç altında farklı akış hızlarına sahip olmasıdır. Bu nedenle, girişlerden akan sulu reaktiflerin karşılaştırılabilir viskozitelerde olduğundan emin olunmalıdır. Farklı viskozitelerdeki sıvıların kullanılması, yalnızca giriş kanallarındaki sıvı akışını değil, aynı zamanda T-bağlantısındaki tıkaç oluşumunu da etkileyecek ve böylece tapa popülasyonlarının bileşimini tehlikeye atacaktır. Diğer bir dezavantaj, bir tıkaç popülasyonunun T-bağlantısındaki artık reaktiflerden kirlenmesidir. Cihaz, farklı fiş popülasyonlarının üretimi arasında geçiş yaptığında, her popülasyonun dizisindeki ilk/son fiş, önceki veya sonraki popülasyon tarafından kontamine olma eğilimindedir. Bu, her popülasyonun ekstra kopyalarını üreterek ve analiz sırasında kontamine fişi indirgeyerek üstesinden gelinebilir. Son olarak, fabrikasyon ve/veya dış kaynaklardaki tutarsızlıklardan (basınç dalgalanmaları) kaynaklanan bireysel cihazlar arasında farklılık potansiyeli de vardır. Bu sorun, tek bir mikroakışkan çipin birden çok kez yeniden kullanılmasıyla ve bu tutarsızlıkların etkisini en aza indirmek için tek bir çip üzerinde bir kombinatoryal kitaplığın tam çalışmasının gerçekleştirilmesini sağlayarak azaltılabilir.
Bu yazıda sunulan mikroakışkan cihaz ve beraberindeki operasyonel protokoller seti, kantitatif bir kombinatoryal fiş kütüphanesinin üretimini göstermek için kullanılmıştır. Bu nedenle bu platform, yüksek verimli bir şekilde farklı fiş popülasyonlarının kombinatoryal kitaplıklarını hızlı bir şekilde oluşturabilir. Sonuç olarak, bu tür teknolojiler, hasta biyopsi numuneleri üzerinde kombinatoryal ilaç taraması dahil ancak bunlarla sınırlı olmamak üzere çeşitli tarama amaçları için kullanılabilir - bu sayede bir biyopsiden alınan az sayıda hücre çok sayıda damlacık halinde dağıtılabilir ve belirli bir hasta numunesi için bireysel tedaviyi optimize etmek için büyük bir anti-kanser ilacı kombinasyonu ile tedavi edilebilir - ve bu nedenle kişiselleştirilmiş kanser tedavisini hızlandırır46, 48,55.
Açıklamalar
F. E., TheraMe için serbest çalışan bir kişidir! AG. Yazarlar, rekabet eden hiçbir mali çıkarları olmadığını beyan ederler.
Teşekkürler
HMDS buhar biriktirme konusundaki yardımı için NanoLab TuE'den Stacey Martina'ya teşekkür ederiz. Bu araştırma, TU/e'deki Karmaşık Moleküler Sistemler Enstitüsü (ICMS) ve Hollanda Bilimsel Araştırma Örgütü (NWO) Yerçekimi programı IMAGINE tarafından finanse edildi! (Proje numarası 24.005.009).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,1,3,3 tetramethyldisiloxane | Merck Life Science NV | MFCD00008256 | |
| 4 channel digital input/output module | WAGO Kontakttechnik GmbH | 750-504 | |
| Acetone | Boom Labs | BOOMSKEUZW3 | |
| Analysis Software | Eindhoven University of Technology | https://github.com/SysBioOncology/BilayerMicrofluidicsAnalysis_JoVE | |
| AZ 40XT 11D | Merck Life Science NV | 212299 | Positive photoresist |
| AZ 726 MIF developer | Merck Life Science NV | 10055824960 | Developer for positive photoresist |
| Biopsy Punch, Rapid Core | World Precision Instruments Germany, GMBH | 504529 | 0.75 mm ID, W/Plunge |
| Blue food dye | PME | FC1036 | |
| Controller end module | WAGO Kontakttechnik GmbH | 750-600 | |
| Ethernet Controller | WAGO Kontakttechnik GmbH | 750-881 | |
| FC-40 | Merck Millipore | F9755-100ML | |
| Fluigent flow unit | Fluigent | FLU-S-D | |
| Fluigent pressure system | Fluigent | MFCS-EZ | 0 - 2 bar |
| Fluorescein | Merck Life Science NV | MFCD00005050 | |
| Hot plate | Torrey Pines Scientific | HP61 | |
| Inverted microscope | Nikon Instruments | Eclipse Ti-E | |
| Isopropanol | Boom Labs | BOOMSKEUZE3 | |
| LabVIEW (Software Version 20) | Eindhoven University of Technology | https://github.com/SysBioOncology/BilayerMicrofluidicsAnalysis_JoVE/tree/main/LabVIEW_8_inlet_device_ VERSION_1 | All files have been saved for LabVIEW version 20. It is advised to use this version or higher to open the files. |
| Luer stubs | Instech Laboratories, Inc. | LS23 | 23 ga, 0.5" |
| Male Luer to barb connectors | Cole Parmer | 45505-32 | 3/32" ID |
| MasterFlex PTFE tubing | Avator/VWR | 48634 | |
| Microscope Slides | VWR | 470150-480 | |
| Microscope slides, Plain | Corning | 2947-75X50 | |
| Mineral Oil | Merck Millipore | 330760-1L | |
| mr DEV 600 | Micro resist Technology | R815100 | Developer for negative photoresist |
| Oven | Thermo Scientific | Heraeus T6P 50045757 | |
| Oxygen plasma asher | Quorum Technologies | K1050X | |
| Photomask | CAD/Art Services, Inc. | ||
| Photomask Design | Eindhoven University of Technology (Adapted from Merten Lab, EPFL) | https://github.com/SysBioOncology/BilayerMicrofluidicsAnalysis_JoVE/blob/main/8_inlet_JoVE_device_design.dwg | |
| Pneumatic valve array | FESTO | 1x 8 valve array, Normally closed valves | |
| Silicon Wafers | Silicon Materials | <1-0-0>, 100 mm diameter, 525 μm thickness | |
| Single edge blades | GEM Scientific | ||
| Soft tubing | Fluigent | 1 mm ID, 3 mm OD | |
| Spin coater | Laurell Technologies Corporation | WS-650MZ-23NPPB | |
| Stereo microscope | Olympus Corporation | SZ61 | |
| SU-8 3050 | Kayakli Advanced Materials | Y311075 1000L1GL | Negative photoresist |
| Sylgard 184 Silicone Elastomer Kit (PDMS) | Dow | 1317318 | |
| Syringe | B Braun Injekt - F Fine Dosage Syringe | 10303002 | |
| UV-LED exposure system | Idonus | UV-EXP150S-SYS | |
| Vacuum pump | Vacuumbrand GmbH | MD1C | |
| Weighing scales | Sartorius | M-prove |
Referanslar
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Terry, S. C., Herman, J. H., Angell, J. B. A gas chromatographic air analyzer fabricated on a Silicon wafer. IEEE Transactions on Electron Devices. 26 (12), 1880-1886 (1979).
- Mellors, J. S., Gorbounov, V., Ramsey, R. S., Ramsey, J. M. Fully integrated glass microfluidic device for performing high-efficiency capillary electrophoresis and electrospray ionization mass spectrometry. Anal Chem. 80 (18), 6881-6887 (2008).
- Wlodarczyk, K. L., Hand, D. P., Maroto-Valer, M. M. Maskless, rapid manufacturing of glass microfluidic devices using a picosecond pulsed laser. Sci Rep. 9 (1), 20215 (2019).
- Nielsen, J. B., et al. Microfluidics: innovations in materials and their fabrication and functionalization. Anal Chem. 92 (1), 150-168 (2020).
- Nge, P. N., Rogers, C. I., Woolley, A. T. Advances in microfluidic materials, functions, integration, and applications. Chem Rev. 113 (4), 2550-2583 (2013).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Unger, M. A., Chou, H. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic microfabricated valves and pumps by multilayer soft lithography. Science. 288 (5463), 113-116 (2000).
- Oh, K. W., Ahn, C. H. A review of microvalves. Journal of Micromechanics and Microengineering. 16 (5), R13 (2006).
- Au, A. K., Lai, H., Utela, B. R., Folch, A. Microvalves and micropumps for BioMEMS. Micromachines. 2 (2), 179-220 (2011).
- Jerman, H. Electrically-activated, normally-closed diaphragm valves. J. Micromech. Microeng. 4 (4), 210 (1994).
- Neagu, C. R., Gardeniers, J. G. E., Elwenspoek, M., Kelly, J. J. An electrochemical microactuator: principle and first results. J microelectromechanical sys. 5 (1), 2-9 (1996).
- Gu, W., Zhu, X., Futai, N., Cho, B. S., Takayama, S. Computerized microfluidic cell culture using elastomeric channels and Braille displays. Proc Natl Acad Sci U S A. 101 (45), 15861-15866 (2004).
- Studer, V., et al. Scaling properties of a low-actuation pressure microfluidic valve. J Appl Phys. 95 (1), 393-398 (2004).
- Hansen, C. L., Sommer, M. O. A., Quake, S. R. Systematic investigation of protein phase behavior with a microfluidic formulator. Proc Natl Acad Sci U S A. 101 (40), 14431-14436 (2004).
- Ridgeway, W. K., Seitaridou, E., Phillips, R., Williamson, J. R. RNA-protein binding kinetics in an automated microfluidic reactor. Nucleic Acids Res. 37 (21), e142 (2009).
- Fu, A. Y., Chou, H. P., Spence, C., Arnold, F. H., Quake, S. R. An integrated microfabricated cell sorter. Anal Chem. 74 (11), 2451-2457 (2002).
- Liu, J., Enzelberger, M., Quake, S. A nanoliter rotary device for polymerase chain reaction. Electrophoresis. 23 (10), 1531-1536 (2002).
- Thorsen, T., Maerkl, S. J., Quake, S. R. Microfluidic large-scale integration. Science. 298 (5593), 580-584 (2002).
- Galas, J. C., Haghiri-Gosnet, A. M., Estévez-Torres, A. A nanoliter-scale open chemical reactor. Lab Chip. 13 (3), 415-423 (2013).
- Niederholtmeyer, H., Stepanova, V., Maerkl, S. J. Implementation of cell-free biological networks at steady state. Proc Natl Acad Sci U S A. 110 (40), 15985-15990 (2013).
- Yelleswarapu, M., et al. Sigma factor-mediated tuning of bacterial cell-free synthetic genetic oscillators. ACS Synth Biol. 7 (12), 2879-2887 (2018).
- van der Linden, A. J., et al. A multilayer microfluidic platform for the conduction of prolonged cell-free gene expression. J Vis Exp. (152), 59655 (2019).
- Shang, L., Cheng, Y., Zhao, Y. Emerging droplet microfluidics. Chem Rev. 117 (12), 7964-8040 (2017).
- Seemann, R., Brinkmann, M., Pfohl, T., Herminghaus, S. Droplet based microfluidics. Rep Prog Phys. 75, 016601 (2012).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab Chip. 12 (3), 422-433 (2012).
- Clausell-Tormos, J., et al. Droplet-based microfluidic platforms for the encapsulation and screening of mammalian cells and multicellular organisms. Chem Biol. 15 (5), 427-437 (2008).
- Umbanhowar, P. B., Prasad, V., Weitz, D. A. Monodisperse emulsion generation via drop break off in a coflowing stream. Langmuir. 16 (2), 347-351 (2000).
- Abate, A. R., Thiele, J., Weitz, D. A. One-step formation of multiple emulsions in microfluidics. Lab Chip. 11 (2), 253-258 (2011).
- Chen, Y., Gao, W., Zhang, C., Zhao, Y. Three-dimensional splitting microfluidics. Lab Chip. 16 (8), 1332-1339 (2016).
- Ahn, K., Agresti, J., Chong, H., Marquez, M., Weitz, D. A. Electrocoalescence of drops synchronized by size-dependent flow in microfluidic channels. Appl Phys Lett. 88 (26), 264105 (2006).
- Fidalgo, L. M., Abell, C., Huck, W. T. S. Surface-induced droplet fusion in microfluidic devices. Lab Chip. 7 (8), 984-986 (2007).
- Bernath, K., et al. In vitro compartmentalization by double emulsions: Sorting and gene enrichment by fluorescence activated cell sorting. Anal Biochem. 325 (1), 151-157 (2004).
- Aharoni, A., Amitai, G., Bernath, K., Magdassi, S., Tawfik, D. S. High-throughput screening of enzyme libraries: thiolactonases evolved by fluorescence-activated sorting of single cells in emulsion compartments. Chem Biol. 12 (12), 1281-1289 (2005).
- Deng, N. N., Yelleswarapu, M., Huck, W. T. S. Monodisperse uni- and multicompartment liposomes. J Am Chem Soc. 138 (24), 7584-7591 (2016).
- Deng, N. N., Yelleswarapu, M., Zheng, L., Huck, W. T. S. Microfluidic assembly of monodisperse vesosomes as artificial cell models. J Am Chem Soc. 139 (2), 587-590 (2016).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Anal Chem. 83 (22), 8604-8610 (2011).
- Macosko, E. Z., et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets. Cell. 161 (5), 1202-1214 (2015).
- Shembekar, N., Chaipan, C., Utharala, R., Merten, C. A. Droplet-based microfluidics in drug discovery, transcriptomics and high-throughput molecular genetics. Lab Chip. 16 (8), 1314-1331 (2016).
- Wong, A. H., et al. Drug screening of cancer cell lines and human primary tumors using droplet microfluidics. Sci Rep. 7 (1), 9109 (2017).
- Jing, W., Han, H. Droplet microfluidics for high-resolution virology. Anal Chem. 94 (23), 8085-8100 (2022).
- Ding, Y., Choo, J., deMello, A. J. From single-molecule detection to next-generation sequencing: microfluidic droplets for high-throughput nucleic acid analysis. Microfluid Nanofluidics. 21 (3), 58 (2017).
- Nightingale, A. M., et al. A stable droplet reactor for high temperature nanocrystal synthesis. Lab Chip. 11 (7), 1221-1227 (2011).
- De Stefano, P., Bianchi, E., Dubini, G. The impact of microfluidics in high- throughput drug-screening applications. Biomicrofluidics. 16 (3), 031501 (2022).
- Tekin, E., et al. Prevalence and patterns of higher-order drug interactions in Escherichia coli. NPJ Syst Biol Appl. 4, 31 (2018).
- Eduati, F., et al. A microfluidics platform for combinatorial drug screening on cancer biopsies. Nat Commun. 9 (1), 2434 (2018).
- Utharala, R., et al. A microfluidic Braille valve platform for on-demand production, combinatorial screening and sorting of chemically distinct droplets. Nat Protoc. 17 (12), 2920-2965 (2022).
- Mathur, L., et al. Combi-seq for multiplexed transcriptome-based profiling of drug combinations using deterministic barcoding in single-cell droplets. Nat Commun. 13 (1), 4450 (2022).
- Dubuc, E., et al. Cell-free microcompartmentalised transcription–translation for the prototyping of synthetic communication networks. Curr Opin Biotechnol. 58, 72-80 (2019).
- Kulesa, A., Kehe, J., Hurtado, J. E., Tawde, P., Blainey, P. C. Combinatorial drug discovery in nanoliter droplets. Proc Natl Acad Sci U S A. 115 (26), 6685-6690 (2018).
- Tomasi, R. F. X., Sart, S., Champetier, T., Baroud, C. N. Individual control and quantification of 3D spheroids in a high-density microfluidic droplet array. Cell Rep. 31 (8), 107670 (2020).
- White, J. A., Streets, A. M. Controller for microfluidic large-scale integration. HardwareX. 3, 135-145 (2018).
- Brower, K., et al. An open-source, programmable pneumatic setup for operation and automated control of single- and multi-layer microfluidic devices. HardwareX. 3, 117-134 (2018).
- Gonzalez-Suarez, A. M., Long, A., Huang, X. H., Revzin, A. A Compact control system to enable automated operation of microfluidic bioanalytical assays. Biosensors. 12 (12), 1160 (2022).
- Mathur, L., Ballinger, M., Utharala, R., Merten, C. A. Microfluidics as an enabling technology for personalized cancer therapy. Small. 16 (9), e1904321 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır