Method Article
Zweischichtiges mikrofluidisches Gerät für die kombinatorische Steckerproduktion
In diesem Artikel
Zusammenfassung
Die Herstellung einer auf Polydimethylsiloxan (PDMS) basierenden Doppelschichtbaurichtung zur Herstellung von kombinatorischen Bibliotheken in Wasser-in-Öl-Emulsionen (Plugs) wird hier vorgestellt. Die notwendige Hard- und Software, die zur Automatisierung der Steckerproduktion erforderlich ist, wird im Protokoll detailliert beschrieben, und die Herstellung einer quantitativen Bibliothek von Leuchtstoffsteckern wird ebenfalls demonstriert.
Zusammenfassung
Die Tröpfchen-Mikrofluidik ist ein vielseitiges Werkzeug, das die Durchführung einer großen Anzahl von Reaktionen in chemisch unterschiedlichen Nanoliter-Kompartimenten ermöglicht. Solche Systeme wurden verwendet, um eine Vielzahl von biochemischen Reaktionen zu verkapseln - von der Inkubation einzelner Zellen bis zur Durchführung von PCR-Reaktionen, von der Genomik bis zur chemischen Synthese. Die Kopplung der mikrofluidischen Kanäle mit Regelventilen ermöglicht die Kontrolle über deren Öffnen und Schließen und ermöglicht so die schnelle Produktion großer kombinatorischer Bibliotheken, die aus einer Population von Tröpfchen mit einzigartigen Zusammensetzungen bestehen. In dieser Arbeit werden Protokolle für die Herstellung und den Betrieb einer druckgetriebenen, PDMS-basierten zweischichtigen mikrofluidischen Baurichtung vorgestellt, die zur Erzeugung kombinatorischer Bibliotheken von Wasser-in-Öl-Emulsionen, sogenannten Plugs, verwendet werden kann. Durch die Integration von Softwareprogrammen und mikrofluidischer Hardware kann der Fluss der gewünschten Flüssigkeiten im Gerät gesteuert und manipuliert werden, um kombinatorische Pfropfenbibliotheken zu generieren und die Zusammensetzung und Menge der konstituierenden Pfropfenpopulationen zu steuern. Diese Protokolle werden den Prozess der Generierung kombinatorischer Screens beschleunigen, insbesondere um das Ansprechen von Medikamenten in Zellen aus Biopsien von Krebspatienten zu untersuchen.
Einleitung
Die Mikrofluidik ermöglicht die Manipulation kleiner Mengen von Flüssigkeiten in Mikrokanälen1. Der Funktionsumfang typischer mikrofluidischer Geräte beträgt Dutzende bis Hunderte von Mikrometern, was die Miniaturisierung chemischer und biologischer Reaktionen ermöglicht, wodurch solche Reaktionen mit relativ kleinen Mengen an Reagenzien durchgeführt werden können. Ursprünglich wurden mikrofluidische Bauelemente mit Materialien wie Silizium2 und Glas3 hergestellt. Obwohl sie noch in Gebrauch sind4, werfen sie bestimmte Probleme auf, wie z. B. Lösungsmittelverträglichkeit, hohe Herstellungskosten und Schwierigkeiten bei der Integration von Steuerungen für den Flüssigkeitsdurchfluss 5,6. PDMS-basierte Fertigungsmethoden, die als Softlithographie bezeichnet werden, bieten eine kostengünstige Alternative für das Rapid Prototyping von Bauelementen7 und eine Möglichkeit zur Herstellung komplexer mehrschichtiger Bauelemente8. Das Hinzufügen von Ventilen und Pumpen zu PDMS-Geräten ermöglicht die Steuerung der Leitung und Geschwindigkeit von Flüssigkeiten in Geräten 9,10. Es wurden mehrere Verfahren entwickelt, um Mikroventile in einer reversiblen oder irreversiblen Weise zu entwerfen und zu betätigen - zum Beispiel Bimetallventile aus Silizium und Aluminium, die thermisch betätigt werden11 oder unter Verwendung von Gas, das aus einer elektrochemischen Reaktion erzeugt wird, um eine Siliziumnitridmembran12 abzulenken. Gu et al. demonstrieren die Verwendung der mechanischen Stifte einer Braillezeile, um Druck auf Mikrokanäle auszuüben, um den Durchflusszu regulieren 13. Eine Reihe von Mikroventilen, die an Popularität gewonnen haben, sind die pneumatischen PDMS-basierten Ventile, die von der Gruppe von StephenQuake 14 entwickelt wurden. Typischerweise bestehen solche Ventile aus zwei orthogonalen Mikrokanälen - einem Strömungskanal und einem Steuerkanal. Bei der Druckbeaufschlagung des Steuerkanals lenkt eine dünne PDMS-Membran auf den Strömungskanal ab, schließt ihn und unterbricht dadurch den Flüssigkeitsfluss. Nach dem Druckabfall entspannt sich die Membran, wodurch der Strömungskanal geöffnet wird und der Flüssigkeitsfluss wieder aufgenommen werden kann. PDMS-Ventile ermöglichen somit eine robuste und reversible Durchflussregelung, da der Steuerkanal mehrfach unter Druck gesetzt und drucklos gemacht werden kann15. Da solche Ventile durch die Anwendung von Druck betätigt werden können, eröffnen sie außerdem Wege für die digitale Steuerung und Automatisierung16. Da sie aus dem gleichen Material bestehen, können sie außerdem nahtlos in die Herstellung von PDMS-basierten Bauelementen unter Verwendung von Softlithographie-Techniken integriert werden 8,17,18. Diese Eigenschaften machen PDMS-Ventile zu einer attraktiven Wahl für die Durchflussregelung in mikrofluidischen Geräten. Thorsen et al. nutzten das Prinzip solcher Ventile, um einen fluidischen Multiplexer - eine kombinatorische Anordnung von Pneumatikventilen - zu entwerfen, der fast tausend Eingangsströmungskanäle mit zwanzig Steuerkanälen anspricht19. Dieses Prinzip wurde erweitert, um Flüssigkeiten selektiv zu mikrofluidischen In-Chip-Chemostaten zu leiten, so dass einzigartige Reaktionen gleichzeitig in jedem Reaktor 20,21,22,23 durchgeführt werden können. Solche Mikroreaktoren sind zwar nützlich, um die Verwendung begrenzter Reagenzien zu optimieren, können jedoch nicht mehrere Reaktionen parallelisieren und sind für Hochdurchsatzstudien nicht ausreichend.
Die Tröpfchenmikrofluidik ist eine Unterkategorie der Mikrofluidik, die die Erzeugung von Tröpfchen durch die Manipulation eines nicht mischbaren, mehrphasigen Flüssigkeitsflusses in mikrofluidischen Gerätenumfasst 24. Bei der Tröpfchenbildung handelt es sich um das Aufbrechen einer kontinuierlichen Flüssigkeit durch Einbringen einer nicht mischbaren Flüssigkeit, was zu einem Abklemmen aufgrund der Instabilität der Grenzflächenenergie und zur Bildung einer Emulsionführt 25. Tenside helfen bei der Bildung von abgerundeten Tröpfchen, wenn Emulsionen den Mikrokanal verlassen, indem sie die Grenzflächenenergienstabilisieren 26. Größere Tröpfchen, die als Stopfen bezeichnet werden, sind weniger stabil und können in einem Haltefach (z. B. einem Schlauchstück) als eine Anordnung von wässrigen Kompartimenten gesammelt werden, die auf beiden Seiten von einer oder mehreren nicht mischbaren Flüssigkeiten beabstandet sind27. Neben der Miniaturisierung und Kompartimentierung bietet die Tröpfchen-Mikrofluidik auch einen erhöhten Durchsatz biologischer Reaktionen, da eine große Anzahl monodisperser Tröpfchen hergestellt werden kann - jeder dient als Nanoreaktor28. Einmal erzeugte Tröpfchen können auch weiteren Manipulationen unterzogen werden, wie z. B. der Spaltung29,30, der Fusion31,32, der Sortierung33,34 und der Assemblage zu Strukturen höherer Ordnung35,36. Die Tröpfchen-Mikrofluidik hat mehrere wissenschaftliche Bereiche und Technologien revolutioniert - von PCR37 bis zur Einzelzell-Transkriptomik38, von der Wirkstoffforschung39,40 bis zur Virologie41, von der Next-Generation-Sequenzierung42 bis zur chemischen Synthese43.
Die Integration von PDMS-basierter Softlithographie und Mikroventilen mit Tröpfchentechnologie ist eine wirksame Kombination, die die Regulierung der Flüssigkeitsströmung in Mikrokanälen und die anschließende Kontrolle des Tröpfchengehalts ermöglicht. Abhängig von der Öffnung und dem Schließen von Kanälen ist es möglich, unterschiedliche Populationen von Tröpfchen mit jeweils einer spezifischen Zusammensetzung zu erzeugen. Eine solche Plattform könnte biochemische Reaktionen miniaturisieren, kompartimentieren und parallelisieren und daher eine nützliche Technik für das kombinatorische Screening sein44. Kombinatorisches Screening ist eine Hochdurchsatzmethode zur Erzeugung von Zehntausenden von Kombinationen ausgewählter Reagenzien zur Herstellung von Bibliotheken, die aus einzelnen Populationen bekannter Zusammensetzung bestehen. Kombinatorisches Screening wurde verwendet, um synergistische Effekte zwischen Arzneimitteln und Antibiotika zur Hemmung des Bakterienwachstums zu entdecken45. Im Bereich der Krebstherapie wurde das kombinatorische Screening eingesetzt, um Kombinationen von Krebsmedikamenten für einen bestimmten Patienten zu testen und damit die personalisierte Therapie voranzutreiben46,47. Mathur et al. haben auf dieser Technologie aufgebaut, indem sie einen kombinatorischen DNA-Barcoding-Ansatz zur Bewertung von Transkriptomveränderungen im Hochdurchsatz-Wirkstoffscreening integriert haben48. Daher ist das kombinatorische Screening eine leistungsfähige, aber noch im Entstehen begriffene Technologie, und es besteht ein Bedarf an der Entwicklung verschiedener mikrofluidischer Technologien, um solche Screening-Verfahren durchzuführen und zu erleichtern.
Das Ziel dieses Manuskripts ist es, einen vollständigen Satz von Protokollen für die Herstellung einer zweischichtigen mikrofluidischen Vorrichtung vorzustellen, die in der Lage ist, eine kombinatorische Bibliothek von Wasser-in-Öl-Pfropfen zu erzeugen, und die für den Betrieb einer solchen Vorrichtung erforderliche Hardware und Software zu beschreiben. Der Flüssigkeitsfluss wird über druckgesteuerte Pneumatikventile auf PDMS-Basis geregelt, die wiederum von einem benutzerdefinierten LabVIEW-Programm gesteuert werden. Der Fluss der Reagenzien im Gerät wird mit handelsüblichen Druckpumpen erreicht. Es wird ein Prototyp mit acht Einlässen vorgestellt, wobei ein Stopfen durch den Inhalt von drei Einlässen gebildet wird, die jeweils ein wässriges Reagenz enthalten. Die wässrige Phase trifft auf eine kontinuierliche Ölphase, und an einem T-Übergang mit einer Frequenz von 0,33 Hz werden Stopfen hergestellt. Die Funktionsweise des Systems wird durch die Erstellung einer quantitativen Bibliothek demonstriert, die drei verschiedene Populationen von Fluoreszenzpfropfen enthält. Diese Technologie und eine Reihe von Protokollen werden dazu beitragen, die Produktion kombinatorischer Bibliotheken für Hochdurchsatz-Screening-Zwecke zu beschleunigen.
Protokoll
1. Weiche Lithographie
HINWEIS: Das mikrofluidische Gerät besteht aus zwei Schichten, einer Flussschicht und einer Kontrollschicht (Abbildung 1A), und jede Schicht wird aus individuell strukturierten Wafern unter Verwendung eines positiven bzw. negativen Fotolacks geformt (Einzelheiten zu Fotolack und Entwicklern finden Sie in der Materialtabelle ).
- Führen Sie die Wafer-Fertigung für die Flussschicht wie unten beschrieben durch.
- Einen Siliziumwafer (100 mm Durchmesser, <1-0-0> orientiert, 525) über Nacht (12-16 h) bei 250 °C dehydrieren.
- Lassen Sie den Wafer abkühlen, bevor Sie mit dem Schleuderbeschichten fortfahren. Tragen Sie 3-4 mL des positiven Fotolacks auf die Mitte des Wafers auf.
- Drehen Sie sich 40 s lang bei 1400 U/min (344 U/min/s), um eine Strukturhöhe von 45 μm zu erhalten.
- Auf einer Herdplatte mit einer Temperaturrampe sanft backen und mit einer Geschwindigkeit von 450 °C/h von 35 °C auf 105 °C erhöhen. Dieser Schritt kann auch an Mikrofasergeweben durchgeführt werden, um einen direkten Kontakt zu verhindern und die Blasenbildung des Fotolacks zu minimieren. Nehmen Sie den Wafer von der Kochplatte und lassen Sie ihn auf Mikrofasertüchern abkühlen.
- Die Fotomaske (kommerziell hergestellt), die der Flussschicht entspricht (mit der Emulsionsseite nach unten), wird auf den resistbeschichteten Siliziumwafer aufgesetzt und unter einer UV-Lampe bei 10 mW/cm2 belichtet, bis eine Gesamtbelichtung von 200 mJ/cm2 erreicht ist.
- Verwenden Sie zwei Kochplatten - eine bei 65 °C und die andere bei 95 °C -, um nach der Belichtung 1 min bzw. 7 min auf den Platten zu backen.
- Entwickeln Sie den Wafer, indem Sie ihn in eine Petrischale geben, die mit Entwickler gefüllt ist, um einen positiven Fotolack zu erhalten. Rühren Sie die Petrischale, indem Sie sie auf einem Tischschüttler schütteln, wobei der Wafer vollständig eingetaucht ist, und erneuern Sie die Entwicklerlösung regelmäßig, bis der Wafer vollständig entwickelt ist und die Merkmale deutlich zu sehen sind.
- Spülen Sie den Wafer mit demineralisiertem Wasser von Lackresten ab und prüfen Sie unter einem Stereomikroskop auf Rückstände in den Kanälen. Entfernen Sie Rückstände, indem Sie den Wafer wieder in die Entwicklerlösung geben oder den Entwickler vorsichtig mit einer Mikropipette auf den Wafer geben. Sobald der Vorgang abgeschlossen ist, trocknen Sie den Wafer mit einer Stickstoffspritzpistole.
- Legen Sie den Wafer für 25 Minuten auf eine Heizplatte, die auf 110 °C eingestellt ist. Dieser Prozess führt zu abgerundeten Merkmalen.
- Fahren Sie mit der Silanisierung des Wafers fort, wie in Schritt 1.3 beschrieben.
HINWEIS: Die Aufdampfabscheidung von Hexamethyldisilazan (HMDS) kann auch auf den Siliziumwafern vor dem Auftragen des Lacks durchgeführt werden, um die Haftung zwischen dem Resist und dem Wafer zu verbessern.
- Führen Sie die Wafer-Fertigung für die Kontrollschicht wie unten beschrieben durch.
- Nehmen Sie einen weiteren Siliziumwafer und dehydrieren Sie ihn, indem Sie ihn für 15 Minuten auf eine auf 110 °C eingestellte Kochplatte legen.
- Entfernen Sie den Wafer und lassen Sie ihn auf Raumtemperatur abkühlen, bevor Sie mit der Schleuderbeschichtung fortfahren.
- Tragen Sie 5 mL des negativen Fotolacks auf die Mitte des Wafers auf.
- Verwenden Sie das folgende Spin-Protokoll, um eine Strukturhöhe von 40 μm zu erhalten: 5 s bei 500 U/min (100 U/min Beschleunigung), 33 s bei 1400 U/min (300 U/min) und schließlich für 5 s bei 300 U/min/s auf 0 U/min abbremsen.
- Mit zwei separaten Kochplatten auf 65 °C und 95 °C für 1 min bzw. 15 min weich backen. Nehmen Sie den Wafer von der Kochplatte und lassen Sie ihn auf Mikrofasertüchern abkühlen.
- Platzieren Sie die Fotomaske (kommerziell hergestellt), die der Kontrollschicht entspricht (mit der Emulsionsseite nach unten), auf den resistbeschichteten Wafer und belichten Sie den Wafer unter einer UV-Lampe, die auf 15 mW/cm2 eingestellt ist, bis eine Gesamtbelichtung von 250 mJ/cm2 erreicht ist.
- Verwenden Sie zwei Heizplatten - eine bei 65 °C und die andere bei 95 °C - und führen Sie ein Nachbelichten des Wafers für 2 min bzw. dann 5 min durch. Nehmen Sie den Wafer von der Kochplatte und lassen Sie ihn auf Mikrofasertüchern abkühlen.
- Entwickeln Sie den Wafer, indem Sie ihn für 4 Minuten in eine mit Entwickler gefüllte Petrischale für negativen Fotolack geben. Aktualisieren Sie den Entwickler, und setzen Sie den Vorgang für weitere 4 Minuten fort.
- Spülen Sie den Wafer mit Isopropanol, um Reste von Fotolack zu entfernen, und verwenden Sie ein Stereomikroskop, um den Wafer auf Rückstände in den Kanälen zu überprüfen.
- Entfernen Sie Rückstände, indem Sie den Wafer wieder in die Entwicklerlösung geben oder den Entwickler vorsichtig mit einer Mikropipette auf den Wafer geben. Sobald der Vorgang abgeschlossen ist, trocknen Sie den Wafer mit einer Stickstoffspritzpistole.
- Sobald der Fotolack vollständig entwickelt ist, backen Sie ihn hart, indem Sie ihn 10 Minuten lang auf eine auf 95 °C eingestellte Kochplatte legen.
- Fahren Sie mit der Silanisierung fort, wie in Schritt 1.3 beschrieben.
- Führen Sie die Silanisierung wie unten beschrieben durch.
- Legen Sie den Wafer in einen Exsikkator. Stellen Sie eine Glasflasche in den Exsikkator und fügen Sie 4-5 Tropfen 1,1,3,3 Tetramethyldisiloxan hinzu.
ACHTUNG: 1,1,3,3-Tetramethyldisiloxan ist nicht giftig, aber brennbar. Andere Silane können verwendet werden, aber sie können giftig sein. Es wird empfohlen, die Silanisierung in einem Abzug durchzuführen, während die erforderliche persönliche Schutzausrüstung (PSA) wie Laborkittel, Brille und Nitrilhandschuhe getragen wird. - Ziehen Sie das Vakuum für 15 min und versiegeln Sie den Exsikkator für 12-16 h, damit sich das Silan auf dem Wafer ablagern kann.
- Öffnen Sie den Exsikkator und entsorgen Sie die Glasflasche. Legen Sie die Waffel in eine saubere Petrischale.
- Legen Sie den Wafer in einen Exsikkator. Stellen Sie eine Glasflasche in den Exsikkator und fügen Sie 4-5 Tropfen 1,1,3,3 Tetramethyldisiloxan hinzu.
- Führen Sie die Herstellung eines mikrofluidischen Geräts wie unten beschrieben durch.
ANMERKUNG: Das folgende Protokoll wurde von früheren Arbeitenübernommen 23.- Bereiten Sie zwei separate PDMS-Lösungen vor - eine für die Fließschicht und eine für die Kontrollschicht. Für jede Lösung das Basismittel und das Härtungsmittel des PDMS-Kits in einem Becherglas mischen und mit einem Mischstab umrühren. Für die Kontrollschicht werden 10 g Grundmittel und 0,5 g Härter (Verhältnis 20:1) benötigt, während für die Fließschicht 40 g des Grundmittels und 8 g des Härters (Verhältnis 5:1) benötigt werden.
- Entgasen Sie die PDMS-Lösungen in einem Exsikkator, bis die Lösungen gasfrei sind.
- Legen Sie den silanisierten Flow-Layer-Wafer in eine mit Folie bedeckte Petrischale und gießen Sie die entsprechende PDMS-Lösung über den Wafer. Setzen Sie die Petrischale wieder in den Exsikkator ein und ziehen Sie das Vakuum zur weiteren Entgasung (ca. 20 Minuten lang).
- Schleudern Sie den silanisierten Kontrollschichtwafer mit der entsprechenden PDMS-Lösung. Gießen Sie 3-4 mL der Lösung auf die Mitte des Wafers und drehen Sie sie 20 s lang bei 1500 U/min bei 408 U/min. Den Wafer auf einer ebenen Fläche in einer geschlossenen Petrischale für 20 Min. legen.
- Sowohl die Fließ- als auch die Kontrollschicht für 18-20 min bei 80 °C in einen Ofen stellen. Überwachen Sie die beiden Schichten regelmäßig, um zu überprüfen, ob sie ausgehärtet sind. Die Schichten sind fertig, wenn sie zäh genug sind, um formbar und dennoch leicht klebrig zu sein, da dies die Verbindung zwischen den beiden Schichten verbessert.
- Schneiden Sie das PDMS um jedes der Geräte auf dem Flow-Layer-Wafer mit einem Skalpell aus. Achten Sie darauf, nicht zu nah an den Elementen zu schneiden, und lassen Sie ca. 2 cm Abstand zwischen dem Element und den Kanten des PDMS. Nachdem Sie sich vom Siliziumwafer gelöst haben, decken Sie den PDMS-Block auf der Feature-Seite mit Klebeband ab, um eine Staubkontamination zu vermeiden.
- Nachdem alle PDMS-Blöcke ausgeschnitten wurden, platzieren Sie sie nacheinander auf dem entsprechenden Kontrollschicht-Wafer und führen Sie eine grobe Ausrichtung mit dem Auge durch.
- Nachdem alle Blöcke auf den entsprechenden Bereichen auf der Steuerungsschicht platziert wurden, passen Sie die Position der einzelnen Blöcke so an, dass sich die Regelventile über die entsprechenden Strömungskanäle überlappen, um die Ausrichtung abzuschließen. Dies kann auch mit Hilfe eines Stereomikroskops erfolgen.
- Entfernen Sie Lufteinschlüsse zwischen den beiden Schichten, indem Sie Druck ausüben. Wenn sich die Lufttasche auf oder in der Nähe eines Merkmals befindet, achten Sie darauf, dass die Kanäle nicht kollabieren, wenn Sie Druck ausüben.
- Stellen Sie die Geräte in den 80 °C heißen Backofen und lassen Sie sie 12-16 h lang verbinden. Platzieren Sie 100 g Gewichte auf jedem der Geräte, um die Verbindung zwischen den beiden Schichten zu verbessern.
- Nehmen Sie den Wafer heraus und schneiden Sie jedes einzelne Gerät aus. Ziehen Sie die Geräte vom Controller Layer Wafer ab und decken Sie die Feature-Seite mit Klebeband ab.
- Legen Sie jedes einzelne Gerät mit der Merkmalsseite nach oben auf eine Schneidematte und stanzen Sie mit einem 0,75-mm-Biopsiestempel ein Loch für jeden der acht Flow-Layer-Einlässe, acht Kontrollschicht-Kanaleinlässe, die Öleinlässe und den Auslass.
- Beladen Sie den Plasma-Asher mit einem Objektträger und einem einzelnen Gerät, wobei das Klebeband entfernt wurde und die Merkmalsseite nach oben zeigt. Führen Sie die Sauerstoffplasma-Veraschung mit einer Leistung von 30 W für eine Dauer von 20 s durch.
- Nehmen Sie das Gerät und den Glasschieber heraus, sobald die Veraschung abgeschlossen ist, und legen Sie das Gerät mit der Funktionsseite nach unten auf den Objektträger. Die Adhäsion zwischen PDMS und Glas sollte sofort mit bloßem Auge sichtbar sein. Üben Sie Druck auf alle Bereiche mit Lufteinschlüssen aus, um die Luft herauszudrücken.
- Stellen Sie die Geräte für 60 min auf eine auf 110 °C eingestellte Kochplatte mit einem Gewicht darauf, um die Haftung des PDMS mit dem Glas zu verbessern.
2. Hardware-Einrichtung
HINWEIS: Ein Schema der Verbindungen zum mikrofluidischen Gerät ist in Abbildung 1B dargestellt und eine Realisierung eines solchen Schemas unter Verwendung der erforderlichen Hardware ist in Abbildung 2 dargestellt.
- Richten Sie die Pneumatikventile wie unten beschrieben ein.
HINWEIS: Jeder Steuerkanal, der ein PDMS-Ventil auf dem Chip regelt, wird wiederum von einem einzelnen Magnetventil gesteuert. Der hier vorgestellte Prototyp besteht aus acht Steuerkanälen (Bild 1A), so dass acht Magnetventile erforderlich sind.- Die Steuerung der Magnetventile erfolgt über ein speziell entwickeltes LabVIEW-Softwareprogramm (Main Interface Program; Abbildung 3 und Zusatzdatei 1, Zusatzdatei 2, Zusatzdatei 3, Zusatzdatei 4). Dieses Programm sendet MODBUS-Befehle über eine TCP-Verbindung (Ergänzungsdatei 5, Ergänzungsdatei 6) an eine WAGO-Steuerung. Verbinden Sie das WAGO-Gerät über ein Ethernet-Kabel mit dem Rechner mit dem LabVIEW-Programm. Fahren Sie fort, die Magnetventile nacheinander an die Anschlüsse der WAGO-Steuerung anzuschließen. Für eine detailliertere Beschreibung verweisen wir auf die zuvor beschriebenen Protokolle23.
- Schließen Sie das Magnetventilarray mit einem 1/4-Zoll-Schlauch an eine Druckluftquelle an und stellen Sie den Druck des Ventilarrays auf 3,5 bar ein. In diesem System wurden die acht Ventile mit der Bezeichnung 9-16 verwendet.
- Richten Sie die Druckregler wie unten beschrieben ein.
HINWEIS: Zur Steuerung des Flüssigkeitsflusses wird eine handelsübliche Druckpumpe verwendet (Abbildung 2). Ein Pumpensatz mit acht und vier Anschlüssen wurde verwendet, um acht wässrige Einlässe und zwei Öleinlässe im Gerät unterzubringen. Der Druck jedes Anschlusses wird über eine Software geregelt, die von den Herstellern zur Verfügung gestellt wird.- Schließen Sie die Druckpumpe an eine Druckluftquelle an und stellen Sie sicher, dass der zugeführte Druck den von der Pumpe maximal zulässigen Druck nicht überschreitet (2,2 bar sowohl für die Acht- als auch für die Vier-Port-Regler).
- Schließen Sie die Druckpumpen über einen USB-Anschluss an einen Computer an.
- Sobald die Pumpen eingeschaltet sind, sollten sie in der entsprechenden Software sichtbar sein. Stellen Sie die Drücke beim Einrichten der Pumpen auf Null.
- Verbinden Sie einen männlichen Luer mit 3/32-Zoll-Widerhaken mit jedem der 12 weiblichen Luer-Lock-Ausgangsanschlüsse an den Controllern.
- Verbinden Sie ein Stück weichen Schlauch (AD: 3 mm, ID: 1 mm, L: 15 cm) mit dem Widerhaken. Schließen Sie einen weiteren Luer-Stecker an den 3/32-Zoll-Widerhaken an das andere Ende des weichen Schlauchs an.
- Schließen Sie einen Luer-Stub (23 G, 0,5 Zoll) an den Widerhakenanschluss an. Zu diesem Zeitpunkt ist der Druckregler eingerichtet und kann verwendet werden.
3. Einrichtung des mikrofluidischen Geräts
- Schließen Sie den Steuerkanalschlauch wie unten beschrieben an (Abbildung 2).
- Schneiden Sie für jeden Steuerkanal ein Stück Schlauch aus Polytetrafluorethylen (PTFE) ab (AD: 0,042 in, ID: 0,022 in). Stecken Sie den Stift eines 23 G, 0,5 Zoll Luer-Stummel an einem Ende.
- Verbinden Sie den Luer-Stummel mit einem männlichen Luer an einem 3/32-Zoll-Nylonstecker mit Widerhaken. Stecken Sie den Widerhaken des Verbinders in ein Stück Polyurethanschlauch (AD: 4 mm, ID: 2,5 mm). Verbinden Sie das andere Ende des Polyurethanschlauchs direkt mit einem Magnetventil.
- Füllen Sie eine Spritze mit Wasser und schließen Sie am Ende einen 23 G, 0,5 Zoll Luer-Stub an.
- Verbinden Sie das freie Ende des PTFE-Schlauchs mit dieser Spritze und injizieren Sie Wasser bis etwa zur Hälfte des Schlauchs.
- Trennen Sie den Schlauch von der Spritze und führen Sie das freie Ende des Schlauchs in ein gestanztes Loch des entsprechenden Steuerkanals ein (Abbildung 1A-C 1-8). Wiederholen Sie diesen Vorgang, bis jeder Steuerkanal mit dem entsprechenden Magnetventil verbunden ist.
HINWEIS: In dieser Arbeit wurden die Magnetventile 9 bis 16 mit den Steuerkanälen verbunden, die C1 bis C8 entsprechen. Obwohl diese auf beliebige Weise angeschlossen werden können, ist es wichtig, sich an die Reihenfolge und Reihenfolge der Verbindungen zu erinnern, insbesondere bei der Bedienung des Hauptschnittstellenprogramms. - Verwenden Sie das Programm Hauptschnittstelle (Abbildung 3), um alle Magnetventile zu öffnen (Alle Steuerkanäle unter Druck setzen). Dadurch wird die Flüssigkeit aus dem Schlauch in die Steuerkanäle des mikrofluidischen Geräts gedrückt und dadurch gefüllt. Ein Beispiel für druckbeaufschlagte und drucklose Ventile ist in Abbildung 4 dargestellt.
- Schließen Sie die Reagenzien an und grundieren Sie das Gerät wie unten beschrieben.
- Stellen Sie sicher, dass alle Steuerkanäle unter Druck gesetzt sind, indem Sie die Taste " Alle Steuerkanäle unter Druck setzen" im Programm "Hauptschnittstelle" drücken (Abbildung 3).
- Schneiden Sie für jedes der wässrigen Reagenzien ein Segment des PTFE-Schlauchs (AD: 0,042 in, ID: 0,022 in) lang genug ab, um die Pumpen mit den Einlässen der Einlässe der mikrofluidischen Geräte zu verbinden. Verbinden Sie einen der Schläuche mit dem Luer-Stummel aus Schritt 2.2.6.
- Füllen Sie eine Spritze mit dem erforderlichen Reagenz und schließen Sie am Ende einen 23 G, 0,5 Zoll Luer-Stub an.
- Injizieren Sie das Reagenz in den entsprechenden PTFE-Schlauch, bis der Schlauch voll ist. Achten Sie darauf, dass das Reagenz nicht in den Ausgangsanschluss des Pumpenaggregats gelangt.
- Führen Sie das freie Ende des Schlauchs in einen entsprechenden Einlass im Mikrofluidik-Chip ein.
- Üben Sie mit der mitgelieferten Software einen Druck von 400 mbar auf jedes der wässrigen Einlassreagenzien aus.
- Entlasten Sie die Steuerkanäle nacheinander einzeln mit dem Programm Main Interface (Abbildung 3), um sicherzustellen, dass alle Reagenzien den T-Übergang des Geräts erreicht haben. Betätigen Sie bei Bedarf einzelne Ventile, indem Sie die entsprechenden Tasten des Programms im Feld Steuerkanäle Manuelle Druckbeaufschlagung drücken.
- Wiederholen Sie die Schritte 3.2.3 bis 3.2.5 für die Ölreagenzien. Üben Sie einen Druck von 400 mbar auf jedes der Einlassölreagenzien aus.
- Entlasten Sie gleichzeitig alle Steuerkanäle, indem Sie die Druckentlastung aller Steuerkanäle drücken (Abbildung 3), bis die gesamte Luft aus dem Gerät entfernt wurde. Dies ist mit bloßem Auge oder unter dem Mikroskop zu beobachten.
- Setzen Sie alle Steuerkanäle unter Druck, indem Sie die Taste "Alle Steuerkanäle unter Druck setzen" drücken (Abbildung 3). Zu diesem Zeitpunkt sind alle Reagenzien angeschlossen und das Gerät ist vorbereitet und einsatzbereit.
- Programmieren Sie das Experiment und führen Sie es wie unten beschrieben aus.
- Kodieren Sie die Zusammensetzung, die Sequenz und die Replikationen jeder Plug-Population, die in einer .csv Datei erzeugt werden soll, wie in der Zusatzdatei 7 gezeigt, die als Eingabe für das automatische Experiment im Hauptschnittstellenprogramm dient (Abbildung 3). Markieren Sie die erforderlichen Steuerkanäle mit einer 0, wenn es sich um einen Einlass handelt, der geöffnet werden soll, und mit einer 1, wenn dieser geschlossen werden soll. Jede Zeile in der .csv Datei entspricht einer bestimmten Plug-Population.
- Laden Sie das .csv in das Hauptschnittstellenprogramm, indem Sie auf die Schaltfläche Ordner auf der Registerkarte Experimentdatei klicken.
- Geben Sie die entsprechenden Felder im Programm ein, wie z.B. Iterationen des Experiments (um zu bestimmen, wie oft die gegebene Sequenz von Stopfen erzeugt wird), Zeit der Druckentlastung (um zu bestimmen, wie lange die Einlasskanäle geöffnet sein müssen und der entsprechende Steuerkanal in Millisekunden drucklos gemacht werden muss), Zeit der Druckbeaufschlagung (um zu bestimmen, wie lange die Einlässe zwischen den Sequenzen der Steckerbestückung in Millisekunden geschlossen werden müssen).
- Wählen Sie im Abschnitt Barcode-Eingänge (bis zu 3 Kanäle) die Einlasskanäle aus, die der Barcode-Produktion entsprechen, zusammen mit der Dauer, für die sie geöffnet sein müssen (Zeit für die Barcode-Codierung (ms)). Alternativ können diese Barcodes auch in die Eingabedatei .csv hartcodiert werden, wie in der Zusatzdatei 7 gezeigt.
- Reduzieren Sie den Druck der Einlassölreagenzien auf 200 mbar.
- Schließen Sie einen PTFE-Schlauch (AD: 0,042 in, ID: 0,022 in) der gewünschten Länge an den Auslass an, um die Stecker aufzufangen. Um eine gleichmäßige Stopfenproduktion zu gewährleisten, verwenden Sie für die Sammlung ca. 100 cm lange Schläuche von ca. 100 cm, die mit Stopfen vorgefüllt sind. Dies dient dazu, den Druckunterschied am Auslass zu neutralisieren, der durch die Ansammlung von Stopfen in den Schläuchen ausgeübt wird.
- Drücken Sie auf Experiment ausführen , um das Programm zu starten und die Produktion zu unterbrechen.
- Führen Sie die Datenaufzeichnung und -analyse wie unten beschrieben durch (siehe Abbildung 5).
HINWEIS: In diesem Abschnitt wird speziell eine Methode zur Analyse von Fluoreszenzpfropfen beschrieben. Abhängig von der Art der erzeugten Stecker kann dieser Abschnitt nach Bedarf geändert werden.- Füllen Sie eine Spritze mit Öl (entweder Mineralöl oder fluoriertes Öl) und schließen Sie am Ende einen 23 G 0,5 Zoll Luer-Stub an. Befestigen Sie die Spritze an einer Pumpe.
- Verbinden Sie eines der Enden des gefüllten Auffangschlauchs mit dem Luer-Stummel an der Spritze. Befestigen Sie das andere Ende des gefüllten Sammelschlauchs über der Objektivlinse eines Mikroskops.
- Platzieren Sie einen Abfallbehälter unter dem Ende des Schlauchs in der Nähe des Objektivs.
- Fokussieren Sie das Mikroskop auf einen bestimmten Bereich des Schlauchs und stellen Sie es so ein, dass die Fluoreszenz in den gewünschten Kanälen aufgezeichnet wird.
- Stellen Sie die Pumpe auf eine Fördermenge von 50 μL/min ein.
- Nehmen Sie das Video des Fluoreszenzkanals als .avi Datei auf.
- Analysieren Sie die .avi-Datei mit dem bereitgestellten Python-Skript (Ergänzende Datei 8), um die durchschnittliche Fluoreszenz in einem vordefinierten Bereich of Interest (ROI) pro Frame der .avi-Datei zu extrahieren (ein Beispiel dafür finden Sie in der Ergänzenden Datei 9).
- Verwenden Sie das bereitgestellte angepasste R-Skript (Ergänzende Datei 10), um die Bedingungen zu extrahieren und die Rohdaten und die Peakhöhen darzustellen.
HINWEIS: Das R-Skript in der Zusatzdatei 10 wurde für die Analyse in diesem Dokument verwendet. Die benutzerdefinierten R-Funktionen, die in diesem Skript zum Schneiden von Daten, zum Erkennen von Bedingungen mithilfe von Barcodes und zum Analysieren der Peakhöhen für einzelne Stecker und Plotten verwendet werden, sind in der Zusatzdatei 11 enthalten.
Ergebnisse
Eines der entscheidenden Merkmale des mikrofluidischen Chips sind die PDMS-Ventile, und ihre Fähigkeit, den Flüssigkeitsfluss zu regulieren, wurde charakterisiert, da sie das Betriebsparadigma des Geräts beeinflusst. Zu diesem Zweck wurde die Durchflussmenge von destilliertem Wasser (gemessen mit einem handelsüblichen Durchflusssensor) durch die Einlasskanäle in Abhängigkeit von unterschiedlichen Eingangsdrücken aufgezeichnet, während die PDMS-Ventile periodisch unter Druck gesetzt (3,5 bar für 2000 ms) und drucklos (1000 ms) wurden (Abbildung 6A). Es wurde beobachtet, dass die Ventile in der Lage waren, den Flüssigkeitsfluss bis zu einem Eingangsdruck von etwa 800 mbar zu regeln, was durch den Abfall der Durchflussmenge auf Null bei Betätigung der Ventile angezeigt wird (Abbildung 6 B-D). Dies bestätigt die Verwendung solcher PDMS-basierten Ventile zur Regulierung des Reagenzienflusses in den Kanälen. Darüber hinaus ist der Eingangsdruck mit 1200 mbar zu hoch, als dass die Ventile den Durchfluss regulieren könnten, was sich daran zeigt, dass die Durchflussmenge nicht auf Null reduziert wird (Abbildung 6E). Während die Dauer der Druckbeaufschlagung und Druckentlastung der PDMS-Ventile modifiziert werden kann, wurde die Änderungsrate des Fluidstroms unter den aktuellen Bedingungen der Druckbeaufschlagung (2000 ms) und der Druckentlastung (1000 ms) berechnet. Bei einem Eingangsdruck von 400 mbar kann der Durchfluss mit einer Geschwindigkeit von 1,26 Hz bzw. 1,44 Hz ein- und ausgeschaltet werden (Abbildung 6C).
Frühere Iterationen einer ähnlichen kombinatorischen mikrofluidischen Vorrichtung mit hohem Durchsatz enthielten ebenfalls einen Abfallkanal, der mit jedem Strömungskanal46, 47 gekoppelt war. Diese Geräte wurden in einem konstanten Durchflussregime betrieben (bei dem Reagenzien mit konstanten Durchflussraten und nicht mit konstantem Druck in das Gerät injiziert wurden), und die Abfallkanäle wurden so programmiert, dass sie sich öffneten, wenn die entsprechenden Einlasskanäle geschlossen wurden, um einen Druckaufbau zu verringern. Solche Kanäle sind zwar nützlich, führen aber zu einem Verlust von Reagenzien, da der Inhalt des Abfallkanals nicht zur Pfropfenbildung beiträgt. Darüber hinaus sind zusätzliche Steuerkanäle – und damit zusätzliche Pumpen – erforderlich, um das Öffnen und Schließen der Abfallkanäle zu regeln. In dem hier vorgestellten Prototyp wurden die Abfallkanäle entfernt und ein betriebliches Paradigma etabliert, das eine reduzierte Verschwendung von Reagenzien und eine Reduzierung des Designs und der Betriebskomplexität ermöglicht. Dabei werden die wässrigen Reagenzien im Modus mit konstantem Druck und nicht im Modus mit konstanter Durchflussrate injiziert. Um die beiden Regime besser zu verstehen, wurde jeweils der Zusammenhang zwischen Druck und Durchfluss in den Kanälen während der Ventilbetätigung bewertet (unter Verwendung des gleichen Aufbaus wie in Abbildung 6A), dessen Ergebnisse in Abbildung 7 dargestellt sind. In Abbildung 7A wurde die Durchflussrate von destilliertem Wasser gemessen, während es mit einem konstanten Druck (300 mbar) eingespritzt wurde, und es wurde beobachtet, dass die Durchflussrate während der Ventilbetätigung auf Null abfällt und bei Druckentlastung des Ventils die Durchflussrate auf das Niveau vor der Betätigung zurückkehrt. In einem konstanten Durchflussregime, bei dem der Druck in den Kanälen aufgezeichnet wurde, während das destillierte Wasser mit einer konstanten Durchflussrate (2,5 μL/min; Abbildung 7B) führte die Ventilbetätigung nicht zu einem vollständigen Verschluss des Einlasses - was sich daran zeigt, dass die Durchflussmenge nicht auf Null abfiel - und es wurde ein Druckaufbau im Kanal beobachtet. Dies ist der Druck, der durch das Öffnen von Abfallkanälen abgebaut wird. Da ein konstanter Eingangsdruckbereich den Betrieb des Geräts ohne Gegendruck bei Ventilbetätigung ermöglicht und dadurch die Notwendigkeit von Abfallkanälen entfällt, wurde dieses Regime für den Betrieb des Mikrofluidik-Chips übernommen.
Um die Funktionalität des mikrofluidischen Bauelements zu demonstrieren, wurde eine quantitative kombinatorische Bibliothek von Fluoreszenzsteckern erstellt. Zu den acht Einlässen des Gerätes werden drei wässrige Reagenzien - Fluorescein (50 μM) in vier Einlässen (I1Ich3, Ich5, Ich7), destilliertes Wasser in drei Einläufen (I4Ich6, Ich8), ein Einlass mit einem blauen Farbstoff (I2; als Barcode) - und zwei Ölreagenzien - fluoriertes Öl (FC-40) und Mineralöl (MO) in den Einlässen O1 und O2bzw. - eingesteckt wurden (Abbildung 1A, Abbildung 8A). Das fluorierte Öl dient als Trägerphase, in der die wässrigen Stopfen dispergiert werden, und das Mineralöl trägt zur Stabilität des Stopfens bei und minimiert die Haftung des Stopfeninhalts an den Wänden, wodurch Kreuzkontaminationen zwischen den Stopfen minimiert werden46. Mit drei Eingängen, die zur Zusammensetzung einer einzelnen Pfropfenpopulation beitragen, kann diese Konfiguration drei verschiedene Fluoreszenzpopulationen erzeugen: FFF - bestehend aus Fluorescein aus drei Kanälen, FFW - bestehend aus Fluorescein aus zwei Kanälen und Wasser aus einem Kanal und FWW - bestehend aus Fluorescein aus einem Kanal und Wasser aus zwei Kanälen. Bei diesem Aufbau gibt es 12 unterschiedliche Bedingungen (Steckerpopulationen, die mit einer eindeutigen Kombination von drei Eingängen erzeugt werden), die FWW-Stecker erzeugen können, 18 unterschiedliche Bedingungen, die FFW-Stecker erzeugen können, und vier verschiedene Bedingungen, die FFF-Stecker erzeugen können. Daher wurde der Chip so programmiert, dass er diese 34 verschiedenen Bedingungen mit jeweils fünf verschiedenen Replikatsteckern erzeugt, zusammen mit fünf Replikaten von Barcode-Steckern, die sie voneinander trennen. Es wird empfohlen, die fluoreszierenden Pfropfenpopulationen mit einer Barcode-Population zu durchsetzen, d. h. einem Satz farbiger (idealerweise nicht fluoreszierender) Pfropfen (in diesem Fall gebildet durch Öffnen der Einlasskanäle, die dem blauen Farbstoff entsprechen, und zwei Kanälen für destilliertes Wasser), die mit bloßem Auge sichtbar sind. Es ermöglicht dem Anwender, die Steckerproduktion auf Probleme wie Steckeraufbruch oder Verschmelzung zu überwachen und hilft bei der nachgelagerten Analyse von Steckern. Dazu wurden insgesamt 340 Stopfen - 170 experimentelle Stopfen und 170 Barcode-Stopfen, die die verschiedenen Bedingungen trennen - erzeugt und in PTFE-Schläuchen gesammelt, von denen eine Probe in Abbildung 8B. Die Zeit der Druckentlastung und die Zeit der Druckbeaufschlagung wurden auf 1000 ms bzw. 2000 ms festgelegt. Es wurden die Fluoreszenz der Pfropfen und ihre Variabilität innerhalb und zwischen den verschiedenen experimentellen Bedingungen analysiert, deren Ergebnisse in der Studie gezeigt werden. Abbildung 8C,D. Abbildung 8C Zeigt die Fluoreszenz pro Frame der in Schritt 3.4.6 erzeugten .avi Datei an, die die 34 betrachteten experimentellen Bedingungen hervorhebt (abgegrenzt durch eine blaue Linie). Der mittlere Fluoreszenzwert von Peaks innerhalb einer Bedingung wird rot dargestellt, und die gestrichelten Linien zeigen den Standardfehler innerhalb dieser Bedingung an. Die Höhen der Peaks aller Plugs in jeder Population, die durch Subtraktion der Baseline-Fluoreszenz von der maximalen Fluoreszenz, die in jedem Peak detektiert wurde, erhalten wurden, wurden in Abbildung 8D. Der letzte Peak in jeder Bedingung wurde für die Berechnungen vernachlässigt, da es sich um einen kontaminierten Pfropfen handelte, der durch die Vermischung von Reagenzien am T-Übergang verursacht wurde (da die Fluoreszenz der Pfropfen in umgekehrter Reihenfolge der Pfropfenproduktion aufgezeichnet wurde, ist der erste Pfropfen in einer Population während der Produktion der letzte Pfropfen in einer Population während der Analyse). Es zeigte sich, dass die Höhe der FWW-Stecker etwa ein Drittel (Mittelwert = 40,9, Standardabweichung = 3,1) und die der FFW-Stecker etwa zwei Drittel (Mittelwert = 78,4, Standardabweichung = 5) der Höhe der FFF-Stecker (Mittelwert = 117, Standardabweichung = 10) beträgt. Diese Ergebnisse stimmen mit den erwarteten Anteilen der Fluoreszenz in verschiedenen Populationen von FFF/FFW/FWW-Steckern überein, was die Robustheit des Geräts und seine Funktion unterstreicht.
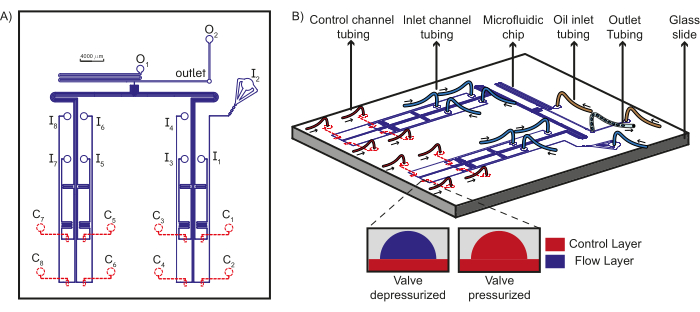
Abbildung 1: Schematische Darstellung des Gerätedesigns und des mikrofluidischen Aufbaus. (A) Die Flussschicht des Chips ist blau und die Steuerschicht rot dargestellt. Insgesamt acht einzigartige wässrige Reagenzien können durch die Einlässe (I1-8) in Richtung T-Übergang fließen, wo sie auf die Ölphasen aus den Öleinlässen (O1-2) treffen und Stopfen bilden, die am Auslass gesammelt werden. Jeder Einlassströmungskanal wird von einem eindeutigen Steuerkanal (C1-8) gesteuert. (B) Das Schema des mikrofluidischen Chips zusammen mit den Schlauchverbindungen zu den Einlässen, Steuerkanälen und Ölreagenzien wird zusammen mit den Auslassschläuchen dargestellt. Pfeile zeigen die Richtung des Flüssigkeitsflusses im Schlauch an. Der Einschub zeigt das Funktionsprinzip von PDMS-Ventilen. Gestrichelte Linien zeigen an, dass sich der Steuerungs-Layer unter dem Flow-Layer befindet. Diese Zahl wurde von Dubuc et al.49 modifiziert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
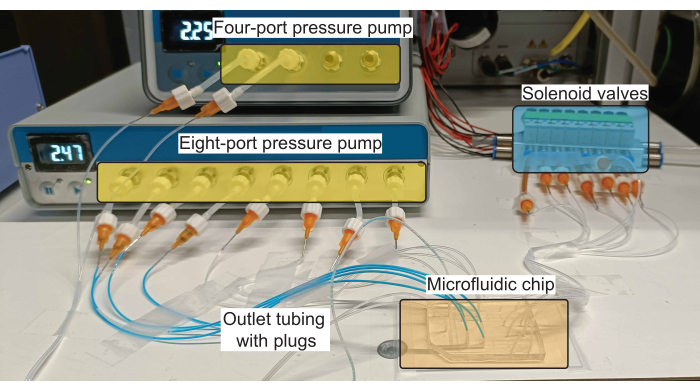
Abbildung 2: Schematische Darstellung des Hardware-Setups für die Steckerproduktion. Die Druckpumpen steuern den Durchfluss von Reagenzien (sowohl wässrig als auch ölisch) in den Einlasskanälen, und die Magnetventile steuern die Betätigung der PDMS-Ventile. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Das Hauptschnittstellenprogramm zur Steuerung des mikrofluidischen Geräts. Dieses maßgeschneiderte Programm ermöglicht die manuelle Druckbeaufschlagung einzelner pneumatischer Ventile (weißes Panel). Es ermöglicht auch die Durchführung eines vollständigen Experiments (blaues Feld), bei dem es eine .csv Datei mit den gewünschten Stopfenpopulationen und notwendigen Parametern wie Ventildruckbeaufschlagung und Druckentlastungszeiten akzeptiert und den Status der Versuchsausführung in Echtzeit anzeigt, einschließlich der Frage, welche Steuerkanäle unter Druck stehen und welche nicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Druckgetriebene Ventilbetätigung. Hellfeldmikroskopische Aufnahmen von (A) PDMS-Ventil (horizontal), das drucklos gemacht wird und der Einlasskanal (vertikal) geöffnet ist, und (B) PDMS-Ventil, das unter Druck gesetzt wird und den Einlasskanal verschließt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
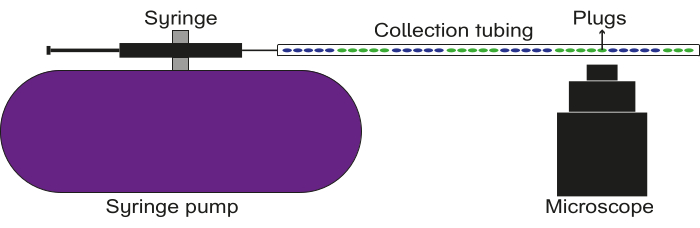
Abbildung 5: Schematische Darstellung des Aufbaus der Datenaufzeichnung. Der Auffangschlauch ist mit einer Spritze mit Öl verbunden, die an einer Pumpe befestigt ist. Die Pfropfen werden durch den Sammelschlauch geflogen, und Bilder/Videos werden mit einem Fluoreszenzmikroskop aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
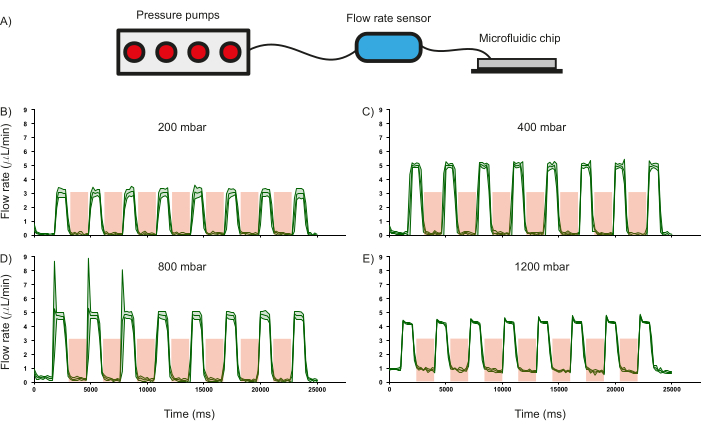
Abbildung 6: Auswirkung der Ventilbetätigung auf die Durchflussmenge bei gegebenem Eingangsdruck. (A) Schematische Darstellung des Hardware-Setups zur Überwachung der Durchflussrate in den mikrofluidischen Kanälen. Das Ansprechverhalten der Durchflussrate in den Kanälen bei unterschiedlichen Eingangsdrücken von (B) 200 mbar, (C) 400 mbar, (D) 800 mbar und (E) 1200 mbar. Die Dauer der Ventilbetätigung ist im rot schattierten Bereich dargestellt. Für alle Experimente wurde destilliertes Wasser verwendet. Die Standardabweichung von drei unabhängigen Messungen wird durch den grün schattierten Bereich dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
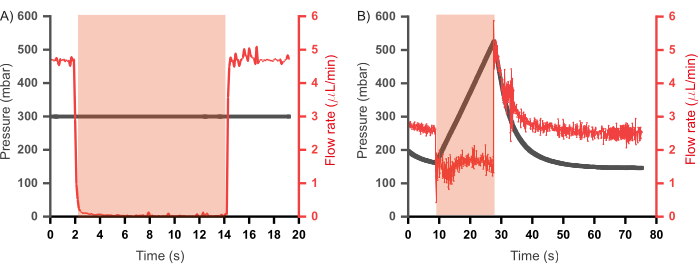
Abbildung 7: Beziehung zwischen Druck und Durchfluss von Reagenzien in den Einlasskanälen bei Ventilbetätigung. (A) In einem Ventil mit konstantem Eingangsdruckbereich (300 mbar) reduziert sich der Durchfluss bei Ventilbetätigung auf Null. (B) Bei einem konstanten Durchflussbereich (2,5 μl/min) führt die Ventilbetätigung zu einem schnellen Druckaufbau im Kanal, bis das Ventil drucklos wird. Die Dauer der Ventilbetätigung ist im rot schattierten Bereich dargestellt. Für alle Experimente wurde destilliertes Wasser verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
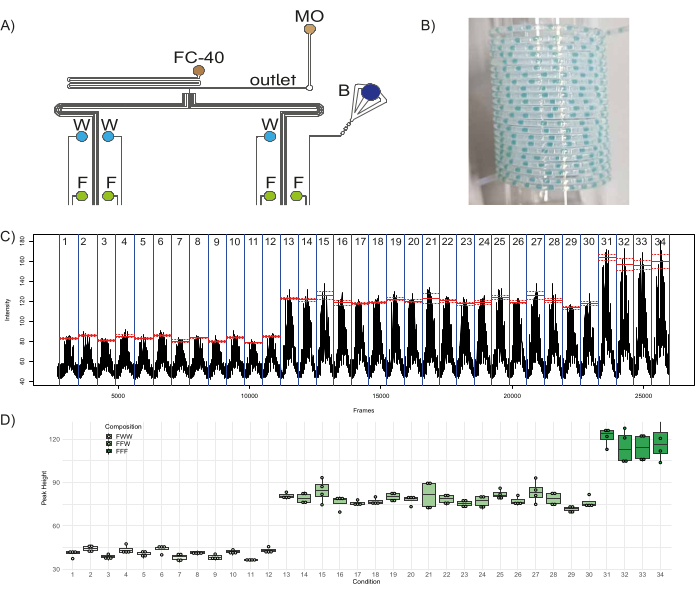
Abbildung 8: Herstellung von fluoreszierenden Pfropfenpopulationen. (A) Schematische Darstellung des Versuchsaufbaus, der die Verbindung der verschiedenen Reagenzien mit dem Gerät darstellt. Abkürzungen: F = Fluorescein, W = destilliertes Wasser, B = Blauer Lebensmittelfarbstoff, FC-40 = fluoriertes Öl und MO = Mineralöl. (B) Beispielbild eines Sammelschlauchs mit Stopfen. (C) Die aus der Analyse gewonnenen Rohdaten zeigen die durchschnittliche Fluoreszenzintensität, die in einem bestimmten Bereich of Interest (ROI) gemessen wird, im Vergleich zur Frame-Nummer der Videodatei. Rote Linien zeigen den Mittelwert der Spitzenfluoreszenz für jede Bedingung (Population von Steckern, die mit einer bestimmten Kombination von drei Eingängen hergestellt wurden), und die gestrichelten Linien zeigen den entsprechenden Standardfehler. (D) Boxplots der Höhe der Gipfel unter den verschiedenen Bedingungen. Die Punkte entsprechen den einzelnen Peaks, die Kästchen für jede Bedingung reichen vom ersten bis zum dritten Quartil der Verteilung der entsprechenden Peaks, und die dicke Linie wird für den Medianwert verwendet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzungsdatei 1: Das Hauptschnittstellenprogramm für die Bedienung des Geräts. Die Steuerschnittstelle für die manuelle Druckbeaufschlagung der Steuerkanäle und das Durchführen eines automatischen Experiments in der Acht-Einlass-Vorrichtung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 2: Alternatives Hauptschnittstellenprogramm für den Gerätebetrieb. Die Steuerungsschnittstelle für den Betrieb eines Geräts mit acht Eingängen ohne Barcode-Funktion. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 3: LabVIEW-Unterprogramm mit globalen Variablen. SubVI des Hauptschnittstellenprogramms, das den Status der globalen Variablen im Hauptschnittstellenprogramm, d.h. der Steuerkanäle, auflistet und anzeigt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 4: LabVIEW-Programm zum Speichern von Werten globaler Variablen. SubVI des Hauptschnittstellenprogramms, das den aktuellen Zustand der Ventile als Array speichert, das verwendet wird, um den gleichen Zustand der Ventile beizubehalten, falls der Benutzer länger als 30 Sekunden inaktiv ist. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 5: Transmission Control Protocol (TCP) LabVIEW-Programm. SubVI zur Aufrechterhaltung der TCP-Verbindung zwischen dem Hauptschnittstellenprogramm und der WAGO-Steuerung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 6: TCP-Unterprogramm für die globale Variable LabVIEW. Programm zum Speichern der TCP-Ausgangsvariablen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 7: Eingang für die Durchführung des automatischen Experiments. Die .csv Datei, die Zusammensetzung, Sequenz und Repliken von Plug-Populationen kodiert, um Experimente zur Herstellung quantitativer Fluoreszenz-Plugs durchzuführen, wie in diesem Artikel beschrieben. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 8: Python-Skript zur Analyse der Fluoreszenzpfropfenpopulation. Benutzerdefiniertes Python-Skript zum Auslesen von Fluoreszenzwerten aus der Aufzeichnung von Plugs (.avi Datei). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 9: Ausgabe der Fluoreszenzanalyse von Steckern. Ausgabe des Python-Skripts mit Fluoreszenzwerten für einen 5x5-ROI aus der Aufzeichnung der Plugs. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 10: R-Programm zum Lesen der Ausgabedatei. Benutzerdefiniertes Programm, das in dieser Arbeit verwendet wird, um die ausgegebenen Fluoreszenzwerte zu lesen und Rohdaten, Peakhöhen und Standardabweichungen darzustellen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 11: R-Funktionen zum Analysieren und Plotten von Fluoreszenzdaten. Benutzerdefinierte R-Funktionen, die verwendet werden, um 1. Schneiden Sie die Rohdaten der Fluoreszenzwerte ab, 2. verschiedene Versuchsbedingungen definieren, 3. Peaks aus den gegebenen Bedingungen identifizieren, 4.die Rohdaten und die erkannten Bedingungen überlappen darstellen und 5. Plotten Sie die identifizierten Peaks und die überlappenden Rohdaten. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
In diesem Artikel wurde eine Reihe von Protokollen für die Herstellung und den Betrieb einer PDMS-basierten mikrofluidischen Vorrichtung zur automatisierten Erzeugung von kombinatorischen Bibliotheken in Wasser-in-Öl-Kammern, den sogenannten Plugs, vorgestellt. Die Kombination von Mikrofluidik mit Tröpfchentechnologie bietet eine leistungsstarke Technik zur Verkapselung kleiner Mengen von Reagenzien in einer großen Anzahl von Kompartimenten und eröffnet somit Wege für ein groß angelegtes kombinatorisches Screening.
Zuvor wurden mehrere Technologien beschrieben, um chemisch unterschiedliche Kompartimente mit Hilfe der Mikrofluidik zu erzeugen, jede mit ihren Vor- und Nachteilen. Kulesa et al.50 beschrieben eine Strategie, um Zellen mit Barcodes in Tröpfchen unter Verwendung von Mikrotiterplatten einzukapseln und diese Tröpfchen unter Verwendung eines elektrischen Feldes zusammenzuführen, um eine kombinatorische Bibliothek zu erstellen. Ein solcher Ansatz kann zwar viele Kombinationen von Tröpfchen erzeugen, ist aber durch die Notwendigkeit manueller Handhabungsschritte im Arbeitsablauf begrenzt. Tomasi et al.51 entwickelten eine mikrofluidische Plattform, um ein sphäroidhaltiges Tröpfchen (frei schwebende Zellaggregate) mit einem Stimuluströpfchen zu verschmelzen und so die Manipulation der sphäroiden Mikroumgebung zu ermöglichen. Diese Methode ermöglicht die Untersuchung wichtiger Phänomene wie Zell-Zell-Wechselwirkungen und die Wirkung von Medikamenten, hat aber einen relativ geringen Durchsatz. Eduati et al.46 und Utharala et al.47 entwickelten eine mikrofluidische Ventil-basierte Plattform, die kombinatorische Bibliotheken mit hohem Durchsatz automatisiert generieren kann. In diesen Studien werden die Ventile jedoch mit einer Braille-Vorrichtung betätigt, was umständliche Ausrichtungsschritte zwischen dem Mikroventil und dem mikrofluidischen Chip erfordert. Ein Schlüsselmerkmal des in dieser Arbeit beschriebenen Systems ist die Implementierung von pneumatischen PDMS-Ventilen zur Regulierung des Flüssigkeitsflusses in den Eingangskanälen. Da diese Ventile PDMS-basiert sind, können sie relativ reibungslos in die Fertigungsschritte des Mikrofluidik-Chips integriert werden. Darüber hinaus sind sie eine relativ einfache Möglichkeit, den Flüssigkeitsfluss in den Einlasskanälen zu steuern, da sie durch Ausüben von Druck durch eine externe Gasquelle betätigt werden können. Schließlich können die Dauer und die Reihenfolge der Druckbeaufschlagung und -entlastung dieser Ventile programmiert werden, wodurch die Produktion unterschiedlicher Populationen von Stopfen in einer Weise mit hohem Durchsatz automatisiert wird. Ein weiteres wichtiges Merkmal ist die Verwendung von konstanten Druckregimen für die Injektion von Reagenzien durch den Einlass, was es ermöglicht, auf den Einbau von Abfallkanälen zu verzichten, um die Druckansammlung zu verringern, die in einem konstanten Durchflussbereich auftritt. Dies vereinfacht das Gerätedesign, reduziert den Bedarf an zusätzlichen Ventilen und Hardware zur Steuerung der Ventile des Abfallkanals und minimiert die Verschwendung von Reagenzien.
Während die Herstellung von Geräten mit PDMS relativ unkompliziert ist, erfordert die Implementierung solcher Geräte die Verwendung umfangreicher Hardware-Utensilien wie die pneumatischen Magnetventile (zur Steuerung der Betätigung der PDMS-Ventile), Druckpumpen (zur Steuerung des Durchflusses von Einlass- und Ölreagenzien) und Softwareprogramme (zur Regelung der Magnetventile). Obwohl sie eine erhebliche Investition darstellen, bietet ein solches Setup Konsistenz und Zuverlässigkeit für den erfolgreichen Betrieb des Geräts. Darüber hinaus sind die in diesem Protokoll beschriebenen Hardwarekomponenten und die Architektur modular aufgebaut. Daher können für einige Module Alternativen verwendet werden, um Kosten zu senken oder sie an einen bestimmten Bedarf anzupassen. Zum Beispiel gibt es eine Vielzahl von Pumpen, die je nach Nutzen, Budget, Verfügbarkeit und Komfort verwendet werdenkönnen 52,53,54. Zusätzliche Komponenten, wie z. B. Flüssigkeitsbehälter und Temperaturregler, können für empfindliche Einlassreagenzien eingebaut werden23. Darüber hinaus kann dieses Design nach oben oder unten skaliert werden, um spezifischen wissenschaftlichen Anforderungen gerecht zu werden. Zum Beispiel wird in dieser Arbeit ein Prototyp mit acht Eingängen beschrieben, der es ermöglicht, acht einzigartige Reagenzien zu kombinieren, um Stopfen herzustellen. Dies kann auf ein Gerät mit 16 Eingängen hochskaliert werden, was eine höhere Anzahl von Eingängen und größere Kombinationen davon ermöglicht. Folglich werden zusätzliche Steuerkanäle und Magnetventile benötigt, um die Einlässe zu adressieren, aber ein solcher Prototyp ermöglicht die Generierung größerer und vielfältigerer kombinatorischer Bibliotheken. Schließlich wird in dieser Arbeit jede Pfropfenpopulation durch die Öffnung von drei der acht wässrigen Einlässe der mikrofluidischen Vorrichtung erzeugt. Es wurde beobachtet, dass für eine solche Konfiguration ein Druck von etwa 200 mbar für die Ölreagenzien und 400 mbar für die wässrigen Reagenzien einem Regime der Stopfenproduktion entsprach, das ausschließlich durch Ventilbetätigung angetrieben wird. Wenn höhere Drücke auf das/die Öl(e) ausgeübt wurden, wurde ein Aufbrechen der Stopfen beobachtet, und die Anwendung niedrigerer Drücke führte zu einer Verschmelzung der Stopfen. Das optimale Druckregime für die Herstellung von Stopfen hängt von einer Vielzahl von Faktoren ab, wie z. B. der Anzahl der Einlässe, die zur Bildung eines Stopfens beitragen, der Art und Viskosität der Flüssigkeiten sowie den Abmessungen der Kanäle und sollte bei Bedarf optimiert werden.
Einer der Nachteile des Betriebs in einem konstanten Druckregime besteht darin, dass Flüssigkeiten mit unterschiedlichen Viskositäten bei konstantem Druck unterschiedliche Durchflussraten aufweisen. Daher muss sichergestellt werden, dass die wässrigen Reagenzien, die durch die Einlässe fließen, vergleichbare Viskositäten aufweisen. Die Verwendung von Flüssigkeiten unterschiedlicher Viskosität beeinflusst nicht nur die Strömung in den Einlasskanälen, sondern auch die Pfropfenbildung am T-Übergang und beeinträchtigt dadurch die Zusammensetzung der Pfropfenpopulationen. Ein weiterer Nachteil ist die Kontamination einer Stopfenpopulation durch Restreagenzien am T-Übergang. Wenn das Gerät zwischen der Produktion verschiedener Steckerpopulationen umschaltet, neigt der erste/letzte Stecker in der Sequenz jeder Population dazu, durch die vorherige oder die folgende Population verunreinigt zu werden. Dies kann überwunden werden, indem zusätzliche Replikate jeder Population erstellt und der kontaminierte Pfropfen während der Analyse ausgeschlossen wird. Schließlich gibt es auch das Potenzial für Schwankungen zwischen einzelnen Geräten, die sich aus Inkonsistenzen in der Herstellung und/oder externen Quellen (Druckschwankungen) ergeben. Dieses Problem kann gemildert werden, indem ein einzelner mikrofluidischer Chip mehrmals wiederverwendet wird und sichergestellt wird, dass ein vollständiger Lauf einer kombinatorischen Bibliothek auf einem einzigen Chip durchgeführt wird, um die Auswirkungen dieser Inkonsistenzen zu minimieren.
Das mikrofluidische Gerät und der begleitende Satz von Betriebsprotokollen, die in diesem Artikel vorgestellt werden, wurden verwendet, um die Herstellung einer quantitativen kombinatorischen Bibliothek von Steckern zu demonstrieren. Diese Plattform kann daher schnell kombinatorische Bibliotheken unterschiedlicher Steckerpopulationen mit hohem Durchsatz generieren. Infolgedessen können solche Technologien für eine Vielzahl von Screening-Zwecken eingesetzt werden, einschließlich, aber nicht beschränkt auf das kombinatorische Wirkstoffscreening an Patientenbiopsieproben - wobei eine kleine Anzahl von Zellen, die aus einer Biopsie gewonnen werden, in einer großen Anzahl von Tröpfchen verteilt und mit einer großen Kombination des Krebsmedikaments behandelt werden kann, um die individuelle Therapie für eine bestimmte Patientenprobe zu optimieren - und somit die personalisierte Krebstherapie zu beschleunigen46, 48,55.
Offenlegungen
F. E. ist Freelancer bei TheraMe! AG. Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Wir bedanken uns bei Stacey Martina vom NanoLab TuE für die Hilfe bei der HMDS-Gasphasenabscheidung. Diese Forschung wurde vom Institute for Complex Molecular Systems (ICMS) der TU/e und vom Gravitationsprogramm IMAGINE! (Projektnummer 24.005.009).
Materialien
| Name | Company | Catalog Number | Comments |
| 1,1,3,3 tetramethyldisiloxane | Merck Life Science NV | MFCD00008256 | |
| 4 channel digital input/output module | WAGO Kontakttechnik GmbH | 750-504 | |
| Acetone | Boom Labs | BOOMSKEUZW3 | |
| Analysis Software | Eindhoven University of Technology | https://github.com/SysBioOncology/BilayerMicrofluidicsAnalysis_JoVE | |
| AZ 40XT 11D | Merck Life Science NV | 212299 | Positive photoresist |
| AZ 726 MIF developer | Merck Life Science NV | 10055824960 | Developer for positive photoresist |
| Biopsy Punch, Rapid Core | World Precision Instruments Germany, GMBH | 504529 | 0.75 mm ID, W/Plunge |
| Blue food dye | PME | FC1036 | |
| Controller end module | WAGO Kontakttechnik GmbH | 750-600 | |
| Ethernet Controller | WAGO Kontakttechnik GmbH | 750-881 | |
| FC-40 | Merck Millipore | F9755-100ML | |
| Fluigent flow unit | Fluigent | FLU-S-D | |
| Fluigent pressure system | Fluigent | MFCS-EZ | 0 - 2 bar |
| Fluorescein | Merck Life Science NV | MFCD00005050 | |
| Hot plate | Torrey Pines Scientific | HP61 | |
| Inverted microscope | Nikon Instruments | Eclipse Ti-E | |
| Isopropanol | Boom Labs | BOOMSKEUZE3 | |
| LabVIEW (Software Version 20) | Eindhoven University of Technology | https://github.com/SysBioOncology/BilayerMicrofluidicsAnalysis_JoVE/tree/main/LabVIEW_8_inlet_device_ VERSION_1 | All files have been saved for LabVIEW version 20. It is advised to use this version or higher to open the files. |
| Luer stubs | Instech Laboratories, Inc. | LS23 | 23 ga, 0.5" |
| Male Luer to barb connectors | Cole Parmer | 45505-32 | 3/32" ID |
| MasterFlex PTFE tubing | Avator/VWR | 48634 | |
| Microscope Slides | VWR | 470150-480 | |
| Microscope slides, Plain | Corning | 2947-75X50 | |
| Mineral Oil | Merck Millipore | 330760-1L | |
| mr DEV 600 | Micro resist Technology | R815100 | Developer for negative photoresist |
| Oven | Thermo Scientific | Heraeus T6P 50045757 | |
| Oxygen plasma asher | Quorum Technologies | K1050X | |
| Photomask | CAD/Art Services, Inc. | ||
| Photomask Design | Eindhoven University of Technology (Adapted from Merten Lab, EPFL) | https://github.com/SysBioOncology/BilayerMicrofluidicsAnalysis_JoVE/blob/main/8_inlet_JoVE_device_design.dwg | |
| Pneumatic valve array | FESTO | 1x 8 valve array, Normally closed valves | |
| Silicon Wafers | Silicon Materials | <1-0-0>, 100 mm diameter, 525 μm thickness | |
| Single edge blades | GEM Scientific | ||
| Soft tubing | Fluigent | 1 mm ID, 3 mm OD | |
| Spin coater | Laurell Technologies Corporation | WS-650MZ-23NPPB | |
| Stereo microscope | Olympus Corporation | SZ61 | |
| SU-8 3050 | Kayakli Advanced Materials | Y311075 1000L1GL | Negative photoresist |
| Sylgard 184 Silicone Elastomer Kit (PDMS) | Dow | 1317318 | |
| Syringe | B Braun Injekt - F Fine Dosage Syringe | 10303002 | |
| UV-LED exposure system | Idonus | UV-EXP150S-SYS | |
| Vacuum pump | Vacuumbrand GmbH | MD1C | |
| Weighing scales | Sartorius | M-prove |
Referenzen
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Terry, S. C., Herman, J. H., Angell, J. B. A gas chromatographic air analyzer fabricated on a Silicon wafer. IEEE Transactions on Electron Devices. 26 (12), 1880-1886 (1979).
- Mellors, J. S., Gorbounov, V., Ramsey, R. S., Ramsey, J. M. Fully integrated glass microfluidic device for performing high-efficiency capillary electrophoresis and electrospray ionization mass spectrometry. Anal Chem. 80 (18), 6881-6887 (2008).
- Wlodarczyk, K. L., Hand, D. P., Maroto-Valer, M. M. Maskless, rapid manufacturing of glass microfluidic devices using a picosecond pulsed laser. Sci Rep. 9 (1), 20215 (2019).
- Nielsen, J. B., et al. Microfluidics: innovations in materials and their fabrication and functionalization. Anal Chem. 92 (1), 150-168 (2020).
- Nge, P. N., Rogers, C. I., Woolley, A. T. Advances in microfluidic materials, functions, integration, and applications. Chem Rev. 113 (4), 2550-2583 (2013).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Anal Chem. 70 (23), 4974-4984 (1998).
- Unger, M. A., Chou, H. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic microfabricated valves and pumps by multilayer soft lithography. Science. 288 (5463), 113-116 (2000).
- Oh, K. W., Ahn, C. H. A review of microvalves. Journal of Micromechanics and Microengineering. 16 (5), R13 (2006).
- Au, A. K., Lai, H., Utela, B. R., Folch, A. Microvalves and micropumps for BioMEMS. Micromachines. 2 (2), 179-220 (2011).
- Jerman, H. Electrically-activated, normally-closed diaphragm valves. J. Micromech. Microeng. 4 (4), 210 (1994).
- Neagu, C. R., Gardeniers, J. G. E., Elwenspoek, M., Kelly, J. J. An electrochemical microactuator: principle and first results. J microelectromechanical sys. 5 (1), 2-9 (1996).
- Gu, W., Zhu, X., Futai, N., Cho, B. S., Takayama, S. Computerized microfluidic cell culture using elastomeric channels and Braille displays. Proc Natl Acad Sci U S A. 101 (45), 15861-15866 (2004).
- Studer, V., et al. Scaling properties of a low-actuation pressure microfluidic valve. J Appl Phys. 95 (1), 393-398 (2004).
- Hansen, C. L., Sommer, M. O. A., Quake, S. R. Systematic investigation of protein phase behavior with a microfluidic formulator. Proc Natl Acad Sci U S A. 101 (40), 14431-14436 (2004).
- Ridgeway, W. K., Seitaridou, E., Phillips, R., Williamson, J. R. RNA-protein binding kinetics in an automated microfluidic reactor. Nucleic Acids Res. 37 (21), e142 (2009).
- Fu, A. Y., Chou, H. P., Spence, C., Arnold, F. H., Quake, S. R. An integrated microfabricated cell sorter. Anal Chem. 74 (11), 2451-2457 (2002).
- Liu, J., Enzelberger, M., Quake, S. A nanoliter rotary device for polymerase chain reaction. Electrophoresis. 23 (10), 1531-1536 (2002).
- Thorsen, T., Maerkl, S. J., Quake, S. R. Microfluidic large-scale integration. Science. 298 (5593), 580-584 (2002).
- Galas, J. C., Haghiri-Gosnet, A. M., Estévez-Torres, A. A nanoliter-scale open chemical reactor. Lab Chip. 13 (3), 415-423 (2013).
- Niederholtmeyer, H., Stepanova, V., Maerkl, S. J. Implementation of cell-free biological networks at steady state. Proc Natl Acad Sci U S A. 110 (40), 15985-15990 (2013).
- Yelleswarapu, M., et al. Sigma factor-mediated tuning of bacterial cell-free synthetic genetic oscillators. ACS Synth Biol. 7 (12), 2879-2887 (2018).
- van der Linden, A. J., et al. A multilayer microfluidic platform for the conduction of prolonged cell-free gene expression. J Vis Exp. (152), 59655 (2019).
- Shang, L., Cheng, Y., Zhao, Y. Emerging droplet microfluidics. Chem Rev. 117 (12), 7964-8040 (2017).
- Seemann, R., Brinkmann, M., Pfohl, T., Herminghaus, S. Droplet based microfluidics. Rep Prog Phys. 75, 016601 (2012).
- Baret, J. C. Surfactants in droplet-based microfluidics. Lab Chip. 12 (3), 422-433 (2012).
- Clausell-Tormos, J., et al. Droplet-based microfluidic platforms for the encapsulation and screening of mammalian cells and multicellular organisms. Chem Biol. 15 (5), 427-437 (2008).
- Umbanhowar, P. B., Prasad, V., Weitz, D. A. Monodisperse emulsion generation via drop break off in a coflowing stream. Langmuir. 16 (2), 347-351 (2000).
- Abate, A. R., Thiele, J., Weitz, D. A. One-step formation of multiple emulsions in microfluidics. Lab Chip. 11 (2), 253-258 (2011).
- Chen, Y., Gao, W., Zhang, C., Zhao, Y. Three-dimensional splitting microfluidics. Lab Chip. 16 (8), 1332-1339 (2016).
- Ahn, K., Agresti, J., Chong, H., Marquez, M., Weitz, D. A. Electrocoalescence of drops synchronized by size-dependent flow in microfluidic channels. Appl Phys Lett. 88 (26), 264105 (2006).
- Fidalgo, L. M., Abell, C., Huck, W. T. S. Surface-induced droplet fusion in microfluidic devices. Lab Chip. 7 (8), 984-986 (2007).
- Bernath, K., et al. In vitro compartmentalization by double emulsions: Sorting and gene enrichment by fluorescence activated cell sorting. Anal Biochem. 325 (1), 151-157 (2004).
- Aharoni, A., Amitai, G., Bernath, K., Magdassi, S., Tawfik, D. S. High-throughput screening of enzyme libraries: thiolactonases evolved by fluorescence-activated sorting of single cells in emulsion compartments. Chem Biol. 12 (12), 1281-1289 (2005).
- Deng, N. N., Yelleswarapu, M., Huck, W. T. S. Monodisperse uni- and multicompartment liposomes. J Am Chem Soc. 138 (24), 7584-7591 (2016).
- Deng, N. N., Yelleswarapu, M., Zheng, L., Huck, W. T. S. Microfluidic assembly of monodisperse vesosomes as artificial cell models. J Am Chem Soc. 139 (2), 587-590 (2016).
- Hindson, B. J., et al. High-throughput droplet digital PCR system for absolute quantitation of DNA copy number. Anal Chem. 83 (22), 8604-8610 (2011).
- Macosko, E. Z., et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets. Cell. 161 (5), 1202-1214 (2015).
- Shembekar, N., Chaipan, C., Utharala, R., Merten, C. A. Droplet-based microfluidics in drug discovery, transcriptomics and high-throughput molecular genetics. Lab Chip. 16 (8), 1314-1331 (2016).
- Wong, A. H., et al. Drug screening of cancer cell lines and human primary tumors using droplet microfluidics. Sci Rep. 7 (1), 9109 (2017).
- Jing, W., Han, H. Droplet microfluidics for high-resolution virology. Anal Chem. 94 (23), 8085-8100 (2022).
- Ding, Y., Choo, J., deMello, A. J. From single-molecule detection to next-generation sequencing: microfluidic droplets for high-throughput nucleic acid analysis. Microfluid Nanofluidics. 21 (3), 58 (2017).
- Nightingale, A. M., et al. A stable droplet reactor for high temperature nanocrystal synthesis. Lab Chip. 11 (7), 1221-1227 (2011).
- De Stefano, P., Bianchi, E., Dubini, G. The impact of microfluidics in high- throughput drug-screening applications. Biomicrofluidics. 16 (3), 031501 (2022).
- Tekin, E., et al. Prevalence and patterns of higher-order drug interactions in Escherichia coli. NPJ Syst Biol Appl. 4, 31 (2018).
- Eduati, F., et al. A microfluidics platform for combinatorial drug screening on cancer biopsies. Nat Commun. 9 (1), 2434 (2018).
- Utharala, R., et al. A microfluidic Braille valve platform for on-demand production, combinatorial screening and sorting of chemically distinct droplets. Nat Protoc. 17 (12), 2920-2965 (2022).
- Mathur, L., et al. Combi-seq for multiplexed transcriptome-based profiling of drug combinations using deterministic barcoding in single-cell droplets. Nat Commun. 13 (1), 4450 (2022).
- Dubuc, E., et al. Cell-free microcompartmentalised transcription–translation for the prototyping of synthetic communication networks. Curr Opin Biotechnol. 58, 72-80 (2019).
- Kulesa, A., Kehe, J., Hurtado, J. E., Tawde, P., Blainey, P. C. Combinatorial drug discovery in nanoliter droplets. Proc Natl Acad Sci U S A. 115 (26), 6685-6690 (2018).
- Tomasi, R. F. X., Sart, S., Champetier, T., Baroud, C. N. Individual control and quantification of 3D spheroids in a high-density microfluidic droplet array. Cell Rep. 31 (8), 107670 (2020).
- White, J. A., Streets, A. M. Controller for microfluidic large-scale integration. HardwareX. 3, 135-145 (2018).
- Brower, K., et al. An open-source, programmable pneumatic setup for operation and automated control of single- and multi-layer microfluidic devices. HardwareX. 3, 117-134 (2018).
- Gonzalez-Suarez, A. M., Long, A., Huang, X. H., Revzin, A. A Compact control system to enable automated operation of microfluidic bioanalytical assays. Biosensors. 12 (12), 1160 (2022).
- Mathur, L., Ballinger, M., Utharala, R., Merten, C. A. Microfluidics as an enabling technology for personalized cancer therapy. Small. 16 (9), e1904321 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten