Method Article
Floresan In Situ Hibridizasyon ile Formalinle Sabitlenmiş Parafine Gömülü Numunelerde Gen Amplifikasyonunun Sağlam Tespiti
Bu Makalede
Özet
Bu protokol, formalinle sabitlenmiş parafine gömülü (FFPE) doku örneklerinde gen amplifikasyonunu görselleştirmek için tekrarlanabilir bir yöntem sağlar.
Özet
Ekstrakromozomal DNA (ecDNA) gibi fokal gen amplifikasyonu, kanser gelişiminde ve tedavi direncinde önemli bir rol oynar. Dizileme tabanlı metodolojiler ecDNA'nın tarafsız bir şekilde tanımlanmasını sağlarken, floresan in situ hibridizasyon (FISH) gibi sitogenetik tabanlı teknikler, klinik örneklerde ecDNA'yı tanımlamak için zaman ve maliyet etkin olmaya devam etmektedir. Formalinle sabitlenmiş parafine gömülü (FFPE) doku örneklerinde FISH uygulaması, özellikle karyotip incelemesi için canlı örnekler mevcut olmadığında, amplifiye genleri tespit etmek için benzersiz bir yol sunar. Bununla birlikte, bu teknik için fikir birliği prosedürleri eksikliği vardır. Bu protokol, bu protokolün üstesinden gelmeyi ve standartlaştırmayı amaçladığı benzersiz zorluklar sunan FFPE doku örneklerinde ecDNA da dahil olmak üzere gen amplifikasyonunu tespit etmek için FISH'in yürütülmesi için kapsamlı, tamamen optimize edilmiş, adım adım talimatlar sağlar. Araştırmacılar bu protokolü izleyerek, gen amplifikasyonunu değerlendirmek için tekrarlanabilir şekilde yüksek kaliteli görüntüleme verileri elde edebilirler.
Giriş
Fokal onkogen amplifikasyonunun incelenmesi, kanser oluşumunu, ilerlemesini ve tedavi direncini yönlendirdiği için çok önemlidir1. Daha da önemlisi, onkogenler ve immün düzenleyicileyici genler, asimetrik kalıtımları kanserdegenetik heterojenliği teşvik eden ekstrakromozomal DNA'lar (ecDNA) olarak çoğalabilir 2,3. ecDNA, tedavi direnci ve olumsuz klinik sonuçlarla ilişkilendirilmiştir 4,5,6.
Formalinle sabitlenmiş parafine gömülü (FFPE) doku örnekleri, patoloji laboratuvarlarında geniş bir arşiv kaynağını temsil eder ve retrospektif çalışmalar için bol miktarda bilgi sunar. Bununla birlikte, FFPE örneklerinden PCR veya dizileme yoluyla moleküler verilerin çıkarılması, fiksasyon sırasında nükleik asit parçalanması, bozunması ve çapraz bağlanma nedeniyle zordur7. FFPE dokularının moleküler analizi için mevcut olan bir dizi teknik arasında, floresan in situ hibridizasyonun (FISH) spesifik DNA dizilerini görselleştirmek için etkili olduğu kanıtlanmıştır8.
Modern moleküler tanı tekniklerinin ilerlemesine rağmen, FISH'in tek hücre düzeyinde gen amplifikasyonunu görselleştirme ve ölçme yeteneği, tümör oluşumunun altında yatan moleküler mekanizmalar ve klinik sonuçlar hakkında değerli bilgiler sağlar. İlgilenilen hedef geni tamamlayan floresan etiketli problar kullanarak, FISH, bir onkogenin lokalizasyonunu uygun bir şekilde çözebilir ve tek tek hücreler içinde onkogen amplifikasyonu (ecDNA gibi) şeklini çıkarabilir, aksi takdirde diğer teknolojiler aracılığıyla imkansız veya pahalıdır. Bu nedenle FISH, tümör heterojenliğini ve klonal evrimi değerlendirmek için ekonomik bir yol sunar9. Ayrıca, otomasyon, görüntüleme ve hesaplamalı analizdeki ilerlemeler, FISH verilerinin yüksek verimli analizini kolaylaştırarak, büyük doku kohortlarında gen amplifikasyonunun sağlam bir şekilde ölçülmesini sağlamıştır10.
Bununla birlikte, FISH'in FFPE dokusuna uygulanması, çapraz bağlama artefaktları ve arka plan otofloresansı dahil olmak üzere doğal zorluklar sunar. Bu engellerin üstesinden gelmek, doğru ve tekrarlanabilir sonuçlar elde etmek için her prosedürün dikkatli bir şekilde optimize edilmesini gerektirir. Bu makale, FFPE doku örneklerinde gen amplifikasyonunu araştırmak için FISH'i uygulamak için adım adım, tamamen optimize edilmiş bir protokol sağlar. ERBB2 (HER2) gen lokusunu hedefleyen bir prob kullanarak, FISH'in meme kanseri hastalarından alınan FFPE örneklerinde ERBB2 amplifikasyon durumunu sağlam bir şekilde tespit edebileceğini gösteriyoruz. ERBB2'nin ecDNA olarak amplifiye edilip edilmediğini tahmin etmek bile mümkündür. Mevcut literatürü ve deneysel bulgularımızı sentezleyerek, FISH tabanlı analizin metodolojik hususlarını, teknik zorluklarını ve potansiyel tuzaklarını aydınlatıyoruz. Ayrıca, çeşitli kanser türlerinde gen amplifikasyon profillemesinin klinik önemini tartışıyor, prognostik önemini ve kişiselleştirilmiş terapötik stratejiler için potansiyelini vurguluyoruz.
Özetle, bu makale, FFPE doku örneklerinde gen amplifikasyonunu incelemek, tümör biyolojisi hakkında benzersiz bilgiler sunmak ve onkolojide klinik karar vermeye rehberlik etmek için değerli bir araç olarak FISH'in önemini vurgulamaktadır. Devam eden iyileştirme ve tamamlayıcı moleküler tahlillerle entegrasyon ile FISH tabanlı analiz, kanser patogenezi konusundaki anlayışımızı daha da geliştirmeye ve hassas tıp çağında hasta sonuçlarını iyileştirmeye hazırdır.
Protokol
Bu araştırma protokolü, Texas Üniversitesi Güneybatı Tıp Merkezi Kurumsal İnceleme Kurulu (IRB) tarafından onaylanmıştır. Ameliyat öncesi tüm hastalardan bilgilendirilmiş onam alındı.
1. Reaktifler ve malzemelerin hazırlanması
- 0.2 N sodyum klorür (HCl) çözeltisini, 8.212 mL HCl (% 37 w / w veya 12.1 N) 491.788 mL ddH2O'ya yavaşça ekleyerek bir davlumbazda hazırlayın. Oda sıcaklığında (RT) saklayın.
DİKKAT: Suya yavaş yavaş asit ekleyin. Aside su eklemeyin. - 1.47 g Tri-sodyum sitrat (dihidrat) 400 mL ddH2O içinde çözerek 10 mM sitrik asit çözeltisi (pH 6.0) hazırlayın. pH 6.0'a ayarlamak için HCl kullanın ve ardından son hacmi ddH2O ile 500 mL'ye getirin. Tamponu RT'de saklayın.
- 100 μL Tween-20 ila 900 μL ddH2O ekleyerek %10 Tween-20 çözeltisini hazırlayın. RT'de saklayın.
- 45 mL ddH2O'ya 5 mL IGEPAL CA-630 ekleyerek% 10 IGEPAL çözeltisini hazırlayın.
- 44.1 g Tri-sodyum sitrat (dihidrat) ve 87.65 g sodyum klorür (NaCl) 900 mL ddH2O içinde çözerek 20x SSC (pH 7.0, 3 M NaCl, 0.3 M Sodyum Sitrat) çözeltisini hazırlayın. pH 7.0'a ayarlamak için HCl kullanın ve ardından son hacmi ddH2O ile 1000 mL'ye getirin. Tamponu RT'de saklayın.
- 900 mL ddH2O'ya 100 mL 20x SSC ekleyerek 2x SSC çözeltisini hazırlayın. Gerekirse, 0,5 mL koruyucu ekleyin (Malzeme Tablosu). RT'de saklayın.
- 910 μL ddH2O, 500 μL 20x SSC, 50 μL %10 Tween-20, 40 μL RNase A, 1 mL %50 dekstran sülfat ve 2.5 mL formamid karıştırarak prob hibridizasyon tamponunu hazırlayın. 1 mL'ye ayırın ve -20 °C'de saklayın.
- 100 mL 2x SSC, 15 mL %10 IGEPAL ve 385 mL ddH2O karıştırarak 0.4x SSC'yi %0.3 IGEPAL çözeltisi ile hazırlayın.
- 495 mL 2x SSC çözeltisine 5 mL %10 IGEPAL ekleyerek 2x SSC'yi %0.1 IGEPAL çözeltisi ile hazırlayın. RT'de saklayın.
- Kullanmadan önce 99 μL Tris-EDTA tamponuna 1 μL Proteinaz K ekleyerek Proteinaz K sindirim tamponunu taze olarak hazırlayın.
- 1 mg DAPI'yi 1 mL ddH2O'da çözerek 1 mg / mL DAPI depolama stoğu hazırlayın. -20 ° C'de ve ışıktan uzakta saklayın. 999 μL 2x SSC çözeltisine 1 μL DAPI depolama stoğu ekleyerek DAPI çalışma çözümünü hazırlayın. Kullanana kadar ışıktan uzak tutunuz.
2. Numune ön işlemi
NOT: Burada kullanılan slayt numuneyi içermektedir.
- Slaytı 60-90°C'de 20 dakika veya gece boyunca yaşlandırın (Şekil 1).
NOT: Bu adım parafin erimesini kolaylaştırır. Genellikle 20 dakikalık ısıtma yeterlidir. Programa uyum sağlamak için bir geceye kadar uzatılabilir. - Slaytı 10 dakika boyunca bir Coplin kavanozunda ksilen veya ikamelerine batırarak deparafinize edin. Bu adımı taze ksilen veya ikameleriyle tekrarlayın. Aşağıdaki tüm ön işlem ve yıkama adımlarını bir Coplin kavanozunda gerçekleştirin.
NOT: Ksilen ikameleri, ksilene güvenli ve çevre dostu alternatiflerdir. İkamelerden biri (Malzeme Tablosuna bakınız), daha iyi olmasa da, ksilen kadar iyi performans gösterir. Ksilen ikameleri ksilenden daha az koku üretse de, çeker ocak içinde kullanılması tavsiye edilir. Ksilen ikamelerine erişilemiyorsa, tüm prosedürler herhangi bir değişiklik yapılmadan ksilen bazlı deparafinizasyon ile uyumludur. - Ksilen ikamesini %100 etanol ile 5 dakika yıkayın.
- Slaytı 5 dakika boyunca %70 etanol daldırma ile yeniden sulandırın.
- Slaytı 20 dakika boyunca RT'de 0,2 N hidroklorik aside (HCl) daldırın.
NOT: HCl, FISH problarına11 DNA erişilebilirliğini iyileştirmek için bazik nükleer proteinler gibi asitte çözünen proteinleri etkili bir şekilde çıkarır. - Slaytı 10 mM sıcak sitrik asit çözeltisine daldırın ve 90-95 ° C'de 20 dakika inkübe edin.
NOT: Yüksek sıcaklıklarda sitrik asit muamelesi benzer şekilde asitte çözünür proteinleri çıkarır. Her iki asit tedavisinin de otofloresan12'yi azaltmak için hücre dışı matris proteinlerini çıkardığı düşünülmektedir. Sitrik çözeltinin lam üzerine uygulanmadan önce istenen sıcaklık aralığına önceden ısıtılması tavsiye edilir. Mikrodalga bunu yapmak için uygun bir yol olabilir. Sous vide pişirici gibi bir su banyosu, yüksek sıcaklıkta inkübasyon için en etkili ve ekonomik çözümdür. - PH'ı nötralize etmek için slaytı 2x SSC'de kısa bir süre durulayın.
- 100-200 μL (bölümün büyüklüğüne bağlı olarak dokuyu tamamen kaplayacak kadar) Proteinaz K sindirim tamponu ekleyerek dokuyu sindirin ve RT'de 1 dakika inkübe edin.
NOT: Proteinaz K sindirimi, FISH probları için erişilebilirliği daha da artırır ve otofloresanı azaltır. Sindirim süresi doku tiplerine göre optimize edilmelidir. Çoğu durumda, 1 dakikalık sindirim yeterlidir. Aşırı sindirim, hale şeklindeki çekirdek morfolojisine yol açar ve sindirim süresi azaltılmalıdır. - Proteinaz K sindirimini hemen durdurun ve slaytı 2 dakika boyunca %70 etanole batırarak kurutun, ardından her biri 2 dakika boyunca %85 ve %100 etanol muamelesi yapın.
3. BALIK ve görüntüleme
- 2 μL FISH prob stoğunu 8 μL hibridizasyon tamponu ile seyrelterek FISH hibridizasyon karışımını hazırlayın, ardından slayta uygulayın. Numuneyi bir lamel ile örtün.
NOT: Kullanılan toplam FISH prob stoğu, görüntü kalitesine bağlı olarak 0,5-4 μL arasında değişir. Sinyal çok düşükse, prob girişini artırın. Arka plan çok yüksekse, özellikle çekirdeğin dışında floresan kalıntıları gözlendiğinde FISH prob girişini azaltın. Hibridizasyon tamponu, ticari olarak satın alınan problarla sağlanan veya bölüm 1'deki gibi hazırlanan tampon olabilir. - DNA'yı 75 °C'de 2-5 dakika denatüre etmek için slaytları sürgülü hendek hibridizasyon sistemi gibi sıcak bir plakaya yerleştirin. Ardından, gece boyunca hibritlemek için slaytı 37 °C'ye ayarlanmış başka bir sıcak plakaya aktarın.
NOT: Sıcak plakanın hibridizasyon sırasında nemi korumak için bir su tepsisi veya rezervuarı varsa, lamel kauçuk çimento ile sızdırmaz hale getirilmelidir. - Hibridizasyondan sonra, sürgünü %0,3 IGEPAL CA-630 yıkama tamponu ile 40-60 °C ısıtılmış 0,4x SSC'ye batırın, ardından lamel dikkatlice çıkarın. Karanlıkta her biri 5 dakika boyunca iki kez yıkamaya devam edin, ilk 10-15 saniye boyunca çalkalayın.
NOT: Sürgünü yıkama tamponuna daldırmak, lamellerin nazikçe serbest kalmasına yardımcı olur. - Slaytı SSC'de% 0.1 IGEPAL CA-630 ile karanlıkta RT'de 5 dakika boyunca, ilk 10-15 saniye boyunca çalkalayarak yıkayın.
- Otofloresanı söndürmek için, slaytı otofloresan söndürme kiti ile tedavi edin (Malzeme Tablosuna bakın) 150 μL reaktif (50 μL + 50 μL reaktif A, B, C) 2-5 dakika, ardından 2x SSC ile 5 dakika yıkayın.
NOT: Bu isteğe bağlı bir adımdır. Doku otofloresansı esas olarak kollajen ve elastin gibi hücre dışı matriks bileşenlerinden kaynaklanır. Ayrıca lipofuscin, NADPH ve flavin koenzim içeriği nedeniyle lizozomlar ve mitokondriden önemli ölçüde etkilenir. Aldehit fiksasyonu ve kan hücresi varlığı da otofloresanı iyiartırabilir 13,14. - Slaytı DAPI ile 10 dakika boyayın. Slaytı 2x SSC tamponu ile 5 dakika durulayın.
NOT: Slayt, otofloresan söndürme kiti tarafından işlenmezse, DAPI boyaması 2 dakikaya düşürülebilir. - Slaytı 1 saniyeden fazla olmamak üzere hızlı bir şekilde deiyonize suya batırın, ardından bir kağıt havluyla fazla nemi emerek hızlı bir şekilde kurulayın.
NOT: Bu isteğe bağlı bir adımdır. Deiyonize su arıtma, slayt üzerinde SSC tamponunun tuz kristali birikmesini etkili bir şekilde önler ve görüntüleme kalitesini artırır. Bununla birlikte, bu kadar düşük iyon koşulları altında, FISH probu ile hedeflenen DNA arasındaki hidrojen bağları zayıflar, bu da probun ayrışmasına ve sinyal kaybına yol açar. Bu nedenle, su arıtma adımını çok kısa bir süre için korumak çok önemlidir. - Sürgüyü kurutun, ardından antifade montaj ortamı ile monte edin. Görüntülemeden önce lameli oje ile kapatın.
NOT: Sürgü, otomatik floresan söndürme reaktifi ile işlenmişse, sürgüyü üreticinin talimatına göre bir antifade montaj ortamı ile monte edin. Ayrıca, montaj ortamının tipine, sertleşmeye veya sertleşmemeye bağlı olarak, numunenin mühürleme ve görüntülemeden önce 1-24 saat kürlenmesi gerekir. Görüntüleme için en iyi kırılma indisini elde etmek için numunenin en az gece boyunca kürlenmesi önerilir. - Floresan sinyalini yakalamak için 60× yağ lensi kullanın. Odağı ayarlamak için DAPI kanalını kullanın. Birden fazla Z yığını elde ettiğinizden emin olun. Tipik olarak, 1 μm aralıklı 5-10 z-yığını yeterlidir. En iyi çözünürlüğü elde etmek için maksimum 3D projeksiyon gerçekleştirin. Görüntü kalitesini daha da iyileştirmek için evrişim giderme veya diğer arka plan temizleme algoritmaları uygulayın.
Sonuçlar
FISH görüntülemenin sonucunu göstermek için hem HER2 pozitif hem de negatif meme kanserlerinden FFPE örnekleri kullandık. HER2'nin amplifikasyonu ( ERBB2 geni tarafından kodlanır), HER2 moleküler hedefleme tedavilerinin mevcudiyeti ve etkinliği nedeniyle uygun bir belirteçtir. Aksine, HER2, östrojen reseptörü (ER) ve progesteron reseptörü (PR) ekspresyonu olmayan üçlü negatif meme kanserli hastalar, sınırlı tedavi seçenekleri nedeniyle kötü sonuçlarla karşı karşıyadır. Bu nedenle, HER2 durumunun belirlenmesi meme kanseri araştırma ve tedavisinde çok önemlidir15.
Üçlü negatif meme kanseri örneğinde, çoğu çekirdek HER2 / ERBB2 FISH sinyallerini temsil eden iki farklı nokta gösterir. Bazı çekirdekler, kesit yanlılığı nedeniyle yalnızca bir noktaya sahip olabilir (Şekil 2, solda). Buna karşılık, HER2 pozitif numuneler, iki farklı modele sahip bol miktarda FISH sinyali sunar. Bir model, çekirdek boyunca dağınık noktaları gösterir (Şekil 2, orta). Bu model, ecDNA morfolojisinin bir özelliğidir, çünkü ecDNA'lar benzersiz ve organize bir nükleer bölgeyi işgal etmeyebilir16. Ayrıca, ecDNA'ların mitoz sırasında asimetrik ayrışması, kopya sayısı varyasyonunu tetikleyerek çekirdek17 arasında sinyal heterojenliğine yol açar. Bazı çekirdekler, ecDNA merkezlerinin18 göstergesi olan ara sıra kümeler gösterebilir (Şekil 2, sağda). Diğer HER2 amplifikasyon türü, öncelikle çubuk şeklinde, yoğunlaştırılmış agregaları gösterir. Bu morfoloji muhtemelen homojen boyama bölgeleri (HSR)19 veya kırılma-füzyon-köprü (BFB) döngüsü20 gibi kromozom bazlı amplifikasyonu gösterir. Özellikle, ecDNA, HSR ve BFB amplifikasyonu aynı çekirdekte bir arada bulunabilir. Bu nedenle, fokal amplifikasyon şeklini anlamak için birden fazla çekirdeğin incelenmesi önerilir.
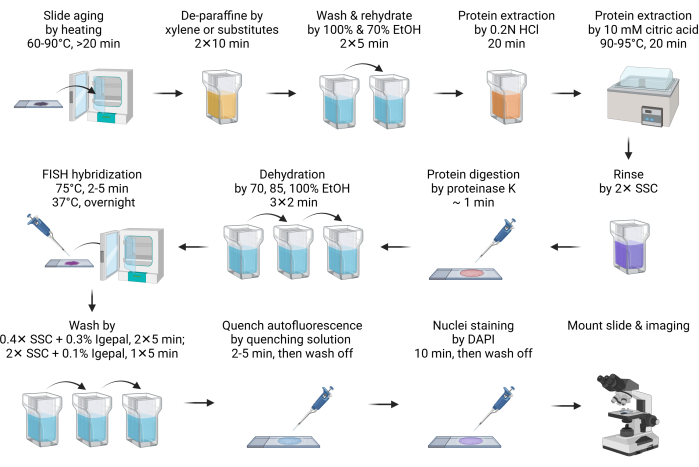
Şekil 1: FFPE örneklerinde FISH için şematik. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
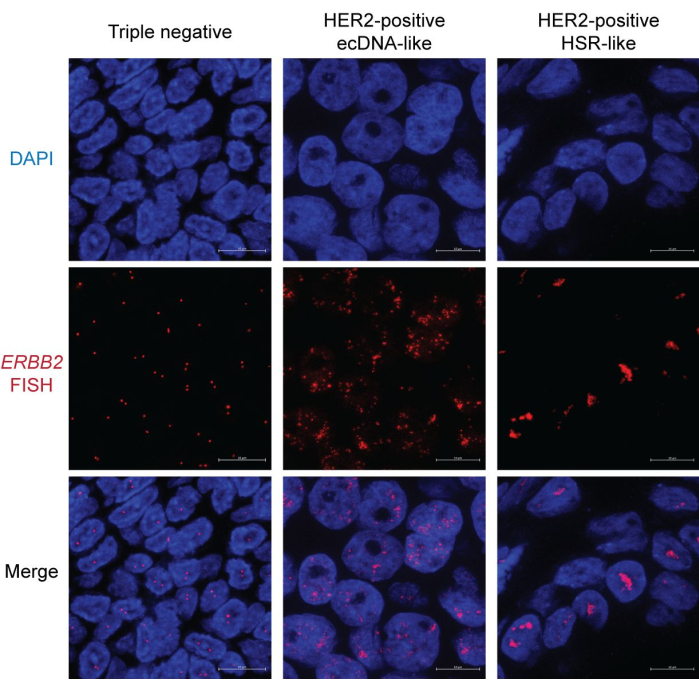
Şekil 2: Meme kanseri FFPE örneklerinde temsili FISH görüntüsü. Büyütme: 600x; Ölçek çubuğu: 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
FISH, sitogenetik tanı için hızlı ve uygun fiyatlı bir seçenektir. Özellikle ecDNA'nın kanserde bulunup bulunmadığının belirlenmesinde, FISH kanıtları altın standart1 olmaya devam etmektedir. FFPE dokusundaki FISH, bir hastanın biyopsi örneklerinde gen durumunun hızlı bir şekilde belirlenmesine olanak tanıyarak daha hızlı tanı konulmasına ve hastalığın ilerlemesi boyunca değişikliklerin izlenmesine olanak tanır. Bu teknik, patoloji için önceden toplanmış olan klinik örneklerin test edilmesi için özellikle değerlidir.
Bu protokol birkaç kritik adımı içerir. İlk adım, kapsamlı bir deparafinizasyondur. Artık parafin, FISH hibridizasyonunu bozabilir. Numune 2. adımdan sonra hala mumsu görünüyorsa, tekrar taze ksilen veya ikameleri ile muamele edilmelidir.
İkincisi, protein ekstraksiyonu ve sindirimi kritik öneme sahiptir. Bu işlemler sadece DNA'nın FISH probuna erişilebilirliğini arttırmakla kalmaz, aynı zamanda otomatik floresansı da önemli ölçüde azaltır. Bu protokol üç deproteinizasyon adımı içerir. 0.2 N HCl ve 10 mM sitrik asit ile tedavi basit olsa da, proteinaz K sindirimi optimizasyon gerektirebilir. Aşırı sindirim, proteinaz K kullanılırken en yaygın hatadır ve hale şeklinde çekirdeklerle sonuçlanır. Sindirim süresinin kısaltılması çekirdek morfolojisini iyileştirecektir. Ek olarak, ilk ve son numune arasındaki zaman farkını en aza indirmek için aynı anda dörtten fazla numunenin sindirilmemesi önerilir. Sağlam bir çekirdeğin bile yüksek büyütmeli ve yüksek çözünürlüklü mikroskopi altında bir hale olarak görünebileceğine dikkat etmek önemlidir. Bunun nedeni, çekirdeğin aynı odak düzleminde olmamasıdır. Bu nedenle, nükleer morfolojiyi incelemek için birden fazla Z-yığını alınması ve maksimum bir projeksiyon yapılması önerilir.
Son olarak, otofloresansın söndürülmesi önerilir. Asit ekstraksiyonu ve proteinaz K sindirimi, protein kaynaklı arka planı önemli ölçüde azaltabilse de, floresan metabolitleri yine de görüntüleme kalitesini etkileyebilir.
FISH, fokal gen amplifikasyonunu tanımlamada benzersiz uzamsal çözünürlük sunarken, sınırlamaları vardır. İlk olarak, içerik ve verim, PCR veya yeni nesil dizileme (NGS) tabanlı yaklaşımlara kıyasla düşüktür. Tipik olarak, farklı renklerde bir ila üç FISH probu, özel ekipman olmadan tek bir slayta uygulanabilir. Bununla birlikte, otomasyon teknolojilerindeki gelişmeler, yerinde sıralama21 gibi yüksek içerikli ve yüksek verimli FISH'i mümkün kılmıştır. İkincisi, FISH prob tasarımı önceden bilgi gerektirir. Kanserde tekrarlayan fokal amplifikasyon olaylarını belirlemeye yönelik devam eden çabalar, laboratuvar ve klinik uygulamalar için önceden tasarlanmış FISH panellerinin oluşturulmasını sağlamıştır. Örneğin, MYC ailesi onkogenleri, kemoterapi direncine aracılık etmek için küçük hücreli akciğer kanserinde sıklıkla ecDNA olarak amplifiye edilir. Bu nedenle, MYC, MYCL ve MYCN genlerini hedefleyen bir FISH paneli, biyopsilerde tedavi yanıtlarının belirlenmesini hızlandırabilir. Karşılaştırıldığında, NGS, ilgilenilen genlerin daha tarafsız bir şekilde taranmasına izin verir. Bununla birlikte, NGS tabanlı teknolojiler arasında, yalnızca hesaplama pahalı analiz22 ile tüm genom dizilimi ecDNA'yı karakterize edebilir.
Özetle, FFPE örneklerinde fokal gen amplifikasyonunu araştırmak için sağlam ve kapsamlı talimatlar sunuyoruz. FISH sinyal modelini inceleyerek, bir gen lokusunun amplifiye edilip edilmediği ve nasıl yükseltildiği kesin olarak netleşir. Kopya sayısı ve amplifikasyon şekli (kromozom veya ecDNA) ile ilgili sitogenetik bilgileri çıkarmak için makine öğreniminin interfaz çekirdeklerinin görüntü analizine23 entegrasyonunu öngörüyoruz, böylece moleküler tanı sürecini düzene sokuyor ve kanserdeki patogenetik mekanizmalar hakkındaki anlayışımızı geliştiriyoruz.
Açıklamalar
SW, Dimension Genomics Inc.'in bilimsel danışma kurulu üyesidir.
Teşekkürler
SW, Teksas Kanser Önleme ve Araştırma Enstitüsü (RR210034) tarafından desteklenmektedir ve bu enstitü tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| DAPI | Tocris Bioscience | 5748 | Nucleus staining |
| Dextran sulfate 50% solution | EMD Millipore Sigma | S4030 | Probe hybridization buffer |
| ERBB2 (HER2) FISH Probe | Empire Genomics | ERBB2-20-RE | FISH probe |
| Ethanol | Decon Labs | 2716 | Dehydrating and hydrating tissue |
| Formamide | Thermo Scientific Chemicals | 205821000 | Probe hybridization buffer |
| Formula 83 (Xylene substitute) | CBG Biotech | CH0104A | Removing paraffin |
| Hydrochloric acid | Fisher Chemical | A144-500 | Sample pretreatment |
| IGEPAL CA-630 | Thermo Scientific Chemicals | J19628K2 | Slide washing |
| Proclin 300 | Sigma-Aldrich | 48914-U | Preservative for SSC buffer (optional) |
| Proteinase K (800 units/mL) | New England Biolabs | P8107S | Protein digestion |
| RNase A (20 mg/mL) | New England Biolabs | T3018L | Probe hybridization buffer |
| Slide Moat Hybridization System | Boekel Scientific | 280001 | Sample denature and hybridization. Alternative hot plates are acceptable. |
| Sodium chloride | Fisher Chemical | S2713 | SSC buffer |
| Sodium citrate dihydrate | Fisher BioReagents | FLBP3271 | SSC buffer and sample pretreatment |
| Tris-EDTA (TE) buffer | Fisher BioReagents | BP2473500 | Proteinase K digestion buffer |
| Tween-20 | Fisher BioReagents | BP337-500 | Probe hybridization buffer |
| Vectashield antifade mounting media | Vector Laboratories | H190010 | Slide mounting |
| Vector TrueVIEW | Vector Laboratories | SP8400 | Autofluorescence quenching kit |
Referanslar
- ICGC/TCGA Pan-Cancer Analysis of Whole Genomes Consortium. Pan-cancer analysis of whole genomes. Nature. 578 (7793), 82-93 (2020).
- Wu, S., Bafna, V., Chang, H. Y., Mischel, P. S. Extrachromosomal DNA: An emerging hallmark in human cancer. Annu Rev Pathol. 17, 367-386 (2022).
- Luebeck, J., et al. Extrachromosomal DNA in the cancerous transformation of Barrett's oesophagus. Nature. 616 (7958), 798-805 (2023).
- Nathanson, D. A., et al. Targeted therapy resistance mediated by dynamic regulation of extrachromosomal mutant EGFR DNA. Science. 343 (6166), 72-76 (2014).
- Kim, H., et al. Extrachromosomal DNA is associated with oncogene amplification and poor outcome across multiple cancers. Nat Genet. 52 (9), 891-897 (2020).
- Pal Choudhuri, S., et al. Acquired cross-resistance in small cell lung cancer due to extrachromosomal DNA amplification of MYC paralogs. Cancer Discov. 14 (5), 804-827 (2024).
- Greytak, S. R., Engel, K. B., Bass, B. P., Moore, H. M. Accuracy of molecular data generated with FFPE biospecimens: Lessons from the literature. Cancer Res. 75 (8), 1541-1547 (2015).
- Chrzanowska, N. M., Kowalewski, J., Lewandowska, M. A. Use of fluorescence in situ hybridization (FISH) in diagnosis and tailored therapies in solid tumors. Molecules. 25 (8), 1864 (2020).
- Cui, C., Shu, W., Li, P. Fluorescence in situ hybridization: Cell-based genetic diagnostic and research applications. Front Cell Dev Biol. 4, 89 (2016).
- Finn, E. H., Misteli, T. A high-throughput DNA FISH protocol to visualize genome regions in human cells. STAR Protoc. 2 (3), 100741 (2021).
- Watters, A. D., Bartlett, J. M. S. Fluorescence in situ hybridization in paraffin tissue sections. Mol Biotechnol. 21 (3), 217-220 (2002).
- Richardson, S. O., et al. One-fits-all pretreatment protocol facilitating fluorescence in situ hybridization on formalin-fixed paraffin-embedded, fresh frozen and cytological slides. Mol Cytogenet. 12, 27 (2019).
- Monici, M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnol Annu Rev. 11, 227-256 (2005).
- Davis, A. S., et al. Characterizing and diminishing autofluorescence in formalin-fixed paraffin-embedded human respiratory tissue. J Histochem Cytochem. 62 (6), 405-423 (2014).
- Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast tumours. Nature. 490 (7418), 61-70 (2012).
- Liang, Z., et al. Chromatin-associated RNA dictates the ecDNA interactome in the nucleus. bioRxiv. , (2023).
- Lange, J. T., et al. The evolutionary dynamics of extrachromosomal DNA in human cancers. Nat Genet. 54 (10), 1527-1533 (2022).
- Hung, K. L., et al. ecDNA hubs drive cooperative intermolecular oncogene expression. Nature. 600 (7890), 731-736 (2021).
- Storlazzi, C. T., et al. Gene amplification as double minutes or homogeneously staining regions in solid tumors: origin and structure. Genome Res. 20 (9), 1198-1206 (2010).
- Guerin, T. M., Marcand, S. Breakage in breakage-fusion-bridge cycle: an 80-year-old mystery. Trends Genet. 38 (7), 641-645 (2022).
- Nguyen, H. Q., et al. 3D mapping and accelerated super-resolution imaging of the human genome using in situ sequencing. Nat Methods. 17 (8), 822-832 (2020).
- Deshpande, V., et al. Exploring the landscape of focal amplifications in cancer using AmpliconArchitect. Nat Commun. 10 (1), 392 (2019).
- Rajkumar, U., et al. EcSeg: Semantic segmentation of metaphase images containing extrachromosomal DNA. iScience. 21, 428-435 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır