Method Article
Détection robuste de l’amplification génique dans des échantillons fixés au formol et inclus dans de la paraffine par hybridation in situ en fluorescence
Dans cet article
Résumé
Ce protocole fournit une méthode reproductible pour visualiser l’amplification génique dans des échantillons de tissus fixés au formol et inclus dans de la paraffine (FFPE).
Résumé
L’amplification focale des gènes, comme l’ADN extrachromosomique (ADNec), joue un rôle important dans le développement du cancer et la résistance aux traitements. Alors que les méthodologies basées sur le séquençage permettent une identification impartiale de l’ADNec, les techniques basées sur la cytogénétique, telles que l’hybridation in situ en fluorescence (FISH), restent rapides et rentables pour identifier l’ADNec dans les échantillons cliniques. L’application de FISH dans des échantillons de tissus fixés au formol et inclus dans de la paraffine (FFPE) offre une voie unique pour détecter les gènes amplifiés, en particulier lorsque des échantillons viables ne sont pas disponibles pour l’examen du caryotype. Cependant, il n’existe pas de procédures consensuelles pour cette technique. Ce protocole fournit des instructions complètes, entièrement optimisées et étape par étape pour la réalisation de FISH afin de détecter l’amplification génique, y compris l’ADNec, dans des échantillons de tissus FFPE qui présentent des défis uniques que ce protocole vise à surmonter et à normaliser. En suivant ce protocole, les chercheurs peuvent acquérir de manière reproductible des données d’imagerie de haute qualité pour évaluer l’amplification des gènes.
Introduction
L’étude de l’amplification focale de l’oncogène est cruciale car elle favorise la formation, la progression et la résistance au traitementdu cancer 1. Il est important de noter que les oncogènes et les gènes immunorégulateurs peuvent s’amplifier sous forme d’ADN extrachromosomique (ADNec), dont l’hérédité asymétrique favorise l’hétérogénéité génétique dans le cancer 2,3. L’ADNec a été associé à une résistance au traitement et à des résultats cliniques défavorables 4,5,6.
Les échantillons de tissus fixés au formol et inclus dans de la paraffine (FFPE) représentent une vaste ressource d’archives dans les laboratoires de pathologie, offrant des informations abondantes pour des études rétrospectives. Cependant, l’extraction de données moléculaires à partir d’échantillons FFPE par PCR ou séquençage est difficile en raison de la fragmentation, de la dégradation et de la réticulation des acides nucléiques pendant la fixation7. Parmi l’éventail de techniques disponibles pour l’analyse moléculaire des tissus FFPE, l’hybridation in situ fluorescente (FISH) s’est avérée efficace pour visualiser des séquences d’ADN spécifiques8.
Malgré les progrès des techniques modernes de diagnostic moléculaire, la capacité de FISH à visualiser et à quantifier l’amplification génique au niveau de la cellule unique fournit des informations précieuses sur les mécanismes moléculaires sous-jacents à la tumorigenèse et aux résultats cliniques. En utilisant des sondes marquées par fluorescence complémentaires au gène cible d’intérêt, FISH peut facilement résoudre la localisation d’un oncogène et déduire la forme d’amplification de l’oncogène (comme l’ADNec) dans les cellules individuelles, ce qui est autrement impossible ou coûteux avec d’autres technologies. Par conséquent, FISH offre un moyen économique d’évaluer l’hétérogénéité tumorale et l’évolution clonale9. De plus, les progrès de l’automatisation, de l’imagerie et de l’analyse computationnelle ont facilité l’analyse à haut débit des données FISH, permettant une quantification robuste de l’amplification génique dans de grandes cohortes de tissus10.
Cependant, l’application de FISH sur les tissus FFPE présente des défis inhérents, notamment les artefacts de réticulation et l’autofluorescence de fond. Pour surmonter ces obstacles, il faut optimiser soigneusement chaque procédure afin de garantir des résultats précis et reproductibles. Cet article fournit un protocole étape par étape, entièrement optimisé, pour l’application de FISH afin d’étudier l’amplification génique dans des échantillons de tissus FFPE. À l’aide d’une sonde ciblant le locus du gène ERBB2 (HER2), nous démontrons que FISH peut détecter de manière robuste l’état d’amplification d’ERBB2 dans des échantillons FFPE de patientes atteintes d’un cancer du sein. Il est même possible d’estimer si ERBB2 est amplifié sous forme d’ADNec. En synthétisant la littérature existante et nos résultats expérimentaux, nous élucidons les considérations méthodologiques, les défis techniques et les pièges potentiels de l’analyse basée sur les FISH. Nous discutons également de la pertinence clinique du profilage d’amplification génique dans divers types de cancer, en soulignant son importance pronostique et son potentiel pour des stratégies thérapeutiques personnalisées.
En résumé, cet article souligne l’importance de FISH en tant qu’outil précieux pour l’étude de l’amplification génique dans les échantillons de tissus FFPE, offrant des informations inégalées sur la biologie tumorale et guidant la prise de décision clinique en oncologie. Grâce au perfectionnement continu et à l’intégration avec des tests moléculaires complémentaires, l’analyse basée sur FISH est sur le point d’améliorer notre compréhension de la pathogenèse du cancer et d’améliorer les résultats pour les patients à l’ère de la médecine de précision.
Protocole
Ce protocole de recherche a été approuvé par l’Institutional Review Board (IRB) du Southwestern Medical Center de l’Université du Texas. Le consentement éclairé a été obtenu de tous les patients avant la chirurgie.
1. Préparation des réactifs et des matériaux
- Préparez la solution de chlorure de sodium (HCl) 0,2 N dans une hotte en ajoutant lentement 8,212 mL de HCl (37 % p/p ou 12,1 N) à 491,788 mL de ddH2O. Conserver à température ambiante (RT).
ATTENTION : Ajouter lentement de l’acide à l’eau. N’ajoutez pas d’eau à l’acide. - Préparez une solution d’acide citrique de 10 mM (pH 6,0) en dissolvant 1,47 g de citrate trisodique (dihydraté) dans 400 mL de ddH2O. Utilisez du HCl pour ajuster à pH 6,0, puis portez le volume final à 500 mL avec du ddH2O. Conservez le tampon à RT.
- Préparez la solution de Tween-20 à 10 % en ajoutant 100 μL de Tween-20 à 900 μL de ddH2O. Conservez-la à RT.
- Préparez la solution d’IGEPAL à 10 % en ajoutant 5 mL d’IGEPAL CA-630 à 45 mL de ddH2O. Conservez-la à RT.
- Préparez la solution 20x SSC (pH 7,0, 3 M NaCl, 0,3 M Sodium Citrate) en dissolvant 44,1 g de citrate tri-sodique (dihydraté) et 87,65 g de chlorure de sodium (NaCl) dans 900 mL de ddH 2 O. Utilisez HCl pour ajuster au pH7,0, puis amenez le volume final à 1000 mL avec ddH2O. Conservez le tampon à RT.
- Préparez la solution 2x SSC en ajoutant 100 mL de 20x SSC à 900 mL de ddH2O. Au besoin, ajouter 0,5 mL de produit de préservation (Table des matières). Stockez-le chez RT.
- Préparez le tampon d’hybridation de la sonde en mélangeant 910 μL de ddH2O, 500 μL de 20x SSC, 50 μL de 10 % de Tween-20, 40 μL de RNase A, 1 mL de sulfate de dextran à 50 % et 2,5 mL de formamide. Injectez-les dans 1 mL et conservez-les à -20 °C.
- Préparez la solution 0,4x SSC avec 0,3% IGEPAL en mélangeant 100 mL de 2x SSC, 15 mL d’IGEPAL 10% et 385 mL de ddH2O. Conservez-le à RT.
- Préparez la solution 2 fois avec 0,1 % d’IGEPAL en ajoutant 5 mL d’IGEPAL à 10 % à 495 mL de solution 2 fois plus d’IGEPAL. Stockez-le chez RT.
- Préparez fraîchement le tampon de digestion de la protéinase K avant de l’utiliser en ajoutant 1 μL de protéinase K à 99 μL de tampon Tris-EDTA.
- Préparez un stock de stockage de DAPI de 1 mg/mL en dissolvant 1 mg de DAPI dans 1 mL de ddH2O. Conservez-le à -20 °C et à l’abri de la lumière. Préparez la solution de travail DAPI en ajoutant 1 μL de stock de stockage DAPI à 999 μL de solution SSC 2x. Conserver à l’abri de la lumière jusqu’à l’utilisation.
2. Prétraitement de l’échantillon
REMARQUE : La lame utilisée ici contient l’échantillon.
- Faites vieillir la lame à 60-90 °C pendant 20 minutes ou toute la nuit (Figure 1).
REMARQUE : Cette étape facilite la fusion de la paraffine. Habituellement, 20 min de chauffage suffisent. Il peut être prolongé jusqu’à la nuit pour s’adapter à l’horaire. - Déparaffiniser la lame en l’immergeant dans du xylène ou ses substituts dans un bocal Coplin pendant 10 min. Répétez cette étape avec du xylène frais ou ses substituts. Effectuez toutes les étapes de prétraitement et de lavage suivantes dans un bocal Coplin.
REMARQUE : Les substituts de xylène sont des alternatives sûres et écologiques au xylène. L’un des substituts (voir tableau des matériaux) fonctionne aussi bien que le xylène, sinon mieux. Bien que les substituts de xylène produisent moins d’odeurs que le xylène, il est recommandé de l’utiliser à l’intérieur d’une hotte. Si les substituts de xylène ne sont pas accessibles, toutes les procédures sont compatibles avec la déparaffinisation à base de xylène sans aucune modification. - Lavez le substitut de xylène avec de l’éthanol à 100 % pendant 5 min.
- Réhydratez la lame avec une immersion à 70% d’éthanol pendant 5 min.
- Immergez la lame dans de l’acide chlorhydrique 0,2 N (HCl) à RT pendant 20 min.
REMARQUE : Le HCl extrait efficacement les protéines solubles dans l’acide, telles que les protéines nucléaires basiques, pour améliorer l’accessibilité de l’ADN aux sondes FISH11. - Immerger la lame dans 10 mM de solution chaude d’acide citrique et incuber à 90-95 °C pendant 20 min.
REMARQUE : Le traitement à l’acide citrique à haute température extrait de la même manière les protéines solubles dans l’acide. On pense que les deux traitements à l’acide extraient les protéines de la matrice extracellulaire pour diminuer l’autofluorescence12. Il est recommandé de préchauffer la solution citrique à la plage de température souhaitée avant d’être appliquée sur la lame. Le micro-ondes peut être un moyen pratique de le faire. Un bain-marie, comme avec un cuiseur sous vide, est la solution la plus efficace et la plus économique pour l’incubation à haute température. - Rincez brièvement la lame dans 2x SSC pour neutraliser le pH.
- Digérez le tissu en ajoutant 100 à 200 μL (suffisamment pour couvrir complètement le tissu selon la taille de la section) de tampon de digestion de la protéinase K et incubez à RT pendant 1 min.
REMARQUE : La digestion de la protéinase K augmente encore l’accessibilité des sondes FISH et réduit l’autofluorescence. Le temps de digestion doit être optimisé en fonction des types de tissus. Dans la plupart des cas, 1 minute de digestion suffit. Une surdigestion conduit à une morphologie des noyaux en forme de halo, et le temps de digestion doit être réduit. - Arrêtez immédiatement la digestion de la protéinase K et déshydratez la lame en l’immergeant dans de l’éthanol à 70 % pendant 2 min, suivie d’un traitement à 85 % et à 100 % d’éthanol pendant 2 minutes chacune.
3. FISH et imagerie
- Préparez le mélange d’hybridation FISH en diluant 2 μL de sonde FISH avec 8 μL de tampon d’hybridation, puis appliquez-le sur la lame. Recouvrez l’échantillon d’une lamelle.
REMARQUE : Le stock total de sondes FISH utilisé varie de 0,5 à 4 μL, en fonction de la qualité de l’image. Si le signal est trop faible, augmentez l’entrée de la sonde. Réduisez l’entrée de la sonde FISH si le bruit de fond est trop élevé, en particulier lorsque des débris fluorescents sont observés à l’extérieur des noyaux. Le tampon d’hybridation peut être soit celui fourni avec les sondes achetées dans le commerce, soit préparé comme indiqué dans la section 1. - Placez les lames sur une plaque chauffante, telle qu’un système d’hybridation des douves de diapositives, pour dénaturer l’ADN à 75 °C pendant 2 à 5 min. Ensuite, transférez la lame sur une autre plaque chauffante réglée à 37 °C pour hybrider pendant la nuit.
REMARQUE : Si la plaque chauffante dispose d’un bac à eau ou d’un réservoir pour maintenir l’humidité pendant l’hybridation, il n’est pas nécessaire de sceller la lamelle avec de la colle de caoutchouc. - Après l’hybridation, trempez la glissière dans 40-60 °C réchauffé 0,4x SSC avec 0,3% de tampon de lavage IGEPAL CA-630, puis retirez soigneusement la lamelle. Continuez le lavage deux fois pendant 5 minutes chacune dans l’obscurité, en agitant pendant les 10 à 15 premières secondes.
REMARQUE : Tremper la glissière dans le tampon de lavage aide à libérer doucement la lamelle. - Lavez la lame en SSC avec 0,1% d’IGEPAL CA-630 pendant 5 min à RT dans l’obscurité, avec agitation pendant les 10-15 premières s.
- Pour éteindre l’autofluorescence, traitez la lame avec le kit de trempe par autofluorescence (voir le tableau des matériaux) en appliquant 150 μL de réactif (50 μL + 50 μL + 50 μL de réactifs A, B, C) pendant 2 à 5 min, puis lavez-la avec 2x SSC pendant 5 min.
REMARQUE : Il s’agit d’une étape facultative. L’autofluorescence tissulaire provient principalement de composants de la matrice extracellulaire, tels que le collagène et l’élastine. Il est également significativement influencé par les lysosomes et les mitochondries en raison de leur teneur en lipofuscine, en NADPH et en coenzyme flavine. La fixation de l’aldéhyde et la présence de cellules sanguines peuvent également augmenter l’autofluorescence13,14. - Teintez la lame avec du DAPI pendant 10 min. Rincez la lame avec 2x tampon SSC pendant 5 min.
REMARQUE : Si la lame n’est pas traitée par le kit de trempe par autofluorescence, la coloration DAPI peut être réduite à 2 min. - Trempez rapidement la lame dans de l’eau déminéralisée pendant 1 s maximum, puis séchez-la rapidement en absorbant l’humidité supplémentaire avec une serviette en papier.
REMARQUE : Il s’agit d’une étape facultative. Le traitement de l’eau désionisée empêche efficacement le dépôt de cristaux de sel de tampon SSC sur la lame et améliore la qualité de l’imagerie. Cependant, dans de telles conditions de faible ionion, les liaisons hydrogène entre la sonde FISH et l’ADN ciblé sont affaiblies, ce qui entraîne une dissociation de la sonde et une perte de signal. Par conséquent, il est crucial de maintenir l’étape de traitement de l’eau pendant une très courte période. - Séchez la diapositive, puis montez-la avec un support de montage anti-évanouissement. Scellez la lamelle avec du vernis à ongles avant l’imagerie.
REMARQUE : Si la lame est traitée avec un réactif d’extinction par autofluorescence, montez la lame avec un support de montage anti-décoloration conformément aux instructions du fabricant. De plus, selon le type de support d’enrobage, durcissant ou non durci, l’échantillon doit être durci pendant 1 à 24 h avant le scellement et l’imagerie. Il est recommandé de durcir l’échantillon au moins pendant la nuit pour obtenir le meilleur indice de réfraction pour l’imagerie. - Utilisez une lentille à huile de 60 × pour capturer le signal de fluorescence. Utilisez le canal DAPI pour régler la mise au point. Assurez-vous d’obtenir plusieurs piles Z. En règle générale, 5 à 10 piles z avec un intervalle de 1 μm sont suffisantes. Effectuez une projection 3D maximale pour obtenir la meilleure résolution. Appliquez des algorithmes de déconvolution ou d’effacement d’arrière-plan pour améliorer encore la qualité de l’image.
Résultats
Nous avons utilisé des échantillons FFPE de cancers du sein HER2-positifs et négatifs pour démontrer le résultat de l’imagerie FISH. L’amplification de HER2 (codé par le gène ERBB2 ) est un marqueur favorable en raison de la disponibilité et de l’efficacité des thérapies de ciblage moléculaire HER2. Au contraire, les patientes atteintes de cancers du sein triple négatifs, qui n’expriment pas HER2, le récepteur des œstrogènes (ER) et le récepteur de la progestérone (PR), font face à de mauvais résultats en raison des options thérapeutiques limitées. Par conséquent, la détermination du statut HER2 est cruciale dans la recherche et le traitement du cancer du sein15.
Dans l’échantillon de cancer du sein triple négatif, la plupart des noyaux présentent deux points distincts représentant les signaux FISH HER2/ERBB2 . Certains noyaux peuvent n’avoir qu’un seul point en raison du biais de section (Figure 2, à gauche). En revanche, les échantillons HER2-positifs présentent des signaux FISH abondants avec deux motifs différents. Un motif montre des points épars dans tout le noyau (figure 2, au milieu). Ce modèle est une caractéristique de la morphologie de l’ADNec, car les ADNec peuvent ne pas occuper un territoire nucléaire unique et organisé16. De plus, la ségrégation asymétrique des ADNec pendant la mitose entraîne une variation du nombre de copies, conduisant à une hétérogénéité du signal entre les noyaux17. Certains noyaux peuvent présenter des grappes occasionnelles, indiquant des hubs d’ADNec18 (Figure 2, à droite). L’autre type d’amplification HER2 présente principalement des agrégats condensés en forme de tige. Cette morphologie indique probablement une amplification basée sur les chromosomes, telle que la coloration homogène des régions (HSR)19 ou à travers le cycle de rupture-fusion-pont (BFB)20. Notamment, l’ADNec, la HSR et l’amplification BFB peuvent coexister dans le même noyau. Par conséquent, il est recommandé d’examiner plusieurs noyaux pour déduire la forme d’amplification focale.
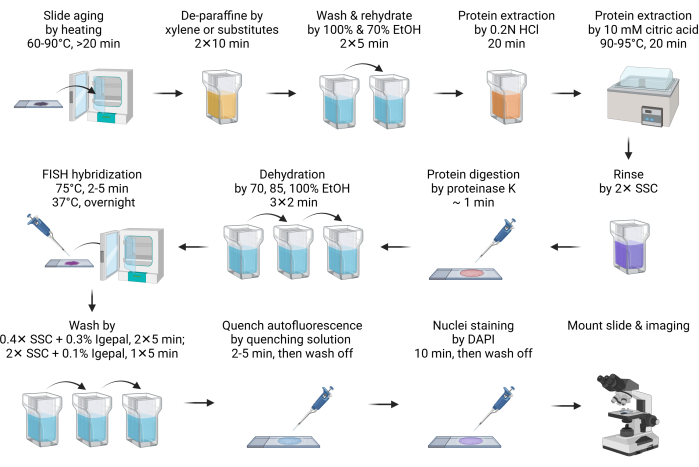
Figure 1 : Schéma de FISH dans les échantillons FFPE. Veuillez cliquer ici pour voir une version agrandie de cette figure.
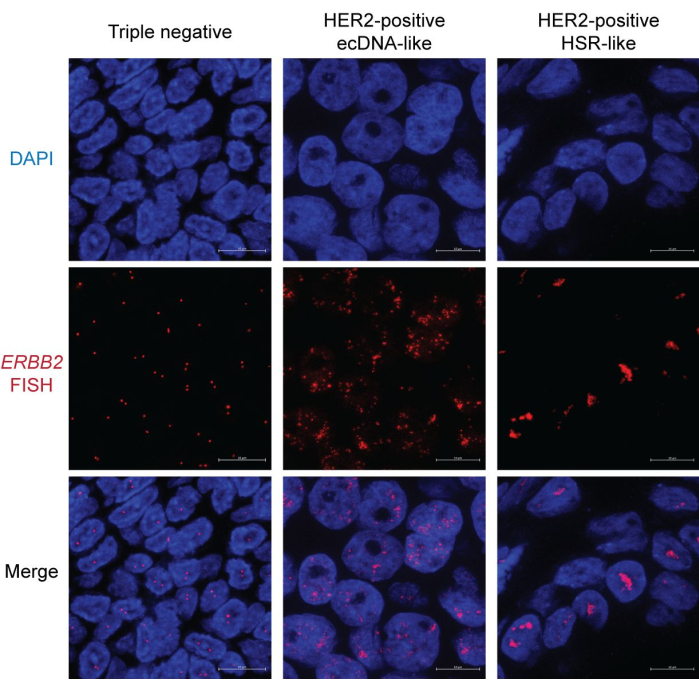
Figure 2 : Image FISH représentative dans les échantillons FFPE de cancer du sein. Grossissement : 600x ; Barre d’échelle : 10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
FISH est une option rapide et abordable pour le diagnostic cytogénétique. En particulier pour déterminer si l’ADNec est présent dans le cancer, les preuves FISH restent l’étalon-or1. La FISH dans les tissus FFPE permet de déterminer rapidement l’état des gènes dans les échantillons de biopsie d’un patient, ce qui permet un diagnostic plus rapide et un suivi des changements tout au long de la progression de la maladie. Cette technique est particulièrement précieuse pour tester des échantillons cliniques qui ont déjà été collectés pour la pathologie.
Ce protocole comporte plusieurs étapes critiques. La première étape est une déparaffinisation complète. La paraffine résiduelle peut perturber l’hybridation des FISH. Si l’échantillon semble toujours cireux après l’étape 2, il doit être traité à nouveau avec du xylène frais ou ses substituts.
Deuxièmement, l’extraction et la digestion des protéines sont essentielles. Ces processus améliorent non seulement l’accessibilité de l’ADN à la sonde FISH, mais réduisent également considérablement l’autofluorescence. Ce protocole comprend trois étapes de déprotéinisation. Bien que le traitement avec 0,2 N HCl et 10 mM d’acide citrique soit simple, la digestion de la protéinase K peut nécessiter une optimisation. La surdigestion est l’erreur la plus courante lors de l’utilisation de la protéinase K, ce qui entraîne des noyaux en forme de halo. Raccourcir le temps de digestion améliorera la morphologie des noyaux. De plus, il est recommandé de ne pas digérer plus de quatre échantillons simultanément afin de minimiser la différence de temps entre le premier et le dernier échantillon. Il est important de noter que même un noyau intact peut apparaître comme un halo sous une microscopie à fort grossissement et à haute résolution. En effet, le noyau n’est pas sur le même plan focal. Par conséquent, il est suggéré de prendre plusieurs piles Z et d’effectuer une projection maximale pour inspecter la morphologie nucléaire.
Enfin, l’extinction de l’autofluorescence est recommandée. Bien que l’extraction acide et la digestion de la protéinase K puissent réduire considérablement le bruit de fond dérivé des protéines, les métabolites fluorescents peuvent toujours affecter la qualité de l’imagerie.
Bien que la FISH offre une résolution spatiale inégalée dans l’identification de l’amplification des gènes focaux, elle a des limites. Tout d’abord, le contenu et le débit sont faibles par rapport aux approches basées sur la PCR ou le séquençage de nouvelle génération (NGS). En règle générale, une à trois sondes FISH de couleurs différentes peuvent être appliquées sur une seule lame sans équipement spécialisé. Néanmoins, les progrès des technologies d’automatisation ont rendu possibles les FISH à haut contenu et à haut débit, tels que le séquençage in situ 21. Deuxièmement, la conception de la sonde FISH nécessite des informations préalables. Les efforts continus pour identifier les événements récurrents d’amplification focale dans le cancer ont permis de créer des panels FISH préconçus pour des applications en laboratoire et cliniques. Par exemple, les oncogènes de la famille MYC sont fréquemment amplifiés sous forme d’ADNec dans le cancer du poumon à petites cellules pour médier la résistance à la chimiothérapie. Par conséquent, un panel FISH ciblant les gènes MYC, MYCL et MYCN peut accélérer la détermination des réponses au traitement dans les biopsies. En comparaison, le NGS permet un dépistage plus impartial des gènes d’intérêt. Cependant, parmi les technologies basées sur le NGS, seul le séquençage du génome entier avec une analyse coûteuseen calcul 22 peut caractériser l’ADNec.
En résumé, nous présentons des instructions robustes et complètes pour étudier l’amplification des gènes focaux dans les échantillons FFPE. En examinant le modèle de signal FISH, il devient clair sans équivoque si et comment un locus de gène est amplifié. Nous prévoyons l’intégration de l’apprentissage automatique dans l’analyse d’images23 des noyaux interphasiques afin d’extraire des informations cytogénétiques concernant le nombre de copies et la forme d’amplification (chromosome ou ADNec), rationalisant ainsi le processus de diagnostic moléculaire et améliorant notre compréhension des mécanismes pathogéniques dans le cancer.
Déclarations de divulgation
S.W. est membre du conseil consultatif scientifique de Dimension Genomics Inc.
Remerciements
S.W. est boursier et est soutenu par l’Institut de prévention et de recherche sur le cancer du Texas (RR210034)
matériels
| Name | Company | Catalog Number | Comments |
| DAPI | Tocris Bioscience | 5748 | Nucleus staining |
| Dextran sulfate 50% solution | EMD Millipore Sigma | S4030 | Probe hybridization buffer |
| ERBB2 (HER2) FISH Probe | Empire Genomics | ERBB2-20-RE | FISH probe |
| Ethanol | Decon Labs | 2716 | Dehydrating and hydrating tissue |
| Formamide | Thermo Scientific Chemicals | 205821000 | Probe hybridization buffer |
| Formula 83 (Xylene substitute) | CBG Biotech | CH0104A | Removing paraffin |
| Hydrochloric acid | Fisher Chemical | A144-500 | Sample pretreatment |
| IGEPAL CA-630 | Thermo Scientific Chemicals | J19628K2 | Slide washing |
| Proclin 300 | Sigma-Aldrich | 48914-U | Preservative for SSC buffer (optional) |
| Proteinase K (800 units/mL) | New England Biolabs | P8107S | Protein digestion |
| RNase A (20 mg/mL) | New England Biolabs | T3018L | Probe hybridization buffer |
| Slide Moat Hybridization System | Boekel Scientific | 280001 | Sample denature and hybridization. Alternative hot plates are acceptable. |
| Sodium chloride | Fisher Chemical | S2713 | SSC buffer |
| Sodium citrate dihydrate | Fisher BioReagents | FLBP3271 | SSC buffer and sample pretreatment |
| Tris-EDTA (TE) buffer | Fisher BioReagents | BP2473500 | Proteinase K digestion buffer |
| Tween-20 | Fisher BioReagents | BP337-500 | Probe hybridization buffer |
| Vectashield antifade mounting media | Vector Laboratories | H190010 | Slide mounting |
| Vector TrueVIEW | Vector Laboratories | SP8400 | Autofluorescence quenching kit |
Références
- ICGC/TCGA Pan-Cancer Analysis of Whole Genomes Consortium. Pan-cancer analysis of whole genomes. Nature. 578 (7793), 82-93 (2020).
- Wu, S., Bafna, V., Chang, H. Y., Mischel, P. S. Extrachromosomal DNA: An emerging hallmark in human cancer. Annu Rev Pathol. 17, 367-386 (2022).
- Luebeck, J., et al. Extrachromosomal DNA in the cancerous transformation of Barrett's oesophagus. Nature. 616 (7958), 798-805 (2023).
- Nathanson, D. A., et al. Targeted therapy resistance mediated by dynamic regulation of extrachromosomal mutant EGFR DNA. Science. 343 (6166), 72-76 (2014).
- Kim, H., et al. Extrachromosomal DNA is associated with oncogene amplification and poor outcome across multiple cancers. Nat Genet. 52 (9), 891-897 (2020).
- Pal Choudhuri, S., et al. Acquired cross-resistance in small cell lung cancer due to extrachromosomal DNA amplification of MYC paralogs. Cancer Discov. 14 (5), 804-827 (2024).
- Greytak, S. R., Engel, K. B., Bass, B. P., Moore, H. M. Accuracy of molecular data generated with FFPE biospecimens: Lessons from the literature. Cancer Res. 75 (8), 1541-1547 (2015).
- Chrzanowska, N. M., Kowalewski, J., Lewandowska, M. A. Use of fluorescence in situ hybridization (FISH) in diagnosis and tailored therapies in solid tumors. Molecules. 25 (8), 1864 (2020).
- Cui, C., Shu, W., Li, P. Fluorescence in situ hybridization: Cell-based genetic diagnostic and research applications. Front Cell Dev Biol. 4, 89 (2016).
- Finn, E. H., Misteli, T. A high-throughput DNA FISH protocol to visualize genome regions in human cells. STAR Protoc. 2 (3), 100741 (2021).
- Watters, A. D., Bartlett, J. M. S. Fluorescence in situ hybridization in paraffin tissue sections. Mol Biotechnol. 21 (3), 217-220 (2002).
- Richardson, S. O., et al. One-fits-all pretreatment protocol facilitating fluorescence in situ hybridization on formalin-fixed paraffin-embedded, fresh frozen and cytological slides. Mol Cytogenet. 12, 27 (2019).
- Monici, M. Cell and tissue autofluorescence research and diagnostic applications. Biotechnol Annu Rev. 11, 227-256 (2005).
- Davis, A. S., et al. Characterizing and diminishing autofluorescence in formalin-fixed paraffin-embedded human respiratory tissue. J Histochem Cytochem. 62 (6), 405-423 (2014).
- Cancer Genome Atlas Network. Comprehensive molecular portraits of human breast tumours. Nature. 490 (7418), 61-70 (2012).
- Liang, Z., et al. Chromatin-associated RNA dictates the ecDNA interactome in the nucleus. bioRxiv. , (2023).
- Lange, J. T., et al. The evolutionary dynamics of extrachromosomal DNA in human cancers. Nat Genet. 54 (10), 1527-1533 (2022).
- Hung, K. L., et al. ecDNA hubs drive cooperative intermolecular oncogene expression. Nature. 600 (7890), 731-736 (2021).
- Storlazzi, C. T., et al. Gene amplification as double minutes or homogeneously staining regions in solid tumors: origin and structure. Genome Res. 20 (9), 1198-1206 (2010).
- Guerin, T. M., Marcand, S. Breakage in breakage-fusion-bridge cycle: an 80-year-old mystery. Trends Genet. 38 (7), 641-645 (2022).
- Nguyen, H. Q., et al. 3D mapping and accelerated super-resolution imaging of the human genome using in situ sequencing. Nat Methods. 17 (8), 822-832 (2020).
- Deshpande, V., et al. Exploring the landscape of focal amplifications in cancer using AmpliconArchitect. Nat Commun. 10 (1), 392 (2019).
- Rajkumar, U., et al. EcSeg: Semantic segmentation of metaphase images containing extrachromosomal DNA. iScience. 21, 428-435 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon