Method Article
Nörorejenerasyonun Görüntülenmesi için Kanallı Agar Pedleri Üzerinde Caenorhabditis elegans Oryantasyonunun İnce Ayarlanması
Bu Makalede
Özet
Burada, vinil kayıtlardan oluşturulan PDMS kalıplarını kullanarak kanallı agar pedleri üretmek için bir protokol sunuyoruz. Kanallar, kullanıcıların görüntüleme kontrastını iyileştirmek ve yapıların karşılaştırılmasını kolaylaştırmak için Caenorhabditis elegans'ı hassas bir şekilde yönlendirmelerini sağlar. Bu yetenekler özellikle nörorejenerasyon çalışmalarında faydalıdır.
Özet
Caenorhabditis elegans , biyolojik süreçleri incelemek için yaygın olarak kullanılan bir model organizmadır. Şeffaflığı ve küçük boyutu onu dokuları, hücreleri ve hücre altı yapıları görüntülemek için ideal kılar. C. elegans'ı görüntülemek için geleneksel düz agar pedleri, hayvanın yönelimi üzerindeki kontrolü sınırlar ve görüşleri öncelikle yanal perspektiflerle sınırlar. Bu sınırlama, dorsal-ventral yapıların görselleştirilmesini zorlaştırır ve özellikle pigmentasyonu artmış ve daha büyük çapları olan yaşlı hayvanlarda görüntü netliğini azaltır. Bu zorlukların üstesinden gelmek için, hayvan oryantasyonunun hassas bir şekilde kontrol edilmesini sağlayan kanallı agaroz pedleri geliştirdik. Bu kanallar, araştırmacıların C. elegans'ı belirli pozisyonlarda döndürmesini ve sabitlemesini sağlayarak, birden fazla yapının aynı anda görüntülenmesini kolaylaştırır ve hedef hücreleri mikroskop objektifine yaklaştırarak görüntü çözünürlüğünü iyileştirir. Bu, özellikle ameliyattan sonra, geleneksel düz agar pedleriyle yakalanması zor yönlerde büyüyebilen rejenere nöronal liflerin görüntülenmesi için kullanışlıdır. Kanallı agar pedlerinin üretilmesi, düz pedlerle aynı zaman ve malzeme gerektirdiğinden, bu yönteme erişilebilir, bu da onu çoğu laboratuvar için pratik bir seçenek haline getirir.
Giriş
Nematod Caenorhabditis elegans (C. elegans), memeli muadilleriyle güçlü bir şekilde korunmuş genetiği nedeniyle gelişim ve davranış gibi biyolojik süreçleri incelemek için yaygın olarak kullanılan bir model organizmadır1. Araştırmacılar, deneysel koşulları standartlaştıran ve sonuçların deneysel değişkenlere daha kesin bir şekilde atfedilmesine izin veren, sıkı bir şekilde kontrol edilen bir ortamda bir nematod büyüme ortamı (NGM) plakası üzerinde C. elegans yetiştiriyorlar. Hayvan şeffaftır ve dokuların, hücrelerin ve hücre altı yapıların net bir şekilde görüntülenmesini sağlar. C. elegans küçüktür, yetişkin hayvanlar ~ 1 mm uzunluğunda ve 80 μm çapındadır, bu da görüntüleme1 için birden fazla hayvanın tek bir slayt yuvasına yerleştirilmesine izin verir. Küçük boyutları, tek bir görüntünün tek tek hücreleri çözerken tüm organizmayı yakalamasına izin verir, bu da nöron liflerinin yenilenmesini görselleştirmek için çok önemlidir. Mikroskopi için bu avantajlarla sinerjik olarak, C. elegans'ın hızlı gelişimi, kalıplaşmış anatomisi ve kolay genetiği büyük ölçekli çalışmalara izin verir1.
C. elegans'taki hücrelerin görüntülenmesi için tipik prosedür onlarca yıl önce kurulmuştur ve büyük ölçüde değişmeden kalmıştır. Araştırmacılar, hücrelerinin görselleştirilmesi için hayvanları monte etmek ve hareketsiz hale getirmek için slaytlar üzerinde düz agar pedleri kullanırlar2. Pedin üstündeki bir lamel hayvanları yerinde tutar ve mikroskobun merceğini korur. Daha da önemlisi, lamel yakalanan ışığın sayısal diyaframını artıran ve görüntüleme çözünürlüğünü iyileştiren yüksek bir kırılma indisine sahiptir. Ek olarak, lamel ışık iletimindeki bozulmayı azaltır. Böylece, bir lamel hedef hücrelerin ve yapıların görselleştirilmesini iyileştirir.
Bununla birlikte, bir lamel ile kullanıldığında, düz agar pedleri genellikle hayvan yönünü kısıtlar. C. elegans dorsal-ventral (DV) yönleri boyunca bükülür, böylece düz bir agar pedi üzerinde yanal bir yönelim benimserler. Bununla birlikte, hareketsiz hale getirme, düzleştirme ve DV oryantasyonuna önceden döndürdükten sonra bile, lamel yerleştirme neredeyse tüm hayvanları yanal bir görünüme döndürür (Şekil 1). Bu yeniden yönlendirmenin, lamel çıkıntılı C. elegans vulvasını yana doğru ittiği için gerçekleştiğine inanıyoruz. Vulvası olmayan genç hayvanlar daha rastgele yönlendirilir. Oryantasyon üzerindeki bu sınırlı kontrol, en az iki nedenden dolayı sorunludur. Birincisi, iki yapının tek bir görüş alanına (örneğin, iki taraflı) yerleştirilmesine izin vermeyebilir, bu da karşılaştırmalarını zorlaştırır. İkinci olarak, yönün ayarlanması görüntüleme kalitesini optimize etmek için önemlidir, çünkü ilgilenilen yapılar genellikle hedefe yakın olduklarında en iyi şekilde görüntülenir. Bunun nedeni, objektiflerin numune içinde sınırlı bir derinliği (yani çalışma mesafesini) görüntülemesi ve daha derin konumlardan gelen ışığın daha fazla saçılma ve emilim yaşamasıdır.
C. elegans için, oryantasyon üzerindeki sınırlı kontrol genellikle yaşlı hayvanlarda daha ciddidir. L1 ila L4 yaş hayvanlarının çapı daha küçüktür ve bu da solucanın daha yüksek bir kısmını görüntülenebilir hale getirir. Bu larvalar ayrıca daha az pigmentasyona sahiptir, bu da görünür ışığın emiliminin azalmasına ve fotonların saçılmasına neden olur, bu da görüntü netliğini ve çözünürlüğünü artırır. Tersine, yetişkin hayvanlar daha büyük bir çapa ve daha fazla pigmentasyona sahiptir, bu da lamel ilk oryantasyonu etkilediği için daha derin z-düzlemlerinde görüntüleme için zorluklar oluşturur.
2008 yılında, hayvanların oryantasyonunu koruyarak bu zorlukların üstesinden gelmek için kanallı agar pedleri kullanan bir strateji başlattık 3,4. Aşağıda açıklandığı gibi, kullanıcılar anatomik yer işaretlerini not ederek kanallardaki hareketsiz hayvanları istenen bir yöne döndürürler. Kanallar, hayvanları yükseltilmiş agar yüzeyleri arasındaki çukurlarda tutar, lamel yerleştirme sırasında hayvan üzerindeki kuvveti en aza indirir ve hayvanın dönüşünü ortadan kaldırır. Kanallı pedlerin ve ortak düz pedlerin imalatı hemen hemen aynı prosedürü takip ettiğinden ve aynı zamanı gerektirdiğinden, tekniğimiz oldukça erişilebilirdir. Birçok laboratuvar, anatomik özellikleri incelemek, gelişimi gözlemlemek ve davranışanöronal katkıları analiz etmek için C. elegans'ı hareketsiz hale getirmek için tekniğimizi kullanır 5,6,7,8. Aşağıdaki bölüm, sıcak bir bıçak kullanılarak dörde bölünmüş bir vinil plaktan başlayarak kanallı agar yapmak için tüm süreci açıklamaktadır. İlk olarak, kanallı agar dökmek için kullanılan polidimetilsiloksan (PDMS) kalıbının imalatını açıklıyoruz. Ardından, kanallı agarın adım adım nasıl üretileceğini gösteriyoruz. Tüm prosedürün uzmanlık olmadan 3 saat sürmesi bekleniyor. PDMS üretim prosedürünü takiben, kalıpla yapılan pedlerin yapımı tipik agar pedleri ile aynı süreyi alacaktır (birkaç dakika).
Protokol
1. İmalat için polidimetilsiloksanın (PDMS) hazırlanması
- Hızlı kürleme maddesinin tabana 1:10 oranını tek kullanımlık bir tartım kabına dökün. Kürlenmemiş sıvıyı, sıvı tamamen bütünleşene ve kabarcıklarla dolana kadar 45 saniye karıştırın.
- Tepsiyi eğimli bir vakumlu kurutucuya yerleştirin. Hava kabarcıklarının yüzeye çıkmasına izin vermek için basıncı -0.09 ila -0.1 kPa 3x arasında değiştirin.
- Manuel olarak çıkarılabilen birkaç görünür kabarcık kalana kadar vakumu -0.09 ila -0.1 kPa basınç aralığında yaklaşık bir saat açık tutun.
2. Vinil kaydın PDMS kalıbının imalatı
- Vinil plağı ve cam plakayı deiyonize (DI) su ile durulayın. En iyi kalıbı elde etmek için toz olmadığından emin olun. Vinil plağın kullanılana kadar kurumasını bekleyin.
- Fazla PDMS'yi yakalamak için sıcak plakanın üzerine bir alüminyum folyo tabakası yerleştirin.
- Kalıp kalınlığını cam slaytların genişliğine ayarlamak için vinil kaydın her iki ucuna bir cam slayt koyun. Bu, cam bölmeyi kürlenmemiş PDMS'ye bastırırken eşit yükseklik sağlar.
- Kürlenmemiş PDMS sıvısını vinil plağın bir tarafına dökün.
- Sıvı yüzeyindeki ışık yansımasını kullanarak kabarcıkları gözlemleyin ve bunları bir pipet ucuyla çıkarın. Cam plakayı eğin ve plakayı yavaşça aşağı indirin, havanın çıkmasına izin vererek kabarcıkların girmesini önleyin.
- PDMS'yi 80 ° C'de 35 dakika kürleyin.
- Vinil plağı sıcak plakadan çıkarın ve soğumaya bırakın. Yırtılmayı önlemek için PDMS'yi vinil plaktan dikkatlice soyun.
- Kanallı bir agar kalıbı oluşturmak için PDMS'yi keskin bir usturayla kesmek için kılavuz olarak yeni bir cam sürgü kullanın.
3. NaN3 ile kanallı agar pedlerinin imalatı
NOT: Düz agar pedleri için prosedür ve malzemeler daha önce belirlenmiştir9. Bu prosedür çok benzer.
- Bir şişeye 0.6 g agar ve 30 mL NGM sıvı9 stoğu ekleyin. Bir karıştırma çubuğu ekleyin ve 120 °C'de sıcak bir plaka üzerinde ısıtın.
- Jel eritildikten sonra 120 μL NaN3 stoğu (1 M stok konsantrasyonu) ekleyin.
- PDMS kalıbını suyla yıkayın ve kurumaya bırakın. PDMS kalıbını iki set kayar çift arasına yerleştirin.
- Pipet ucunu ısıtmak için agarı yukarı ve aşağı pipetleyin. 300 μL erimiş agarı PDMS kalıbına pipetleyin, slayt yerleştirme agarı kanallar boyunca yayacağından, agarı kanallar boyunca manuel olarak yayın.
- Yanlardaki slaytların üzerinde duracak şekilde doğrudan agarın üzerine bir mikroskop lamı yerleştirin. Agar soğuduktan sonra slaytı çıkarın.
4. C. elegans'ın montajı
- Slaytlar soğuduktan sonra, slaytı kesmeden doğrudan kalıptan kaldırın.
- Hayvanları NaN3 tarafından hareketsiz hale getirildikten sonra kanallara taşıyın
- Hayvanları istediğiniz yöne döndürün.
- Pedin üzerine bir lamel yerleştirin. Havayı yana doğru itmek ve kabarcık oluşturmasını önlemek için pedi eğin ve bir taraftan diğer tarafa hafifçe aşağı doğru itin.
Sonuçlar
PDMS kalıbının imalatı
Kalıp imalatı sırasında vakum basıncının çevrilmesi, kürlenmemiş PDMS'yi deler ve hava kabarcıklarını giderir, böylece kabarcıksız bir kalıp sağlar. Şekil 3D'de gösterildiği gibi, kabarcıklar yüzeye çıkar ve delinir. Kabarcıksız kalıplar temiz kanallar üretebilir.
PDMS kalıbının katılaşması
Cam bölmeyi vinil plağın üzerine yerleştirirken hava boşlukları oluşturmaktan kaçının. Bu boşluklar eşit olmayan kalınlığa veya yüzey kusurlarına yol açabilir. Kabarcıklar, varsa, görsel olarak tespit edilebilir. Cam panelin bir taraftan diğer tarafa bastırılması havanın yerini alır, kabarcık oluşumunu en aza indirir ve Şekil 4A'da gösterilen eşit bir küf kalınlığı sağlar.
C. elegans'ın ince oryantasyonu için kanallı agar pedlerinin kullanılması
Kanallı agar pedleri, C. elegans'ın hassas bir şekilde yönlendirilmesine izin verir. Vulva veya S şeklindeki bağırsak gibi yer işaretlerini kullanarak yönlendirmeyi doğrularken, hayvanı bir platin tel çekme ile hafifçe yuvarlayarak hayvan yönünü belirledik (Şekil 5A,C). Hayvanları Şekil 5B,D'de gösterilen ters çevrilmiş bir mikroskoba aktarmadan önce bir floresan diseksiyon mikroskobu altında oryantasyonu doğrularız.
Kanallı agar pedleri ile nöron liflerinin rejenerasyonunun değerlendirilmesi
Kanallı agar pedleri, hayvanı en iyi şekilde yönlendirerek nöronal rejenerasyonun görüntüleme kalitesini iyileştirir. Rejenere nöron liflerinin objektif merceğe daha yakın konumlandırılması, ışık saçılımını ve emilimini azaltarak görüntü netliğini artırır. Şekil 5E,F, rejenerasyon bölgesini hedefe daha yakın yerleştirmenin, nöronal yeniden büyümenin daha doğru analizini kolaylaştırarak görüntüleme kalitesini artırdığını göstermektedir.
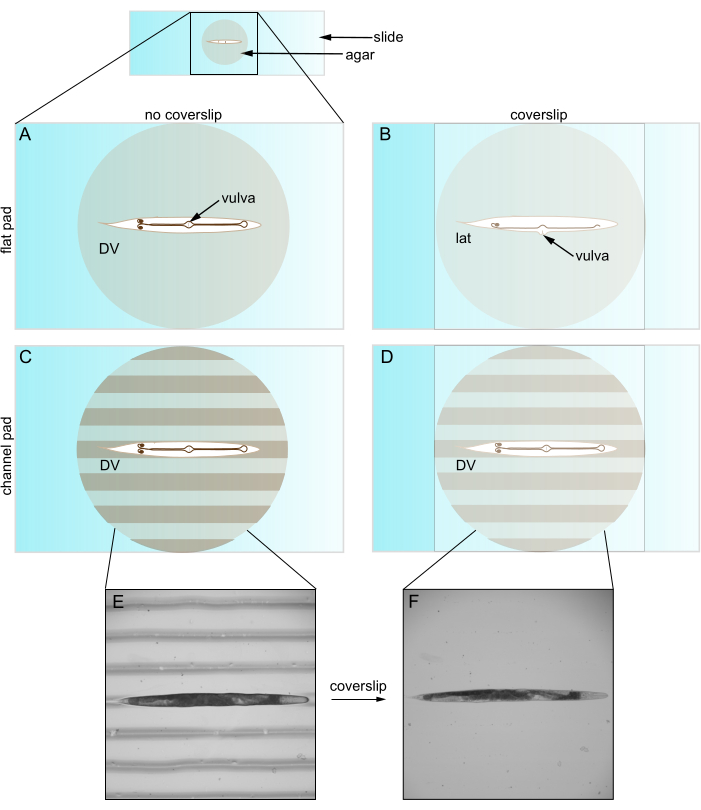
Resim 1: Caenorhabditis elegans düz ve kanallı pedler üzerinde. (A) DV oryantasyonunda düz agar pedi üzerindeki hayvan; Vulva yüzleri lamel ile karşı karşıyadır. (B) Lamel girişi vulvayı yana doğru iterek hayvanı yanal yönlendirmeye zorlar. (C) DV oryantasyonunda kanallı agar pedi üzerindeki hayvan. (D) Lamel girişinden sonra hayvan DV oryantasyonunda kalır. (E) DV oryantasyonunda kanallı agar pedi üzerinde silindir mutantın parlak alan görüntüsü. (F) Lamelli parlak alan görüntüsü, E ile aynı hayvan DV yönünde kalır. Kısaltmalar: DV = dorsal-ventral; lat = yanal. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
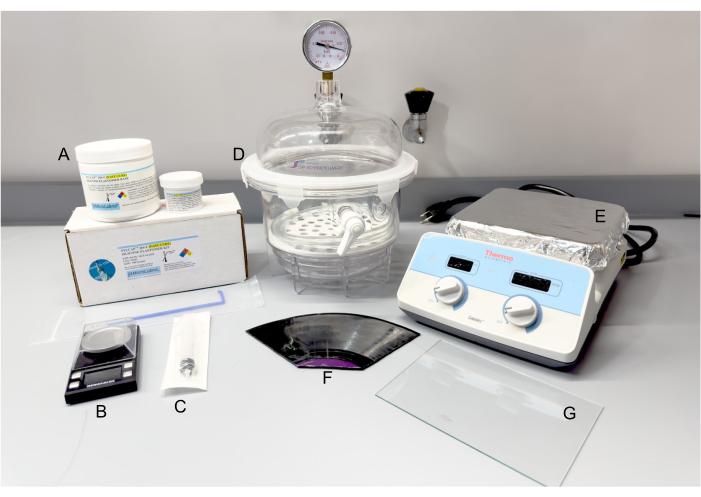
Şekil 2: PDMS üretimi için malzeme ve ekipman. (A) SYLCAP 284-F Silikon Elastomer Kiti. (b) Ölçek. (C) Plastik şırınga. (D) Vakum desikatör. (E) Sıcak plaka. (F) 12 inç uzun çalan vinil plak, gerektiği gibi parçalayın. (G) Cam bölme. Kısaltma: PDMS = polidimetilsiloksan. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Kürlenmemiş PDMS'nin karıştırılması ve vakumlanması. (A) Tabanı ve sertleştiriciyi tepside karıştırın. (B) Tepsiyi bir vakum odasına yerleştirin. (C) Kabarcıkların yüzeye çıkmasına izin vermek için vakumu üç kez çevirin. (D) Bir saat sonra çoğu baloncuk patladı. PDMS üzerinden geliştirilmiş iletimi not edin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Kabarcıklar olmadan kürlenmemiş PDMS'ye bir cam bölmenin tanıtılması. (A) Kabarcıksız vinil plak üzerine cam panelin tanıtılması. (B) Katılaşmış PDMS kalıbı, iç detaylandırma kanalları ile kayıttan çıkarıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
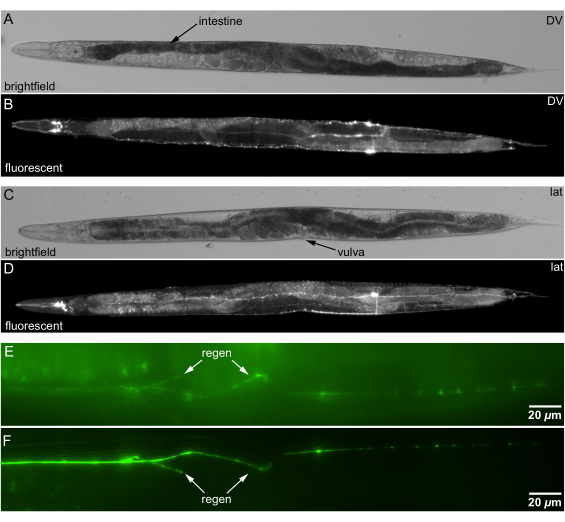
Şekil 5: Kanallı agar üzerine monte edilmiş C. elegans'ın parlak alan ve floresan görüntüleri. (A) İki taraflı DV oryantasyonunda bir hayvanın parlak alan görüntüsü. DV oryantasyonu için anatomik dönüm noktası: burundan kuyruğa olan mesafenin ~% 60'ını geçen spiral S-şekilli bağırsak (okla gösterilen daha koyu doku). (B) DV oryantasyonundaki nöronların floresan görüntüsü, A ile aynı hayvan. (C) Enlem yönündeki bir hayvanın parlak alan görüntüsü. Enlem oryantasyonu için anatomik dönüm noktası: vulvaya bakan taraf. (D) Enlem oryantasyonundaki nöronların floresan görüntüsü, C ile aynı hayvan. (E) Bir hayvanın daha derin (uzak) tarafında rejenerasyon (ok) ile oryantasyon. (F) Hedefe daha yakın olan daha sığ yan hayvanda rejenerasyon ile oryantasyon; rejenerasyon daha net (ok). Ölçek çubukları = 20 μm. Kısaltmalar: DV = dorsal-ventral; lat = yanal. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Kanallı agar pedlerinin birincil avantajı, görüntüleme için hayvanların oryantasyonunu koruma yetenekleridir. Kanallar yetişkin hayvanlara uyar ve lamel girişinde sürdürülen kontrollü rotasyona izin verir. Yabani tip, merdane ve çöplük hayvanlarını başarıyla görüntüledik. Tek bir görüş alanında birden fazla yapının görüntülenmesine ve karşılaştırılmasına olanak tanıyan ve hedef hücreleri yüzeye yaklaştıran anatomik yer işaretlerini kullanarak hayvanları uygun şekilde yönlendiriyoruz. Özellikle, bu rotasyon, hayvanın sol ve sağ tarafının karşılaştırılmasına izin veren dorsal veya ventral (iki taraflı görünümler) görselleştirmeyi kolaylaştırır.
Önceden, bu ikili yapıların görselleştirilmesi ve karşılaştırılması, daha büyük derinliklerde azaltılmış iletimi hesaba katmak için 3D z-yığınları ve sinyallerin potansiyel normalleştirilmesini gerektiriyordu. Bu nedenle, kanallı agar tarafından sağlanan tanımlanmış oryantasyon, birden fazla solucan arasında daha tutarlı görüntülemeye izin verir ve gelişmiş ölçümlere izin vermelidir. Bu, özellikle çevresel2 gibi görüntülenmesi zor yönlerde büyüyebilen rejenere nöronal liflerin ameliyat sonrası değerlendirmesi için yararlıdır.
Ek olarak, kanallı agar, hayvanlar üzerindeki stresi azaltır, çünkü lamel basıncını hafifleten ve normal fizyolojiyi destekleyen bir depresyona yerleştirilirler5. Sarkık suşlar montaj sırasında bükülebilirken, kanallar doğrusal bir hayvan konfigürasyonunu ve tüm hayvanın dönüşünü teşvik eder. Farklı bir uygulamada, desenleme, hayvanı görüntülemek veya gözlemlemek için gereken anestezik miktarını azaltmak için hayvan hareketini de kısıtlayabilir8.
Son olarak, kanallı agar tekniği de oldukça erişilebilirdir. Kalıp imalatından sonra, kanallı agar pedleri oluşturmak, normal düz agar pedleri yapmakla kabaca aynı miktarda zaman, uzmanlık ve maliyet gerektirir. PDMS kalıbını oluşturmak için gereken tüm bileşenler birçok akademik laboratuvarda ortaktır veya çevrimiçi olarak satın alınır. PDMS kalıplarının dayanıklılığı, onları laboratuvarlar için uygun maliyetli bir seçenek haline getirir ve zaman içinde yoğun kullanıma dayanabilir. PDMS kalıpları yıllarca ve yüzlerce kullanıma dayanabilir. Orta derecede bozulma ile 17 yıllık bir küf kullanmaya devam ediyoruz. Kalıpları, gerekirse deiyonize su ile yıkanabilen kalıntılardan uzak tutmak için oda sıcaklığında bir kapta saklamanızı öneririz.
Bu avantajlara rağmen, tekniğimizle ilgili çeşitli sınırlamalar vardır. Hayvanları pedin üzerine yerleştirmek için kullanılan pena kuvveti, kanalları deforme edebilir ve potansiyel olarak hayvanın konumunu etkileyebilir. Herhangi bir ince manipülasyonda olduğu gibi, hayvanı istenen yöne konumlandırmak ve döndürmek zaman alıcı olabilir, bu da hayvanın anesteziye maruz kalmasını artırır ve potansiyel olarak strese neden olur. Kanallar ayrıca lamel yerleştirilmesi sırasında havayı hapsedebilir ve kabarcıklar oluşturabilir, bu da ışığı saçarak görüntülemenin netliğini engelleyebilir. Protokoldeki baloncukları en aza indirmenin yollarını tartışıyoruz. Deneyimlerimiz, kanallı agarın dezavantajlarının çoğunun, bir nebze eğitim ve uygulama ile büyük ölçüde önlendiğini göstermektedir.
Bu kanalları optimize etmek için gelecekteki yönergeler, farklı yaşlar ve C. elegans fenotipleri için farklı boyutlar ve şekiller dahil olmak üzere belirli deneysel ihtiyaçlara göre uyarlanmış tasarımlar geliştirmeyi içerir. Nanofabrikasyon10 ile özelleştirilmiş kanal boyutlarının üretilmesi, jenerik kanallara5 kıyasla hayvanlar üzerindeki fizyolojik etkiyi azaltabilir. Sonuç olarak, kanallı agar pedlerinin uygulanması, yaşlı hayvanlarda belirsiz yapıların yüksek çözünürlüklü görüntülenmesini sağlar. Bu pedler, C. elegans'ın oryantasyonunu koruyarak, gelişmiş görüntüleme kalitesi ve ayrıntılı görselleştirmeye yol açarken, kanalların destekleyici yapısı nedeniyle hayvanlar üzerindeki stresi azaltır.
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Finansman NIH R56NS128413 tarafından sağlandı. Vinil kayıtların işlenmesi konusunda yardım için Noah Joseph'e (Kuzeydoğu Biyomühendislik Departmanı) teşekkür ederiz. El yazması hakkındaki anlayışlı yorumları için Chung Laboratuvarı üyelerine teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Corning | 4980-125 | |
| 33 1/2 RPM or 12-inch long playing (LP) vinyl record | N/A | N/A | Individual channel depth: 50 µm, width: 200 µm |
| 30 mL plastic syringe | Fisher Scientific | 50-793-817 | |
| 90% Platinum, 10% Iridium Wire | Tritech Research | PT-9010 | used to create platinum pick |
| aluminum foil | Amazon | N/A | |
| Calcium chloride | Fisher Scientific | AAL131910B | |
| glass pane | N/A | N/A | 7 in x 5 in glass pane taken from frame |
| glass pipette | Fisher Scientific | 13-678-20A | used to create platinum pick |
| hot plate | Thermofisher | SP88857104 | |
| Magnesium Sulfate | Fisher Scientific | AA3333736 | |
| microscope slides | Mckesson | 938360 | |
| molecular biology grade agar | Benchmark Scientific | A1705 | |
| Potassium Phosphate dibasic | Fisher Scientific | P290-500 | |
| Potassium Phosphate monobasic | Fisher Scientific | P285-500 | |
| Sodium Azide | Fisher Scientific | AAJ2161022 | |
| Sodium Chloride | Fisher Scientific | BP358-212 | |
| square cover glass | Fisher Scientific | 12-541-016 | |
| SYLCAP 284-F (Fast Cure) Silicone Elastomer Encapsulant Kit, Transparent, Optically Clear, 10:1 Mix, 500 Gm/ML (0.5 Kg), Faster Than Sylgard 184 and Similar | MicroLubrol | N/A | |
| vacuum desiccator | Fisher Scientific | 08-648-100 | |
| weighing dish | Fisher Scientific | 01-549-750 |
Referanslar
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Bargmann, C. I., Avery, L. Laser killing of cells in Caenorhabditis elegans. Methods Cell Biol. 48, 225-250 (1995).
- Zhang, M., et al. A self-regulating feed-forward circuit controlling C-elegans egg-laying behavior. Curr Biol. 18 (19), 1445-1455 (2008).
- Chung, S. H., Mazur, E. Femtosecond laser ablation of neurons in C. elegans for behavioral studies. Appl Phys A-Mater Sci Process. 96 (2), 335-341 (2009).
- Zellag, R. M., et al. CentTracker: a trainable, machine-learning-based tool for large-scale analyses of Caenorhabditis elegans germline stem cell mitosis. Mol Biol Cell. 32 (9), 915-930 (2021).
- Huang, Y. C., et al. A single neuron in C. elegans orchestrates multiple motor outputs through parallel modes of transmission. Curr Biol. 33 (20), 4430-4445.e6 (2023).
- Rasmussen, N. R., Dickinson, D. J., Reiner, D. J. Ras-dependent cell fate decisions are reinforced by the RAP-1 small GTPase in Caenorhabditis elegans. Genetics. 210 (4), 1339-1354 (2018).
- Rivera Gomez, K., Schvarzstein, M. Immobilization of nematodes for live imaging using an agarose pad produced with a vinyl record. MicroPubl Biol. 2018, (2018).
- Chung, S. H., Clark, D. A., Gabel, C. V., Mazur, E., Samuel, A. D. T. The role of the AFD neuron in C. elegans thermotaxis analyzed using femtosecond laser ablation. BMC Neuroscience. 7 (1), 30 (2006).
- Gerhold Abigail, R., et al. Investigating the regulation of stem and progenitor cell mitotic progression by in situ imaging. Curr Biol. 25 (9), 1123-1134 (2015).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır