Method Article
Ajuste fino da orientação de Caenorhabditis elegans em almofadas de ágar canalizadas para neuroregeneração de imagem
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para a fabricação de almofadas de ágar canalizadas usando moldes PDMS criados a partir de discos de vinil. Os canais permitem que os usuários orientem com precisão Caenorhabditis elegans para melhorar o contraste da imagem e facilitar a comparação de estruturas. Esses recursos são particularmente úteis em estudos de neurorregeneração.
Resumo
Caenorhabditis elegans é um organismo modelo amplamente utilizado para o estudo de processos biológicos. Sua transparência e tamanho pequeno o tornam ideal para imagens de tecidos, células e estruturas subcelulares. As almofadas de ágar planas tradicionais para imagens de C. elegans limitam o controle sobre a orientação do animal, restringindo as visões principalmente às perspectivas laterais. Essa limitação complica a visualização das estruturas dorso-ventrais e reduz a clareza da imagem, principalmente em animais mais velhos com pigmentação aumentada e diâmetros maiores. Para superar esses desafios, desenvolvemos almofadas de agarose canalizadas que permitem o controle preciso da orientação do animal. Esses canais permitem que os pesquisadores girem e fixem C. elegans em posições especificadas , facilitando a imagem simultânea de várias estruturas e melhorando a resolução da imagem, aproximando as células-alvo da objetiva do microscópio. Isso é particularmente útil para obter imagens de fibras neuronais regeneradas após a cirurgia, que podem crescer em direções difíceis de capturar com almofadas de ágar planas tradicionais. Este método é acessível, pois a fabricação de almofadas de ágar canalizadas requer o mesmo tempo e materiais que as almofadas planas, tornando-o uma opção prática para a maioria dos laboratórios.
Introdução
O nematóide Caenorhabditis elegans (C. elegans) é um organismo modelo amplamente utilizado para o estudo de processos biológicos, como desenvolvimento e comportamento, devido à sua genética fortemente conservada com os mamíferos1. Os pesquisadores cultivam C. elegans em uma placa de meio de crescimento de nematóides (NGM) em um ambiente rigidamente controlado que padroniza as condições experimentais e permite uma atribuição mais precisa dos resultados às variáveis experimentais. O animal é transparente, permitindo imagens claras de tecidos, células e estruturas subcelulares. C. elegans são pequenos, com os animais adultos tendo ~ 1 mm de comprimento e 80 μm de diâmetro, o que permite a colocação de vários animais em um único suporte de lâmina para imagens1. Seu tamanho pequeno também permite que uma única imagem capture todo o organismo enquanto resolve células individuais, o que é crucial para visualizar a regeneração das fibras dos neurônios. Sinérgico a essas vantagens para a microscopia, o rápido desenvolvimento, a anatomia estereotipada e a genética fácil de C. elegans permitem estudos em larga escala1.
O procedimento típico para imagens de células em C. elegans foi estabelecido décadas atrás e permaneceu praticamente inalterado. Os pesquisadores usam almofadas de ágar planas em lâminas para montar e imobilizar os animais para visualização de suas células2. Uma lamínula na parte superior da almofada mantém os animais no lugar e protege a lente do microscópio. É importante ressaltar que a lamínula tem um alto índice de refração que aumenta a abertura numérica da luz capturada e melhora a resolução da imagem. Além disso, a lamínula reduz a distorção na transmissão de luz. Assim, uma lamínula melhora a visualização das células-alvo e
Quando usado com uma lamínula, no entanto, as almofadas de ágar planas geralmente restringem a orientação do animal. C. elegans se dobram ao longo de sua direção dorsal-ventral (DV) para que adotem uma orientação lateral em uma almofada de ágar plana. No entanto, mesmo após imobilizar, endireitar e pré-girar para uma orientação DV, a colocação da lamínula reverte quase todos os animais para uma visão lateral (Figura 1). Acreditamos que essa reorientação ocorre porque a lamínula empurra a vulva saliente de C. elegans para o lado. Animais mais jovens sem vulva são mais orientados aleatoriamente. Esse controle limitado sobre a orientação é problemático por pelo menos dois motivos. Primeiro, pode não permitir colocar duas estruturas em um único campo de visão (por exemplo, bilateral), o que complica sua comparação. Em segundo lugar, definir a orientação é importante para otimizar a qualidade da imagem, pois as estruturas de interesse geralmente são melhor visualizadas quando estão próximas da objetiva. Isso ocorre porque as objetivas apresentam uma profundidade limitada dentro da amostra (ou seja, distância de trabalho) e porque a luz de locais mais profundos experimenta mais dispersão e absorção.
Para C. elegans, o controle limitado sobre a orientação é geralmente mais sério com animais mais velhos. Os animais de L1 a L4 são menores em diâmetro, tornando uma fração maior do verme imaginável. Essas larvas também têm menos pigmentação, resultando em redução da absorção de luz visível e dispersão de fótons, o que melhora a clareza e a resolução da imagem. Por outro lado, os animais adultos têm um diâmetro maior e mais pigmentação, o que representa desafios para a imagem em planos z mais profundos, uma vez que a lamínula afeta a orientação inicial.
Em 2008, introduzimos uma estratégia usando almofadas de ágar com canais para superar esses desafios, mantendo a orientação dos animais 3,4. Conforme descrito abaixo, os usuários giram os animais imobilizados nos canais para a orientação desejada, observando os pontos de referência anatômicos. Os canais mantêm os animais em depressões entre superfícies elevadas de ágar, minimizando a força sobre o animal durante a colocação da lamínula e eliminando a rotação do animal. Como a fabricação de almofadas canalizadas e almofadas planas comuns segue quase o mesmo procedimento e requer o mesmo tempo, nossa técnica é altamente acessível. Muitos laboratórios utilizam nossa técnica para imobilizar C. elegans para estudar características anatômicas, observar o desenvolvimento e analisar as contribuições neuronais para o comportamento 5,6,7,8. A seção a seguir descreve todo o processo de fabricação de ágar canalizado, a partir de um disco de vinil que foi cortado em quartos usando uma faca quente. Primeiro, descrevemos a fabricação do molde de polidimetilsiloxano (PDMS) usado para fundir ágar canalizado. Em seguida, mostramos como fabricar o ágar canalizado passo a passo. Espera-se que todo o procedimento leve 3 horas sem perícia. Seguindo o procedimento de fabricação do PDMS, as almofadas feitas com o molde levarão o mesmo tempo para serem feitas que as almofadas de ágar típicas (alguns minutos).
Protocolo
1. Preparação de polidimetilsiloxano (PDMS) para fabricação
- Despeje uma proporção de 1:10 do agente de cura rápida na base em um prato de pesagem descartável. Misture o líquido não curado por 45 s até que o líquido esteja totalmente integrado e cheio de bolhas.
- Coloque a bandeja em um dessecador a vácuo inclinado. Alterne a pressão entre -0.09 a -0.1 kPa 3x para permitir que as bolhas de ar apareçam.
- Mantenha o vácuo ligado por cerca de uma hora a uma faixa de pressão de -0,09 a -0,1 kPa até que haja poucas bolhas visíveis restantes, que podem ser removidas manualmente.
2. Fabricação de molde PDMS de disco de vinil
- Enxágue o disco de vinil e a placa de vidro com água deionizada (DI). Garanta a ausência de poeira para obter o melhor molde. Deixe o disco de vinil secar ao ar até ser usado.
- Coloque uma folha de papel alumínio em cima da placa de aquecimento para coletar o excesso de PDMS.
- Coloque uma lâmina de vidro em cada extremidade do disco de vinil para definir a espessura do molde para a largura das lâminas de vidro. Isso garante uma altura uniforme ao pressionar o painel de vidro no PDMS não curado.
- Despeje o líquido PDMS não curado em um lado do disco de vinil.
- Observe as bolhas usando o reflexo da luz na superfície do líquido e remova-as com uma ponta de pipeta. Incline a placa de vidro e abaixe a placa lentamente, permitindo que o ar escape, evitando a introdução de bolhas.
- Catalise o PDMS a 80 °C durante 35 min.
- Retire o disco de vinil da placa quente e deixe esfriar. Retire cuidadosamente o PDMS do disco de vinil para evitar rasgos.
- Use uma nova lâmina de vidro como guia para cortar o PDMS com uma navalha afiada para criar um molde de ágar canalizado.
3. Fabricação de almofadas de ágar canalizadas com NaN3
NOTA: O procedimento e os materiais para almofadas de ágar planas foram previamente estabelecidos9. Este procedimento é muito semelhante.
- Adicione 0,6 g de ágar e 30 ml de caldo líquido NGM9 num balão. Adicione uma barra de agitação e aqueça em uma placa quente a 120 °C.
- Adicione 120 μL de estoque de NaN3 (concentração de estoque de 1 M) após o derretimento do gel.
- Lave o molde PDMS com água e deixe secar ao ar. Coloque o molde PDMS entre dois conjuntos de pares de lâminas.
- Pipetar ágar para cima e para baixo para aquecer a ponta da pipeta. Pipete 300 μL de ágar derretido no molde PDMS, espalhando manualmente o ágar pelos canais, pois a colocação da lâmina espalhará o ágar ao longo dos canais.
- Coloque uma lâmina de microscópio diretamente no ágar, apoiada nas lâminas nas laterais. Remova a corrediça depois que o ágar esfriar.
4. Montagem de C. elegans
- Assim que as lâminas esfriarem, levante-a diretamente do molde sem cisalhar.
- Mova os animais para os canais depois de serem imobilizados pelo NaN3
- Gire os animais para a orientação desejada.
- Coloque uma lamínula na almofada. Incline a almofada e empurre levemente de um lado para o outro para empurrar o ar para o lado e evitar a criação de bolhas.
Resultados
Fabricação de moldes PDMS
O ciclo da pressão de vácuo durante a fabricação do molde perfura e remove as bolhas de ar do PDMS não curado, garantindo um molde sem bolhas. Como mostrado na Figura 3D , as bolhas sobem à superfície e perfuram. Moldes sem bolhas podem produzir canais limpos.
Solidificação do molde PDMS
Ao colocar o painel de vidro no disco de vinil, evite criar espaços de ar. Essas lacunas podem levar a espessuras irregulares ou defeitos superficiais. Bolhas, se presentes, podem ser detectadas visualmente. Pressionar o painel de vidro de um lado para o outro desloca o ar, minimizando a formação de bolhas e garantindo uma espessura uniforme do molde mostrada na Figura 4A.
Usando almofadas de ágar canalizadas para orientação fina de C. elegans
As almofadas de ágar canalizadas permitem a orientação precisa de C. elegans. Definimos a orientação do animal rolando levemente o animal com uma palheta de fio de platina, enquanto verificamos a orientação usando pontos de referência, como a vulva ou o intestino em forma de S (Figura 5A, C). Confirmamos a orientação sob um microscópio de dissecação fluorescente antes de transferir os animais para um microscópio invertido mostrado na Figura 5B,D.
Avaliação da regeneração de fibras neuronais com almofadas de ágar canalizadas
As almofadas de ágar canalizadas melhoram a qualidade da imagem da regeneração neuronal, orientando o animal de maneira ideal. O posicionamento das fibras dos neurônios regenerados mais perto da lente objetiva reduz a dispersão e a absorção de luz, aumentando a clareza da imagem. A Figura 5E, F mostra que colocar o local de regeneração mais próximo da objetiva melhora a qualidade da imagem, facilitando uma análise mais precisa do crescimento neuronal.
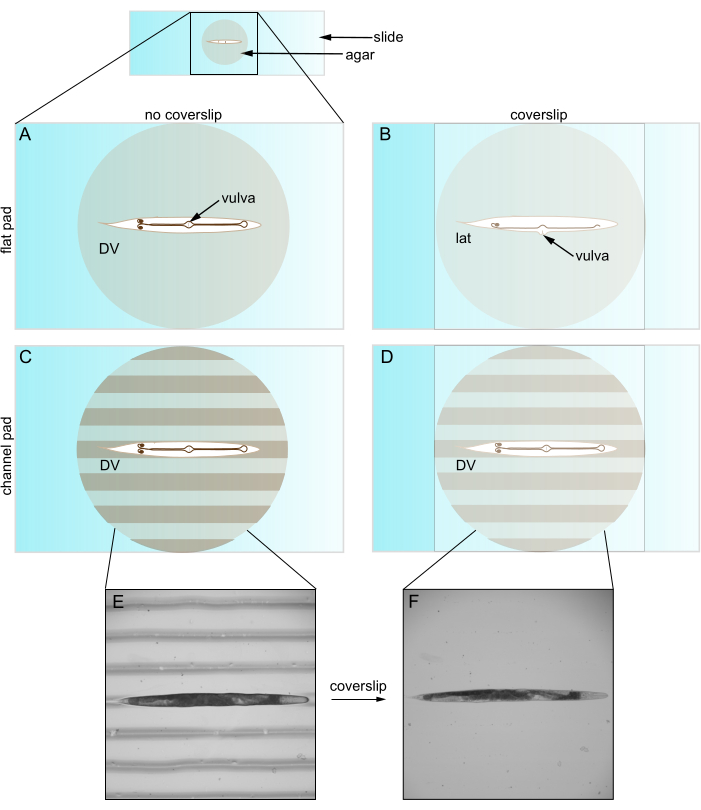
Figura 1: Caenorhabditis elegans em almofadas planas e canalizadas. (A) Animal em almofada de ágar plana na orientação DV; vulva enfrenta lamínula. (B) A introdução de lamínula empurra a vulva para o lado, forçando o animal a se orientar lateralmente. (C) Animal em almofada de ágar canalizada na orientação DV. (D) O animal permanece na orientação DV após a introdução da lamínula. (E) Imagem de campo claro do rolo mutante em almofada de ágar canalizada na orientação DV. (F) Imagem de campo claro com lamínula, o mesmo animal que E permanece na orientação DV. Abreviaturas: DV = dorsal-ventral; lat = lateral. Clique aqui para ver uma versão maior desta figura.
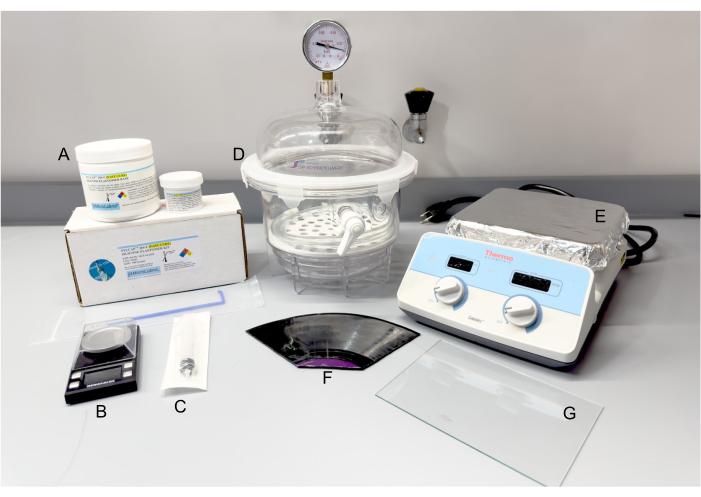
Figura 2: Materiais e equipamentos para fabricação de PDMS. (A) Kit de elastômero de silicone SYLCAP 284-F. (B) Escala. (C) Seringa de plástico. (D) Dessecador a vácuo. (E) Placa quente. (F) Disco de vinil de 12 polegadas de longa duração, desmonta conforme necessário. (G) Painel de vidro. Abreviatura: PDMS = polidimetilsiloxano. Clique aqui para ver uma versão maior desta figura.

Figura 3: Mistura e aspiração de PDMS não curado. (A) Misture a base e o agente de cura na bandeja. (B) Coloque a bandeja em uma câmara de vácuo. (C) Cicle o vácuo três vezes para permitir que as bolhas apareçam. (D) Depois de uma hora, a maioria das bolhas estourou. Observe a transmissão aprimorada por meio do PDMS. Clique aqui para ver uma versão maior desta figura.

Figura 4: Introdução de um painel de vidro ao PDMS não curado sem bolhas. (A) Introdução de painel de vidro em disco de vinil sem bolhas. (B) Molde PDMS solidificado removido do registro, com canais de detalhamento inseridos. Clique aqui para ver uma versão maior desta figura.
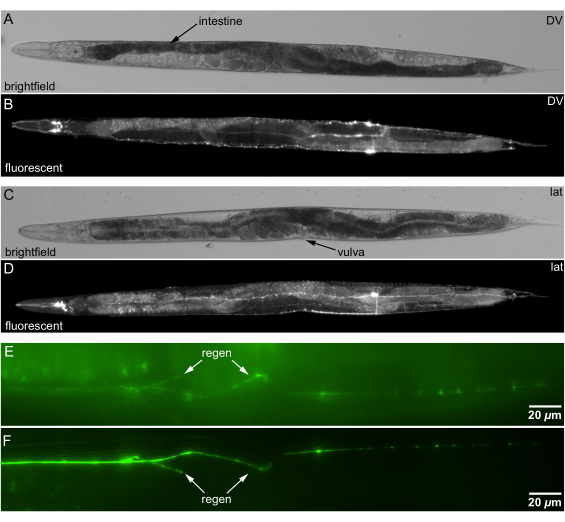
Figura 5: Imagens de campo claro e fluorescência de C. elegans montadas em ágar canalizado. (A) Imagem de campo claro de um animal em orientação DV bilateral. Marco anatômico para orientação DV: intestino espiral em forma de S (tecido mais escuro indicado por seta) cruzando a linha média ~ 60% da distância do nariz à cauda. (B) Imagem de fluorescência de neurônios na orientação DV, mesmo animal que A. (C) Imagem de campo claro de um animal na orientação lat. Ponto de referência anatômico para orientação lateral: vulva voltada para o lado. (D) Imagem de fluorescência de neurônios na orientação lat, mesmo animal que C. (E) Orientação com regeneração (seta) no lado mais profundo (distante) de um animal. (F) Orientação com regeneração em animal lateral mais raso mais próximo do objetivo; regeneração mais clara (seta). Barras de escala = 20 μm. Abreviaturas: DV = dorsal-ventral; lat = lateral. Clique aqui para ver uma versão maior desta figura.
Discussão
A principal vantagem das almofadas de ágar canalizadas é sua capacidade de manter a orientação dos animais para a geração de imagens. Os canais se adaptam a animais adultos, permitindo uma rotação controlada que é mantida após a introdução da lamínula. Fotografamos com sucesso animais selvagens, rolos e atarracados. Orientamos adequadamente os animais usando pontos de referência anatômicos, o que permite imagens e comparação de várias estruturas em um campo de visão e aproxima as células-alvo da superfície. Em particular, essa rotação facilita a visualização nas vistas dorsal ou ventral (bilaterais), que permitem a comparação do lado esquerdo e direito do animal.
Anteriormente, a visualização e comparação dessas estruturas bilaterais exigiria pilhas z 3D e potencial normalização de sinais para levar em conta a transmissão reduzida em profundidades maiores. Assim, a orientação definida habilitada pelo ágar canalizado permite imagens mais consistentes em vários vermes e deve permitir medições aprimoradas. Isso é particularmente útil para a avaliação pós-cirúrgica de fibras neuronais regeneradas, que podem crescer em direções difíceis de visualizar, como a circunferencial2.
Além disso, o ágar canalizado reduz o estresse nos animais porque eles são colocados em uma depressão que alivia a pressão da lamínula e promove a fisiologia normal5. Embora as cepas flácidas possam torcer durante a montagem, os canais incentivam uma configuração linear do animal e a rotação de todo o animal. Em uma implementação diferente, o padrão também pode restringir o movimento do animal para reduzir a quantidade de anestésico necessária para obter imagens ou observar o animal8.
Finalmente, a técnica de ágar canalizado também é altamente acessível. Após a fabricação do molde, a criação de almofadas de ágar canalizadas requer aproximadamente a mesma quantidade de tempo, experiência e custo que a fabricação de almofadas de ágar planas regulares. Todos os componentes necessários para criar o molde PDMS são comuns a muitos laboratórios acadêmicos ou comprados online. A durabilidade dos moldes PDMS os torna uma opção econômica para laboratórios, capaz de suportar o uso extensivo ao longo do tempo. Os moldes PDMS podem durar anos e centenas de usos. Continuamos a usar um molde de 17 anos com degradação moderada. Recomendamos armazenar os moldes em temperatura ambiente em um recipiente para mantê-los livres de detritos, que podem ser lavados com água deionizada, se necessário.
Apesar dessas vantagens, existem várias limitações associadas à nossa técnica. A força da picareta usada para colocar os animais na almofada pode deformar os canais, afetando potencialmente o posicionamento do animal. Como acontece com qualquer manipulação fina, posicionar e girar o animal para a orientação desejada pode ser demorado, o que aumenta a exposição do animal ao anestésico e potencialmente induz estresse. Os canais também podem reter o ar e formar bolhas durante a colocação da lamínula, o que pode interferir na clareza da imagem ao espalhar a luz. Discutimos maneiras de minimizar as bolhas no protocolo. Nossa experiência indica que a maioria das desvantagens do ágar canalizado são amplamente evitadas por um mínimo de treinamento e prática.
As direções futuras para otimizar esses canais incluem o desenvolvimento de projetos adaptados a necessidades experimentais específicas, incluindo diferentes tamanhos e formas para diferentes idades e fenótipos de C. elegans. A fabricação de tamanhos de canal personalizados por nanofabricação10 pode reduzir o impacto fisiológico nos animais em comparação com os canais genéricos5. Em conclusão, a implementação de almofadas de ágar canalizadas permite imagens de alta resolução de estruturas obscuras em animais mais velhos. Essas almofadas mantêm a orientação de C. elegans, levando a uma melhor qualidade de imagem e visualização detalhada, ao mesmo tempo em que reduzem o estresse nos animais devido à estrutura de suporte dos canais.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
O financiamento foi fornecido pelo NIH R56NS128413. Agradecemos a Noah Joseph (Departamento de Bioengenharia do Nordeste) pela assistência no processamento de discos de vinil. Agradecemos aos membros do Laboratório Chung pelos comentários perspicazes sobre o manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Corning | 4980-125 | |
| 33 1/2 RPM or 12-inch long playing (LP) vinyl record | N/A | N/A | Individual channel depth: 50 µm, width: 200 µm |
| 30 mL plastic syringe | Fisher Scientific | 50-793-817 | |
| 90% Platinum, 10% Iridium Wire | Tritech Research | PT-9010 | used to create platinum pick |
| aluminum foil | Amazon | N/A | |
| Calcium chloride | Fisher Scientific | AAL131910B | |
| glass pane | N/A | N/A | 7 in x 5 in glass pane taken from frame |
| glass pipette | Fisher Scientific | 13-678-20A | used to create platinum pick |
| hot plate | Thermofisher | SP88857104 | |
| Magnesium Sulfate | Fisher Scientific | AA3333736 | |
| microscope slides | Mckesson | 938360 | |
| molecular biology grade agar | Benchmark Scientific | A1705 | |
| Potassium Phosphate dibasic | Fisher Scientific | P290-500 | |
| Potassium Phosphate monobasic | Fisher Scientific | P285-500 | |
| Sodium Azide | Fisher Scientific | AAJ2161022 | |
| Sodium Chloride | Fisher Scientific | BP358-212 | |
| square cover glass | Fisher Scientific | 12-541-016 | |
| SYLCAP 284-F (Fast Cure) Silicone Elastomer Encapsulant Kit, Transparent, Optically Clear, 10:1 Mix, 500 Gm/ML (0.5 Kg), Faster Than Sylgard 184 and Similar | MicroLubrol | N/A | |
| vacuum desiccator | Fisher Scientific | 08-648-100 | |
| weighing dish | Fisher Scientific | 01-549-750 |
Referências
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Bargmann, C. I., Avery, L. Laser killing of cells in Caenorhabditis elegans. Methods Cell Biol. 48, 225-250 (1995).
- Zhang, M., et al. A self-regulating feed-forward circuit controlling C-elegans egg-laying behavior. Curr Biol. 18 (19), 1445-1455 (2008).
- Chung, S. H., Mazur, E. Femtosecond laser ablation of neurons in C. elegans for behavioral studies. Appl Phys A-Mater Sci Process. 96 (2), 335-341 (2009).
- Zellag, R. M., et al. CentTracker: a trainable, machine-learning-based tool for large-scale analyses of Caenorhabditis elegans germline stem cell mitosis. Mol Biol Cell. 32 (9), 915-930 (2021).
- Huang, Y. C., et al. A single neuron in C. elegans orchestrates multiple motor outputs through parallel modes of transmission. Curr Biol. 33 (20), 4430-4445.e6 (2023).
- Rasmussen, N. R., Dickinson, D. J., Reiner, D. J. Ras-dependent cell fate decisions are reinforced by the RAP-1 small GTPase in Caenorhabditis elegans. Genetics. 210 (4), 1339-1354 (2018).
- Rivera Gomez, K., Schvarzstein, M. Immobilization of nematodes for live imaging using an agarose pad produced with a vinyl record. MicroPubl Biol. 2018, (2018).
- Chung, S. H., Clark, D. A., Gabel, C. V., Mazur, E., Samuel, A. D. T. The role of the AFD neuron in C. elegans thermotaxis analyzed using femtosecond laser ablation. BMC Neuroscience. 7 (1), 30 (2006).
- Gerhold Abigail, R., et al. Investigating the regulation of stem and progenitor cell mitotic progression by in situ imaging. Curr Biol. 25 (9), 1123-1134 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados