Method Article
Réglage fin de l’orientation de Caenorhabditis elegans sur des coussinets gélifiés canalisés pour l’imagerie de la neurorégénération
Dans cet article
Résumé
Ici, nous présentons un protocole de fabrication de tampons gélifiés canalisés à l’aide de moules PDMS créés à partir de disques vinyles. Les canaux permettent aux utilisateurs d’orienter finement Caenorhabditis elegans afin d’améliorer le contraste de l’image et de faciliter la comparaison des structures. Ces capacités sont particulièrement utiles dans les études de neurorégénération.
Résumé
Caenorhabditis elegans est un organisme modèle largement utilisé pour l’étude des processus biologiques. Sa transparence et sa petite taille le rendent idéal pour l’imagerie des tissus, des cellules et des structures subcellulaires. Les coussinets de gélose plats traditionnels pour l’imagerie de C. elegans limitent le contrôle de l’orientation de l’animal, limitant les vues principalement aux perspectives latérales. Cette limitation complique la visualisation des structures dorsale-ventrale et réduit la clarté de l’image, en particulier chez les animaux plus âgés avec une pigmentation accrue et des diamètres plus grands. Pour surmonter ces défis, nous avons développé des coussinets d’agarose canalisés qui permettent un contrôle précis de l’orientation des animaux. Ces canaux permettent aux chercheurs de faire pivoter et de fixer C. elegans dans des positions spécifiées, facilitant ainsi l’imagerie simultanée de plusieurs structures et améliorant la résolution de l’image en rapprochant les cellules cibles de l’objectif du microscope. Ceci est particulièrement utile pour l’imagerie des fibres neuronales régénérées après la chirurgie, qui peuvent se développer dans des directions difficiles à capturer avec des tampons gélifiés plats traditionnels. Cette méthode est accessible, car la fabrication de tampons gélifiés canalisés nécessite le même temps et les mêmes matériaux que les tampons plats, ce qui en fait une option pratique pour la plupart des laboratoires.
Introduction
Le nématode Caenorhabditis elegans (C. elegans) est un organisme modèle largement utilisé pour étudier les processus biologiques tels que le développement et le comportement en raison de sa génétique fortement conservée avec ses homologues mammifères1. Les chercheurs cultivent C. elegans sur une plaque de milieu de croissance de nématodes (NGM) dans un environnement étroitement contrôlé qui normalise les conditions expérimentales et permet une attribution plus précise des résultats aux variables expérimentales. L’animal est transparent, ce qui permet une imagerie claire des tissus, des cellules et des structures subcellulaires. C. elegans est petit, les animaux adultes mesurant ~1 mm de long et 80 μm de diamètre, ce qui permet de placer plusieurs animaux sur un seul support de lame pour l’imagerie1. Leur petite taille permet également à une seule image de capturer l’ensemble de l’organisme tout en résolvant les cellules individuelles, ce qui est crucial pour visualiser la régénération des fibres neuronales. En synergie avec ces avantages pour la microscopie, le développement rapide, l’anatomie stéréotypée et la génétique facile de C. elegans permettent des études à grande échelle1.
La procédure typique d’imagerie des cellules chez C. elegans a été établie il y a des décennies et est restée en grande partie inchangée. Les chercheurs utilisent des coussinets de gélose plats sur des lames pour monter et immobiliser les animaux afin de visualiser leurs cellules2. Une lamelle sur le dessus du tampon maintient les animaux en place et protège l’objectif du microscope. Il est important de noter que la lamelle a un indice de réfraction élevé qui augmente l’ouverture numérique de la lumière capturée et améliore la résolution de l’imagerie. De plus, la lamelle de recouvrement réduit la distorsion de la transmission de la lumière. Ainsi, une lamelle améliore la visualisation des cellules et des structures cibles.
Cependant, lorsqu’ils sont utilisés avec une lamelle, les tampons de gélose plats limitent souvent l’orientation de l’animal. C. elegans se plie le long de sa direction dorsale-ventrale (DV) de sorte qu’il adopte une orientation latérale sur un coussin de gélose plat. Cependant, même après l’immobilisation, le redressement et la prérotation vers une orientation DV, le placement de la lamelle ramène presque tous les animaux en vue latérale (figure 1). Nous pensons que cette réorientation se produit parce que la lamelle recouvre la vulve saillante de C. elegans sur le côté. Les animaux plus jeunes sans vulve sont orientés de manière plus aléatoire. Ce contrôle limité sur l’orientation est problématique pour au moins deux raisons. Premièrement, il peut ne pas permettre de placer deux structures dans un seul champ de vision (par exemple, bilatéral), ce qui complique leur comparaison. Deuxièmement, le réglage de l’orientation est important pour optimiser la qualité de l’imagerie, car les structures d’intérêt sont généralement mieux imagées lorsqu’elles sont proches de l’objectif. Cela s’explique par le fait que les objectifs imagent une profondeur limitée à l’intérieur de l’échantillon (c’est-à-dire la distance de travail) et que la lumière provenant d’endroits plus profonds subit plus de diffusion et d’absorption.
Chez C. elegans, le contrôle limité de l’orientation est généralement plus grave chez les animaux plus âgés. Les animaux d’âge L1 à L4 ont un diamètre plus petit, ce qui rend une fraction plus élevée du ver imageable. Ces larves ont également moins de pigmentation, ce qui réduit l’absorption de la lumière visible et la diffusion des photons, ce qui améliore la clarté et la résolution de l’image. À l’inverse, les animaux adultes ont un diamètre plus grand et une pigmentation plus importante, ce qui pose des défis pour l’imagerie dans les plans z plus profonds, car la lamelle affecte l’orientation initiale.
En 2008, nous avons introduit une stratégie utilisant des coussinets de gélose avec des canaux pour surmonter ces défis en maintenant l’orientation des animaux 3,4. Comme décrit ci-dessous, les utilisateurs font pivoter les animaux immobilisés dans les canaux jusqu’à l’orientation souhaitée en notant les repères anatomiques. Les canaux maintiennent les animaux dans des dépressions entre des surfaces de gélose surélevées, minimisant ainsi la force exercée sur l’animal lors de la mise en place des lamelles et éliminant la rotation de l’animal. Comme la fabrication de coussinets rainurés et de coussinets plats courants suit presque la même procédure et nécessite le même temps, notre technique est très accessible. De nombreux laboratoires utilisent notre technique pour immobiliser C. elegans afin d’étudier les caractéristiques anatomiques, d’observer le développement et d’analyser les contributions neuronales au comportement 5,6,7,8. La section suivante décrit l’ensemble du processus de fabrication de l’agar canalisé, à partir d’un disque vinyle qui a été coupé en quartiers à l’aide d’un couteau chaud. Tout d’abord, nous décrivons la fabrication du moule en polydiméthylsiloxane (PDMS) utilisé pour couler la gélose canalisée. Ensuite, nous montrons comment fabriquer la gélose canalisée étape par étape. L’ensemble de la procédure devrait prendre 3 h sans expertise. Après la procédure de fabrication PDMS, les tampons fabriqués avec le moule prendront le même temps à fabriquer que les tampons de gélose typiques (quelques minutes).
Protocole
1. Préparation du polydiméthylsiloxane (PDMS) pour la fabrication
- Versez un rapport de 1:10 de l’agent de durcissement rapide par rapport à la base dans un plat de pesée jetable. Mélangez le liquide non durci pendant 45 s jusqu’à ce que le liquide soit complètement intégré et plein de bulles.
- Placez le plateau dans un dessiccateur sous vide incliné. Réglez la pression entre -0,09 et -0,1 kPa 3x pour permettre aux bulles d’air de faire surface.
- Gardez le vide allumé pendant environ une heure à une plage de pression de -0,09 à -0,1 kPa jusqu’à ce qu’il reste quelques bulles visibles, qui peuvent être éliminées manuellement.
2. Fabrication du moule PDMS du disque vinyle
- Rincez le disque vinyle et la plaque de verre avec de l’eau désionisée (DI). Assurez-vous de l’absence de poussière pour obtenir le meilleur moule. Laissez le disque vinyle sécher à l’air libre jusqu’à ce qu’il soit utilisé.
- Placez une feuille de papier d’aluminium sur la plaque chauffante pour récupérer l’excès de PDMS.
- Placez une lame de verre à chaque extrémité du disque vinyle pour régler l’épaisseur du moule à la largeur des lames de verre. Cela garantit une hauteur uniforme lors de la pression de la vitre sur le PDMS non polymérisé.
- Versez le liquide PDMS non durci sur une face du disque vinyle.
- Observez les bulles à l’aide de la réflexion de la lumière sur la surface du liquide et retirez-les à l’aide d’une pointe de pipette. Inclinez la plaque de verre et abaissez-la lentement pour permettre à l’air de s’échapper, empêchant ainsi l’introduction de bulles.
- Durcissez le PDMS à 80 °C pendant 35 min.
- Retirez le disque vinyle de la plaque chauffante et laissez-le refroidir. Décollez soigneusement le PDMS du disque vinyle pour éviter de le déchirer.
- Utilisez une nouvelle lame de verre comme guide pour couper le PDMS avec un rasoir bien aiguisé afin de créer un moule à gélose canalisé.
3. Fabrication de tampons gélifiés canalisés avec NaN3
REMARQUE : La procédure et les matériaux pour les tampons de gélose plate ont été précédemment établis9. Cette procédure est très similaire.
- Ajouter 0,6 g de gélose et 30 ml de bouillon NGM liquid9 dans une fiole. Ajoutez un barreau d’agitation et faites chauffer sur une plaque chauffante à 120 °C.
- Ajouter 120 μL de stock NaN3 (concentration de 1 M) après la fusion du gel.
- Lavez le moule PDMS à l’eau et laissez-le sécher à l’air libre. Placez le moule PDMS entre deux ensembles de paires de diapositives.
- Pipeter la gélose de haut en bas pour réchauffer la pointe de la pipette. Pipetez 300 μL de gélose fondue dans le moule PDMS, en étalant manuellement la gélose sur les canaux, car le placement de la lame répandra la gélose le long des canaux.
- Placez une lame de microscope directement sur la gélose, en reposant sur les lames sur les côtés. Retirez la lame une fois que la gélose a refroidi.
4. Montage de C. elegans
- Une fois les lames refroidies, soulevez la diapositive directement du moule sans cisaillement.
- Déplacer les animaux dans les canaux après qu’ils aient été immobilisés par NaN3
- Faites pivoter les animaux dans l’orientation souhaitée.
- Placez une lamelle sur le tampon. Inclinez le tampon et appuyez légèrement d’un côté à l’autre pour pousser l’air sur le côté et éviter de créer des bulles.
Résultats
Fabrication de moules PDMS
Le cycle de pression du vide pendant la fabrication du moule perfore et élimine les bulles d’air du PDMS non durci, garantissant ainsi un moule sans bulles. Comme le montre la figure 3D , les bulles remontent à la surface et se perforent. Les moules sans bulles peuvent produire des canaux propres.
Solidification du moule PDMS
Lorsque vous placez la vitre sur le disque vinyle, évitez de créer des espaces d’air. Ces espaces peuvent entraîner une épaisseur inégale ou des défauts de surface. Les bulles, si elles sont présentes, peuvent être détectées visuellement. En pressant la vitre d’un côté à l’autre, on déplace l’air, ce qui minimise la formation de bulles et garantit une épaisseur de moule uniforme illustrée à la figure 4A.
Utilisation de tampons gélifiés canalisés pour une orientation fine de C. elegans
Les coussinets de gélose canalisés permettent une orientation précise de C. elegans. Nous définissons l’orientation de l’animal en roulant légèrement l’animal avec un pic en fil de platine, tout en vérifiant l’orientation à l’aide de repères, tels que la vulve ou l’intestin en forme de S (Figure 5A,C). Nous confirmons l’orientation sous un microscope de dissection fluorescent avant de transférer les animaux dans un microscope inversé illustré à la figure 5B,D.
Évaluation de la régénération des fibres neuronales à l’aide de coussinets gélifiés canalisés
Les coussinets de gélose canalisés améliorent la qualité d’imagerie de la régénération neuronale en orientant de manière optimale l’animal. Le positionnement des fibres neuronales régénérées plus près de la lentille de l’objectif réduit la diffusion et l’absorption de la lumière, améliorant ainsi la clarté de l’image. Les figures 5E, F montrent que le fait de rapprocher le site de régénération de l’objectif améliore la qualité de l’imagerie, facilitant une analyse plus précise de la repousse neuronale.
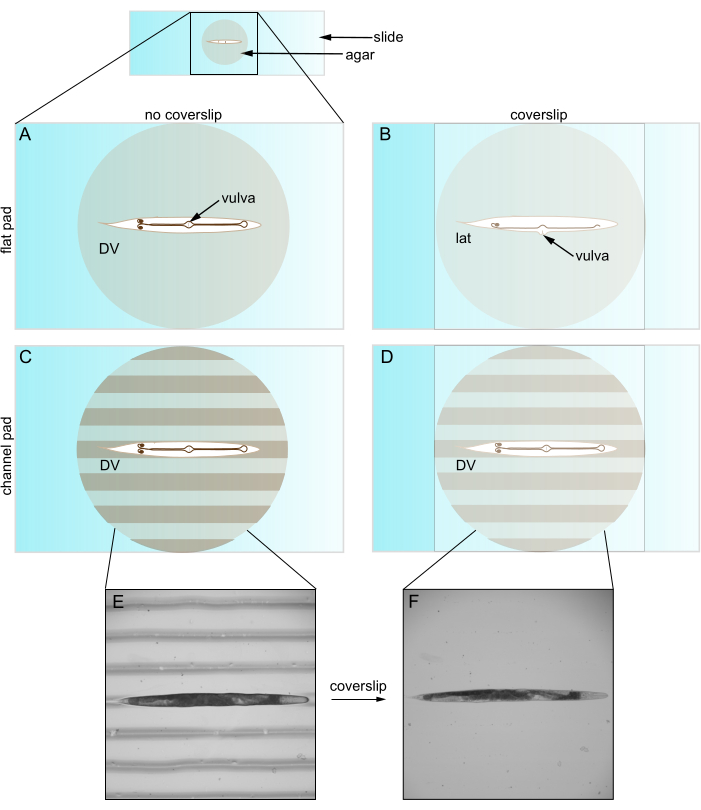
Figure 1 : Caenorhabditis elegans sur des coussinets plats et canalisés. (A) Animal sur un tampon gélosé plat en orientation DV ; Couvre-visage de la vulve. (B) L’introduction de la lamelle pousse la vulve sur le côté, forçant l’animal à s’orienter latéralement. (C) Animal sur une plaque de gélose canalisée en orientation DV. (D) L’animal reste en orientation DV après l’introduction de la lamelle. (E) Image en fond clair d’un mutant au rouleau sur une plaque de gélose canalisée en orientation DV. (F) Image en fond clair avec lamelle, le même animal que E reste en orientation DV. Abréviations : DV = dorsale-ventrale ; lat = latéral. Veuillez cliquer ici pour voir une version agrandie de cette figure.
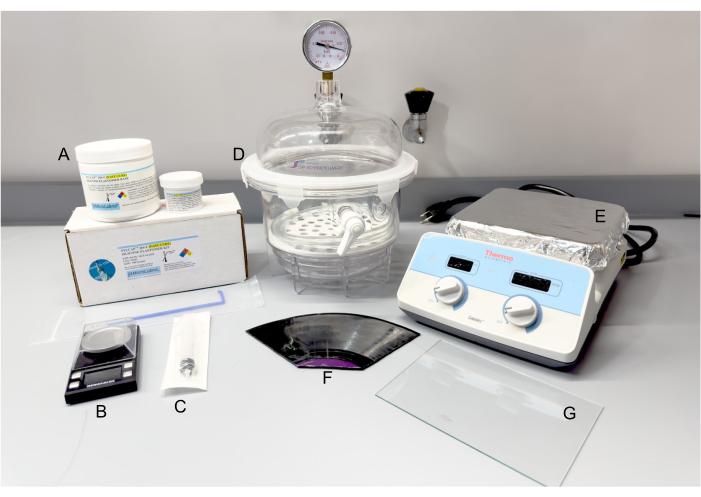
Figure 2 : Matériaux et équipements pour la fabrication de PDMS. (A) Kit d’élastomère de silicone SYLCAP 284-F. (B) Échelle. (C) Seringue en plastique. (D) Dessiccateur sous vide. (E) Plaque chauffante. (F) Disque vinyle longue durée de 12 pouces, démontable au besoin. (G) Vitre. Abréviation : PDMS = polydiméthylsiloxane. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Mélange et mise sous vide de PDMS non polymérisés. (A) Mélangez la base et l’agent de durcissement dans le plateau. (B) Placez le plateau dans une chambre à vide. (C) Passez l’aspirateur trois fois pour permettre aux bulles de faire surface. (D) Au bout d’une heure, la plupart des bulles ont éclaté. Notez une transmission améliorée grâce au PDMS. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Introduction d’une vitre dans un PDMS non polymérisé sans bulles. (A) Introduction de la vitre sur le disque vinyle sans bulles. (B) Moule PDMS solidifié retiré du disque, avec des canaux de détail encastrés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
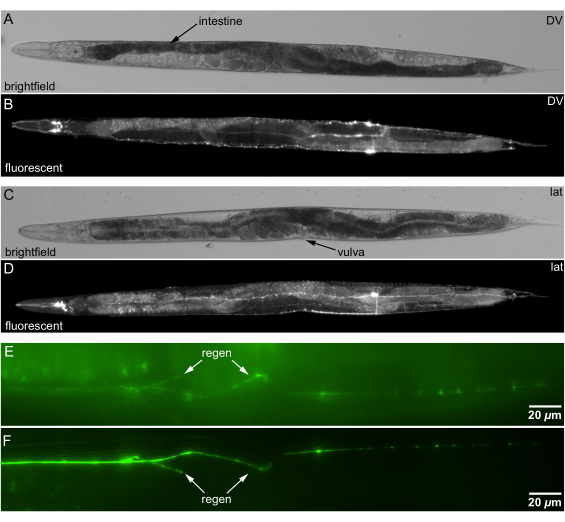
Figure 5 : Images en fond clair et en fluorescence de C. elegans montées sur gélose canalisée. (A) Image en fond clair d’un animal en orientation DV bilatérale. Repère anatomique pour l’orientation DV : intestin en forme de S en spirale (tissu plus foncé indiqué par une flèche) traversant la ligne médiane ~60 % de la distance entre le nez et la queue. (B) Image de fluorescence des neurones en orientation DV, même animal que A. (C) Image en fond clair d’un animal en orientation latérale. Repère anatomique pour l’orientation latérale : vulve tournée vers le côté. (D) Image de fluorescence des neurones en orientation latérale, même animal que C. (E) Orientation avec régénération (flèche) dans le côté plus profond (éloigné) d’un animal. (F) Orientation avec régénération chez l’animal du côté moins profond plus proche de l’objectif ; Régénération plus claire (flèche). Barres d’échelle = 20 μm. Abréviations : DV = dorsale-ventrale ; lat = latéral. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le principal avantage des tampons gélosés canalisés est leur capacité à maintenir l’orientation des animaux pour l’imagerie. Les canaux s’adaptent aux animaux adultes, permettant une rotation contrôlée qui est maintenue lors de l’introduction de la lamelle. Nous avons réussi à imager des animaux de type sauvage, de type roller, et dumpy. Nous orientons correctement les animaux à l’aide de repères anatomiques, ce qui permet l’imagerie et la comparaison de plusieurs structures dans un seul champ de vision et rapproche les cellules cibles de la surface. En particulier, cette rotation facilite la visualisation dans le dos ou le ventral (vues bilatérales), ce qui permet de comparer le côté gauche et le côté droit de l’animal.
Auparavant, la visualisation et la comparaison de ces structures bilatérales nécessitaient des empilements en Z 3D et une normalisation potentielle des signaux pour tenir compte d’une transmission réduite à de plus grandes profondeurs. Ainsi, l’orientation définie permise par la gélose canalisée permet une imagerie plus cohérente sur plusieurs vers et devrait permettre de meilleures mesures. Ceci est particulièrement utile pour l’évaluation postopératoire des fibres neuronales régénérées, qui peuvent se développer dans des directions difficiles à imager, telles que la circonférence2.
De plus, la gélose canalisée réduit le stress des animaux car ils sont placés dans une dépression qui atténue la pression de la lamelle et favorise une physiologie normale5. Bien que les souches flasques puissent se tordre pendant le montage, les canaux encouragent une configuration linéaire de l’animal et la rotation de l’ensemble de l’animal. Dans une mise en œuvre différente, la structuration peut également contraindre le mouvement de l’animal pour réduire la quantité d’anesthésique nécessaire pour imager ou observer l’animal8.
Enfin, la technique de la gélose canalisée est également très accessible. Après la fabrication du moule, la création de tampons de gélose canalisés nécessite à peu près le même temps, le même savoir-faire et le même coût que la fabrication de tampons de gélose plats ordinaires. Tous les composants nécessaires à la création du moule PDMS sont communs à de nombreux laboratoires universitaires ou achetés en ligne. La durabilité des moules PDMS en fait une option rentable pour les laboratoires, capable de résister à une utilisation intensive au fil du temps. Les moules PDMS peuvent durer des années et des centaines d’utilisations. Nous continuons à utiliser un moule de 17 ans avec une dégradation modérée. Nous vous recommandons de conserver les moules à température ambiante dans un récipient pour les garder exempts de débris, qui peuvent être lavés avec de l’eau déminéralisée si nécessaire.
Malgré ces avantages, il existe plusieurs limitations associées à notre technique. La force de la pioche utilisée pour placer les animaux sur le tampon peut déformer les canaux, affectant potentiellement le positionnement de l’animal. Comme pour toute manipulation fine, le positionnement et la rotation de l’animal dans l’orientation souhaitée peuvent prendre beaucoup de temps, ce qui augmente l’exposition de l’animal à l’anesthésique et induit potentiellement du stress. Les canaux peuvent également piéger l’air et former des bulles lors de la mise en place de la lamelle, ce qui peut interférer avec la clarté de l’image en diffusant la lumière. Nous discutons des moyens de minimiser les bulles dans le protocole. Notre expérience indique que la plupart des inconvénients de la gélose canalisée sont largement évités par un minimum de formation et de pratique.
Les orientations futures pour l’optimisation de ces canaux comprennent l’élaboration de conceptions adaptées à des besoins expérimentaux spécifiques, y compris différentes tailles et formes pour différents âges et phénotypes de C. elegans. La fabrication de canaux personnalisés par nanofabrication10 peut réduire l’impact physiologique sur les animaux par rapport aux canaux génériques5. En conclusion, la mise en œuvre de tampons gélosés canalisés permet d’imager à haute résolution des structures obscures chez les animaux plus âgés. Ces coussinets maintiennent l’orientation de C. elegans, ce qui permet d’améliorer la qualité de l’imagerie et la visualisation détaillée, tout en réduisant le stress sur les animaux en raison de la structure de soutien des canaux.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Le financement a été fourni par le NIH R56NS128413. Nous remercions Noah Joseph (Département de bio-ingénierie du Nord-Est) pour son aide dans le traitement des disques vinyles. Nous remercions les membres du laboratoire Chung pour leurs commentaires perspicaces sur le manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Corning | 4980-125 | |
| 33 1/2 RPM or 12-inch long playing (LP) vinyl record | N/A | N/A | Individual channel depth: 50 µm, width: 200 µm |
| 30 mL plastic syringe | Fisher Scientific | 50-793-817 | |
| 90% Platinum, 10% Iridium Wire | Tritech Research | PT-9010 | used to create platinum pick |
| aluminum foil | Amazon | N/A | |
| Calcium chloride | Fisher Scientific | AAL131910B | |
| glass pane | N/A | N/A | 7 in x 5 in glass pane taken from frame |
| glass pipette | Fisher Scientific | 13-678-20A | used to create platinum pick |
| hot plate | Thermofisher | SP88857104 | |
| Magnesium Sulfate | Fisher Scientific | AA3333736 | |
| microscope slides | Mckesson | 938360 | |
| molecular biology grade agar | Benchmark Scientific | A1705 | |
| Potassium Phosphate dibasic | Fisher Scientific | P290-500 | |
| Potassium Phosphate monobasic | Fisher Scientific | P285-500 | |
| Sodium Azide | Fisher Scientific | AAJ2161022 | |
| Sodium Chloride | Fisher Scientific | BP358-212 | |
| square cover glass | Fisher Scientific | 12-541-016 | |
| SYLCAP 284-F (Fast Cure) Silicone Elastomer Encapsulant Kit, Transparent, Optically Clear, 10:1 Mix, 500 Gm/ML (0.5 Kg), Faster Than Sylgard 184 and Similar | MicroLubrol | N/A | |
| vacuum desiccator | Fisher Scientific | 08-648-100 | |
| weighing dish | Fisher Scientific | 01-549-750 |
Références
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Bargmann, C. I., Avery, L. Laser killing of cells in Caenorhabditis elegans. Methods Cell Biol. 48, 225-250 (1995).
- Zhang, M., et al. A self-regulating feed-forward circuit controlling C-elegans egg-laying behavior. Curr Biol. 18 (19), 1445-1455 (2008).
- Chung, S. H., Mazur, E. Femtosecond laser ablation of neurons in C. elegans for behavioral studies. Appl Phys A-Mater Sci Process. 96 (2), 335-341 (2009).
- Zellag, R. M., et al. CentTracker: a trainable, machine-learning-based tool for large-scale analyses of Caenorhabditis elegans germline stem cell mitosis. Mol Biol Cell. 32 (9), 915-930 (2021).
- Huang, Y. C., et al. A single neuron in C. elegans orchestrates multiple motor outputs through parallel modes of transmission. Curr Biol. 33 (20), 4430-4445.e6 (2023).
- Rasmussen, N. R., Dickinson, D. J., Reiner, D. J. Ras-dependent cell fate decisions are reinforced by the RAP-1 small GTPase in Caenorhabditis elegans. Genetics. 210 (4), 1339-1354 (2018).
- Rivera Gomez, K., Schvarzstein, M. Immobilization of nematodes for live imaging using an agarose pad produced with a vinyl record. MicroPubl Biol. 2018, (2018).
- Chung, S. H., Clark, D. A., Gabel, C. V., Mazur, E., Samuel, A. D. T. The role of the AFD neuron in C. elegans thermotaxis analyzed using femtosecond laser ablation. BMC Neuroscience. 7 (1), 30(2006).
- Gerhold Abigail, R., et al. Investigating the regulation of stem and progenitor cell mitotic progression by in situ imaging. Curr Biol. 25 (9), 1123-1134 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon