Method Article
Тонкая корректировка ориентации Caenorhabditis elegans на канальных агаровых подушечках для визуализации нейрорегенерации
В этой статье
Резюме
Здесь мы представляем протокол изготовления канальных агаровых прокладок с использованием пресс-форм PDMS, созданных из виниловых пластинок. Каналы позволяют пользователям точно ориентировать Caenorhabditis elegans для улучшения контраста изображения и облегчения сравнения структур. Эти возможности особенно полезны в исследованиях нейрорегенерации.
Аннотация
Caenorhabditis elegans является модельным организмом, широко используемым для изучения биологических процессов. Его прозрачность и небольшой размер делают его идеальным для визуализации тканей, клеток и субклеточных структур. Традиционные плоские агаровые подушечки для визуализации C. elegans ограничивают контроль над ориентацией животного, ограничивая взгляд в первую очередь боковыми перспективами. Это ограничение затрудняет визуализацию дорсально-вентральных структур и снижает четкость изображения, особенно у пожилых животных с повышенной пигментацией и большими диаметрами. Чтобы преодолеть эти проблемы, мы разработали канальные агарозные подушечки, которые позволяют точно контролировать ориентацию животного. Эти каналы позволяют исследователям вращать и фиксировать C. elegans в заданных положениях, облегчая одновременную визуализацию нескольких структур и улучшая разрешение изображения, приближая клетки-мишени к объекту микроскопа. Это особенно полезно для визуализации регенерированных нейронных волокон после операции, которые могут расти в направлениях, которые трудно захватить с помощью традиционных плоских агаровых подушечек. Этот метод доступен, так как для изготовления канальных агаровых прокладок требуется столько же времени и материалов, сколько и для плоских прокладок, что делает его практичным вариантом для большинства лабораторий.
Введение
Нематода Caenorhabditis elegans (C. elegans) является широко используемым модельным организмом для изучения биологических процессов, таких как развитие и поведение, благодаря своей сильно консервативной генетике с аналогами млекопитающих. Исследователи выращивают C. elegans на планшете с нематодой для роста (NGM) в строго контролируемой среде, которая стандартизирует экспериментальные условия и позволяет более точно соотносить результаты с экспериментальными переменными. Животное прозрачное, что позволяет четко визуализировать ткани, клетки и субклеточные структуры. C. elegans небольшие, взрослые животные имеют длину ~1 мм и диаметр 80 мкм, что позволяет разместить несколько животных на одном стенде для визуализации1. Их небольшой размер также позволяет на одном изображении захватывать весь организм, разрешая при этом отдельные клетки, что имеет решающее значение для визуализации регенерации нейронных волокон. Синергетические с этими преимуществами для микроскопии, быстрое развитие, стереотипная анатомия и легкая генетика C. elegans позволяют проводить крупномасштабные исследования1.
Типичная процедура визуализации клеток C. elegans была разработана несколько десятилетий назад и в значительной степени осталась неизменной. Исследователи используют плоские агаровые подушечки на предметных стеклах для крепления и обездвиживания животных для визуализации их клеток2. Покровная крышка в верхней части подушечки удерживает животных на месте и защищает линзу микроскопа. Важно отметить, что покровное стекло имеет высокий показатель преломления, который увеличивает числовую апертуру захваченного света и улучшает разрешение изображения. Кроме того, покровное стекло снижает искажения светопропускания. Таким образом, покровное стекло улучшает визуализацию целевых клеток и структур.
Однако при использовании с покровным стеклом плоские агаровые подушечки часто ограничивают ориентацию животного. C. elegans изгибаются вдоль спинно-вентрального (DV) направления, поэтому они принимают боковую ориентацию на плоской агаровой подушечке. Тем не менее, даже после обездвиживания, выпрямления и предварительного поворота в положение DV, размещение покровного стекла возвращает почти всех животных в боковой вид (Рисунок 1). Мы считаем, что эта переориентация происходит из-за того, что покровная крышка отодвигает выступающую вульву C. elegans в сторону. Молодые животные без вульвы ориентированы более случайно. Этот ограниченный контроль над ориентацией проблематичен, по крайней мере, по двум причинам. Во-первых, он может не позволять разместить две структуры в одном поле зрения (например, двустороннее), что усложняет их сравнение. Во-вторых, установка ориентации важна для оптимизации качества изображения, поскольку интересующие структуры обычно лучше всего визуализируются, когда они находятся близко к объекту. Это связано с тем, что объективы получают изображение на ограниченной глубине в образце (т. е. на рабочем расстоянии), а также с тем, что свет из более глубоких мест больше рассеивается и поглощается.
Для C. elegans ограниченный контроль над ориентацией, как правило, более серьезен у пожилых животных. Животные в возрасте от L1 до L4 меньше в диаметре, что делает визуализацию большей части червя. Эти личинки также имеют меньшую пигментацию, что приводит к снижению поглощения видимого света и рассеянию фотонов, что улучшает четкость изображения и разрешение. И наоборот, взрослые животные имеют больший диаметр и большую пигментацию, что создает проблемы для визуализации в более глубоких z-плоскостях, поскольку покровное стекло влияет на первоначальную ориентацию.
В 2008 году мы внедрили стратегию с использованием агаровых прокладок с каналами для преодоления этих проблем за счет сохранения ориентации животных 3,4. Как описано ниже, пользователи поворачивают обездвиженных животных в каналах в нужную ориентацию, отмечая анатомические ориентиры. Каналы удерживают животных в углублениях между возвышенными поверхностями агара, сводя к минимуму усилие на животное при размещении покровного стекла и исключая вращение животного. Поскольку изготовление канальных и обычных плоских контактных площадок происходит по одной и той же процедуре и требует одинакового времени, наша технология очень доступна. Многие лаборатории используют нашу методику для иммобилизации C. elegans для изучения анатомических особенностей, наблюдения за развитием и анализа вклада нейронов в поведение 5,6,7,8. В следующем разделе описывается весь процесс изготовления канального агара, начиная с виниловой пластинки, которая разрезается на четвертинки с помощью горячего ножа. Во-первых, мы опишем изготовление формы из полидиметилсилоксана (PDMS), используемой для литья канального агара. Затем мы покажем, как шаг за шагом изготовить канальный агар. Ожидается, что вся процедура займет 3 часа без специальных знаний. В соответствии с процедурой изготовления PDMS, изготовление прокладок, изготовленных с помощью пресс-формы, займет столько же времени, сколько и изготовление обычных агаровых прокладок (несколько минут).
протокол
1. Подготовка полидиметилсилоксана (PDMS) к изготовлению
- Вылейте в одноразовую весовую чашку средство быстрого отверждения в соотношении 1:10 к основанию. Перемешивайте неотвержденную жидкость в течение 45 с, пока жидкость полностью не смешается и не заполнится пузырьками.
- Поместите лоток в вакуумный эксикатор под наклоном. Установите давление в диапазоне от -0,09 до -0,1 кПа 3x, чтобы пузырьки воздуха вышли на поверхность.
- Держите вакуум включенным в течение часа в диапазоне давления от -0,09 до -0,1 кПа, пока не останется несколько видимых пузырьков, которые можно удалить вручную.
2. Изготовление PDMS пресс-формы для виниловой пластинки
- Промойте виниловую пластинку и стеклянную пластину деионизированной (DI) водой. Убедитесь в отсутствии пыли для получения наилучшей формы. Дайте виниловой пластинке высохнуть на воздухе до использования.
- Положите лист алюминиевой фольги поверх горячей плиты, чтобы собрать излишки PDMS.
- Поместите стеклянное стекло на каждый конец виниловой пластинки, чтобы установить толщину формы на ширину стеклянных стекол. Это обеспечивает равномерную высоту при нажатии стекла на неотвержденный PDMS.
- Вылейте неотвержденную жидкость PDMS на одну сторону виниловой пластинки.
- Наблюдайте за пузырьками, отражающимися от поверхности жидкости, и удаляйте их с помощью наконечника для дозатора. Наклоните стеклянную пластину и медленно опустите пластину вниз, позволяя воздуху выходить, предотвращая попадание пузырьков.
- Отверждите PDMS при 80 °C в течение 35 минут.
- Снимите виниловую пластинку с горячей плиты и дайте ей остыть. Осторожно снимите PDMS с виниловой пластинки, чтобы не порвать.
- Используйте новое предметное стекло в качестве ориентира, чтобы разрезать PDMS острой бритвой, чтобы создать форму с каналами из агара.
3. Изготовление канальных агаровых прокладок с NaN3
ПРИМЕЧАНИЕ: Порядок и материалы для плоских агаровых прокладок были ранее установлены9. Эта процедура очень похожа.
- Добавьте в колбу 0,6 г агара и 30мл жидкого бульона NGM 9 бульона. Добавьте мешалку и нагрейте на горячей плите до 120 °C.
- Добавьте 120 мкл материала NaN3 (концентрация 1 М стока) после того, как гель расплавится.
- Промойте форму PDMS водой и дайте ей высохнуть на воздухе. Поместите форму PDMS между двумя наборами пар слайдов.
- Пипеткой агаром вверх и вниз прогрейте кончик пипетки. Нанесите 300 мкл расплавленного агара на форму PDMS, вручную распределяя агар по каналам, так как размещение предметного стекла распределит агар по каналам.
- Поместите предметное стекло микроскопа прямо на агар, опираясь на предметные стекла по бокам. Снимите предметное стекло после того, как агар остынет.
4. Монтаж C. elegans
- Как только предметные стекла остынут, снимите предметное стекло прямо с формы без резки.
- Перемещение животных в каналы после того, как они будут обездвижены NaN3
- Поверните животных в нужное положение.
- Положите на подушечку покровный листок. Наклоните подушку и слегка надавливайте с одной стороны на другую, чтобы вытолкнуть воздух в сторону и избежать образования пузырей.
Результаты
Изготовление пресс-формы PDMS
Циклическое давление вакуума во время изготовления пресс-формы прокалывает и удаляет пузырьки воздуха из неотвержденной PDMS, обеспечивая отсутствие пузырьков в пресс-форме. Как показано на рисунке 3D , пузырьки поднимаются на поверхность и прокалываются. Формы без пузырей могут образовывать чистые каналы.
Затвердевание пресс-формы PDMS
При размещении стекла на виниловой пластинке избегайте образования воздушных зазоров. Эти зазоры могут привести к неравномерной толщине или поверхностным дефектам. Пузыри, если они присутствуют, могут быть обнаружены визуально. Нажатие на стекло с одной стороны на другую вытесняет воздух, сводя к минимуму образование пузырьков и обеспечивая равномерную толщину формы, показанную на рисунке 4A.
Использование канальных агаровых подушечек для точной ориентации C. elegans
Канальные агаровые подушечки позволяют точно ориентировать C. elegans. Мы устанавливаем ориентацию животного, слегка перекатывая животное платиновой проволокой, проверяя ориентацию с помощью ориентиров, таких как вульва или S-образный кишечник (рис. 5A, C). Мы подтверждаем ориентацию под флуоресцентным препарирующим микроскопом перед переводом животных в инвертированный микроскоп, показанный на рисунке 5B, D.
Оценка регенерации нейронных волокон с помощью канальных агаровых подушечек
Канальные агаровые подушечки улучшают качество визуализации регенерации нейронов за счет оптимальной ориентации животного. Расположение регенерированных нейронных волокон ближе к линзе объектива снижает рассеивание и поглощение света, повышая четкость изображения. Рисунки 5E, F показывают, что размещение сайта регенерации ближе к объективу улучшает качество визуализации, способствуя более точному анализу восстановления нейронов.
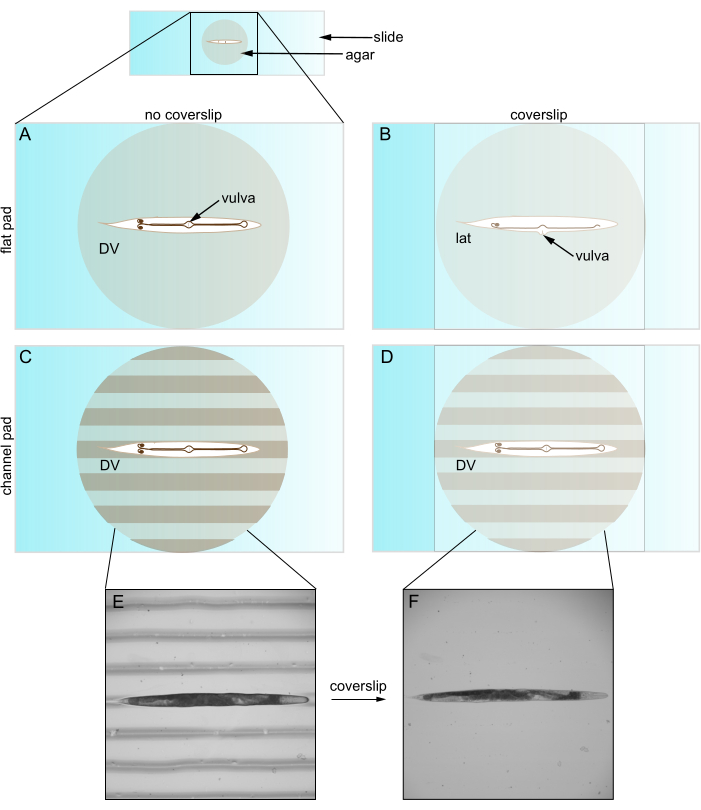
Рисунок 1: Caenorhabditis elegans на плоских и канальных подушечках. (А) Животное на плоской агаровой подушке в ориентации DV; Лица вульвы. (B) Введение покровного стекла отодвигает вульву в сторону, заставляя животное ориентироваться на бок. (C) Животное на канальном агаровом подушечке в ориентации DV. (D) Животное остается в ориентации DV после введения покровного стекла. (E) Светлопольное изображение роллера-мутанта на канальной агаровой прокладке в DV-ориентации. (F) Светлопольное изображение с покровным листом, то же животное, что и E , остается в ориентации DV. Сокращения: DV = дорсально-вентральный; lat = боковой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
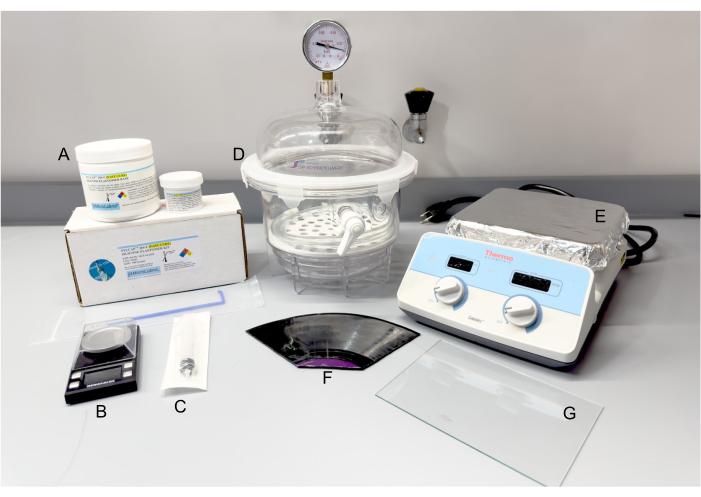
Рисунок 2: Материалы и оборудование для изготовления PDMS. (A) Комплект силиконовых эластомеров SYLCAP 284-F. (b) Масштаб. (С) Пластиковый шприц. (D) Вакуумный эксикатор. (E) Конфорка. (F) 12-дюймовая долгоиграющая виниловая пластинка, разломанная по мере необходимости. (G) Стеклопакет. Сокращение: PDMS = полидиметилсилоксан. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Смешивание и вакуумирование неотвержденного PDMS. (A) Смешайте основу и отвердитель в лотке. (B) Поместите лоток в вакуумную камеру. (C) Трижды запустите цикл вакуума, чтобы пузырьки всплыли на поверхность. (D) Через час лопнуло большинство пузырей. Обратите внимание на улучшенную передачу через PDMS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Введение стеклянного стекла в неотвержденный PDMS без пузырьков. (А) Введение стекла на виниловую пластинку без пузырей. (B) Затвердевшая пресс-форма PDMS, удаленная из пластинки, со вставными каналами для детализации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
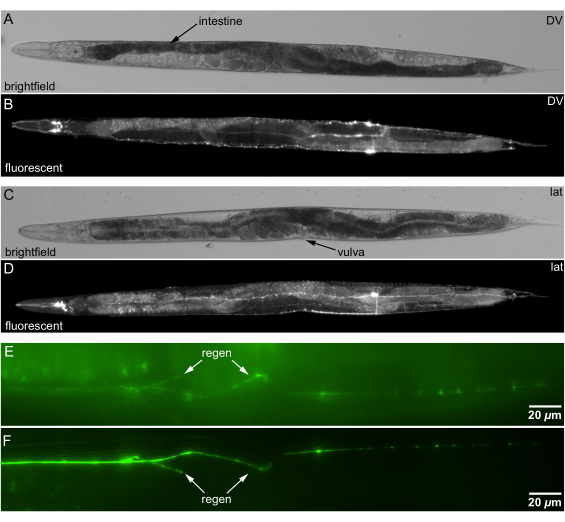
Рисунок 5: Светлопольные и флуоресцентные изображения C. elegans , установленные на канальном агаре. (A) Светлопольное изображение животного в двусторонней DV-ориентации. Анатомический ориентир для ориентации DV: спиралевидная S-образная кишка (более темная ткань обозначена стрелкой), пересекающая среднюю линию ~60% расстояния от носа до хвоста. (B) Флуоресцентное изображение нейронов в ориентации DV, то же животное, что и A. (C) Светлопольное изображение животного в широтной ориентации. Анатомический ориентир для ориентации широчайших: вульва обращена боком. (D) Флуоресцентное изображение нейронов в широчайшей ориентации, то же животное, что и C. (Д) Ориентация с регенерацией (стрелкой) в более глубокую (дальнюю) сторону животного. (F) Ориентация с регенерацией у более мелкого бокового животного ближе к цели; очиститель регенерации (стрелка). Масштабные линейки = 20 μм. Сокращения: DV = дорсально-вентральный; lat = боковой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Основным преимуществом канальных агаровых подушечек является их способность сохранять ориентацию животных для визуализации. Каналы подходят для взрослых животных, обеспечивая контролируемое вращение, которое сохраняется при введении покровного стекла. Мы успешно визуализировали диких животных, сизоворонок и самородьев. Мы правильно ориентируем животных по анатомическим ориентирам, что позволяет визуализировать и сравнивать множественные структуры в одном поле зрения и приближает клетки-мишени к поверхности. В частности, такое вращение облегчает визуализацию в дорсальном или вентральном (двустороннем видении), что позволяет сравнивать левую и правую сторону животного.
Ранее для визуализации и сравнения этих двусторонних структур требовались 3D-z-стеки и потенциальная нормализация сигналов, чтобы учесть снижение передачи на больших глубинах. Таким образом, определенная ориентация, обеспечиваемая канальным агаром, позволяет получить более согласованную визуализацию на нескольких червях и должна обеспечить более качественные измерения. Это особенно полезно для послеоперационной оценки регенерированных нейронных волокон, которые могут расти в направлениях, которые трудно визуализировать, например, в окружности2.
Кроме того, канальный агар снижает стресс у животных, поскольку они помещаются в углубление, которое снижает давление покровного скольжения и способствует нормальной физиологии5. В то время как вялые штаммы могут скручиваться во время верховой езды, каналы способствуют линейной конфигурации животного и вращению всего животного. В другой реализации моделирование может также ограничивать движения животного, чтобы уменьшить количество анестетика, необходимого для визуализации или наблюдения за животным8.
Наконец, техника канального агара также очень доступна. После изготовления пресс-формы создание канальных агаровых прокладок требует примерно столько же времени, знаний и затрат, сколько и изготовление обычных плоских агаровых прокладок. Все компоненты, необходимые для создания пресс-формы PDMS, являются общими для многих академических лабораторий или приобретаются в Интернете. Долговечность пресс-форм PDMS делает их экономичным вариантом для лабораторий, способным выдерживать интенсивное использование в течение долгого времени. Пресс-формы PDMS могут прослужить годы и сотни использований. Мы продолжаем использовать плесень 17-летней давности с умеренной деградацией. Мы рекомендуем хранить формы при комнатной температуре в контейнере, чтобы на них не было мусора, который при необходимости можно смыть деионизированной водой.
Несмотря на эти преимущества, есть несколько ограничений, связанных с нашей методикой. Сила кирки, используемой для размещения животных на площадке, может деформировать каналы, что может повлиять на положение животного. Как и при любых тонких манипуляциях, позиционирование и вращение животного в нужной ориентации может занять много времени, что увеличивает воздействие анестетика на животное и потенциально вызывает стресс. Каналы также могут задерживать воздух и образовывать пузыри во время размещения покровного стекла, которые могут мешать четкости изображения из-за рассеивания света. Обсуждаем способы минимизации пузырей в протоколе. Наш опыт показывает, что большинство недостатков канального агара в значительной степени устраняются благодаря небольшому обучению и практике.
Будущие направления оптимизации этих каналов включают разработку конструкций, адаптированных к конкретным экспериментальным потребностям, включая различные размеры и формы для разных возрастов и фенотипов C. elegans. Изготовление каналов индивидуальных размеров с помощью нанопроизводства10 может снизить физиологическое воздействие на животных по сравнению с обычными каналами5. В заключение следует отметить, что использование канальных агаровых подушечек позволяет получать изображения неясных структур с высоким разрешением у старых животных. Эти подушечки сохраняют ориентацию C. elegans, что приводит к улучшению качества изображения и детальной визуализации, одновременно снижая нагрузку на животных благодаря поддерживающей структуре каналов.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Финансирование было предоставлено NIH R56NS128413. Выражаем благодарность Ноа Джозефу (Noah Joseph) (Северо-восточный отдел биоинженерии) за помощь в обработке виниловых пластинок. Мы благодарим сотрудников лаборатории Чунг за проницательные комментарии к рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 125 mL Erlenmeyer flask | Corning | 4980-125 | |
| 33 1/2 RPM or 12-inch long playing (LP) vinyl record | N/A | N/A | Individual channel depth: 50 µm, width: 200 µm |
| 30 mL plastic syringe | Fisher Scientific | 50-793-817 | |
| 90% Platinum, 10% Iridium Wire | Tritech Research | PT-9010 | used to create platinum pick |
| aluminum foil | Amazon | N/A | |
| Calcium chloride | Fisher Scientific | AAL131910B | |
| glass pane | N/A | N/A | 7 in x 5 in glass pane taken from frame |
| glass pipette | Fisher Scientific | 13-678-20A | used to create platinum pick |
| hot plate | Thermofisher | SP88857104 | |
| Magnesium Sulfate | Fisher Scientific | AA3333736 | |
| microscope slides | Mckesson | 938360 | |
| molecular biology grade agar | Benchmark Scientific | A1705 | |
| Potassium Phosphate dibasic | Fisher Scientific | P290-500 | |
| Potassium Phosphate monobasic | Fisher Scientific | P285-500 | |
| Sodium Azide | Fisher Scientific | AAJ2161022 | |
| Sodium Chloride | Fisher Scientific | BP358-212 | |
| square cover glass | Fisher Scientific | 12-541-016 | |
| SYLCAP 284-F (Fast Cure) Silicone Elastomer Encapsulant Kit, Transparent, Optically Clear, 10:1 Mix, 500 Gm/ML (0.5 Kg), Faster Than Sylgard 184 and Similar | MicroLubrol | N/A | |
| vacuum desiccator | Fisher Scientific | 08-648-100 | |
| weighing dish | Fisher Scientific | 01-549-750 |
Ссылки
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Bargmann, C. I., Avery, L. Laser killing of cells in Caenorhabditis elegans. Methods Cell Biol. 48, 225-250 (1995).
- Zhang, M., et al. A self-regulating feed-forward circuit controlling C-elegans egg-laying behavior. Curr Biol. 18 (19), 1445-1455 (2008).
- Chung, S. H., Mazur, E. Femtosecond laser ablation of neurons in C. elegans for behavioral studies. Appl Phys A-Mater Sci Process. 96 (2), 335-341 (2009).
- Zellag, R. M., et al. CentTracker: a trainable, machine-learning-based tool for large-scale analyses of Caenorhabditis elegans germline stem cell mitosis. Mol Biol Cell. 32 (9), 915-930 (2021).
- Huang, Y. C., et al. A single neuron in C. elegans orchestrates multiple motor outputs through parallel modes of transmission. Curr Biol. 33 (20), 4430-4445.e6 (2023).
- Rasmussen, N. R., Dickinson, D. J., Reiner, D. J. Ras-dependent cell fate decisions are reinforced by the RAP-1 small GTPase in Caenorhabditis elegans. Genetics. 210 (4), 1339-1354 (2018).
- Rivera Gomez, K., Schvarzstein, M. Immobilization of nematodes for live imaging using an agarose pad produced with a vinyl record. MicroPubl Biol. 2018, (2018).
- Chung, S. H., Clark, D. A., Gabel, C. V., Mazur, E., Samuel, A. D. T. The role of the AFD neuron in C. elegans thermotaxis analyzed using femtosecond laser ablation. BMC Neuroscience. 7 (1), 30(2006).
- Gerhold Abigail, R., et al. Investigating the regulation of stem and progenitor cell mitotic progression by in situ imaging. Curr Biol. 25 (9), 1123-1134 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены