A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تنقية والتخيل من الأنفلونزا من المجمعات بروتين نووي ريبوزي الفيروسية
In This Article
Summary
جينوم فيروس الأنفلونزا يتكون من ثمانية مجمعات منفصلة من الحمض النووي الريبي والبروتينات ، ووصف المجمعات بروتين نووي ريبوزي الفيروسي (vRNPs). وتصف هذه الورقة تنقية التدرج الجلسرين والتصور انتقال المجهر الإلكتروني من vRNPs الأنفلونزا.
Abstract
الأنفلونزا A الجينوم الفيروسي يتكون من ثمانية وبالمعنى السلبي ، واحد الذين تقطعت بهم السبل جزيئات الحمض النووي الريبي ، ومعبأة بشكل فردي مع نسخ متعددة من الأنفلونزا من البروتين النووي (NP) في جزيئات ribonulceoprotein الفيروسي (vRNPs). يتم تضمين vRNPs الأنفلونزا داخل المغلف الفيروسية. أثناء دخول الخلية ، ومع ذلك ، يتم الافراج هذه المجمعات vRNP إلى السيتوبلازم ، حيث تمكنوا من الوصول إلى آليات النقل المضيف النووية. من أجل دراسة استيراد النووية vRNPs الأنفلونزا وتكرار للجينوم الإنفلونزا ، فإنه من المفيد للعمل مع vRNPs معزولة بحيث المكونات الأخرى للفيروس لا تتدخل في هذه العمليات. هنا ، نحن وصف الإجراء لتنقية هذه vRNPs من الأنفلونزا من الفيروس. الإجراء يبدأ اضطراب الأنفلونزا A الفيريون مع المنظفات من أجل الافراج عن مجمعات vRNP من الفيريون يلفها. ثم يتم فصل vRNPs من المكونات الأخرى للأنفلونزا الفيريون على التدرج الجلسرين متقطع 33-70 ٪ من سرعة الترسيب. ثم يتم تحليل هذه الكسور التي تم الحصول عليها من الجلسرين على التدرج عبر SDS - PAGE بعد التلوين باللون الأزرق Coomassie. ثم يتم تجميع الكسور التي تحتوي على NP الذروة معا وتتركز بواسطة الطرد المركزي. بعد الاعتقال ، ويتم التحقق من سلامة vRNPs التي تصور من vRNPs بواسطة المجهر الإلكتروني انتقال بعد تلطيخ السلبية. تنقية التدرج الجلسرين هو تعديل ذلك من Kemler
Protocol
الجزء 1 : انقطاع من الأنفلونزا من الفيريون
- إضافة 750 ميكرولتر من MNT العازلة (20 ملي زارة التربية والعلم ، 150 مم كلوريد الصوديوم ، و 30 ملي تريس ، ودرجة الحموضة 7.5) في واحدة بيكمان أنبوب الطرد المركزي البولي (11 ملم × 34 ملم) مصممة لتناسب دوار TLA 120.2 - لاستخدامها في أوبتيما بيكمان ماكس - E نابذة فائقة السرعة.
- إضافة 500 ميكرولتر من فيروس الانفلونزا (H3N2 X - 31 A/AICHI/68 سلالة ؛ 2 ملغ / مل) إلى أن الأنبوب. مزيج الفيروس مع العازلة التي MNT pipetting صعودا وهبوطا عدة مرات.
- أجهزة الطرد المركزي لمدة 10 دقيقة في XG 109000 ، 4 درجات مئوية ، في جهاز للطرد المركزي ماكس بيكمان - E أوبتيما باستخدام الدوار TLA - 120.2.
- إزالة طاف ، وresuspend وبيليه في 500 العازلة تعطل ميكرولتر (100 ملي بوكل ، 5 ملي MgCl 2 ، 5 ٪ (W / V) الجلسرين ، 50 octylglucoside مم ، 10 ملغ / مل lysolecithin ، 1.5 ملي dithiothreitol ، 100 ملي زارة التربية والعلم ، أس هيدروجيني 5.5).
- دوامة بقوة ، ويهز ثم في 31 لمدة 20 دقيقة في thermomixer إيبندورف درجة مئوية.
الجزء 2 : الجلسرين سرعة التدرج الرواسب الطرد المركزي
- إعداد التدرج الجلسرين عن طريق وضع المبالغ التالية من الجلسرين في جهاز للطرد المركزي أنبوب ultraclear بيكمان (13 ملم × 51 ملم) : 1 مل 70 ٪ (V / V) الجلسرين ، 0.75 مل الجلسرين 50 ٪ ، 0.375 مل الجلسرين 40 ٪ ، و 1.8 مل الجلسرين 33 ٪. مصنوعة حلول الجلسرين عن طريق خلط الجلسرين النقي مع عازلة شمال البحر الأبيض المتوسط (150 مم كلوريد الصوديوم ، و 50 ملي زارة التربية والعلم ، ودرجة الحموضة 5.5). أيضا بإعداد أنبوب التوازن تحتوي على كل من الجلسرين والعازلة.
- في دوامة اضطراب عينة فيروسية مرة أخرى ، وتحميلها على التدرج الجلسرين.
- التدرج الطرد المركزي مقابل 3.75 ساعة في XG 217000 ، 4 درجات مئوية ، في الدوار MLS - 50 بيكمان الدلو المتأرجح.
- بعد اكتمال الطرد المركزي ، وجمع 250 يدويا aliquots ميكرولتر من التدرج بدءا من الجزء العلوي من الأنبوب. تبقي على الجليد أو كسور في 4 درجات مئوية.
الجزء 3 : تحليل الانحدار الجلسرين الكسور التي بولي أكريلاميد الكهربائي جل SDS
- إزالة 20 ميكرولتر كل جزء من لأنبوب جديد.
- إضافة 5 ميكرولتر من 5X العازلة عينة SDS - PAGE.
- الحرارة إلى 95 درجة مئوية لمدة 5 دقائق.
- تدور باستمرار على عينات لفترة وجيزة وتحميلها على هلام بولي أكريلاميد 10 ٪ ، وتشمل علامات الوزن الجزيئي في إحدى الآبار.
- تشغيل العينات في الجل حتى برومفينول الصبغة الزرقاء التحميل تصل بالقرب من الجزء السفلي من هلام.
- وصمة عار مع الجل الأزرق Coomassie.
الجزء 4 : تركيز على الكسور vRNP
- اختيار الكسور التي تحتوي على الجلسرين NP أساسا ، والجمع بينها ، وتوزيعها إلى قسمين أنابيب البولي الطرد المركزي بيكمان (11 ملم × 34 ملم).
- ملء كل أنبوب مع pyrocarbonate اثيل (DEPC) معاملة المياه فائقة النقاء ، والماصة صعودا وهبوطا عدة مرات لخلط.
- الطرد المركزي ل 4.5 ساعات في XG 157000 ، 4 درجات مئوية ، في الدوار بيكمان 120.2 - TLA.
- إزالة طاف ، وresuspend وبيليه في 50 ميكرولتر من DEPC معاملة المياه.
- إذا رغبت في ذلك ، يمكن قياس 280 ألف من vRNPs المركزة. كما NP هو الحاضر عنصرا رئيسيا في تجميع الكسور ، يمكن حساب تقدير للmolarity من NP باستخدام معامل لانقراض 55350 م -1 سم -1 (كما هو محدد عبر ProtParam 3).
- قسامة في vRNPs تنقيتها ، وتخزينها في المجمد -80 درجة مئوية لاستخدامها لاحقا.
الجزء 5 : تلطيخ السلبية vRNPs
- 1 ميكرولتر من تمييع vRNP المنقى في 9 ميكرولتر من الصنع وطازجة. تصفيتها ، وهو ضعف العازلة MNT (20 ملي زارة التربية والعلم ، 150 مم كلوريد الصوديوم ، و 30 ملي تريس ، ودرجة الحموضة 7.5) المخازن الأخرى هي أيضا موافق لتمييع vRNPs وشبكة لغسل العينة (الخطوة 5.5) ، ولكن لا تستخدم إذا تم استخدام برنامج تلفزيوني خلات اليورانيل لتلطيخ السلبية.
- توهج تصريف عينة (TEM النحاس) الشبكة المغلفة مسبقا مع parlodion والفيلم الكربون لمدة 30 ثانية.
- عقد حديثا الشبكة عينة يتوهج تفريغها مع ملاقط ، وتطبيق قطرة 5 ميكرولتر من vRNP المخفف على الشبكة عينة.
- ترك قطرة من العينة على الشبكة لمدة 8 دقائق.
- في حين الانتظار ، وضع شريط صغير من Parafilm على مقاعد البدلاء ، والاستغناء 2 قطرات تحتوي على 10 ميكرولتر كل من MNT العازلة (لغسل الشبكة) ، وانخفاض 80 ميكرولتر من الحل تلطيخ الطازجة (1 موليبدات الأمونيوم أو 1 ٪ خلات اليورانيل ٪) على Parafilm.
- بعد دقائق من الامتزاز - 8 ، قبالة الفتيل جزءا من الحل عينة من العينات مع شبكة قطعة من ورق الترشيح (مقطعة إلى مثلثات). لا تدع الشبكة العينة لتجف.
- شبكة غسل العينة في 2 قطرات تحتوي على 10 ميكرولتر من كل العازلة MNT لفترة ما مجموعه 1 دقيقة. يتم ذلك عن طريق خفض بعناية الشبكة عينة على هذا التراجع ، ثم فتل قطع جزءا من الحل عينة من العينات مع شبكة قطعة من ورق الترشيح (من دون السماح للشبكة العينات الجافة).
- مباشرة بعد إيقاف فتل آخر قطرة من العينة العازلة من الشبكة ، واستكماليغرق لاي الشبكة عينة داخل الحبرية وصمة عار وانتظر 1 دقيقة.
- الفتيل تماما قبالة حل صمة عينة من الشبكة مع قطعة من ورق الترشيح.
- تسمح الشبكة العينة لتجف في الهواء لعدة دقائق قبل الملاحظة تحت المجهر انتقال الإلكترون.
الجزء 6 : النتائج الممثل :

الشكل 1
كما NP الأنفلونزا A (~ 56 كيلو دالتون) هو البروتين الموجود في المجمعات الرئيسية بروتين نووي ريبوزي الفيروسية ، والفرقة NP عموما أقوى عصابة في الكسور التي تحتوي على vRNPs (الشكل 1). بالإضافة إلى NP ، كل vRNP الإنفلونزا يحتوي أيضا على نسخة من الحمض النووي الريبي بوليميراز مثلوثي (الأوزان الجزيئية للكيلو دالتون 82 و 86 و 86.5) المعقدة. هذه قد تكون أو لا تكون مرئية من قبل تلوين الزرقاء Coomassie بسبب وفرة منخفضة مقارنة بهم لتلك التي أرستها. وpolymerases ، ومع ذلك ، يمكن الكشف عن إذا ، بدلا من الزرقاء Commassie صمة عار ، وصمة عار من الفضة يتم تنفيذ هلام. ينبغي للبروتين المصفوفة الأنفلونزا M1 (~ 28 كيلو دالتون) أن تكون موجودة في الحد الأدنى من الكسور حيث ذروة البروتين الكسور NP موجودة.
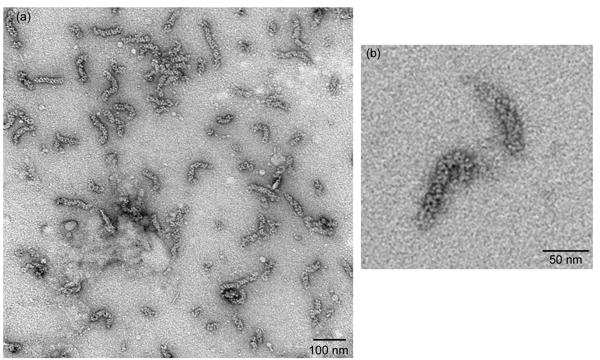
الشكل 2
ينبغي vRNPs سلبا الملطخة كما تصور تحت المجهر الإلكتروني انتقال العائد vRNPs تشبه قضيب على شكل جسيمات ذات طول متغير ما يقرب من 30 نانومتر إلى 120 نانومتر في الطول (الشكل 2A). وينظم الحزب الوطني oligomeric وسلسلة من الجزيئات التي أرستها مطوية الى مزيد من تكرار بنية حلزونية مزدوجة ، وهلم جرا الحلقات إما ينتهي من هذه الجسيمات على شكل قضيب ويمكن أن ينظر إليها في بعض الأحيان (الشكل 2B).
Discussion
وتستند عملية تنقية vRNPs على الإجراء التي وصفها Kemler وآخرون (1994). 1 نحن وغيرنا قد استخدمت أيضا لعزل هذا البروتوكول vRNPs لدراسة استيراد النووية. 2،4،5
نوصي باستخدام ريبونوكلياز خالية من نصائح وأنابيب عند التعامل مع vRNPs لأ...
Acknowledgements
وأيد هذا العمل من المنح المقدمة من المؤسسة الكندية للابتكار (CFI) والمعهد الكندي للبحوث الصحية (CIHR) ، والعلوم الطبيعية والهندسة مجلس البحوث كندا (NSERC).
Materials
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| H3N2 X-31 A/AICHI/68 influenza A | Charles River Laboratories | 490715 | ||
| Tris | Sigma | T1503 | ||
| MES | Sigma | M-8250 | ||
| Glycerol | Fisher | G33-1 | ||
| Octylglucoside | Sigma | O-8001 | ||
| Lysolecithin | Sigma | L-4129 | ||
| Dithiothreitol | Sigma | D-9779 | ||
| Coomassie brilliant blue G-250 | Kodak | 1367796 | ||
| diethyl pyrocarbonate (DEPC)-treated water | Invitrogen | 750024 | ||
| Uranyl Acetate | Ted Pella | 19481 | ||
| Ammonium Molybdate | Fisher | A-674 | ||
| Optima MAX-E Ultracentrifuge | Beckman Coulter | 434491 | ||
| MLS-50 Rotor Package, Swinging Bucket | Beckman Coulter | 367280 | ||
| TLA-120.2 Rotor Assembly, Fixed-Angle, Titanium | Beckman Coulter | 362046 | ||
| Eppendorf Thermomixer | Brinkman | 022670000 |
References
- Kemler, I., Whittaker, G., Helenius, A. Nuclear import of microinjected influenza virus ribonucleoproteins. Virology. 202, 1028-1033 (1994).
- Wu, W. W. H., Weaver, L. L., Panté, N. Ultrastructural analysis of the nuclear localization sequences on influenza a ribonucleoprotein complexes. J Mol Biol. 374, 910-916 (2007).
- Gasteiger, E., Walker, J. M. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Wu, W. W. H., Sun, Y. H. B., Panté, . Nuclear import of influenza A viral ribonucleoprotein complexes is mediated by two nuclear localization sequences on viral nucleoprotein. Virol J. 4, 49-49 (2007).
- Babcock, H. P., Chen, C., Zhuang, X. Using single-particle tracking to study nuclear trafficking of viral genes. Biophys J. 87, 2749-2758 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved