このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
インフルエンザウイルスリボ核タンパク質複合体の精製と可視化
要約
インフルエンザウイルスのゲノムは、RNAとタンパク質の8つの独立した複合体と呼ばれる、ウイルスのリボ核タンパク質複合体(vRNPs)で構成されています。本論文では、グリセロール勾配精製とインフルエンザvRNPsの透過型電子顕微鏡の可視化について説明します。
要約
インフルエンザウイルスゲノムは8つの負のセンス、個々にインフルエンザの複数のコピーウイルスribonulceoprotein粒子(vRNPs)に核蛋白(NP)が充填された一本鎖RNA分子で構成されています。インフルエンザvRNPsは、ウイルスエンベロープで囲まれています。セルの入力時に、しかし、これらのvRNP複合体は、それらが宿主核輸送機構へのアクセスを細胞質に放出されています。インフルエンザvRNPsとインフルエンザのゲノムの複製の核移入を研究するために、それはウイルスの他のコンポーネントがこれらのプロセスに干渉しないように隔離されたvRNPsで作業するのに便利です。ここで、我々は、インフルエンザウイルスからこれらvRNPsを精製する手順を説明します。手順は、包まれたビリオンからvRNP複合体を解放するために、インフルエンザの混乱洗剤とビリオンから始まります。 vRNPsは、インフルエンザ速度沈降によって33から70パーセント不連続グリセロール勾配でビリオンの他のコンポーネントから分離されています。グリセロール勾配から得られた分画は、クマシーブルーで染色後を経由してSDS - PAGEで分析されています。 NPを含有するピーク画分を一緒にプールし、遠心分離により濃縮されています。濃縮後、vRNPsの整合性は、ネガティブ染色した後、透過型電子顕微鏡によるvRNPsの可視化によって検証されます。グリセロール密度勾配による精製はKemlerからその修正したものです
プロトコル
パート1:インフルエンザの破壊ビリオン
- ベックマンオプティマで使用するためのTLA - 120.2ローターに収まるように設計されたものベックマンポリカーボネート遠心管(11ミリメートル× 34ミリメートル)にMNTバッファー750μlの(20mMのMES、150mMのNaCl、30mMトリス、pH 7.5)を追加するマックス- Eの超遠心機。
- そのチューブに、インフルエンザウイルス(2 mg / mlのH3N2 X - 31 A/AICHI/68株)500μlを添加します。数回上下にピペッティングしてMNTバッファを使ってウイルスを混ぜる。
- TLA - 120.2ローターを使用してベックマンオプティママックス- Eの遠心機で、109000 × gで、4℃で10分間遠心します。
- 上清を除去し、500μlの混乱のバッファーでペレットを再懸濁さは(100mMのKCl、5 mMのMgCl 2、5%(w / v)のグリセロール、50 mMのオクチルグルコシド、10 mg / mlのリゾレシチン、1.5mMのジチオトレイトール、100mMのMES、 pHは5.5)。
- 渦は精力的にし、エッペンドルフのサーモミキサーで20分間31℃で振とうする。
パート2:グリセロール勾配土砂速度遠心
- 1 mlの70%(v / v)グリセロール、0.75ミリリットル、50%グリセロール、0.375ミリリットル40%グリセロール、および1.8:ベックマンultraclearの遠心管(13ミリメートル× 51ミリメートル)にグリセロールの以下の量を配置することによって、グリセロール勾配を準備ミリリットル33%グリセロール。グリセロールのソリューションは、NMのバッファー(150mMのNaCl、50mMのMES、pH5.5)で純粋なグリセリンを混合して作られています。また、グリセロールとバッファの両方を含むバランスのチューブを準備する。
- 渦再びウイルスのサンプルを破壊し、グリセロール勾配の上にそれを読み込みます。
- ベックマンMLS - 50スイングバケットローターで、217000 × gで、4℃で3.75時間のために勾配を遠心分離します。
- 遠心分離が完了したら、手動でチューブの上からグラデーションの250μlのアリコートを収集する。 ℃の氷の上または4で分画してください
パート3:SDSポリアクリルアミドゲル電気泳動法によりグリセロール勾配分画の分析
- 各フラクションから新しいチューブに20μlのを削除します。
- 5x SDS - PAGEサンプルバッファー5μlを添加します。
- 95〜ヒート℃で5分間。
- 簡単にサンプルをスピンダウンし、10%ポリアクリルアミドゲル上にロードし、井戸の一つで、分子量マーカーが含まれています。
- ブロモフェノールブルーローディング色素がゲルの底部近くに達するまでゲルにサンプルを実行します。
- クーマシーブルーでゲルを染色する。
パート4:vRNP画分の濃縮
- 主にNPを含むグリセロール画分を選択し、それらを組み合わせて、二ベックマンポリカーボネート遠心管(11ミリメートル× 34ミリメートル)にそれらを配布する。
- 上下ジエチルピロカーボネート(DEPC)処理した超純水、及びピペットで混合するために数回、各チューブを埋める。
- ベックマンTLA - 120.2ローターで、157000 × gで、4℃で4.5時間遠心する。
- 上清を除き、DEPC処理水50μlにペレットを再懸濁します。
- 必要に応じて、濃縮されたvRNPsの280は、測定することができます。 NPは、プールされた画分の主要コンポーネントの存在として、NPのモル濃度の推定値は55350 M -1 cm -1のその吸光係数を(ProtParam 3を介して決定される)を使用して計算することができます。
- 一定分量精製vRNPsを、そしてそれらを° C、後で使用するために-80℃で凍結保存する。
パート5:vRNPsのネガティブ染色
- たてのとフィルタリングの2倍MNT緩衝液(20mM MES、150mMのNaCl、30mMトリス、pH 7.5)を9μLに精製されたvRNPの1μlを希釈します。他のバッファは、vRNPsを希釈すると試料のグリッド(ステップ5.5)洗浄するためにOKですが、酢酸ウラニルが負の染色に使用されている場合PBSを使用しないでください。
- 以前に30秒間parlodionと炭素膜で被覆試験片(銅TEM)グリッドをグロー放電。
- ピンセットでたてのグロー放電試験片のグリッドを保持し、試料のグリッド上に希釈vRNPの5μlをドロップして適用されます。
- 8分のグリッド上で試料の滴を残す。
- 待っている間、ベンチにパラフィルムの小さなストリップを配置し、そして10μlのMNTバッファの各(グリッドを洗浄する)、そしてたて染色液の80μlをドロップ(1%モリブデン酸アンモニウムまたは1を含む2滴を分注するパラフィルム上に%の酢酸ウラニル)。
- 吸着の8分後、ろ紙の切れ端で試料のグリッド(三角にカット)からサンプル溶液の一部を放出する。試料グリッドを乾燥させてはいけない。
- 1分の合計時間のために10μlのMNTバッファの各々を含む2滴の試料の格子を洗います。これは、慎重にドロップで試料の格子を下げるし、ろ紙の切れ端で試料の格子(試料のグリッドは、乾燥させることなく)からサンプル溶液の一部をオフにウィッキングすることによって行われます。
- 直ちに試料のグリッドからバッファの最後の一滴をオフウィッキング後に、完全なLYの水没は、標本の染色液滴内のグリッド、1分間待ちます。
- 完全にろ紙片を持つ試料の格子から染色液をオフに放出する。
- 透過型電子顕微鏡下で観察する前に、数分間空気乾燥して試料のグリッドを許可する。
パート6:代表的な結果:

図1
インフルエンザNP(〜56 kDa)は、ウイルスリボ核タンパク質複合体で見つかった主なタンパク質は、NPのバンドは、一般的にvRNPs(図1)を含有する画分では最強のバンドです。 NPに加えて、それぞれのインフルエンザのvRNPは、複雑な(82、86及び86.5 kDaの分子量)三量体RNAポリメラーゼのコピーが含まれています。彼らの豊かさがNPのそれに比べて低いので、これらは、またはクーマシーブルー染色により表示されない場合があります。ゲルの銀染色が行われ、代わりにCommassie青の汚れ、場合ポリメラーゼは、しかし、検出することができます。インフルエンザマトリックスタンパク質M1(〜28 kDa)はNP蛋白質のピーク分画が存在する分画で最小限に存在する必要があります。
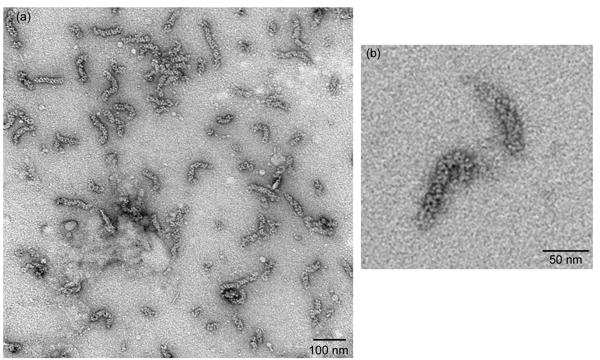
図2
透過型電子顕微鏡下で可視化などの負染色vRNPsの長さは120nmの(図2a)に約30nmである任意の長さを持つロッド状の粒子に似たvRNPsをもたらす必要があります。オリゴマーのNPがさらに二重らせんリピート構造に折り畳まれているNPの分子の鎖のように構成されているので、これらの棒状粒子のいずれかの端にループし、時には(図2b)見ることができます。
ディスカッション
vRNPsの精製がKemler ら (1994)によって記載された手順に基づいている。1私達と他の人も自分の核移入を勉強するvRNPsを分離するためにこのプロトコルを使用している。2,4,5
我々は、ウイルスゲノムはRNAで構成されているためRNaseフリーヒントやvRNPsを操作するチューブの使用をお勧めします、そのためRNAの存在下で容易に分解する。さらに、すべて?...
謝辞
この作品は、イノベーションのためのカナダ基金(CFI)、健康研究(CIHR)のカナダの研究所、およびカナダ自然科学工学研究評議会(NSERC)からの補助金によって支えられている。
資料
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| H3N2 X-31 A/AICHI/68 influenza A | Charles River Laboratories | 490715 | ||
| Tris | Sigma | T1503 | ||
| MES | Sigma | M-8250 | ||
| Glycerol | Fisher | G33-1 | ||
| Octylglucoside | Sigma | O-8001 | ||
| Lysolecithin | Sigma | L-4129 | ||
| Dithiothreitol | Sigma | D-9779 | ||
| Coomassie brilliant blue G-250 | Kodak | 1367796 | ||
| diethyl pyrocarbonate (DEPC)-treated water | Invitrogen | 750024 | ||
| Uranyl Acetate | Ted Pella | 19481 | ||
| Ammonium Molybdate | Fisher | A-674 | ||
| Optima MAX-E Ultracentrifuge | Beckman Coulter | 434491 | ||
| MLS-50 Rotor Package, Swinging Bucket | Beckman Coulter | 367280 | ||
| TLA-120.2 Rotor Assembly, Fixed-Angle, Titanium | Beckman Coulter | 362046 | ||
| Eppendorf Thermomixer | Brinkman | 022670000 |
参考文献
- Kemler, I., Whittaker, G., Helenius, A. Nuclear import of microinjected influenza virus ribonucleoproteins. Virology. 202, 1028-1033 (1994).
- Wu, W. W. H., Weaver, L. L., Panté, N. Ultrastructural analysis of the nuclear localization sequences on influenza a ribonucleoprotein complexes. J Mol Biol. 374, 910-916 (2007).
- Gasteiger, E., Walker, J. M. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Wu, W. W. H., Sun, Y. H. B., Panté, . Nuclear import of influenza A viral ribonucleoprotein complexes is mediated by two nuclear localization sequences on viral nucleoprotein. Virol J. 4, 49-49 (2007).
- Babcock, H. P., Chen, C., Zhuang, X. Using single-particle tracking to study nuclear trafficking of viral genes. Biophys J. 87, 2749-2758 (2004).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved