É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Purificação e Visualização de Influenza A complexos de ribonucleoproteínas Viral
Neste Artigo
Resumo
O genoma do vírus influenza A é composto por oito complexos separada de RNA e proteínas, denominadas complexos de ribonucleoproteínas viral (vRNPs). Este artigo descreve a purificação gradiente glicerol e transmissão de visualização microscopia eletrônica de influenza A vRNPs.
Resumo
A influenza A genoma viral é composto por oito sentido negativo, as moléculas de RNA de fita única, embalados individualmente com várias cópias da influenza A nucleoproteína (NP) em partículas ribonulceoprotein viral (vRNPs). O vRNPs influenza são colocados dentro do envelope viral. Durante a entrada de celulares, no entanto, esses complexos vRNP são liberados para o citoplasma, onde eles ter acesso ao equipamento de transportes anfitrião nuclear. A fim de estudar a importação nuclear de vRNPs influenza ea replicação do genoma da gripe, é útil para trabalhar com vRNPs isolada de modo que outros componentes do vírus não interferem com estes processos. Aqui, descrevemos um procedimento para purificar essas vRNPs do vírus influenza A. O procedimento começa com o rompimento da influenza A virion com detergentes, a fim de liberar os complexos vRNP do virion envolvido. O vRNPs são então separados dos outros componentes da influenza A virion em um gradiente de glicerol 33-70% descontínua por sedimentação velocidade. As frações obtidas a partir do gradiente de glicerol são analisados na via SDS-PAGE após coloração com Coomassie blue. As frações de pico contendo NP são então reunidos e concentrados por centrifugação. Após a concentração, a integridade do vRNPs é verificada através da visualização do vRNPs por microscopia eletrônica de transmissão após coloração negativa. A purificação do gradiente de glicerol é uma modificação do que a partir de Kemler
Protocolo
Parte 1: Rompimento da Influenza A Virion
- Adicionar 750 mL de tampão MNT (20 mM MES, 150 mM NaCl, 30 mM Tris, pH 7,5) em um tubo de centrífuga Beckman policarbonato (11 mm x 34 mm) projetado para caber em um rotor TLA-120,2 para uso em um Optima Beckman Max-E ultracentrífuga.
- Adicionar 500 mL do vírus influenza A (H3N2 X-31 A/AICHI/68 tensão; 2 mg / ml) em que o tubo. Misture o vírus com o buffer MNT pipetando cima e para baixo várias vezes.
- Centrifugar por 10 minutos a 109.000 xg, 4 ° C, em uma centrífuga Beckman Optima Max-E usando um rotor TLA-120,2.
- Remover o sobrenadante e ressuspender o sedimento em 500 mL de buffer interrupção (100 mM KCl, 5 mM MgCl 2, 5% (w / v) de glicerol, 50 octylglucoside mM, 10 mg / ml lysolecithin, 1,5 mM ditiotreitol, 100 mM MES, pH 5,5).
- Vortex vigorosamente, e em seguida, agitar a 31 ° C por 20 minutos em um Thermomixer eppendorf.
Parte 2: O glicerol Gradient Centrifugação Velocity Sedimentos
- Prepare um gradiente de glicerol, colocando as seguintes quantidades de glicerol em um tubo de centrífuga Beckman UltraClear (13 mm x 51 mm): 1 ml de 70% (v / v) de glicerol, 0,75 ml de glicerol 50%, 0,375 ml de glicerol 40%, e 1,8 ml de glicerol 33%. Soluções de glicerol são feitos através da mistura de glicerol puro com tampão NM (150 mM NaCl, 50 mM MES, pH 5,5). Também preparar um tubo de equilíbrio contendo tanto glicerol e buffer.
- Vortex da amostra viral interrompeu novamente, e coloque-os no gradiente de glicerol.
- Centrifugar o gradiente para 3,75 horas em 217.000 xg, 4 ° C, em um MLS-50 Beckman rotor balançando-balde.
- Após a centrifugação é completa, coletar manualmente 250 mL alíquotas do gradiente a partir do topo do tubo. Mantenha frações no gelo ou a 4 ° C.
Parte 3: Análise das Frações Gradient Glicerol por SDS Eletroforese em Gel de Poliacrilamida
- Remover 20 l de cada fração para um novo tubo.
- Adicionar 5 mL de tampão de amostra SDS-PAGE 5x.
- Calor a 95 ° C por 5 minutos.
- Girar as amostras de forma breve e carregá-los em um gel de poliacrilamida 10%, e os marcadores de peso molecular em um dos poços.
- Executar os exemplos sobre o gel até o corante azul de bromofenol carregamento chega perto do fundo do gel.
- Manchar o gel com Coomassie blue.
Parte 4: Concentração das frações vRNP
- Escolha as frações de glicerol contendo principalmente NP, combiná-los e distribuí-los em dois tubos de centrífuga Beckman policarbonato (11 mm x 34 mm).
- Preencher cada tubo com dietil pyrocarbonate (DEPC) tratados com água ultrapura, e pipeta cima e para baixo várias vezes para misturar.
- Centrífuga de 4,5 horas a 157.000 xg, 4 ° C, em um TLA-120,2 Beckman rotor.
- Remover o sobrenadante e ressuspender o sedimento em 50 ul de água tratada DEPC-.
- Se desejar, o 280 A do vRNPs concentrada pode ser medido. Como NP é o principal componente presente nas frações agrupadas, uma estimativa da molaridade de NP pode ser calculada usando seu coeficiente de extinção de 55.350 M -1 cm -1 (como determinado através ProtParam 3).
- Alíquota do vRNPs purificado, e armazená-las congeladas a -80 ° C para uso posterior.
Parte 5: Coloração Negativa de vRNPs
- Diluir 1 ml de vRNP purificada em 9 mL de recém-feitos e filtrada duas vezes-tampão MNT (20 mM MES, 150 mM NaCl, 30 mM Tris, pH 7,5). Buffers outros também são OK para diluir o vRNPs e para lavar a grade de amostra (passo 5.5), mas não use PBS se acetato de uranila é usado para a coloração negativa.
- De descarga luminescente grade um espécime (TEM cobre) previamente revestida com uma película de carbono e parlodion por 30 segundos.
- Segure a grade espécime recém-brilho-alta com uma pinça, e aplicar uma queda de 5 mL de vRNP diluído na grade da amostra.
- Deixe a gota de amostra na grade por 8 minutos.
- Enquanto espera, coloque uma pequena tira de Parafilm no banco, e dispensar 2 gotas contendo 10 ml cada um buffer de MNT (para lavar a grade), e uma queda de 80 mL da solução de coloração feita recentemente (1 molibdato de amônio ou 1% acetato de uranila%) para o Parafilm.
- Após os 8 minutos de adsorção, pavio de parte da solução da amostra a partir da rede amostra com um pedaço de papel de filtro (cortado em triângulos). Não deixe que a grade de amostra para secar.
- Lavar grade amostra em 2 gotas contendo 10 ml cada um buffer de MNT para um tempo total de 1 minuto. Isto é feito com cuidado redução da grade amostra na queda, e depois wicking de parte da solução da amostra a partir da rede amostra com um pedaço de papel de filtro (sem deixar a grade amostra seca).
- Imediatamente após wicking fora a última gota de tampão da rede de espécime, completasubmergir ly grade da amostra dentro da gota da mancha e esperar um minuto.
- Pavio completamente off a solução mancha da rede amostra com um pedaço de papel de filtro.
- Permitir que a grade espécime secarem por alguns minutos antes da observação ao microscópio eletrônico de transmissão.
Parte 6: Resultados Representante:

Figura 1
Como influenza A NP (~ 56 kDa) é a principal proteína encontrada em complexos ribonucleoproteína viral, a banda NP geralmente é o mais forte da banda nas frações contendo o vRNPs (Figura 1). Além de NP, cada vRNP influenza também contém uma cópia de uma RNA polimerase trimérico (pesos moleculares de kDa 82, 86 e 86,5) complexo. Estes podem ou não ser visíveis por Coomassie coloração azul porque a sua abundância é baixa comparada com a de PN. O polimerases, no entanto, pode ser detectado se, em vez de um azul Commassie mancha, uma mancha de prata do gel é realizada. A proteína de matriz M1 influenza (~ 28 kDa) deve ser minimamente presentes nas frações onde o NP frações pico de proteína estão presentes.
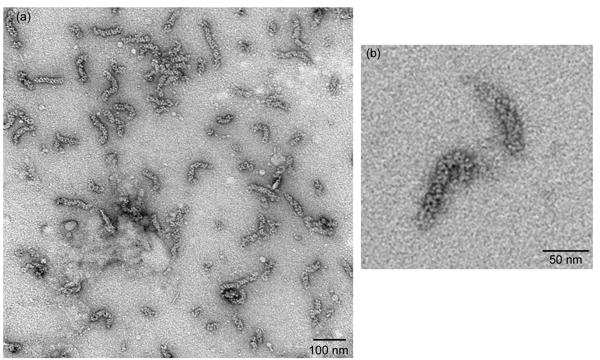
Figura 2
VRNPs negativamente manchada como visto sob um microscópio eletrônico de transmissão deve render vRNPs que se assemelham em forma de bastonete partículas com comprimento variável, que são cerca de 30 nm até 120 nm de comprimento (Figura 2a). O NP oligomérica é organizada como uma cadeia de moléculas de NP que é ainda mais dobrada em uma estrutura de dupla hélice repetir, assim loops de ambos os extremos destas partículas em forma de bastonete às vezes pode ser visto (Figura 2b).
Discussão
A purificação da vRNPs é baseado no procedimento descrito por Kemler et al. (1994). 1 Nós e os outros também têm usado este protocolo para isolar vRNPs para estudar sua importação nuclear. 2,4,5
Recomendamos o uso de RNase dicas e tubos ao manipular vRNPs porque o genoma viral é composto de RNA, e, portanto, degrada facilmente na presença de RNA. Além disso, todos os buffers deve ser feita em água que é RNase livre. O protocolo aqui descrito foi re...
Agradecimentos
Este trabalho foi financiado por doações da Fundação Canadense para a Inovação (CFI), o Instituto Canadense de Pesquisa em Saúde (CIHR), e as Ciências Naturais e Pesquisa de Engenharia Council of Canada (NSERC).
Materiais
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| H3N2 X-31 A/AICHI/68 influenza A | Charles River Laboratories | 490715 | ||
| Tris | Sigma | T1503 | ||
| MES | Sigma | M-8250 | ||
| Glycerol | Fisher | G33-1 | ||
| Octylglucoside | Sigma | O-8001 | ||
| Lysolecithin | Sigma | L-4129 | ||
| Dithiothreitol | Sigma | D-9779 | ||
| Coomassie brilliant blue G-250 | Kodak | 1367796 | ||
| diethyl pyrocarbonate (DEPC)-treated water | Invitrogen | 750024 | ||
| Uranyl Acetate | Ted Pella | 19481 | ||
| Ammonium Molybdate | Fisher | A-674 | ||
| Optima MAX-E Ultracentrifuge | Beckman Coulter | 434491 | ||
| MLS-50 Rotor Package, Swinging Bucket | Beckman Coulter | 367280 | ||
| TLA-120.2 Rotor Assembly, Fixed-Angle, Titanium | Beckman Coulter | 362046 | ||
| Eppendorf Thermomixer | Brinkman | 022670000 |
Referências
- Kemler, I., Whittaker, G., Helenius, A. Nuclear import of microinjected influenza virus ribonucleoproteins. Virology. 202, 1028-1033 (1994).
- Wu, W. W. H., Weaver, L. L., Panté, N. Ultrastructural analysis of the nuclear localization sequences on influenza a ribonucleoprotein complexes. J Mol Biol. 374, 910-916 (2007).
- Gasteiger, E., Walker, J. M. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Wu, W. W. H., Sun, Y. H. B., Panté, . Nuclear import of influenza A viral ribonucleoprotein complexes is mediated by two nuclear localization sequences on viral nucleoprotein. Virol J. 4, 49-49 (2007).
- Babcock, H. P., Chen, C., Zhuang, X. Using single-particle tracking to study nuclear trafficking of viral genes. Biophys J. 87, 2749-2758 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados