A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تصور لايف ذبابة الفاكهة الدبقية العصبية والعضلية ، تقاطع مع الأصباغ نيون
In This Article
Summary
صفنا السمات الهيكلية للنقاط الاشتباك العصبي الدبق العصبي العضلي في نسيج الرواية إعداد الداخل التدريجي من استخدام يرقات الذباب يعيش الأصباغ الفلورية مع المجهري متحد البؤر. نحن المسمى محطات عصبون تعيش مع الأجسام المضادة الأولية الفلورسنت لHRP ، وكذلك تصور الفضاء perisynaptic مع Dextrans الفلورسنت.
Abstract
مشروعنا تحديد هياكل GFP الدبقية المسمى في المشبك العصبي العضلي يرقات ذبابة النامية. للنظر في وضع المشابك العصبية الدبقية - العضلات العيش ، طورنا إعداد الأنسجة اليرقات التي كانت ملامح يرقات حية سليمة ، ولكن أيضا كان الخصائص البصرية جيدة. هذا المستحضر الجديد يسمح أيضا للحصول على perfusates المشبك. استخدمنا يرقات الذباب ، منغمسين في هذه الدملمف الاصطناعي ، واسترخاء الجسم بشكل طبيعي الانقباضات الإيقاعية التي تقشعر لها الأبدان منهم. نحن المقبل تشريح قبالة شرائح الخلفي من كل الحيوانات والحشرات بدبوس حادة دفعت أجزاء الفم الى الوراء من خلال تجويف الجسم. مقلوبة هذه اليرقات جدار الجسم ، مثل تحول جورب من الداخل إلى الخارج. أكملنا تشريح مع مقص تشريح غاية في الدقة وبالتالي يتعرض الجانب الحشوي للعضلات جدار الجسم. وأعرب الهياكل الدبقية في NMJ GFP غشاء المستهدفة تحت سيطرة المروجين الدبقية محددة. وأعرب الغشاء بعد المشبكي ، الاشتراكية السوفياتية (شبيكات تحت المشبك) في العضلات المستهدفة synaptically dsRed. نحن في حاجة لتسمية المحطات تماما الخلايا العصبية الحركية ، والجزء الثالث من المشبك. للقيام بذلك طبقنا الأجسام المضادة الأولية لHRP ، مترافق إلى انبعاث flurophore بعيدة الحمراء. لاختبار خصائص صبغة نشر في الفضاء perisynaptic بين محطات الخلايا العصبية الحركية والاشتراكية السوفياتية ، وطبقنا حل من جزيئات كبيرة ديكستران مترافق لانبعاث flurophore بعيدة الحمراء والصور التي تم جمعها.
Protocol
الجزء 1 : إعداد الأنسجة
- هدفنا هو تحضير الأنسجة من يرقات الذباب حيث الجهاز العصبي سليمة ، ولكن ما يتعرض له السطح الداخلي للجسم الجدار العضلي لالدملمف الاصطناعي ، ويمكن وضعه على مقربة من المجهر زلة تغطية جيدة للبصريات. وبعبارة أخرى ، فإن الداخل الى الخارج إعداد اليرقات.
منذ التحضيرات الأنسجة التقليدية تشمل عدة قطاعات ، ويعلقون تمتد في عضلة جدار الجسم ، وإزالة بعض الأحيان جزءا من الجهاز العصبي ، ونحن في حاجة الى نهج مختلف.
أردنا الحيوانات من الداخل إلى الخارج لأننا كنا نريد الحصول على نظرة فاحصة على الميزات الهيكلية والتغييرات الهيكلية على مر الزمن في المشبك ، وأردنا أن تبقي النظام العصبي سليمة. أردنا أيضا لتجنب الضغط على النسيج ، وتفعيل تمتد المستقبلات ، والتي من شأنها أن تجعل العضلات نشل والخراب صورنا. - بالنسبة للمبتدئين ، ومرحلة الحيوانات. تغذية يرقات الثالث وتجول اليرقات الثالثة هي كبيرة وسهلة لتشريح سنقوم بذلك تبرهن على W3 اليرقات. هذا الحيوان هو النمط الظاهري له بدين ، واسعة ، لذلك فمن السهل أن يقلب للخارج.
كنا فقط اليرقات التي رأيناها الزحف بنشاط ، بما في ذلك W3 اليرقات. - تنظيف سطح نغفة بفرشاة الطلاء لينة جدا في طبق بتري المزدوج المقطر H2O. يرقات نظيفة يكون أفضل البصريات والتنظيف يقلل البكتيريا.
- نقل الحيوانات إلى طبق بتري صغيرة من حوالي 3 مل من الجليد الباردة HL - 6 ، والدملمف الاصطناعي. وضع الطبق على الجليد حتى الحيوانات تتوقف عن التحرك ، ويرتاح (حوالي 5 دقائق).
- عقد ملقط غيض دقيق جدا في يد واحدة والمقص في ربيع الآخر. يمكنني استخدام مقص بيدي المهيمنة. جعل ثقب صغير في جدار الجسم مع مقص لequlibrate الضغط عبر جدار الجسم.
- عقد الحيوان برفق مع ملقط لأسفل على الجزء السفلي من صحن وقطع الخلفي جزأين. بعيدا تشريح الأحشاء والدهون في الجسم من المحتمل أن ينتقل من تجويف الجسم. قطع هذا النسيج أيضا.
- عقد ضد يرقات أسفل الطبق مع ملقط الغرامة. عقد دبوس # 0 حشرة في (مع طرف غير الحادة) ودفعها ضد أجزاء فم اليرقات. دفع أجزاء الفم من خلال تجويف الجسم مثل كنت تحول جورب الداخل الى الخارج.
- والداخل الى الخارج تبدو وكأنها نسيج الرقم : أدناه. مع فائق غرامة أداة تشريح ، تشريح بعيدا الدهون في الجسم وtrachioles من جدار الجسم. لا تحاول بجد لسحب trachioles ، أو قطع الاتصال في الجهاز العصبي. وتمزيق trachioles مزق الثقوب في الجسم في العضلات الجدار.
إزالة الدهون الجسم كما قدر ما تستطيع. كل من هذه الهياكل تعطيل الجودة البصرية من الأنسجة الخاصة بك. قد ترغب في تخطي القهوة قبل القيام بهذا الإعداد. - عند الانتهاء سوف تكون شفافة العضلات ، وليس مبهمة أو بيضاء. إذا قمت بوضع الإعدادية في الأنسجة HL - 6 بدون الغلوتامات ، في درجة حرارة الغرفة ، فإنه من المرجح عقد إيقاعي لأن نمط مولدات السيارات في الجهاز العصبي المركزي تعمل.
تجنب استخدام محضرات تعاقدت مع واضح ، أو بشكل غير منتظم تعاقدت هيئة العضلات الجدار.
الداخل سليمة خارج جدار الجسم يميل بسهولة إلى أضعاف في نصف طول midlines ظهري وبطني ، وبالتالي فإن الإعدادية يعطي اليمين أو اليسار "نصفي الحيوانية" لتصور. - 1.9 جبل النسيج إما في غرفة صغيرة الحجم التجاري ، مثل غرفة وارنر ، أو شريحة المجهر مع ترتيب تغطية زلة ردمها. انظر الجزء 3 للاقتراحات حول النسيج في تصاعد مستمر.
الجزء 2 : متعلق بالخلايا العصبية وصفها بوتون مع الأجسام المضادة الأولية fluorescently المسمى ضد HRP.
- وضع الدقيقة 50 لترا من fluorescently المسمى الابتدائية هيئة مكافحة ضد HRP في HL - 6 في الانخفاض على طبق بتري. تزج جدار الجسم من الداخل إلى الخارج الإعدادية في حمام الصبغة. قد تشاهد العلامات العصبية الطرفية بعد حوالي 5 دقائق ، ولكن احتضان لمدة 10-20 دقيقة ، وذلك لاستكمال تسمية ومشرق.
- شطف قبالة الصبغة لمدة 10-30 ثانية في HL - 6 في درجة حرارة الغرفة. غير ملزمة صبغ يشطف قبالة بسرعة ، وبالتالي فإن دورة شطف لا يلزم أن يكون عدوانيا.
- يختلف تركيز الأصباغ وفترة حضانة حسب الحاجة.
الجزء 3 : Perisynaptic العلامات الفضاء مع ديكستران flurophore المتقارن
- تمييع مترافق fluorescently ديكستران صبغة مخففة في HL - 6. وكان التركيز التي عملت جيدا لأغراضنا :
- إذا كنت لا تشعر بالقلق إزاء توقيت الوصول إلى الفضاء في صبغ الخاص خارج الخلية ، ووضع 20 لتر قطرة صغيرة من الصبغة على ساترة "سد" (انظر الجزء 4) وإيداع الأموال والإعدادية في حمام الصبغة.
الجزء 4 : تركيب الأنسجة لتصور (مع مبائر المجهري).
إذا كنت لا تحتاج إلى يروي الإعدادية الخاص (الملاحظات القصيرة) ، أو كنت ترغب في الاحتفاظ حجم الاستحمام HL - 6 الصغير ، استخدم أسلوب مزدوج الشريحة سدها
إذا كنت تريد أن يروي الإعدادية الخاص بك ، حاول استخدام غرفة الارواء. استخدمنا موdified غرفة من الآلات وارنر.
تفاصيل عن كل من اتبع.
تصاعد الإعدادية على شريحة المزدوج ردمها.
- استخدام شريحة المجهر نظيفة جدا. Superglue اثنين ، 18mm مربع (# 1.5) coverslips على الشريحة. ترك فجوة بين 2 مم حواف coverslips.
- اسمحوا الغراء جافة تماما ، أو أنه سيتم تشكيل لفيلم غريب على وسائل الإعلام حول مائي الإعدادية الخاص.
- موقف الداخل الى الخارج اليرقات بين حواف coverslips. قد تحتاج إلى موقف الإعدادية على قطري إذا اليرقات كبيرة ونظام الحصول على الصور الخاصة بك لديها مجموعة محدودة بكسل.
- تغطية الأنسجة مع ساترة # 1.5 ، 18mm (نظيف جدا). تلتزم "أعلى" ساترة الشريحة الملصقة زلات الأنسجة المحيطة ، مع الحد الأدنى من الفازلين.
- وضع قطرة من النفط كارجيل الهدف مخصصة مع معامل الانكسار من 1.3379 (إذا كنت تستخدم HL - 6) على رأس والوجه ساترة هذا التجمع أكثر.
- موقف الجمعية الأنسجة في الجانب الخاص المجهر النفط ، نحو الهدف ، والتركيز هدفكم.
تركيب الأنسجة في غرفة نضح تعديلها. - الغراء a ساترة 1.5 لتشكيل الكلمة في قاعة 20 RC. موقف الأنسجة في الغرفة وفقا للتعليمات RC - 20. استخدام قطعة من شبكة Nytex بدلا من ساترة لتشكيل لسقف الغرفة.
الجزء 5 : نتائج الممثل :
- من الداخل إلى الخارج تشريح الأنسجة إعداد التسلسل :
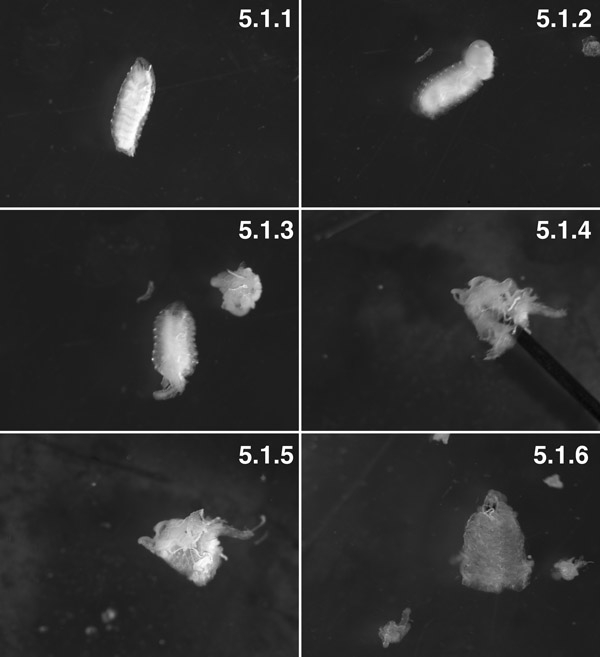
W3 اليرقات ، وغسلها ("بدين" النمط الظاهري) (5.1.1). W3 اليرقات ، والقطع الخلفية 2 تشريح. يمكنك ان ترى الدهون في الجسم طردوا من تجويف الجسم عن طريق الضغط على الجسم عبر الجدار (السهم). في محاولة للحد من الحشوية "الاندفاع" التي إحداث ثقب صغير في الدقيقة الجسم 1 الحائط قبل تشريح (5.1.2). والإعدادية مع تشريح الأحشاء قبل تحويل الإعدادية الداخل الى الخارج (5.1.3). والإعدادية ، مقلوبة في الغالب ، مع دبوس (السهم) داخل تجويف الإعدادية (5.1.4). العضلة الآن في الخارج وجليدة في الداخل ، مع بعض الدهون في الجسم وtrachioles المرفقة (5.1.5). استعدادا كاملا مع الأنسجة تشريح الجسم ما يقرب من جميع الدهون وtrachioles تشريح (5.1.6).
- يعيش وسم استخدام الألغام المضادة للHRP في NMJ اليرقات. A W3 اليرقات ممثل العصبي العضلي المشبك بملحق الدبقية (داخل الإعدادية التدريجي). وصفت في الخلايا العصبية الحركية الطرفية حبة مع الابتدائي أجسام مضادة ضد HRP (قرمزي) ، وهو مترافق لCy5. وصفت عمليات الدبقية مع GFP (الخضراء).
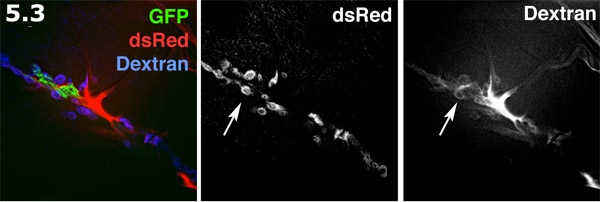
- تصور الفضاء Perisynaptic fluorescently مع اليكسا 680 ديكستران في الداخل الإعدادية. هو المسمى عملية الدبقية (الأخضر) مع GFP غشاء المستهدفة. هو المسمى الاشتراكية السوفياتية بعد متشابك على سطح العضلة (الأزرق) مع dsRed. لديكستران اليكسا (أحمر) أشكال تركز في المناطق خارج الخلية. الصبغة ديكستران أشكال تجمعات على شكل دونات في المساحات perisynaptic. يتم عرض العلامات ديكستران وdsRed SSR المسمى في الرمادي. لاحظ العديد من برك دونات على شكل صبغة تسليط الضوء على مساحات perisynaptic (السهم).
Access restricted. Please log in or start a trial to view this content.
Discussion
يسمح هذا الإجراء على المدى الطويل من العيش التصوير البروتينات وصفت وعمليات الخلية. والإعدادية في الأنسجة وصفنا الوضع الطبيعي لديها سليمة وأداء الجهاز العصبي المركزي ، والجهاز العصبي المحيطي للدوائر المنعكس. هذا النسيج الإعدادية والمزايا على مستوى يرقات ?...
Access restricted. Please log in or start a trial to view this content.
Acknowledgements
وقد تم تمويل هذا المشروع من قبل وCIHR NSERC. نود أن نعترف Jusiak بارب للمساهمة في خلق سلالات ذبابة معربا عن dsRed SSR المسمى (خط BJ) ، وبيو UBC مرفق التصوير.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments | |
| HL-6: Artifical Drosophila hemolymph, with 5 mM L-glutamate added, and 2 mM Calcium. | Reagent | N/A | NA | 5 mM L-glutamate blocked muscle contractions. We used Molecular grade L-Glutamate (Sigma).2 mM Calcium is close to physiological Calcium levels in natural larval hemolymph.References: Macleod et al 2002 and Macleod 2004 |
| Dextran, Alex Fluor 680; 10,000 MW, anionic, fixable | Reagent | Molecular Probes, Life Technologies | D34680 | Use a small volume perfusion chamber to keep the total volume of dye low |
| Anti-HRP-CY5 conjugate (goat) | Reagent | Jackson ImmunoResearch | 123-175-021 | Dilute 2.0 mg into 1 ml ddH2O; aliquot into 4 microliter aliquots. Freeze at –20C. Dilute one aliquot into 100 microliters of HL-6 |
| Alexa 647 antibody labeling kit | Reagent | Molecular Probes, Life Technologies | A10475 | We prepared a total of 80 micro liters of conjugated primary antibody, and stored as 2 microliter aliquots. We diluted each aliquot into 100 microliter of HL-6 for labeling. |
| Custom Formulated Objective Oil, refractive index 1.3379 | Reagent | Cargill Labs | Custom Formulated | |
| Ultra Fine Forceps | Tool | Fine Science Tools | 11252-23 or 11295-20 | |
| Spring scissors | Tool | Fine Science Tools | 91500-09 | |
| Ultra fine clipper scissors | Tool | Fine Science Tools | 15200-00 | |
| Perfusion Chamber RC 20 Series | Tool | Warner Instruments | 64-02222 | |
| Spinning Disc confocal | Microscope | Quorum Technologies | Quorum Wave FX | Mounted on a Leica DMI6000 Inverted Microscope |
References
- Macleod, G. T., Marin, L., Charlton, M., Atwood, H. L. Synaptic Vesicles: Test for a role in presynaptic Calcium regulation. J. Neurosci. 24, 2496-2505 (2004).
- Macleod, G. T., Hegstro, M., Wojtowicz, M., Charlton, M. P., Atwood, H. L. Fast Calcium signals in Drosophila motor neuron terminals. J. Neurophysiology. 88, 2659-2663 (2002).
- Morales, M., Ferrus, A., Martinez-Padron, M. Presynaptic calcium-channel currents in normal and csp mutant Drosophila peptidergic terminals. Eur J Neurosci. 11, 1818-1826 (1999).
- Stork, T., Engelen, D., Krudewig, A., Silies, M., Bainton, R. J., Kla¨mbt, C. Organization and Function of the Blood–Brain Barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved