Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Visualiser le Live Drosophile Gliales-jonction neuromusculaire avec des colorants fluorescents
Dans cet article
Résumé
Nous avons décrit les caractéristiques structurelles des synapses neuromusculaires Glia-dans un roman de préparation des tissus intérieur-extérieur de larves de mouches en direct en utilisant des colorants fluorescents en microscopie confocale. Nous avons étiqueté terminaisons neuronales vivre avec fluorescentes anticorps primaires à HRP, et également visualisé l'espace perisynaptic avec dextranes fluorescents.
Résumé
Notre projet a identifié GFP étiqueté structures gliales à la volée des larves synapse neuromusculaire développement. Pour regarder le développement de vivre gliales-nerf-muscle synapses, nous avons développé une préparation des tissus larvaires qui avait les caractéristiques des larves intactes vivre, mais a également eu de bonnes propriétés optiques. Cette nouvelle préparation a également permis l'accès des perfusates vers la synapse. Nous avons utilisé des larves de mouches, les immergé dans l'hémolymphe artificielle, et assoupli leurs contractions normales du corps rythmés par les paralysant. Ensuite, nous disséqué les segments postérieurs de chaque animal et des insectes avec une épingle émoussée poussé les parties de la bouche vers l'arrière dans la cavité du corps. Cette éversée la paroi du corps larvaire, comme tourner une chaussette à l'envers. Nous avons terminé la dissection aux ciseaux de dissection ultra-fines et donc exposé le côté viscéral du muscles de la paroi du corps. Les structures gliales à la JNM exprimé la GFP membrane cible sous le contrôle de promoteurs spécifiques gliales. La membrane post-synaptique, la SSR (Reticula Subsynaptic) dans le muscle ciblé exprimé synaptiquement DsRed. Nous avions besoin d'acuité l'étiquette des bornes du neurone moteur, la troisième partie de la synapse. Pour ce faire, nous avons appliqué aux anticorps primaires HRP, conjugué à un flurophore émettant rouge lointain. Pour tester les propriétés de diffusion du colorant dans l'espace perisynaptic entre les bornes du neurone moteur et la SSR, nous avons appliqué une solution de molécules de dextran conjugué à grande flurophore émettant rouge lointain et les images collectées.
Protocole
Partie 1: Préparation des tissus
- Notre objectif est une préparation de tissu de larves de mouches, où le système nerveux est intact, mais la surface intérieure de la paroi musculaire du corps est exposé à une hémolymphe artificielle, et peut être positionné à proximité d'un microscope pour lamelle de bonnes qualités optiques. En d'autres termes, une préparation à l'envers des larves.
Depuis des préparations de tissus conventionnels au découpage, épinglant et étirement du muscle de la paroi du corps, et parfois enlever une partie du système nerveux, nous avions besoin d'une approche différente.
Nous voulions que les animaux à l'intérieur-out parce que nous voulions obtenir un bon aperçu des caractéristiques structurelles et des changements structurels au cours du temps dans la synapse, et nous voulions garder le système nerveux intact. Nous voulions aussi éviter d'étirer le tissu, et l'activation de récepteurs d'étirement, ce qui rendrait les muscles à contraction et la ruine de nos images. - Pour commencer, le stade de l'animal. Nourrir les larves troisième et errant larves tiers sont gros et faciles à décortiquer donc nous allons démontrer sur W3 larves. Cet animal est le phénotype a Tubby, et est large, de sorte qu'il est facile d'Evert.
Nous avons seulement utilisé les larves que nous avons vu ramper activement, y compris les larves W3. - Nettoyer la surface d'une mouche avec un pinceau très doux dans une boîte de Petri de H2O bidistillée. Nettoyer les larves ont une meilleure optique et de nettoyage réduit les bactéries.
- Transfert de l'animal à une petite boîte de Petri d'environ 3 ml de glace froide HL-6, et l'hémolymphe artificielle. Mettez le plat sur la glace jusqu'à ce que l'animal cesse de bouger, et détend (environ 5 minutes).
- Tenez pince pointe très fine dans une main et les ciseaux à ressort dans l'autre. J'utilise les ciseaux avec ma main dominante. Faire un petit trou dans la paroi du corps avec les ciseaux pour equlibrate la pression à travers la paroi du corps.
- Tenir l'animal en douceur avec la pince vers le bas sur le fond du plat et couper les deux segments postérieurs. Disséquer loin les viscères et la graisse corporelle sera probablement de sortir de la cavité du corps. Coupez ce tissu aussi.
- Tenir les larves contre le fond plat avec une pince fine. Tenir une broche # 0 insecte (avec une pointe émoussée) et poussez-le contre les pièces buccales de la larve. Poussez les pièces buccales dans la cavité du corps, comme vous tournez une chaussette à l'envers.
- L'intérieur des tissus va ressembler à la figure: ci-dessous. Avec l'outil ultra-fine dissection, disséquer le cadavre de graisse et de la trachioles paroi du corps. Essayez vraiment difficile de ne pas tirer la trachioles, ou déconnecter le système nerveux. Ripping l'trachioles va déchirer les trous dans la paroi musculaire du corps.
Retirer le corps autant de gras que vous pouvez. Ces deux structures perturber la qualité optique de votre tissu. Vous pouvez sauter le café avant de faire cette préparation. - Lorsque vous avez terminé le muscle sera translucide, pas opaque ou blanc. Si vous mettez la préparation de tissu dans HL-6 sans glutamate, à température ambiante, il sera probablement parce que le contrat de façon rythmique générateurs schéma moteur dans le SNC sont travail.
Évitez d'utiliser des préparations avec des muscles du corps mur évidemment contractés, ou irrégulièrement contractés.
L'intérieur des murs intacts corps tend facilement à plier en deux le long de la lignes médianes dorsale et ventrale, alors la prépa donne un droit ou gauche "hémi-animal» à visualiser. - 1.9 Monter les tissus soit dans une chambre de petit volume commercial, comme la chambre de Warner, ou une lame de microscope avec un arrangement lamelle comblé. Voir la partie 3 pour obtenir des suggestions sur le tissu de montage.
Partie 2: Étiquetage Bouton neuronale avec l'anticorps primaire marqué par fluorescence contre la HRP.
- Mettez 50 litres micro de marquage fluorescent anti-corps contre les primaires de HRP dans HL-6 dans une goutte sur une boîte de Pétri. Plonger la préparation dedans-dehors du corps mur dans le bain de teinture. Vous pouvez voir l'étiquetage terminale neurone après environ 5 minutes, mais incuber pendant 10-20 minutes, pour une étiquette complète et claire.
- Rincer le colorant pendant 10-30 secondes dans HL-6 à la température ambiante. Non liés colorant se rince rapidement, de sorte que le cycle de rinçage ne doivent pas être agressifs.
- Varier la concentration de colorant et un temps d'incubation nécessaire.
Partie 3: étiquetage espace Perisynaptic de dextran conjugué flurophore
- Diluer fluorescence conjugué dextrane colorant dilué dans HL-6. Une concentration qui a bien fonctionné pour nos besoins a été:
- Si vous n'êtes pas préoccupés par le calendrier de l'accès à votre colorant dans l'espace extracellulaire, mettre une goutte 20 micro litres de colorant sur un "pont" lamelle (voir partie 4) et le dépôt de la préparation dans le bain de teinture.
Partie 4: Montage du tissus pour la visualisation (avec la microscopie confocale).
Si vous n'avez pas besoin de perfuser votre préparation (observations court) ou que vous voulez garder le volume de la baignade HL-6 petits, utilisez la méthode glisser à double pont
Si vous voulez perfuser votre préparation, essayez d'utiliser une chambre de perfusion. Nous avons utilisé un moChambre à partir dified Instruments Warner.
Détails à la fois pour suivre.
Montage de préparation sur une lame à double pont.
- Utilisez une lame de microscope très propre. Superglue deux carrés, 18mm (# 1.5) des lamelles sur la lame. Laisser un écart de 2 mm entre les bords de la lamelle.
- Laissez la colle sécher complètement, ou il forme un film bizarre sur le milieu aqueux autour de votre préparation.
- Position à l'intérieur des larves entre les bords de la lamelle. Vous pouvez avoir besoin de positionner la prépa sur une diagonale si les larves sont de grandes et de votre système d'acquisition d'image a une matrice de pixels limitée.
- Couvrir le tissu avec une lamelle # 1.5, 18mm (très propre). Respecter le "top" lamelle la diapositive apposé glisse tissus d'accompagnement, avec de la vaseline minime.
- Mettre une goutte d'huile Cargill objectif personnalisé avec un indice de réfraction de 1,3379 (si vous utilisez HL-6) sur la lamelle supérieure et flip cette assemblée plus.
- Positionner l'ensemble des tissus de votre côté du pétrole microscope, vers l'objectif, et de concentrer votre objectif.
Montage du tissu dans une chambre de perfusion modifié. - Collez une lamelle de 1,5 à former un plancher dans la chambre de RC 20. Placez le tissu dans la chambre que par RC-20 des instructions. Utilisez un morceau de filet Nytex au lieu d'une lamelle pour former un toit pour la chambre.
Partie 5: Résultats du représentant:
- Inside-out séquence dissection des tissus de préparation:
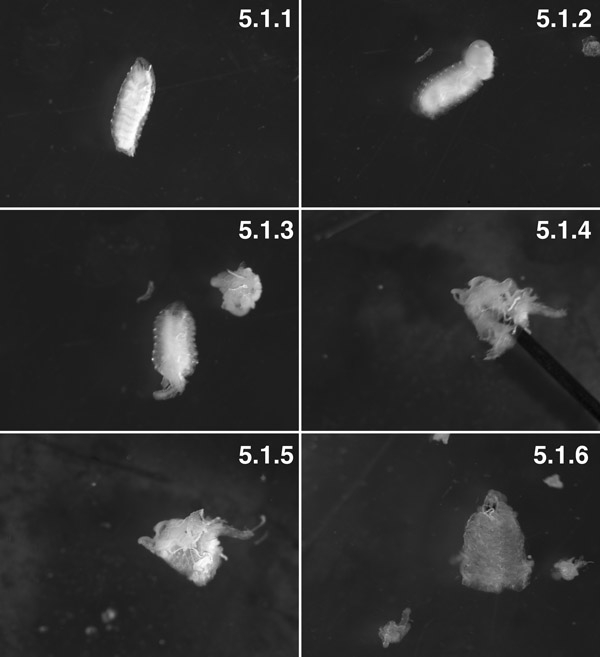
W3 larves, lavé ("Tubby" phénotype) (5.1.1). W3 larves, postérieure 2 segments disséqués. Vous pouvez voir le corps de graisse poussé hors de la cavité du corps par voie trans-corps de pression mur (flèche). Essayez de minimiser viscérale "éruption" en faisant un petit trou dans le mur de corps 1 minute avant la dissection (5.1.2). La préparation avec les viscères disséqué avant de tourner la préparation à l'envers (5.1.3). La préparation, la plupart du temps éversée, avec l'axe (flèche) à l'intérieur du lumen de la prépa (5.1.4). Le muscle est maintenant à l'extérieur et la cuticule est à l'intérieur, avec un corps gras et trachioles attachés (5.1.5). Une préparation des tissus entièrement disséqué avec presque tous les corps gras et trachioles disséqué (5.1.6).
- Direct étiquetage utilisant des anticorps anti-HRP à la JNM larvaire. Un représentant W3 larvaires nerf-muscle synapse avec une extension gliales (intérieur vers l'extérieur-prep). Le neurone moteur terminaux bouton sont marqués avec un primaire anti-corps contre HRP (magenta), qui est conjugué à Cy5. Le processus gliales sont étiquetés avec la GFP (green).
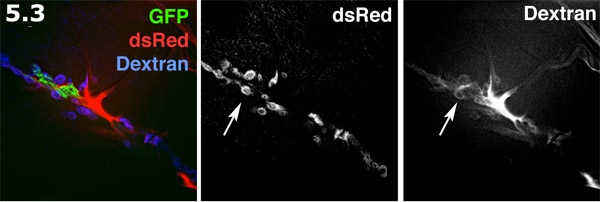
- L'espace Perisynaptic fluorescence visualisées avec Alexa 680 dextrane dans un intérieur vers l'extérieur de préparation. Le processus gliales (vert) est étiqueté avec la GFP membrane cible. La SSR post-synaptique sur la surface du muscle (en bleu) est étiqueté avec DsRed. L'Alexa dextrane (rouge) se concentre dans les zones les formes extracellulaires. Le colorant dextrane formes des piscines en forme de beigne dans les espaces perisynaptic. L'étiquetage de dextran et DsRed SSR étiquetés sont présentés en niveaux de gris. Notez les piscines multiples beignets en forme de teinture mettant en évidence les espaces perisynaptic (flèche).
Access restricted. Please log in or start a trial to view this content.
Discussion
Cette procédure permet à long terme d'imagerie de vivre protéines marquées et les processus cellulaires. La préparation de tissu in situ, nous avons décrit est une SNC intacte et son fonctionnement, PNS et circuits réflexes. Cette préparation de tissus a des avantages sur la norme des larves protocoles musculaire volée, où le muscle du corps larvaire mur est tendu (quand il est tombé sur). Les étirements peuvent fausser la morphologie synaptique et de déclencher des contractions réfle...
Access restricted. Please log in or start a trial to view this content.
Remerciements
Ce projet a été financé par les IRSC et le CRSNG. Nous tenons à remercier Jusiak Barb pour contribuer à la création de souches exprimant volée DsRed étiquetés SSR (ligne BJ), et la UBC de bio-imagerie facilité.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments | |
| HL-6: Artifical Drosophila hemolymph, with 5 mM L-glutamate added, and 2 mM Calcium. | Reagent | N/A | NA | 5 mM L-glutamate blocked muscle contractions. We used Molecular grade L-Glutamate (Sigma).2 mM Calcium is close to physiological Calcium levels in natural larval hemolymph.References: Macleod et al 2002 and Macleod 2004 |
| Dextran, Alex Fluor 680; 10,000 MW, anionic, fixable | Reagent | Molecular Probes, Life Technologies | D34680 | Use a small volume perfusion chamber to keep the total volume of dye low |
| Anti-HRP-CY5 conjugate (goat) | Reagent | Jackson ImmunoResearch | 123-175-021 | Dilute 2.0 mg into 1 ml ddH2O; aliquot into 4 microliter aliquots. Freeze at –20C. Dilute one aliquot into 100 microliters of HL-6 |
| Alexa 647 antibody labeling kit | Reagent | Molecular Probes, Life Technologies | A10475 | We prepared a total of 80 micro liters of conjugated primary antibody, and stored as 2 microliter aliquots. We diluted each aliquot into 100 microliter of HL-6 for labeling. |
| Custom Formulated Objective Oil, refractive index 1.3379 | Reagent | Cargill Labs | Custom Formulated | |
| Ultra Fine Forceps | Tool | Fine Science Tools | 11252-23 or 11295-20 | |
| Spring scissors | Tool | Fine Science Tools | 91500-09 | |
| Ultra fine clipper scissors | Tool | Fine Science Tools | 15200-00 | |
| Perfusion Chamber RC 20 Series | Tool | Warner Instruments | 64-02222 | |
| Spinning Disc confocal | Microscope | Quorum Technologies | Quorum Wave FX | Mounted on a Leica DMI6000 Inverted Microscope |
Références
- Macleod, G. T., Marin, L., Charlton, M., Atwood, H. L. Synaptic Vesicles: Test for a role in presynaptic Calcium regulation. J. Neurosci. 24, 2496-2505 (2004).
- Macleod, G. T., Hegstro, M., Wojtowicz, M., Charlton, M. P., Atwood, H. L. Fast Calcium signals in Drosophila motor neuron terminals. J. Neurophysiology. 88, 2659-2663 (2002).
- Morales, M., Ferrus, A., Martinez-Padron, M. Presynaptic calcium-channel currents in normal and csp mutant Drosophila peptidergic terminals. Eur J Neurosci. 11, 1818-1826 (1999).
- Stork, T., Engelen, D., Krudewig, A., Silies, M., Bainton, R. J., Kla¨mbt, C. Organization and Function of the Blood–Brain Barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon