È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Visualizzazione di Live Drosophila Gliali-giunzione neuromuscolare con tinture fluorescenti
In questo articolo
Riepilogo
Abbiamo descritto le caratteristiche strutturali del Glia-sinapsi neuromuscolare in un preparato romanzo Inside-out tessuto di larve di mosca dal vivo con coloranti fluorescenti con microscopia confocale. Siamo etichettati terminazioni neuronali vivere con anticorpi fluorescenti primario di HRP, e anche visualizzare lo spazio perisynaptic con destrani fluorescenti.
Abstract
Il nostro progetto ha identificato GFP strutture etichettato gliali in via di sviluppo larvale volare sinapsi neuromuscolare. Per vedere lo sviluppo di vivere gliali-neuro-muscolare sinapsi, abbiamo sviluppato una preparazione larvale tessuto che aveva caratteristiche di larve vive intatto, ma ha avuto anche buone proprietà ottiche. Questo nuovo preparato ha anche consentito l'accesso delle perfusates alle sinapsi. Abbiamo usato larve di mosca, immerso in emolinfa artificiale, e rilassato loro normali contrazioni ritmiche del corpo da loro agghiacciante. Poi abbiamo sezionato fuori i segmenti posteriori di ogni animale e con un perno insetti smussato spinto l'apparato boccale indietro attraverso le cavità del corpo. Questo estroflesso il muro larvale corpo, come girare un calzino dentro-fuori. Abbiamo completato la dissezione con finissime forbici dissezione e quindi esposto il lato viscerale dei muscoli della parete del corpo. Le strutture gliali al NMJ espresso GFP mirati membrana sotto il controllo di specifici promotori gliali. La membrana post-sinaptica, la SSR (reticoli Subsynaptic) nei muscoli espresso sinapticamente mirati DsRed. Avevamo bisogno di etichettare acutamente i terminali dei motoneuroni, la terza parte della sinapsi. Per fare questo abbiamo applicato gli anticorpi primari di HRP, coniugata ad un far-rosso flurophore emissione. Per verificare le proprietà di diffusione colorante nello spazio perisynaptic tra i terminali del neurone motore e la SSR, abbiamo applicato una soluzione di grandi molecole destrano coniugato con estrema rosso flurophore emissione e le immagini raccolte.
Protocollo
Parte 1: Preparazione del tessuto
- Il nostro obiettivo è una preparazione tessuto di larve di mosca in cui il sistema nervoso è intatto, ma la superficie interna del muscolo parete del corpo è esposto a una emolinfa artificiale, e può essere posizionato vicino ad un microscopio copertura antiscivolo per una buona ottica. In altre parole, un dentro e fuori la preparazione larvale.
Poiché i preparativi dei tessuti convenzionali relativi al taglio, pinning e stretching il muscolo parete del corpo, ea volte di rimuovere parte del sistema nervoso, avevamo bisogno di un approccio diverso.
Volevamo che gli animali inside-out perché volevamo ottenere una buona occhiata a caratteristiche strutturali e cambiamenti strutturali nel corso del tempo nella sinapsi, e abbiamo voluto mantenere il sistema nervoso intatto. Abbiamo anche voluto evitare l'allungamento dei tessuti, e l'attivazione di recettori, che renderebbe i muscoli a contrazione e rovinare le nostre immagini. - Per cominciare, lo stadio gli animali. Alimentazione delle larve terzo e Wandering larve terzo sono grandi e facili da sezionare quindi dovremo dimostrare sul W3 larve. Questo animale si ha il fenotipo Tubby, ed è larga, quindi è facile da Evert.
Abbiamo usato solo le larve che abbiamo visto attivamente strisciando, tra cui W3 larve. - Pulire la superficie di un verme con un pennello molto morbido in una capsula di Petri di H2O bidistillata. Pulire le larve hanno una migliore ottica e la pulizia riduce i batteri.
- Trasferire l'animale ad una piccola scatola di Petri di circa 3 ml di ghiaccio freddo HL-6, e emolinfa artificiale. Mettere il recipiente sul ghiaccio finché l'animale smette di muoversi, e rilassa (circa 5 minuti).
- Tenere pinze punta molto fine in una mano e le forbici primavera negli altri. Io uso le forbici con la mano dominante. Fai un piccolo foro nella parete del corpo con le forbici per equlibrate la pressione sulla parete del corpo.
- Tenere l'animale delicatamente con la pinza verso il basso sul fondo del piatto e tagliare il posteriore due segmenti. Sezionare via i visceri e il grasso corporeo probabilmente uscire dalla cavità del corpo. Tagliare questo tessuto anche.
- Tenere le larve contro il fondo piatto con una pinza sottile. Tenere un pin # 0 insetto (con una punta smussata) e spingerlo contro le parti della bocca delle larve. Spingere le parti della bocca attraverso la cavità del corpo, come si sta girando un calzino dentro e fuori.
- L'esterno del tessuto sarà simile figura: al di sotto. Con ultra-sottile strumento di dissezione, sezionare via il grasso corporeo e trachioles dalla parete del corpo. Prova davvero difficile non tirare la trachioles, o disconnettere il sistema nervoso. Ripping il trachioles lacererà fori nella parete muscolare del corpo.
Rimuovere il corpo il più grasso possibile. Entrambe queste strutture disturbare la qualità ottica del tessuto. Si consiglia di saltare il caffè prima di fare questa preparazione. - Al termine il muscolo sarà traslucido, non opaco o bianco. Se si inserisce la preparazione dei tessuti in HL-6 senza glutammato, a temperatura ambiente, è probabile che si contrae ritmicamente perché i generatori di pattern motorio del sistema nervoso centrale stanno lavorando.
Evitare di utilizzare prepara con il muscolo del corpo, ovviamente, contratta, o irregolarmente contratto muro.
L'interno intatto dal muro corpo tende facilmente a piegare a metà lungo le linee mediane dorsale e ventrale, quindi la preparazione dà un destro o sinistro "semi-animale" da visualizzare. - 1,9 Montare il tessuto sia in una camera di piccolo volume commerciale, come la camera di Warner, o un vetrino da microscopio con un accordo ponte slittamento di copertura. Vedere la parte 3 per suggerimenti sul tessuto di montaggio.
Parte 2: Etichettatura Bouton neuronale con fluorescente anticorpo primario contro HRP.
- Mettere 50 litri di micro fluorescente primario anti-corpo contro HRP in HL-6 in una goccia su un piatto di Petri. Immergere il dentro-fuori di preparazione parete del corpo nel bagno di tintura. Si può vedere l'etichettatura terminale del neurone dopo circa 5 minuti, ma incubare per 10-20 minuti, per un etichetta completa e luminoso.
- Sciacquare il colorante per 10-30 secondi in HL-6 a temperatura ambiente. Non legato colorante sciacqua via in fretta, così il ciclo di risciacquo non è necessario essere aggressivi.
- Variare la concentrazione di colorante e il tempo di incubazione, se necessario.
Parte 3: etichettatura spazio Perisynaptic con destrano coniugato flurophore
- Diluire destrano colorante fluorescente coniugato diluito in HL-6. Una concentrazione che ha funzionato bene per i nostri scopi è stato:
- Se non siete preoccupati per i tempi di accesso colorante fino al tuo spazio extracellulare, mettere una goccia 20 micro litri di colorante su un vetrino "a ponte" (vedi parte 4) e depositare la preparazione del bagno di tintura.
Parte 4: Montaggio del tessuto per la visualizzazione (con microscopia confocale).
Se non c'è bisogno di perfusione la tua preparazione (osservazione breve) o se si vuole mantenere il volume delle acque di balneazione HL-6 piccoli, utilizzare il metodo della partita doppia scorrimento ponte
Se vuoi perfusione tua preparazione, provare a utilizzare una camera di perfusione. Abbiamo utilizzato un moCamera solidificati Instruments Warner.
Dettagli per entrambi seguono.
Montaggio di preparazione su un doppio ponte di diapositive.
- Utilizzare un vetrino da microscopio molto pulito. Supercolla due quadrate, 18mm (# 1.5) coprioggetto sul vetrino. Lascia un gap 2 mm tra i bordi del coprioggetto.
- Lasciate che la colla completamente asciutto, o si forma un film strano nel mezzo acquoso intorno alla vostra preparazione.
- Posizionare il dentro e fuori le larve tra i bordi del coprioggetto. Potrebbe essere necessario posizionare la preparazione in diagonale, se le larve è grande e il sistema di acquisizione delle immagini è una serie limitata di pixel.
- Coprire il tessuto con un coprioggetto # 1.5, 18mm (molto pulito). Rispettare il coprioggetto "top" della diapositiva apposto scivola tessuto di accompagnamento, con vaselina minimo.
- Mettere una goccia di olio Cargill obiettivo personalizzati con un indice di rifrazione di 1,3379 (se si utilizza HL-6) sul vetrino superiore e capovolgere questa assemblea oltre.
- Posizionare il gruppo del tessuto sul microscopio, lato del petrolio verso l'obiettivo, e mettere a fuoco il tuo obiettivo.
Montaggio del tessuto in una camera perfusione modificato. - Colla di 1,5 coprioggetto per formare un pavimento in camera di 20 RC. Posizionare il tessuto nella camera come da RC-20 istruzioni. Usare un pezzo di nytex maglia al posto di un vetrino per formare un tetto per la camera.
Parte 5: Risultati Rappresentante:
- Inside-out tessuto preparazione sequenza dissezione:
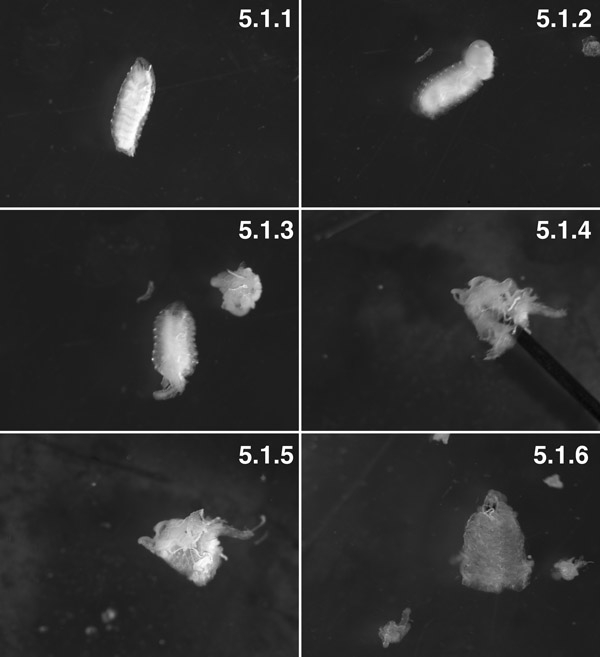
W3 larve, lavato (fenotipo "Tubby") (5.1.1). W3 larve, 2 segmenti posteriore sezionato. Si può vedere il corpo di grasso spinto fuori dalla cavità del corpo da corpo di pressione trans-parete (freccia). Cercare di minimizzare viscerale "eruzione", facendo un piccolo foro nella parete del corpo 1 minuto prima di dissezione (5.1.2). La preparazione con i visceri sezionato prima di accendere la preparazione dentro e fuori (5.1.3). La preparazione, per lo più estroflesso, con il perno (freccia) all'interno del lume della preparazione (5.1.4). Il muscolo è ora sulla parte esterna e la cuticola è sulla parte interna, con un po di grasso corporeo e trachioles allegato (5.1.5). Una preparazione del tessuto completamente sezionato con quasi tutto il corpo grasso e trachioles sezionato (5.1.6).
- Vivere con l'etichettatura anti-HRP al NMJ larvale. Un rappresentante W3 larvale sinapsi neuro-muscolare con estensione gliali (dentro e fuori-prep). Il motore neurone terminali bouton sono etichettati con un primario anti-corpo contro HRP (magenta), che è coniugato con Cy5. I processi gliali sono etichettati con GFP (verde).
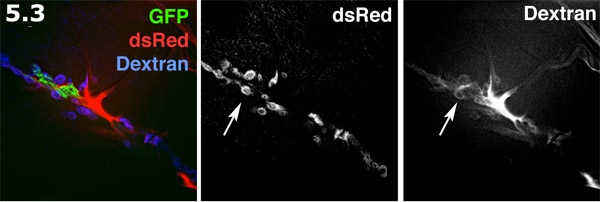
- Spazio Perisynaptic fluorescenti visualizzati con Alexa 680 destrano in un dentro e fuori di preparazione. Il processo gliali (verde) è marcato con GFP membrana mirati. Il post-sinaptica SSR sulla superficie del muscolo (blu) è etichettato con DsRed. Il Alexa destrano (rosso) le forme si concentra nelle aree extracellulare. Il colorante destrano forme piscine a forma di ciambella negli spazi perisynaptic. L'etichettatura destrano e DsRed SSR verranno indicati in scala di grigi. Si noti la serie di piscine a forma di ciambella colorante evidenziando gli spazi perisynaptic (freccia).
Access restricted. Please log in or start a trial to view this content.
Discussione
Questa procedura permette di lungo termine imaging di vivere proteine etichettati e processi cellulari. La preparazione in loco dei tessuti che abbiamo descritto ha un sistema nervoso centrale integro e funzionante, PNS e circuiti riflessi. Questa preparazione del tessuto ha dei vantaggi rispetto protocolli standard di volare larvale muscolare, in cui si distende il muscolo larvale parete del corpo (quando è appuntato fuori). Lo stretching può alterare la morfologia sinaptica e innescare riflessi contra...
Access restricted. Please log in or start a trial to view this content.
Riconoscimenti
Questo progetto è stato finanziato dalla CIHR e NSERC. Vorremmo riconoscere Jusiak Barb per contribuire alla creazione di ceppi volare esprimere DsRed etichettati SSR (linea BJ), e la Bio-imaging UBC Facility.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments | |
| HL-6: Artifical Drosophila hemolymph, with 5 mM L-glutamate added, and 2 mM Calcium. | Reagent | N/A | NA | 5 mM L-glutamate blocked muscle contractions. We used Molecular grade L-Glutamate (Sigma).2 mM Calcium is close to physiological Calcium levels in natural larval hemolymph.References: Macleod et al 2002 and Macleod 2004 |
| Dextran, Alex Fluor 680; 10,000 MW, anionic, fixable | Reagent | Molecular Probes, Life Technologies | D34680 | Use a small volume perfusion chamber to keep the total volume of dye low |
| Anti-HRP-CY5 conjugate (goat) | Reagent | Jackson ImmunoResearch | 123-175-021 | Dilute 2.0 mg into 1 ml ddH2O; aliquot into 4 microliter aliquots. Freeze at –20C. Dilute one aliquot into 100 microliters of HL-6 |
| Alexa 647 antibody labeling kit | Reagent | Molecular Probes, Life Technologies | A10475 | We prepared a total of 80 micro liters of conjugated primary antibody, and stored as 2 microliter aliquots. We diluted each aliquot into 100 microliter of HL-6 for labeling. |
| Custom Formulated Objective Oil, refractive index 1.3379 | Reagent | Cargill Labs | Custom Formulated | |
| Ultra Fine Forceps | Tool | Fine Science Tools | 11252-23 or 11295-20 | |
| Spring scissors | Tool | Fine Science Tools | 91500-09 | |
| Ultra fine clipper scissors | Tool | Fine Science Tools | 15200-00 | |
| Perfusion Chamber RC 20 Series | Tool | Warner Instruments | 64-02222 | |
| Spinning Disc confocal | Microscope | Quorum Technologies | Quorum Wave FX | Mounted on a Leica DMI6000 Inverted Microscope |
Riferimenti
- Macleod, G. T., Marin, L., Charlton, M., Atwood, H. L. Synaptic Vesicles: Test for a role in presynaptic Calcium regulation. J. Neurosci. 24, 2496-2505 (2004).
- Macleod, G. T., Hegstro, M., Wojtowicz, M., Charlton, M. P., Atwood, H. L. Fast Calcium signals in Drosophila motor neuron terminals. J. Neurophysiology. 88, 2659-2663 (2002).
- Morales, M., Ferrus, A., Martinez-Padron, M. Presynaptic calcium-channel currents in normal and csp mutant Drosophila peptidergic terminals. Eur J Neurosci. 11, 1818-1826 (1999).
- Stork, T., Engelen, D., Krudewig, A., Silies, M., Bainton, R. J., Kla¨mbt, C. Organization and Function of the Blood–Brain Barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon