Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Визуализация Живая Drosophila Глиальные-нервно-мышечном соединении с флуоресцентными красителями
Резюме
Мы описали особенности строения Глия-нервно-мышечных синапсов в романе наизнанку ткани подготовке живых личинок лету с помощью флуоресцентных красителей с конфокальной микроскопии. Мы живем помечены терминалами нейрона с люминесцентными первичных антител к HRP, а также визуализировать perisynaptic пространство с люминесцентными декстраны.
Аннотация
Наш проект определили GFP помечены глиальные структуры на развивающихся личиночных синапсов летать нервно-мышечной. Чтобы посмотреть на развитие живых глиальных-нервно-мышечных синапсов, мы разработали личиночной подготовки ткани, которая была особенностей живой нетронутой личинки, но и имели хорошие оптические свойства. Это новый препарат также позволило для доступа к perfusates синапс. Мы использовали личинки мух, погруженный их в искусственных гемолимфы, и расслабленным их нормальной ритмические сокращения тела путем охлаждения их. Далее мы расчлененный от задних сегментов каждого животного и с тупым контактный насекомых толкнул рот частей назад через полость тела. Это вывернутый личиночной стенкой тела, как поворотный носок наизнанку. Мы завершили вскрытие с ультра-тонкие ножницы вскрытие и таким образом, подвергается висцеральной стороны мышц стенки тела. Глиальных структур на NMJ выразил мембраны целевых GFP под контролем глиальных конкретных промоутеров. Постсинаптической мембраны, ССР (субсинаптической сеточек) в мышечных выразил синаптически целевых DsRed. Нам нужно было остро этикетке двигательный нейрон терминалов, третьей части синапса. Для этого мы обратились первичные антитела к HRP, сопряженных с дальней красной излучающих flurophore. Для проверки свойств красителя диффузии в perisynaptic пространство между двигательный нейрон терминалов и ССР, мы применили решения больших молекул Декстран конъюгированных с дальней красной flurophore излучающих и собрал изображений.
протокол
Часть 1: Подготовка ткани
- Наша цель состоит в подготовке ткани личинки мух, где нервная система не повреждена, но внутренняя поверхность мышц стенки тела подвергается воздействию искусственного гемолимфы, и может быть расположен близко к скольжению микроскопа прикрытие для хорошей оптикой. Другими словами, наизнанку личиночной стадии подготовки.
Так как обычные тканевые препараты включают резки, фиксации и растяжения мышц стенки тела, а иногда и удаление части нервной системы, нам нужно другой подход.
Мы хотели животных наизнанку, потому что мы хотели получить хороший взгляд на структурные особенности и структурные изменения с течением времени в синапс, и мы хотели сохранить нервную систему без изменений. Мы также хотели, чтобы избежать растяжения ткани, и активируя рецепторы растяжения, что сделает мышцы дергаться и разорение наших изображений. - Во-первых, этап животных. Кормление личинок и третья Блуждающие личинки третьего большие и легко вскрыть, поэтому мы покажем на W3 личинок. Это животное имеет Табби фенотип, и широкий, поэтому она легко Эверт.
Мы используется только личинки, которые мы видели активно ползать, в том числе W3 личинок. - Очистите поверхность личинки с очень мягкой кистью в чашке Петри бидистиллированной H2O. Чистая личинок лучше оптика и очистки снижает бактерий.
- Передача животных в небольшой чашке Петри около 3 мл ледяной HL-6, и искусственные гемолимфы. Поставьте блюдо на льду, пока животное перестает двигаться, и расслабляет (около 5 минут).
- Держите очень тонкий кончик пинцетом в одной руке и весной ножницами в другой. Я использую ножницы с моей доминирующей рукой. Сделайте небольшое отверстие в стенке тела с ножницами, чтобы equlibrate давления на стенки тела.
- Держите животное осторожно пинцетом вниз на дно тарелки и отрезали заднюю двух сегментов. Рассеките от внутренностей и жира в организме, вероятно, выйти из полости тела. Срежьте этой ткани также.
- Держите личинки против блюдо дно с мелким щипцами. Держите # 0 насекомое булавкой (с тупым кончиком) и нажмите на нее против устья части личинок. Нажмите рот частей через полость тела, как вы превращаете носок наизнанку.
- Наизнанку ткани будет выглядеть фигура: ниже. С ультра-тонкой рассекает инструмент, рассекают от жира в организме и trachioles от стенки тела. Очень постараться, чтобы не тянуть trachioles, или отключите нервной системы. Копирование trachioles будет рип отверстия в мышцах стенки тела.
Удалить столько жира, сколько сможете. Обе эти структуры нарушить оптическое качество вашей ткани. Вы можете пропустить кофе, прежде чем делать этого препарата. - Когда вы закончите мышцы будут полупрозрачными, а не непрозрачными или белый. Если вы поместите ткань приготовительные в HL-6 без глутамата, при комнатной температуре, оно, скорее всего, контракт ритмично так как шаблон двигатель-генераторы в ЦНС работают.
Избегайте использования подготавливает с явно контракт, или нерегулярно контракт мышц стенки тела.
Нетронутым наизнанку стенки тела легко как правило, раз пополам вдоль спинной и брюшной средней линии, так что приготовительные дает влево или вправо "полу-животное" для визуализации. - 1,9 горе ткани в любом небольшом объеме коммерческих камеры, такие как Warner камеры, или стекло микроскопа с моста расположение скольжения покрытия. См. часть 3 для предложений по монтажу ткани.
Часть 2: Нейронные Маркировка Бутона с флуоресцентно меченных первичного антитела против ПХ.
- Положите 50 микро литров флуоресцентно меченных первичных антител против HRP в HL-6 в капли на чашку Петри. Погрузите наизнанку стенки тела приготовительные в красителе ванну. Вы можете увидеть нейрон терминал маркировки примерно через 5 минут, но инкубировать в течение 10-20 минут, для полной и яркой этикеткой.
- Промыть красителя от 10-30 секунд в HL-6 при комнатной температуре. Номера связаны краситель смывается быстро, так что цикл полоскания не должны быть агрессивными.
- Вары концентрации красителя и времени инкубации по мере необходимости.
Часть 3: Perisynaptic маркировки пространство с декстран flurophore сопряженных
- Развести флуоресцентно сопряженных декстрана красителя разводят в HL-6. Концентрации, которая работает хорошо для наших целей было:
- Если вы не обеспокоены сроки красителем доступ в вашу межклеточное пространство, поставить 20 микро-литровый капли красителя на "мост" покровное (см. часть 4) и депозитных приготовительные в красителе ванну.
Часть 4: Монтаж тканей для визуализации (с конфокальной микроскопии).
Если у вас нет необходимости заливать ваш приготовительные (короткий наблюдений) или вы хотите сохранить объемы купания HL-6 небольших, используйте метод двойного моста слайд
Если вы хотите заливать ваш приготовительные, попробуйте использовать перфузии камеры. Мы использовали движениеdified палаты из инструментов Warner.
Подробная информация для обоих следовать.
Монтаж приготовительные на двойной мост слайда.
- Используйте очень чистый предметное стекло. Суперклей два квадрата, 18мм (# 1.5) покровные на слайде. Оставьте 2 мм между краями покровные.
- Пусть клей полностью высохнет, или он будет форме странные пленки по водной среде вокруг преп.
- Позиция наизнанку личинки между краями покровные. Возможно, вам придется позиции приготовительные по диагонали, если личинок крупных и ваше изображение системы сбора имеет ограниченный массив пикселей.
- Обложка ткани с № 1.5 покровное, 18мм (очень чистая). Придерживайтесь "сверху" покровное слайд прикреплена ткань фланговые скользит, с минимальным вазелином.
- Поместите каплю масла Cargill цель обычай с показателем преломления 1,3379 (если вы используете HL-6) на верхней покровное и отражение этой сборке более.
- Расположите ткань сборку на микроскоп, масло стороны в сторону цели, и сосредоточить свои цели.
Монтаж ткани в изменение перфузии камеры. - Клей 1,5 покровное для формирования пола в RC-20 камеры. Поместите ткань в камере в соответствии с RC-20 инструкций. Используйте кусок Nytex сеткой вместо покровное к форме крыши для камеры.
Часть 5: Представитель Результаты:
- Наизнанку подготовки ткани вскрытия последовательности:
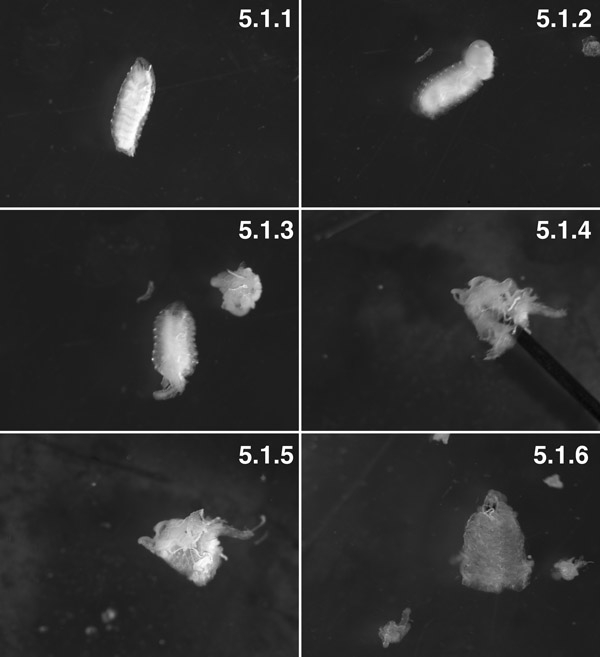
W3 личинки, промывают ("Табби" фенотип) (5.1.1). W3 личинки, задние 2 сегмента расчленены. Вы можете видеть, жира выталкивается из полости тела по транс-стенки тела давления (стрелка). Постарайтесь свести к минимуму висцерального "извержения", сделав небольшое отверстие в стенке тела за 1 минуту до вскрытия (5.1.2). Приготовительный с внутренностями расчлененный до поворота приготовительные наизнанку (5.1.3). Приготовительный, в основном вывернутые, с пальцем (стрелка) внутри просвета приготовительные (5.1.4). Мышцы в настоящее время на улицу и кутикулы с внутренней стороны, с некоторыми жира в организме и trachioles прилагается (5.1.5). Полностью расчлененные подготовки ткани почти со всеми жира в организме и trachioles расчлененный (5.1.6).
- Живая маркировки с использованием анти-HRP на личиночной NMJ. Представитель W3 личиночной нервно-мышечного синапса с глиальных расширение (наизнанку-подготовки). Двигательных нейронов Bouton терминалы помечены первичных антител против HRP (пурпурный), которая сопряжена с Cy5. Глиальных процессов помечены GFP (зеленый).
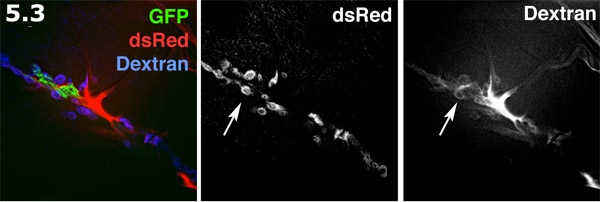
- Perisynaptic пространства флуоресцентно визуализированы с Alexa 680 декстрана в наизнанку преп. Глиальных процесс (зеленый) помечена мембраны целевых GFP. Постсинаптических ССР мышцы поверхности (синие) помечена DsRed. Alexa декстрана (красный) форм концентрируется в внеклеточных областях. Декстран красителя формы пончика формы бассейнов в perisynaptic пространств. Маркировки декстрана и DsRed помечены ССР представлены в оттенках серого. Обратите внимание, несколько пончиков формы бассейны красителя подсветка perisynaptic пространства (стрелка).
Обсуждение
Эта процедура позволяет долгосрочных изображений живых меченых белков и клеточных процессов. На месте приготовительные ткани мы описали еще нетронутыми и функционирование ЦНС, ПНС и рефлекторных цепей. Эта ткань приготовительные имеет преимущества перед стандартными личиночно...
Благодарности
Этот проект был профинансирован CIHR и NSERC. Мы хотели бы выразить признательность Барб Jusiak за вклад в создание летать штаммов выражения DsRed помечены ССР (BJ линия), и UBC Био-изображений фонда.
Материалы
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| HL-6: Artifical Drosophila hemolymph, with 5 mM L-glutamate added, and 2 mM Calcium. | Reagent | NA | NA | 5 mM L-glutamate blocked muscle contractions. We used Molecular grade L-Glutamate (Sigma). 2 mM Calcium is close to physiological Calcium levels in natural larval hemolymph. References: Macleod et al 2002 and Macleod 2004 |
| Dextran, Alex Fluor 680; 10,000 MW, anionic, fixable | Reagent | Molecular Probes/Invitrogen | D34680 | Use a small volume perfusion chamber to keep the total volume of dye low |
| Anti-HRP-CY5 conjugate (goat) | Reagent | Jackson ImmunoResearc | 123-175-021 | Dilute 2.0 mg into 1 ml ddH2O; aliquot into 4 microliter aliquots. Freeze at –20C. Dilute one aliquot into 100 microliters of HL-6 |
| Alexa 647 antibody labeling kit | Reagent | Molecular Probes/Invitrogen | A10475 | We prepared a total of 80 micro liters of conjugated primary antibody, and stored as 2 microliter aliquots. We diluted each aliquot into 100 microliter of HL-6 for labeling. |
| Custom Formulated Objective Oil, refractive index 1.3379 | Reagent | Cargill Labs | Custom Formulated | |
| Ultra Fine Forceps | Tool | Fine Science Tolls | 11252-23 or 11295-20 | |
| Spring scissors | Tool | Fine Science Tools | 91500-09 | |
| Ultra fine clipper scissors | Tool | Fine Science Tools | 15200-00 | |
| Perfusion Chamber RC 20 Series | Tool | Warner Instruments | 64-02222 | |
| Spinning Disc confocal | Microscope | Quorum | Quorum Wave FX | Mounted on a Leica DMI6000 Inverted Microscope |
Ссылки
- Macleod, G. T., Marin, L., Charlton, M., Atwood, H. L. Synaptic Vesicles: Test for a role in presynaptic Calcium regulation. J. Neurosci. 24, 2496-2505 (2004).
- Macleod, G. T., Hegstro, M., Wojtowicz, M., Charlton, M. P., Atwood, H. L. Fast Calcium signals in Drosophila motor neuron terminals. J. Neurophysiology. 88, 2659-2663 (2002).
- Morales, M., Ferrus, A., Martinez-Padron, M. Presynaptic calcium-channel currents in normal and csp mutant Drosophila peptidergic terminals. Eur J Neurosci. 11, 1818-1826 (1999).
- Stork, T., Engelen, D., Krudewig, A., Silies, M., Bainton, R. J., Kla¨mbt, C. Organization and Function of the Blood–Brain Barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены