Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Canlı görselleştirme Drosophila Glial nöromüsküler Kavşağı
Özet
Biz sinek larvaları konfokal mikroskobu ile floresan boyalar kullanarak canlı bir roman Tersyüz doku hazırlanması Glia nöromüsküler sinapsların yapısal özellikleri nitelendirdi. Biz HRP için flüoresan primer antikor ile canlı nöron terminalleri etiketli ve floresan Dextrans perisynaptic alan görüntülendi.
Özet
Projemiz, gelişmekte olan larva, sinek nöromüsküler sinaps GFP etiketli glial yapıları belirledi. Canlı glial-sinir-kas sinaps geliştirme bakmak için canlı bozulmamış larvalarının özellikleri olan bir larva doku hazırlama geliştirdi, ama aynı zamanda iyi bir optik özellikleri vardı. Bu yeni hazırlık sinaps guruplarına erişim için izin verdi. Biz, sinek larvaları kullanılan yapay hemolimf onları dalmış ve onları ürpertici normal ritmik vücut kasılmaları rahat. Sonra her bir hayvanın arka kesimlerine disseke ve künt bir böcek iğne ile vücut boşluğu yoluyla ağız parça geriye itti. Bu çorap, iç-dış torna gibi, larva vücut duvarının dışa dönük. Biz ultra-ince diseksiyon diseksiyon makas ile tamamladı ve böylece vücut duvarı kasları visseral yan maruz. NMJ glial yapıları glial özel yararlanıcı kontrolü altında membran hedeflenen GFP dile getirdi. Kas post-sinaptik membran, SSR (Subsynaptic Reticula) synaptically dsRed hedef dile getirdi. Biz akut motor nöron terminalleri, sinaps üçüncü bölümü etiket gerekiyordu. Bunu yapmak için çok kırmızı yayan flurophore konjuge primer antikor, HRP uygulanır. Motor nöron terminalleri ve SSR arasında perisynaptic uzaya boya difüzyon özellikleri test etmek için, uzak-kırmızı yayan flurophore ve toplanan görüntüleri konjuge büyük Dextran'ın moleküllerin bir çözüm uyguladı.
Protokol
Bölüm 1: Doku Hazırlama
- Amacımız, sinir sisteminin sağlam olduğunu sinek larvaları bir doku hazırlama, ancak vücut duvarı kasının iç yüzeyi yapay bir hemolimf maruz kalan ve iyi optik mikroskop kapağı kayma yakın yerleştirilmiş olabilir. Diğer bir deyişle, larva hazırlık çıkış içinde.
Kesme, iğneleme ve vücut duvarı kas germe ve bazen sinir sisteminin bir parçası kaldırarak geleneksel doku preparatları içeren bu yana, biz farklı bir yaklaşım gerekiyordu.
Biz, yapısal özellikleri ve sinaps zaman içinde yapısal değişiklikler iyi bir görünüm almak istedim, çünkü iç-dış hayvanlar istedim, ve sinir sistemi sağlam tutmak istedim. Ayrıca doku germe önlemek istedim ve kasları kasılan ve görüntü berbat gerilme reseptörleri aktive. - Yeni başlayanlar için, hayvanların sahne. Üçüncü larva Beslenme ve üçüncü larva Wandering W3 larvaları açılayacağız incelemek için büyük ve kolay. Bu hayvan Tubby fenotip ve geniş, bu yüzden tersyüz etmek kolaydır.
Biz sadece biz aktif W3 larvaları da dahil olmak üzere, tarama gördüğünü larvaları kullanılır. - Bir kurtçuk çift distile H2O bir petri çok yumuşak bir fırça ile yüzeyi temizleyin. Temizlik larvalar daha iyi optik ve temizleme bakterileri azaltır.
- HL-6, 3 ml buz hakkında küçük petri ve yapay hemolimf hayvan aktarın. Hayvan hareket durur ve (yaklaşık 5 dakika) rahatlatır kadar buz üzerinde tabak koyun.
- Bir yandan ve diğer yaylı makas çok ince uçlu forseps tutun. Benim dominant elin makas kullanın. Vücut duvarı boyunca basınç equlibrate makas ile vücut duvarında küçük bir delik açın.
- Hayvan aşağı çanak alt forseps ile yavaşça tutun ve arka iki kesimi kesmek. Organlar uzak inceleyin ve yağ vücut olasılıkla vücut boşluğunda hareket edecek. Bu doku da kesip.
- Larvaları ince forseps ile çanak alt karşı tutun. # 0 böcek pin tutun (künt bir ucu ile) ve larvaların ağız parçaları karşı itin. Eğer dışarı içinde bir çorap dönüm gibi vücut boşluğu ile ağız parçaları itin.
- Doku içinde dışarı rakam gibi görünecektir: aşağıda. Ultra-ince kesme aleti ile yağ vücut ve trachioles vücut duvarından uzak teşrih. Trachioles çekmek için gerçekten zor değil deneyin, ya da sinir sistemi çıkarın. Trachioles Kopyalamak vücut duvarı kas delik rip.
Mümkün olduğu kadar yağlı vücut çıkarın. Bu yapıların her ikisi de doku optik kalitesi bozabilir. Bu preparatın yapmadan önce kahve atlamak isteyebilirsiniz. - Bitirdiğinizde kas şeffaf, opak veya beyaz olacaktır. Glutamat olmadan doku hazırlık HL-6 içine koyarsanız, MSS, motor desen jeneratörler çalışma olduğu için, oda sıcaklığında, büyük olasılıkla ritmik sözleşme olacaktır.
Açıkça sözleşmeli ya da düzensiz sözleşmeli vücut duvarı kas preparatlarıyla kullanmaktan kaçının.
Vücut duvarından dışarı bozulmamış içinde kolayca dorsal ve ventral midlines boyunca yarım kat eğilimindedir, bu nedenle hazırlık görselleştirmek için sol veya sağ hemi-hayvan "verir. - 1.9 Warner odası gibi küçük hacimli ticaret odasının, ya da Köprülü kapak kayma düzenleme ile bir mikroskop lamı ya doku monte edin. Montaj doku önerileri için bölüm 3 bakın.
Bölüm 2: HRP karşı floresan etiketli primer antikor ile Nöronal Bouton Etiketleme.
- HL-6 HRP karşı floresan etiketli birincil anti-beden 50 mikro litre petri bir damla koyun. Iç-dış boya banyosu içinde vücut duvarı hazırlık bırakın. Yaklaşık 5 dakika sonra nöron terminaline etiketleme, ancak tam ve parlak bir etiket için, 10-20 dakika boyunca inkübe.
- HL-6 oda sıcaklığında 10-30 saniye boya durulayın. Sigara bağlı boya durulama agresif olması gerekmez, çabuk durular.
- Boya konsantrasyonu ve inkübasyon süresi gerektiği gibi değişir.
Bölüm 3: dekstran flurophore konjuge Perisynaptic alan etiketleme
- Sulandırınız floresan konjuge dekstran boya HL-6 seyreltilir. Iyi amaçlar için çalışan bir konsantrasyon:
- Ekstrasellüler alanı içine boya erişim zamanlaması hakkında söz konusu değilse, "köprülenmiş" lamel (bkz. bölüm 4), boya, 20 mikro litre damla koyun ve boya banyosunda hazırlık yatırmak.
Bölüm 4: görselleştirme (konfokal mikroskobu ile) için doku Montajı.
(Kısa gözlemler) hazırlık serpmek gerek yok veya HL-6 küçük banyo hacmi tutmak istiyorsanız, çift köprülenmiş slayt yöntemi kullanın
Hazırlık serpmek istiyorsanız, bir perfüzyon odasında kullanmayı deneyin. Biz bir moWarner Instruments dified Odası.
Hem de takip Ayrıntılar.
Montaj bir çift köprülenmiş slayt hazırlık.
- Çok temiz bir mikroskop lamı kullanın. Superglue slayt üzerine iki kare, 18mm (1.5) lamelleri. Lamelleri kenarları 2 mm arasında bir boşluk bırakın.
- Tutkal tamamen kurumasına izin verin, ya da hazırlık etrafında sulu ortam içinde garip bir film tabakası oluşturur.
- Lamelleri kenarları arasındaki larvaları dışarı içine yerleştirin. Larvaların büyük ve görüntü toplama sistemi sınırlı bir piksel varsa diyagonal bir hazırlık konumuna gerekebilir.
- 18mm # 1.5 lamel, (çok temiz) ile doku örtün. Slayt, minimal vazelin, doku sınırdaş fişleri yapıştırılmış "top" lamel uyun.
- Üst lamel 1,3379 bir kırılma indeksi (HL-6) ile Cargill özel amacı petrol bir damla koyun ve bu derleme ters çevirin.
- Hedefi doğru mikroskop, petrol yan doku montaj pozisyonu ve objektif odak.
Değiştirilmiş bir perfüzyon odasında doku Montajı. - 20 RC odasında bir zemin oluşturmak için Tutkal 1.5 lamel. RC-20 talimatlara göre odasında doku yerleştirin. Odası için bir çatı oluşturmak yerine bir lamel Nytex mesh bir parça kullanın.
Bölüm 5: Temsilcilik Sonuçları:
- Tersyüz doku hazırlanması diseksiyonu sırası:
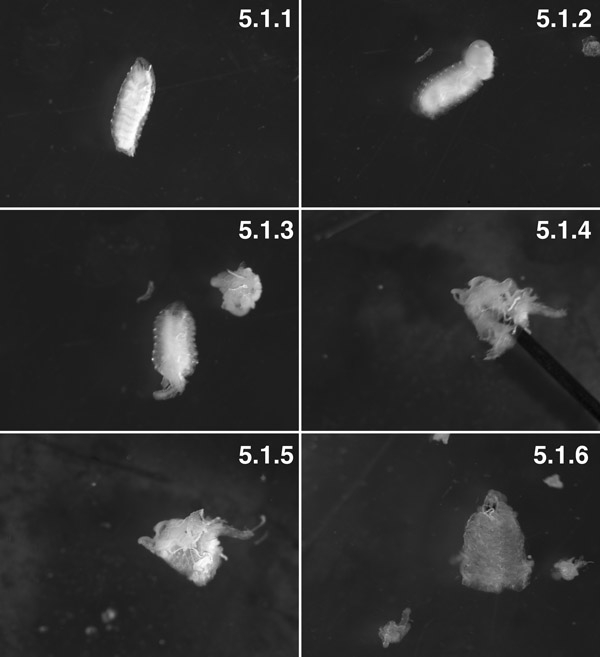
W3 larvaları, yıkanmış ("Tubby" fenotipi) (5.1.1). W3 larvaları, arka 2 segmentleri disseke. , Trans-vücut duvarı basıncı (ok) ile vücut boşluğu dışına itti yağ vücut görebilirsiniz. Visseral "patlaması" diseksiyonu önce vücut duvarı 1 dakika (5.1.2) küçük bir delik yaparak en aza indirmeye çalışın. Organları ile hazırlık dışarı içinde hazırlık (5.1.3) açmadan önce disseke. Pin (ok) (5.1.4) hazırlık lümen içinde çoğunlukla dışa dönük hazırlık,. Kas dışında ve manikür, (5.1.5) bağlı bazı yağlı vücut ve trachioles, iç. Neredeyse tüm yağlı vücut ve disseke trachioles (5.1.6) ile tam olarak disseke doku hazırlanması.
- Canlı larva NMJ anti-HRP kullanarak etiketleme. Glial bir uzantısı (dışarı hazırlık içinde) bir temsilci W3 larva sinir-kas sinaps. Cy5 için konjuge HRP (magenta), karşı bir anti-vücudun birincil motor nöron bouton terminalleri ile etiketlenir. Glial süreçleri GFP (yeşil) ile etiketlenir.
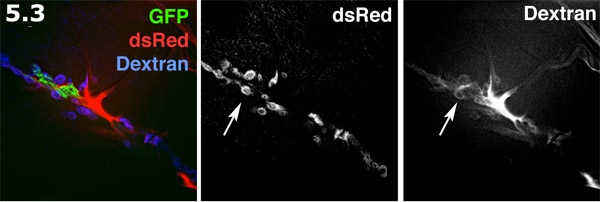
- Perisynaptic alan floresan hazırlık dışında bir iç Alexa 680 dekstran ile görüntülendi. Glial süreci (yeşil), membran hedef GFP ile etiketlenir. Kas yüzeyinde post-sinaptik SSR (mavi) dsRed etiketlenir. Alexa dekstran (kırmızı) formları ekstrasellüler alanlarda yoğunlaşmaktadır. Dekstran boya perisynaptic alanlarda çörek şeklinde havuzlar oluşturur. Dekstran etiketleme ve dsRed etiketli SSR gri tonlamalı gösterilmiştir. Perisynaptic alanlarda (ok) vurgulayarak çok çörek şeklinde boya havuzları unutmayın.
Tartışmalar
Bu prosedür, canlı etiketli proteinler ve hücre süreçlerinin uzun vadeli görüntüleme izin verir. Açıklanan in situ doku hazırlık ve işleyişi sağlam bir merkezi sinir sistemi, PNS ve refleks devreler vardır. Bu doku hazırlık larva vücut duvarı kas gergin standart larva, sinek kas protokolleri, (tutturulmuş.) Üzerinde avantajları vardır. Esneme sinaptik morfolojisi deforme ve refleks tabanlı kasılmaları tetikleyebilir. Hazırlık dışarı içinde mekanik olarak dayanıklı ve gerçek z...
Teşekkürler
Bu proje CIHR ve NSERC tarafından finanse edildi. Barb Jusiak dsRed etiketli SSR (BJ çizgi) ve UBC Biyo-görüntüleme Tesis ifade sinek suşlarının yaratılmasına katkıda bulunmak için kabul etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments | |
| HL-6: Artifical Drosophila hemolymph, with 5 mM L-glutamate added, and 2 mM Calcium. | Reagent | N/A | NA | 5 mM L-glutamate blocked muscle contractions. We used Molecular grade L-Glutamate (Sigma).2 mM Calcium is close to physiological Calcium levels in natural larval hemolymph.References: Macleod et al 2002 and Macleod 2004 |
| Dextran, Alex Fluor 680; 10,000 MW, anionic, fixable | Reagent | Molecular Probes, Life Technologies | D34680 | Use a small volume perfusion chamber to keep the total volume of dye low |
| Anti-HRP-CY5 conjugate (goat) | Reagent | Jackson ImmunoResearch | 123-175-021 | Dilute 2.0 mg into 1 ml ddH2O; aliquot into 4 microliter aliquots. Freeze at –20C. Dilute one aliquot into 100 microliters of HL-6 |
| Alexa 647 antibody labeling kit | Reagent | Molecular Probes, Life Technologies | A10475 | We prepared a total of 80 micro liters of conjugated primary antibody, and stored as 2 microliter aliquots. We diluted each aliquot into 100 microliter of HL-6 for labeling. |
| Custom Formulated Objective Oil, refractive index 1.3379 | Reagent | Cargill Labs | Custom Formulated | |
| Ultra Fine Forceps | Tool | Fine Science Tools | 11252-23 or 11295-20 | |
| Spring scissors | Tool | Fine Science Tools | 91500-09 | |
| Ultra fine clipper scissors | Tool | Fine Science Tools | 15200-00 | |
| Perfusion Chamber RC 20 Series | Tool | Warner Instruments | 64-02222 | |
| Spinning Disc confocal | Microscope | Quorum Technologies | Quorum Wave FX | Mounted on a Leica DMI6000 Inverted Microscope |
Referanslar
- Macleod, G. T., Marin, L., Charlton, M., Atwood, H. L. Synaptic Vesicles: Test for a role in presynaptic Calcium regulation. J. Neurosci. 24, 2496-2505 (2004).
- Macleod, G. T., Hegstro, M., Wojtowicz, M., Charlton, M. P., Atwood, H. L. Fast Calcium signals in Drosophila motor neuron terminals. J. Neurophysiology. 88, 2659-2663 (2002).
- Morales, M., Ferrus, A., Martinez-Padron, M. Presynaptic calcium-channel currents in normal and csp mutant Drosophila peptidergic terminals. Eur J Neurosci. 11, 1818-1826 (1999).
- Stork, T., Engelen, D., Krudewig, A., Silies, M., Bainton, R. J., Kla¨mbt, C. Organization and Function of the Blood–Brain Barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır