A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
نبض مطاردة تحليل سلاسل السكر N - الموصولة من جليكوبروتينات في خلايا الثدييات
In This Article
Summary
نحن تصف طريقة لتحليل تحوير N - مرتبطة glycans خلال السنوات الاولى من حياة جليكوبروتينات بعد الحيوي في خلايا الثدييات. ويتحقق ذلك من خلال نبض مطاردة تحليل عملية الأيض glycans المسمى ، وإطلاق سراح من الأنزيمية جليكوبروتينات والفحص بواسطة HPLC.
Abstract
تعلق GLC
Protocol
ويهدف البروتوكول التالي لتحليل سلاسل من السكر جليكوبروتينات الكلي أو من بروتين سكري محددة من الفائدة. هذا الإجراء هو في الأساس نفسه لكلا الحالتين مع إجراء تعديلات قليلة كما هو مذكور في جميع أنحاء البروتوكول.
- لوصفها الأيضية من N - مرتبطة glycans واحد يحتاج إلى استخدام الثقافة subconfluent من خلايا الثدييات نمت بين عشية وضحاها في صحن 90 مم لكل عينة (عينات قد تمثل نقطة زمنية مختلفة أو العلاج). هو الأمثل لهذا البروتوكول الخلايا NIH 3T3.
- تجويع الخلايا للجلوكوز عن طريق حضانة في 5 مل من المتوسط قبل حرارة (37 درجة مئوية) خالية من السكر الطازجة ، المزود مع FCS مدال 10 ٪ و 4 ملم لالبيروفات الصوديوم 5-15 دقائق.
- استبدال المتوسطة التجويع مع 1 مل من قبل حرارة (37 درجة مئوية) خالية من السكر تحتوي على 400 μCi المتوسطة من [2-3 H] المسمى مانوز (أقل من 65 تركيز يستخدم μCi / مليلتر بالنسبة لوضع العلامات على جليكوبروتينات الإجمالي) ، واحتضان الخلايا في نسيج الثقافة الظروف العادية لمدة 1 ساعة.
- إزالة العلامات المتوسطة من كل عينة ، وإضافة بعناية 2 مل من برنامج تلفزيوني في 4 درجات مئوية الى العينات المطابقة لنبض ووضعها على الجليد (ويشار إلى أن هذه العينات والبقول) ، في حين أن العينات المطابقة لمطاردة يلزم تشطف 3 مرات مع 2 مل من قبل حرارة (37 درجة مئوية) العادي المتوسط ثقافة كاملة ، ومن ثم وضعها في حاضنة 2 أكسيد الكربون عند 37 درجة مئوية مع 5 مل من قبل حرارة متوسطة لفترات منتظمة لمطاردة المطلوب.
- شطف عينات نبض (وضعت في وقت سابق على الجليد) 3 مرات مع 2 مل من الجليد الباردة برنامج تلفزيوني. ثم يتم كشط الخلايا قبالة صحن في برنامج تلفزيوني مل 2 باستخدام مكشطة الخلية ، ووضعها في أنبوب إيبندورف 2 مل.
- قصيرة تدور في الخلايا 16000Xg (60-10 ثانية) ، تجاهل طاف بيليه وتجميد الخلايا في -80 درجة مئوية.
- تنفيذ الخطوات 5 و 6 أيضا على عينات من مطاردة في نهاية الوقت مطاردة.
- إزالة الخلايا من الثلاجة وليز لهم باضافة 300 ألف ميكرولتر من العازلة ، واحتضان vortexing لفترة وجيزة لمدة 20 دقيقة على الجليد ، أو في حالة تحليل جليكوبروتينات الكلي ، من خلال احتضان 20 دقيقة على الجليد مع B العازلة ، تليها صوتنة (4 مرات و 10 ثانية ، والحد الأقصى السعة) ، وتغلي ثم عينات ل5min.
- أجهزة الطرد المركزي في lysates في 16000Xg لمدة 20 دقيقة في درجة مئوية 4 طاف لنقل أنبوب إيبندورف جديدة وتجاهل بيليه.
- إذا كان مجموع تحليل جليكوبروتينات ، انتقل إلى الترشيح الجزيئية وdeglycosylation (الخطوة 17). للمناعي للبروتين سكري H2A أظهر هنا ، إضافة 20l/sample من (Repligen) البروتين A - agarose تعليق الخرز 1:01 و 3 ميكروليتر / لدينا عينة من الأرانب ضد متعدد النسائل H2A المضادة للبروتين سكري المطلوب (الضد لدينا في مكافحة H2A المثال ) ، لطاف من الخطوة 9.
- احتضان العينات المطلوبة لل4-16 ساعات في 4 درجات مئوية ، والخلط باستمرار دوران بطيء.
- تدور باستمرار في حبات 16000Xg لمدة 30 ثانية ، وإزالة بعناية الفراغ طاف به.
- شطف الخرز ، وذلك بإضافة 500 ميكروليتر D العازلة وvortexing. تدور كما في الخطوة 12 وإزالة طاف. تكرار غسيل 3 مرات.
- إضافة 10μl العازلة تغيير طبيعة (مرفق مع عدة إندو NEB - H) إلى بيليه حبة وتغلى العينات لمدة 5 دقائق (عندما يتم تحليل البروتينات الكلية ، يتم تنفيذ deglycosylation على تصفية Microcon ، الخطوة 17).
- تدور باستمرار الخرز (16000Xg لمدة 30 ثانية) ، ونقل في أنبوب طاف إيبندورف جديدة. ثم تضاف 0.5μl إنزيم H إندو لكل عينة مع 10 ميكرولتر من المنطقة العازلة التفاعل (زودت أيضا مع عدة NEB إندو H) ، وحضنت العينات عند 37 درجة مئوية لمدة 3 ساعات.
- لفصل glycans المفرج عنهم من البروتينات ، ويتم تخفيف العينة 5 مرات مع الماء منزوع الأيونات ووضعها على رأس مرشح الجزيئي (Microcon Ultracel YM30) ، مع 30kDa قطع ، ثم طرد في 14000Xg لمدة 3 دقائق. تطبيق 50μl من الماء منزوع الأيونات والطرد المركزي تكرار العينات. ويتكرر هذا الاخفاق 2 مرات أكثر ، والحفاظ على التدفق من خلال.
- إذا كنت تحليل جليكوبروتينات مجموع تطبيق طاف للlysates (من الخطوة 9) لتصفية Microcon. غسل استخراج مع 100 ميكرولتر من E العازلة ، و 3 مرات عن طريق الطرد المركزي في 14000Xg المتكررة لمدة 3 دقائق. إضافة 3 ميكرولتر من 10X إندو العازلة رد فعل H و 1.5 ميكرولتر من أنزيم H إندو إلى retentate Microcon ، واحتضان لمدة 3 ساعات في 37 درجة مئوية. وeluted في glycans إصداره مع منزوع الأيونات الماء بنسبة 3 centrifugations المتكررة ، كما في الخطوة 16.
- إذا رغبت في ذلك ، ثم يتم تحضين retentates من الخطوات 16 و 17 ، التي تحتوي على إندو H - مقاومة جليكوبروتينات مع 200mU من N - F غليكوزيداز في 15 ميكرولتر من C العازلة ، على 37 درجة مئوية لمدة 16 ساعة. يتم شطف مع الماء منزوع الأيونات كما في الخطوة 16.
- وضع أنبوب يحتوي على رد فعل H إندو التدفق من خلال (الخطوات 16 و 17) في المكثف SpeedVacوالعينات الجافة تماما (يمكن القيام بذلك تصل إلى 45 درجة مئوية لتسريع هذه العملية).
- لتحضير العينات لHPLC ، resuspend الكريات الجافة في 12 ميكرولتر من المذيب HPLC (أسيتونتريل : المياه ، 60:40 ، 1 ٪ حامض الفوسفوريك).
- ضبط جهاز HPLC (متصلا إلى العمود Spherisorb) إلى تدفق مستمر من المذيب (1 مل / دقيقة) وضغط (قيمة معينة بين عامي 1000 و 2000 رطل) ، ومكان جامع الكسر لتغيير أنبوب كل 1 دقيقة.
- تحميل العينات في جهاز HPLC وبدء جمع جزء واحد.
- جمع 48 كسور 1 مل من العينة وتشغيل كل من سلسلة من خليط oligosaccharide القياسية.
- نقل 500 ميكرولتر من كل جزء إلى قارورة التلألؤ ، وتخلط محتويات مع 3 مل من السوائل غير قابلة للامتزاج المياه التلألؤ.
- تحميل وقراءة في قارورة عداد التلألؤ.
- يتم رسم حرف في الدقيقة قراءات بوصفها وظيفة من عدد الكسر.
- قيم الاجتماع التحضيري للمؤتمر خلال ذروة تمثل أنواع محددة غليكان على النحو التالي : 18-21 الكسور تتوافق مع M5 ، M6 لكسور 22-26 ، 27-31 لM7 الكسور ، الكسور إلى M8 32-35 ، 36-39 لكسور M9 ، 40-42 الكسور والكسور لG1M9 43-45 لG2M9.
- مجموع القيم CPM عن كسور في كل ذروة يعكس القيمة المطلقة من الأنواع غليكان محددة. من أجل التعويض عن حقيقة أن أكثر الأنواع التي تحتوي على مخلفات مانوز اكتساب مزيد من التسمية ، "مبلغ المولي النسبي" من كل الأنواع غليكان تحسب على النحو التالي : المبلغ المطلق من كل الأنواع غليكان هو مقسوما على عدد من البقايا مانوز أنه يحتوي . ثم يتم تقسيم هذه القيمة على مجموع المبالغ المولي النسبي من جميع الأنواع التي تم الحصول عليها غليكان للحصول على "النسبة المئوية من مجموع" لكل الأنواع غليكان محددة.
| مطاردة (ح) | 0 | 4 |
| أصدرت مع H إندو (CPM) و | 90000 | 16800 |
| أصدرت مع N - F غليكوزيداز (CPM) ب | 20400 | 3900 |
| جليكوبروتينات في retentate (CPM) ج | 371700 | 127695 |
| Dolichol - oligosaccharides في retentate (CPM) د | 4350 | 540 |
| Dolichol - oligosaccharides في retentate (٪) ه | 1.4 ± 0.7 | 0.2 ± 0.2 |
الجدول 1. الافراج عن تحليل سلاسل السكر N - ترتبط deglycosidases وبحضور dolichol - oligosaccharides في عينات بروتين سكري.
طبقنا الإجراء نبض مطاردة لlysate من خلايا NIH 3T3. بعد الترشيح Microcon ، أفرج عن المسمى N - oligosaccharides مرتبطة بشكل رئيسي مع H إندو بعد وضع العلامات نبض (نوع مانوز عالية) ومع مزيد من العلاج مع N - F غليكوزيداز بعد فترة المطاردة ، التي من شأنها أن تتوافق مع نوع معقد (غولجي المجهزة glycans) إندو oligosaccharides H مقاومة. هذا التحليل الكمي قرر أن dolichol - oligosaccharides ، تمثل جزءا لا يكاد يذكر من التسمية في retentate الأولي.
ملاحظات :
- وكانت الخلايا NIH 3T3 المسمى مع نبض [2-3 H] مانوز وطاردت مع متوسط كاملة. بعد تحلل الخلايا والترشيح من خلال Microcon YM30 ، أفرج عن ارتفاع مانوز N - مرتبطة oligosaccharides من retentates بواسطة حضانة مع حاء إندو
- وقد حضنت ثم إندو H - مقاومة المواد في retentates Microcon من (أ) مع N - F غليكوزيداز oligosaccharides وأفرج عنه في عداد قياس التلألؤ.
- retentates Microcon تم الحصول عليها في الفقرة (أ) قبل العلاج H إندو ، تم استخراج 4 مرات بالكلوروفورم : الميثانول : الماء لإزالة 10:10:03 glycolipids السلائف والمواد unextracted solubilized في 1N هيدروكسيد الصوديوم وعدها في عداد التلألؤ.
- وتنقيته من Dolichol - oligosaccharides مقتطفات من صفها بأنها (ج) في (1) وتحسب في عداد التلألؤ.
- بمعدل 3 في المئة من التجارب لdolichol - oligosaccharides (د) من المجموع في الاجتماع التحضيري للمؤتمر retentate (ج + د).
ممثل النتائج
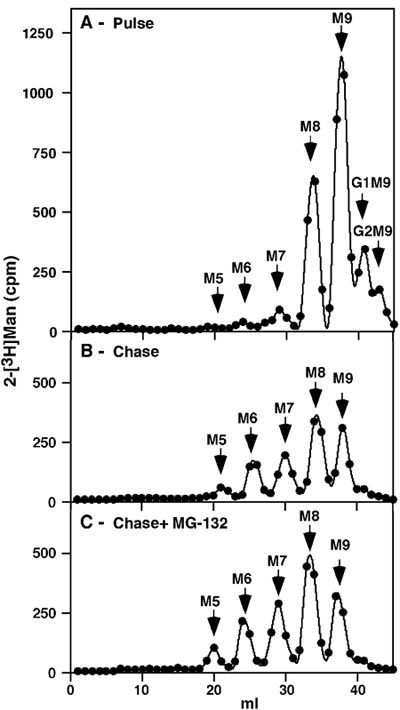
الشكل 1. نبض مطاردة تحليل جليكوبروتينات مجموع NIH 3T3 في الخلايا غير المعالجة ، وبناء على تثبيط proteasomal 1H بعد وضع العلامات مع نبض [2-3 H] حصلنا على ملف تعريف المتوقع مع بعض glucosylatedالسلائف المتبقية (2 GLC مان 9 GlcNAc 2 (G2M9) وG1M9) ، ولكن معظم التسمية موجودة في M9 والأنواع M8 ، وهذا الأخير هو نتيجة لخفض السكر في كل واحد بقايا مانوز (الشكل 1 أ). تم الكشف عن أية مجانا السلائف مانوز الصغيرة أو غيرها ، مما يدل على شمولية عملية تنقية. بعد مطاردة طويلة بدلا 8h كان هناك المزيد من التشذيب واسعة النطاق إلى 6 - M7 وكمية صغيرة من M5 ، ولكن الأنواع الرئيسية لا تزال M9 وM8 (الشكل 1 ب). فإن كان قد تم مطاردة في وجود المانع proteasomal (30 ميكرومتر MG - 132) ، لم يكن هناك سوى تراكم بسيط من هذه الأنواع نفسها قلص (الشكل 1 جيم).
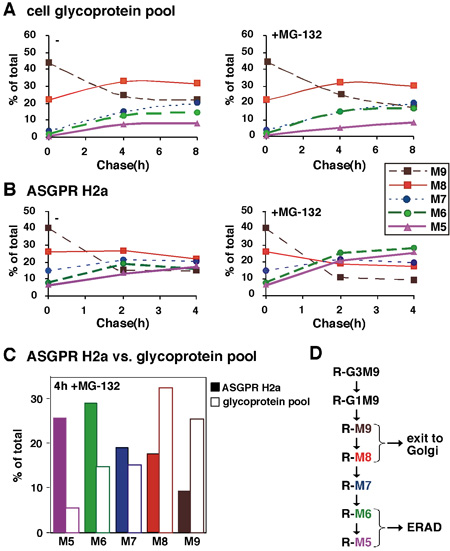
الشكل 2. التحليل الكمي لسلاسل السكر من اراد ان الركيزة مقارنة جليكوبروتينات الإجمالي. (أ) في تجربة مشابهة لتلك الموجودة في الشكل 1 ، وحسبت المبالغ المولي النسبي لكل الأنواع oligosaccharide على أساس المحتوى مانوز. كان علينا تحويل القيم التي تم الحصول عليها عن كل حرف في الدقيقة الأنواع غليكان ، ثم تآمر في المئة من كل الأنواع النسبي لمجموع المبالغ الإجمالية المولي النسبي لجميع الحاضرين الأنواع بوصفها وظيفة من الوقت مطاردة لمدة متوسطها تجربتين (B) مماثلة (أ) إلا أن المفرج عنهم من glycans H2A الركيزة ASGPR اراد حللت بعد وضع العلامات النبض ومطاردة لمدة تصل إلى 4H ، في وجود أو عدم وجود المانع proteasomal MG - 132 (C) لمطاردة القيم 4H في الوجود من MG - 132 من (أ) و (B) لتتم مقارنة H2A ASGPR وتجمع بروتين سكري (D) ومخطط لسلسلة N - السكر مرتبط التشذيب العمليات في لائحة. عمليات التشذيب السكر التي تؤدي إلى 5 - M6 ترتبط البروتينات (R) التي تستهدف اراد مقارنة M9 - 8 على تلك التي للخروج إلى غولجي وخارجها. وتشير النتائج إلى أن يرتبط بعملية اراد مع مانوز تقليم N - glycans لانتاج الأنواع 5-6 مع بقايا مانوز المتبقية.
Discussion
تحليل نبض مطاردة glycans في الخلايا الحية مع الفصل HPLC يوفر طريقة لدراسة ديناميات التعديلات الهيكلية oligosaccharide طوال حياة بروتين سكري. هناك أدلة متزايدة على أن يتم تضمين هذه التعديلات في إنتاج الإشارات للطي ER ، ومراقبة الجودة ونظم الاتجار 2-5. ويمكن تطبيق الأسلوب ليس ف...
Acknowledgements
نشكر زيهافيت فرانكل وTolchinsky ساندرا لتقديم المساعدة التقنية. وتدعم البحوث المتعلقة في هذا العمل من المنح المقدمة من مؤسسة العلوم إسرائيل (1229-1207) والألمانية والإسرائيلية لمشاريع التعاون (DIP - DFG).
Materials
| Name | Company | Catalog Number | Comments |
| 600E Multisolvent delivery System controller | Waters | WAT062710 | |
| Acetonitrile LiChrosolv (gradient grade for liquid chromatography) | Merck & Co., Inc. | 1.0003 | |
| Microcon Amicon Ultra 0.5 ml 30K or Centricon ultracel YM-30 | EMD Millipore | UFC503024 or 4208 | |
| Concentrator 5301, incl. 48 x 1.5 / 2.0 ml fixed-angle rotor | Eppendorf | 5301 000.016 | |
| Dialyzed F–tal Calf Serum | Biological Industries | 04-011-1A | |
| Dulbecco’s Modified Eagle’s Medium | GIBCO, by Life Technologies | 41965039 | |
| Dulbecco’s Modified Eagle’s Medium - glucose free | Sigma-Aldrich | D5030 | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D1408 | |
| EDTA disodium salt(Titriplex Iii) | Merck & Co., Inc. | 1084180250 | |
| Endo Hf Kit (1,000,000 units/ml) | New England Biolabs | p0703S | |
| F–tal Calf Serum (FCS) | Biological Industries | 04-001-1A | |
| Frac-100 fraction collector | Amersham | 18-1000-77 | |
| LS 6500 Liquid Scintillation Counting systems | Beckman Coulter Inc. | 510720 | |
| Mannose, D-[2-3H(N)]- (Specific Activity: 15-30Ci/mmol) | PerkinElmer, Inc. | NET570A | |
| N-carbobenzoxyl-leucinyl-leucinyl-leucinal (MG-132) | Calbiochem | 474790 | |
| N-glycosidase F (1000 units/ml) | Roche Group | 11365177 | |
| N-octylglucoside | Sigma-Aldrich | O3757 | |
| NIH 3T3 cells | American Type Culture Collection | CRL-1658 | |
| Opti-Flour | PerkinElmer, Inc. | 6013199 | |
| Phosphoric acid solution ( 49-51%, for HPLC) | Fluka | 79607 | |
| Protease Inhibitor Cocktail | Sigma-Aldrich | P2714 | |
| Protein A-Sepharose beads | Repligen | IPA300 | |
| Rabbit polyclonal anti-H2 carboxy-terminal 6 | |||
| Sodium deoxycholate | Sigma-Aldrich | 30970 | |
| Sodium dodecyl sulfate | Bio-Rad | 161-0301 | |
| Sodium phosphate | Sigma-Aldrich | 342483 | |
| Sodium pyruvate solution (100mM) | Sigma-Aldrich | S8636 | |
| Spherisorb NH2 Column, 5 μm, 4.6 x 250 mm | Waters | PSS831115 | |
| Triton X-100 | VWR | 306324N | |
| Vibra-Cell ultrasonic processors VCX 750 | Sonics and Materials, Inc. | 690-003 | |
| Buffer A: 1% Triton X-100, 0.5% w/v sodium deoxycholate, Protease inhibitor cocktail 2% v/v in PBS | |||
| Buffer B: 0.5% w/v SDS, Protease inhibitor cocktail 2% v/v in PBS | |||
| Buffer C: N-glycosidase F reaction buffer: 200mM Na3PO4, pH 8.0, 4mM EDTA, 1.5% N-octylglucoside | |||
| NIH 3T3 stably expressing H2a 6 | |||
| Buffer D: 0.5% Triton X-100, 0.25% w/v sodium deoxycholate,0.5% w/v SDS, Protease inhibitor cocktail 2% v/v in PBS | |||
| Buffer E: 0.5% w/v SDS, 1% v/v 2-Mercapt–thanol, Protease inhibitor cocktail 2% v/v in PBS | |||
| 2-mercapt–thanol | Sigma-Aldrich | M3148 |
References
- Parodi, A. J., Behrens, N. H., Leloir, L. F., Carminatti, H. The role of polyprenol-bound saccharides as intermediates in glycoprotein synthesis in liver. Proc Natl Acad Sci U S A. 69 (11), 3268-3272 (1972).
- Avezov, E., Frenkel, Z., Ehrlich, M., Herscovics, A., Lederkremer, G. Z. Endoplasmic reticulum (ER) mannosidase I is compartmentalized and required for N-glycan trimming to Man5-6GlcNAc2 in glycoprotein ER-associated degradation. Mol Biol Cell. 19 (1), 216-225 (2008).
- Frenkel, Z., Gregory, W., Kornfeld, S., Lederkremer, G. Z. Endoplasmic reticulum-associated degradation of mammalian glycoproteins involves sugar chain trimming to Man6-5GlcNAc2. J Biol Chem. 278 (36), 34119-34124 (2003).
- Hosokawa, N. Enhancement of endoplasmic reticulum (ER) degradation of misfolded Null Hong Kong alpha1-antitrypsin by human ER mannosidase I. J Biol Chem. 278 (28), 26287-26294 (2003).
- Jakob, C. A., Burda, P., Roth, J., Aebi, M. Degradation of misfolded endoplasmic reticulum glycoproteins in Saccharomyces cerevisiae is determined by a specific oligosaccharide structure. J Cell Biol. 142 (5), 1223-1233 (1998).
- Tolchinsky, S., Yuk, M. H., Ayalon, M., Lodish, H. F., Lederkremer, G. Z. Membrane-bound versus secreted forms of human asialoglycoprotein receptor subunits. Role of a juxtamembrane pentapeptide. J Biol Chem. 271 (24), 14496-14503 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved