このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
哺乳動物細胞での糖タンパク質からN -結合型糖鎖のパルス - チェイス分析
要約
我々は、哺乳類細胞におけるそれらの生合成後の糖タンパク質の初期の生活を通じて、N -結合型グリカンの変化の分析のための方法を説明します。これは、代謝的に標識した糖鎖、糖タンパク質およびHPLCによる検討からの酵素遊離のパルス - チェイス分析によって達成されます。
要約
Glcの添付ファイル
プロトコル
以下のプロトコルは、全糖のか興味のある特定の糖タンパク質の糖鎖の解析を対象としています。手順は、プロトコル全体に述べたいくつかの変化と基本的にはどちらの場合も同じです。
- 各サンプルの90 mmディッシュ(サンプルは、異なるタイムポイントや治療法を表す可能性がある)で一晩増殖哺乳類細胞のサブコンカルチャを使用するN -結合型グリカンの代謝標識用のニーズ。このプロトコルは、NIH 3T3細胞に最適化されています。
- 10%透析FCSと5〜15分、4 mMのピルビン酸ナトリウムに付属している作りたての予め温めておいた(37℃)グルコースを含まない培地、5mlにインキュベートすることによりグルコースの細胞を飢えさせる。
- [ - 3 H 2](65μCiの/ mlの低濃度は、総糖タンパク質の量のラベリングに使用される)マンノース標識、400μCiのを含む予め温めておいた(37℃)グルコースを含まない培地1mlで飢餓の媒体を交換してくださいと1時間の通常の組織培養条件で細胞をインキュベートする。
- チェイスに対応するサンプルがする必要がある一方、各サンプルから標識メディウムを外し、慎重に4℃の氷(これらのサンプルはパルスと呼ばれる)上にパルスと配置に対応するサンプルをPBS 2 mlを加え2mlで3回すすいだ予め温めておいた(37℃)、通常の完全培地、及びその後37℃CO 2インキュベーターに入れ° C、目的の追撃期間予め温めておいた定期的な培地5mlで。
- 氷冷PBS 2mlでパルスのサンプル(以前氷上に置く)3回すすいでください。その後、細胞をセルスクレーパーを用いて2 mlのPBSでシャーレから掻き取り、そして2mlエッペンドルフチューブに配置されます。
- 16000Xg(6-10秒)で細胞を短期回転、上清を廃棄し、-80細胞ペレットを凍結℃に
- チェイス時間の終了時追撃のサンプルについても手順5と6を実行します。
- 冷凍庫からセルを削除し、バッファー300μlを添加することによって、それらを溶解させる、簡単にボルテックスして氷上で20分間インキュベートする、または、総糖タンパク質の分析の場合には、緩衝液Bで氷上でインキュベーション20分で、超音波処理が続く(4回、10秒、最大振幅)、その後5分間のサンプルを煮る。
- 4℃で20分間16000Xgでライセートを遠心新しいエッペンドルフチューブに上清を移し、ペレットを捨てる。
- 合計糖タンパク質を分析する場合、分子ろ過と脱グリコシル化(ステップ17)に進みます。 H2Aの糖タンパク質の免疫沈降は、ここで紹介するため、(Repligen)プロテインA -アガロースビーズの20l/sample午前1時01分サスペンションを追加し、この例では、目的の糖タンパク質(私たちのウサギポリクローナル抗H2Aの抗体の3μL/サンプルアンチH2Aの抗体)、ステップ9から上清へ。
- 常にゆっくりと回転して混合、4℃で4〜16時間のサンプルをインキュベートする。
- 30秒間16000Xgでビーズをスピンダウンし、注意深く上清を用いて真空を削除します。
- 500μlのバッファーDを追加し、ボルテックスで、ビーズを洗浄します。ステップ12のように回転し、上清を取り除く。洗浄を3回繰り返します。
- ビーズペレットに10μlの変性バッファー(NEBエンド- Hキットに付属)を追加し、5分(総蛋白質を分析する場合、脱グリコシル化は、マイクロコンフィルター、ステップ17で実行される)のサンプルを煮る。
- (30秒間16000Xg)ビーズをスピンダウンし、新しいエッペンドルフチューブに上清を移す。その後、遠藤Hの酵素の0.5μlを反応バッファー(また、NEB遠藤Hキットに付属)を10μlと一緒に各サンプルに追加され、サンプルは3時間、37℃でインキュベートする。
- タンパク質から放出される糖鎖を分離するために、試料を脱イオン水で5倍に希釈され、30kDaカットオフ、その後3分間14000Xg間遠心分離して、分子フィルター(マイクロコンUltracel YM30)の上に配置。脱イオン水と試料の繰り返しの遠心分離の50μLを適用する。このウォッシュアウトは、フロースルー保ち、さらに2回繰り返されます。
- あなたが全体の糖タンパク質を分析している場合、マイクロコンフィルターにライセートの上清を(ステップ9から)適用されます。 3分間14000Xgで繰り返し、遠心分離により3倍のバッファE、100μlの抽出液を洗浄してください。 10X遠藤Hの反応バッファーを3μlを追加し、エンドHの酵素1.5μlをマイクロコンの残留物に、そして37℃で3時間インキュベート℃にリリースグリカンは、ステップ16のように、3を繰り返し遠心分離による脱イオン水で溶出されています。
- 必要に応じて、エンドH -抵抗性の糖タンパク質を含む手順16および17からretentatesは、その後37℃、緩衝液Cの15μlのN -グリコシダーゼFの200mUでインキュベートされる℃で16時間脱イオン水で溶出は、ステップ16のように行われます。
- SpeedVacコンセントレータで遠藤Hの反応フロースルー(ステップ16および17)を含むチューブを、と完全に試料を乾燥させ(これが45まで行うことができます℃で、このプロセスを加速する)。
- HPLC用サンプルを準備するには、HPLC溶媒(水、60:40、1%リン酸アセトニトリル)の12μl中、乾燥ペレットを懸濁します。
- 定数の溶媒の流れ(1 ml /分)と圧力(1000と2000 psiの間に特定の値)にHPLCの装置を(フェリの列に接続されて)調整し、チューブを1分ごとに変更するにはフラクションコレクタを配置。
- HPLC装置にサンプルを読み込むと同時にフラクションコレクターを起動します。
- 各サンプルの実行から、標準的なオリゴ糖混合物の実行から1 mlの48画分を集めた。
- 各画分からのシンチレーションバイアルに500μlを、と水混和性のシンチレーション液3mlで内容を混ぜる。
- バイアルをロードし、シンチレーションカウンターにお読みください。
- CPMの読み出しは、分数の関数としてプロットされます。
- ピーク内のCPMの値は次のように、特定の糖鎖の種表す:分数を18-21 M8、M9のフラクション36から39にM5、フラクション22から26にM6、フラクション27から31にM7、フラクション32から35に対応フラクション40から42へG1M9とフラクション43から45へG2M9。
- 各ピークの内画分のCPM値の合計は、特定の糖鎖の種の絶対量を反映している。より多くのマンノース残基を含む種がより多くのラベルを取得し、各糖鎖の種の"相対的なモル量は、"以下のように計算されているという事実を補正するために:各糖鎖の種の絶対量はそれに含まれるマンノース残基の数で割って。この値は、それぞれの特定の糖鎖の種のための"合計のパーセントを"得るために取得したすべての糖鎖生物種の相対的なモル量の総和で除算されます。
| チェース(H) | 0 | 4 |
| 遠藤H(CPM)をリリースしました | 9万 | 16800 |
| N -グリコシダーゼF(CPM)bでリリース | 20400 | 3900 |
| 濃縮水(CPM)Cの糖タンパク質 | 371700 | 127695 |
| 濃縮水(CPM)、Dにおけるドリコール糖 | 4350 | 540 |
| 濃縮水のドリコール糖(%)E | 1.4 ± 0.7 | 0.2 ± 0.2 |
表1。deglycosidasesあると糖タンパク質の試料におけるドリコール糖の存在のN -結合型糖鎖の放出の分析。
私たちは、NIH 3T3細胞からライセートにパルス - チェイスの手順を適用する。マイクロコンろ過した後、標識したN -結合型糖鎖は、パルスラベリング(高マンノース型)の後と複合型(ゴルジ処理された糖鎖)に対応するだろう追いかける期間後のN -グリコシダーゼFとのさらなる治療、と遠藤Hで主にリリースされました遠藤H抵抗性オリゴ糖。この定量分析はドリコール糖は、初期の残留物のラベルの微々たる割合を占めていると判断。
注意事項:
- NIH 3T3細胞は、パルスが[2 - 3 H]で標識されたマンノースと完全培地で追いかけた。マイクロコンYM30を介して細胞を溶解し、ろ過した後、高マンノースN -結合型糖鎖は、エンドH.とのインキュベーションによりretentatesから解放された
- からマイクロコンのretentates()の遠藤H耐熱材料は、その後、シンチレーションカウンターで測定したN -グリコシダーゼFと放出オリゴ糖でインキュベートした。
- メタノール::前駆体の糖脂質を除去する水午前10時10分03秒、およびunextracted材料を1N NaOHで可溶化し、シンチレーションカウンターでカウントエンドH処理の前に()で得られたマイクロコンのretentatesは、クロロホルムで4回抽出した。
- ドリコール - 糖鎖は、(c)のように1に記載し、シンチレーションカウンターでカウントからの抽出物から精製した。
- 残留液中の総CPMのドリコール糖のパーセントのための3つの実験の平均値(D)(C + D)。
代表的な結果
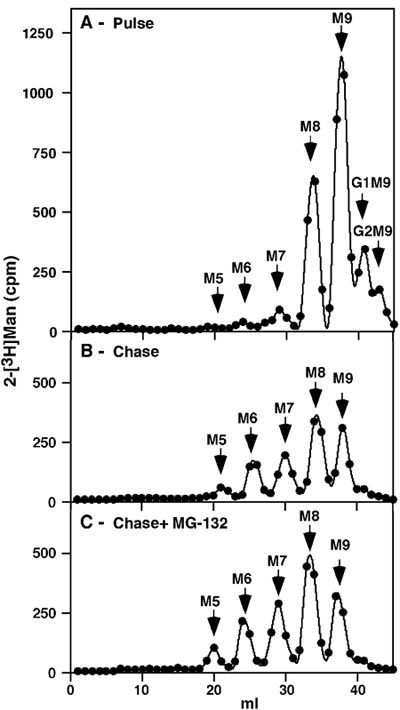
図1。パルスチェイス未処理細胞のとプロテアソーム阻害時に合計NIH 3T3糖タンパク質の解析 1Hパルスラベリングの後で。[2 - 3 H]我々はいくつかglucosylatedと期待されるプロファイルを得前駆体は、(グルコース2マン9 N -アセチルグルコサミン2(G2M9)とG1M9)残りが、M9に存在するラベルとM8種のほとんどが、後者はすべてのグルコースのトリミング一マンノース残基(図1)の結果である。空きマンノースまたはその他の小規模な前駆体は、精製の徹底を証明する、検出されなかった。かなり長い8Hチェースに続いてそこにM7 - 6とM5の少量にトリミングをより広範であったが、主要な種はM9とM8(図1 B)が続きました。チェイスはプロテアソーム阻害剤(30μMのMG - 132)の存在下で行われた場合、これらの同じトリミング種のマイナー蓄積(図1 C)のみがあった。
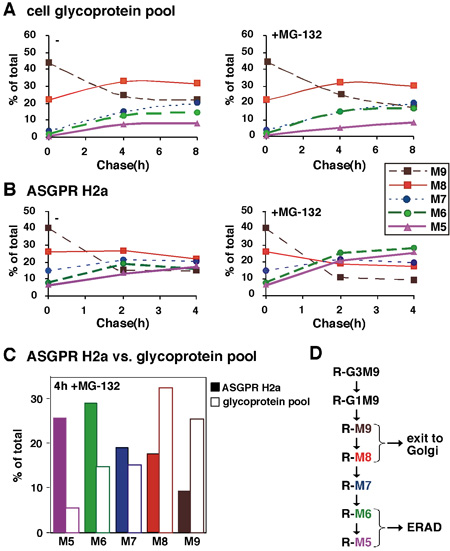
図2。合計糖タンパク質に比べてERAD基質の糖鎖の定量分析。 (A)図1に示すような実験では、各オリゴ糖の種の相対的なモル量は、マンノース含有量に基づいて算出した。私たちは、それぞれの糖鎖生物種で得られたCPMの値を変換し、すべての種の存在の相対的なモル量の総和に対する各種の%は、2つの実験の平均の追求を時間の関数としてプロットした。(B)と同様に()ERAD基質ASGPR H2Aから放出その糖鎖を除いて分析した後、存在下で4時間追いかけるためにプロテアソーム阻害剤MG - 132の存在下または非存在下で4時間までのパルスラベルとチェイスは、。(C)の値からMG - 132の(A)と(B)ASGPR H2Aおよび糖タンパク質のプールのために比較されます。ER内のプロセスをトリミングN -結合型糖鎖の(D)スキーム。砂糖は、ゴルジ体以降に終了するものでM9 - 8と比較しERADを対象とするタンパク質(R)にリンクされているM6 - 5につながるプロセスをトリミング。結果は、ERADのプロセスが残っている5月6日マンノース残基を有する種を生成するためにN -結合型糖鎖のトリミングマンノースに関連付けられていることを示している。
ディスカッション
パルスチェイス生細胞における糖鎖の分析HPLC分離とは、糖タンパク質の一生を通じてオリゴ糖の構造変化のダイナミクスを研究するための方法を提供する。このような変化がERのフォールディング、品質管理および売買システム2-5の信号を生成に関与していることを成長証拠がある。方法はないだけ関心のある特定の糖タンパク質のためだけでなく、我々は対照的な、特定のERADの基?...
謝辞
我々は技術支援のためにZehavitフレンケルとサンドラTolchinskyに感謝。この作品に関連する研究は、イスラエル科学財団(1229年〜1207年)とドイツとイスラエルのプロジェクトの協力(DIP - DFG)からの補助金によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| 600E Multisolvent delivery System controller | Waters | WAT062710 | |
| Acetonitrile LiChrosolv (gradient grade for liquid chromatography) | Merck & Co., Inc. | 1.0003 | |
| Microcon Amicon Ultra 0.5 ml 30K or Centricon ultracel YM-30 | EMD Millipore | UFC503024 or 4208 | |
| Concentrator 5301, incl. 48 x 1.5 / 2.0 ml fixed-angle rotor | Eppendorf | 5301 000.016 | |
| Dialyzed F–tal Calf Serum | Biological Industries | 04-011-1A | |
| Dulbecco’s Modified Eagle’s Medium | GIBCO, by Life Technologies | 41965039 | |
| Dulbecco’s Modified Eagle’s Medium - glucose free | Sigma-Aldrich | D5030 | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D1408 | |
| EDTA disodium salt(Titriplex Iii) | Merck & Co., Inc. | 1084180250 | |
| Endo Hf Kit (1,000,000 units/ml) | New England Biolabs | p0703S | |
| F–tal Calf Serum (FCS) | Biological Industries | 04-001-1A | |
| Frac-100 fraction collector | Amersham | 18-1000-77 | |
| LS 6500 Liquid Scintillation Counting systems | Beckman Coulter Inc. | 510720 | |
| Mannose, D-[2-3H(N)]- (Specific Activity: 15-30Ci/mmol) | PerkinElmer, Inc. | NET570A | |
| N-carbobenzoxyl-leucinyl-leucinyl-leucinal (MG-132) | Calbiochem | 474790 | |
| N-glycosidase F (1000 units/ml) | Roche Group | 11365177 | |
| N-octylglucoside | Sigma-Aldrich | O3757 | |
| NIH 3T3 cells | American Type Culture Collection | CRL-1658 | |
| Opti-Flour | PerkinElmer, Inc. | 6013199 | |
| Phosphoric acid solution ( 49-51%, for HPLC) | Fluka | 79607 | |
| Protease Inhibitor Cocktail | Sigma-Aldrich | P2714 | |
| Protein A-Sepharose beads | Repligen | IPA300 | |
| Rabbit polyclonal anti-H2 carboxy-terminal 6 | |||
| Sodium deoxycholate | Sigma-Aldrich | 30970 | |
| Sodium dodecyl sulfate | Bio-Rad | 161-0301 | |
| Sodium phosphate | Sigma-Aldrich | 342483 | |
| Sodium pyruvate solution (100mM) | Sigma-Aldrich | S8636 | |
| Spherisorb NH2 Column, 5 μm, 4.6 x 250 mm | Waters | PSS831115 | |
| Triton X-100 | VWR | 306324N | |
| Vibra-Cell ultrasonic processors VCX 750 | Sonics and Materials, Inc. | 690-003 | |
| Buffer A: 1% Triton X-100, 0.5% w/v sodium deoxycholate, Protease inhibitor cocktail 2% v/v in PBS | |||
| Buffer B: 0.5% w/v SDS, Protease inhibitor cocktail 2% v/v in PBS | |||
| Buffer C: N-glycosidase F reaction buffer: 200mM Na3PO4, pH 8.0, 4mM EDTA, 1.5% N-octylglucoside | |||
| NIH 3T3 stably expressing H2a 6 | |||
| Buffer D: 0.5% Triton X-100, 0.25% w/v sodium deoxycholate,0.5% w/v SDS, Protease inhibitor cocktail 2% v/v in PBS | |||
| Buffer E: 0.5% w/v SDS, 1% v/v 2-Mercapt–thanol, Protease inhibitor cocktail 2% v/v in PBS | |||
| 2-mercapt–thanol | Sigma-Aldrich | M3148 |
参考文献
- Parodi, A. J., Behrens, N. H., Leloir, L. F., Carminatti, H. The role of polyprenol-bound saccharides as intermediates in glycoprotein synthesis in liver. Proc Natl Acad Sci U S A. 69 (11), 3268-3272 (1972).
- Avezov, E., Frenkel, Z., Ehrlich, M., Herscovics, A., Lederkremer, G. Z. Endoplasmic reticulum (ER) mannosidase I is compartmentalized and required for N-glycan trimming to Man5-6GlcNAc2 in glycoprotein ER-associated degradation. Mol Biol Cell. 19 (1), 216-225 (2008).
- Frenkel, Z., Gregory, W., Kornfeld, S., Lederkremer, G. Z. Endoplasmic reticulum-associated degradation of mammalian glycoproteins involves sugar chain trimming to Man6-5GlcNAc2. J Biol Chem. 278 (36), 34119-34124 (2003).
- Hosokawa, N. Enhancement of endoplasmic reticulum (ER) degradation of misfolded Null Hong Kong alpha1-antitrypsin by human ER mannosidase I. J Biol Chem. 278 (28), 26287-26294 (2003).
- Jakob, C. A., Burda, P., Roth, J., Aebi, M. Degradation of misfolded endoplasmic reticulum glycoproteins in Saccharomyces cerevisiae is determined by a specific oligosaccharide structure. J Cell Biol. 142 (5), 1223-1233 (1998).
- Tolchinsky, S., Yuk, M. H., Ayalon, M., Lodish, H. F., Lederkremer, G. Z. Membrane-bound versus secreted forms of human asialoglycoprotein receptor subunits. Role of a juxtamembrane pentapeptide. J Biol Chem. 271 (24), 14496-14503 (1996).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved