A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Pulse-מרדף ניתוח של N-linked שרשראות סוכר מ גליקופרוטאינים בתאי יונקים
In This Article
Summary
אנו מתארים שיטה לניתוח שינוי של N-linked glycans דרך חיים המוקדם של גליקופרוטאינים לאחר ביוסינתזה שלהם בתאי יונקים. זו מושגת על ידי ניתוח הדופק מרדף של glycans שכותרתו מטבולית, לשחרר האנזימטית של גליקופרוטאינים ובחינה על ידי HPLC.
Abstract
קובץ מצורף של Glc
Protocol
הפרוטוקול הבא מיועד לניתוח של שרשראות סוכר של גליקופרוטאינים או סך של גליקופרוטאין ספציפי של עניין. הליך זה בעצם אותו דבר עבור שניהם מקרים עם שינויים מעטים כאמור בכל פרוטוקול.
- עבור תיוג המטבולית של N-linked glycans אחד צריך להשתמש תרבות subconfluent של בתאי יונקים בוגרים לילה בצלחת 90 מ"מ עבור כל דגימה (דגימות עשוי לייצג נקודות זמן שונות או טיפולים). פרוטוקול זה הוא אופטימיזציה עבור תאים NIH 3T3.
- להרעיב את התאים גלוקוז על ידי הדגירה ב 5 מ"ל של מדיום מראש התחמם (37 ° C) גלוקוז ללא המוכן טרי, מסופק עם 10% dialyzed FCS ו 4 נתרן mM pyruvate במשך 5-15 דקות.
- החלף את המדיום רעב עם 1 מ"ל של טרום התחמם (37 ° C) גלוקוז ללא בינוני המכיל 400 μCi של [2-3 H] שכותרתו מנוז (ריכוז נמוך יותר של 65 μCi / ml משמש עבור תיוג של גליקופרוטאינים סה"כ), ו דגירה התאים בתרבית בתנאים נורמליים ברקמות במשך שעה 1.
- הסר את המדיום תיוג מכל מדגם, ובזהירות מוסיפים 2 מ"ל PBS ב 4 ° C עד דגימות המתאים הדופק ומניחים אותם על הקרח (דגימות אלה מכונים פולסים), בעוד דוגמאות המתאים המרדף צריך להיות שטופים 3 פעמים עם 2 מ"ל של טרום התחמם (37 ° C) תרבות נורמליים בינוני מלא, ולאחר מכן להציב CO 2 באינקובטור ב 37 מעלות צלזיוס עם 5 מ"ל של מדיום מראש חימם קבוע לתקופות לרדוף הרצוי.
- שוטפים את דגימות הדופק (ממוקם בעבר על הקרח) 3 פעמים עם 2 מ"ל של קר כקרח PBS. התאים מגורד אז את המנה ב 2 מ"ל PBS באמצעות מגרד תא, מכניסים צינור 2 Eppendorf מ"ל.
- קצר ספין התאים ב 16000Xg (6-10 שניות), לבטל את supernatant ולהקפיא התא גלולה ב -80 ° C.
- בצע שלבים 5 ו 6 גם דגימות לרדוף בסוף הזמן לרדוף.
- הסרת תאים מהמקפיא lyse אותם על ידי תוספת של 300 μl של חיץ, vortexing בקצרה דוגרים במשך 20 דקות על הקרח, או במקרה של ניתוח גליקופרוטאינים הכולל, על ידי הדגירה 20 דקות על הקרח עם חיץ B, ואחריו sonication (4 פעמים, 10 שניות, מקסימום אמפליטודה), ואז להרתיח את דגימות 5min.
- צנטריפוגה lysates ב 16000Xg במשך 20 דקות ב 4 ° C. מעבירים את supernatant לצינור חדש Eppendorf וזורקים את הכדור.
- אם ניתוח גליקופרוטאינים הכולל, המשך סינון deglycosylation מולקולרית (שלב 17). עבור immunoprecipitation של גליקופרוטאין H2a הפגינו כאן, להוסיף 20l/sample של חלבון (Repligen) A-agarose חרוזים 01:01 ההשעיה ו 3 μl / מדגם של נוגדן ארנבת polyclonal שלנו H2a אנטי עבור גליקופרוטאין הרצויה (נוגדן שלנו נגד H2a למשל ), כדי supernatant משלב 9.
- דגירה דגימות עבור 4-16 שעות 4 ° C, ללא הרף ערבוב על ידי סיבוב איטי.
- ספין למטה חרוזים ב 16000Xg למשך 30 שניות, ובזהירות להסיר את האבק באמצעות supernatant.
- שוטפים את החרוזים, על ידי הוספת 500 חיץ D μl ו vortexing. ספין כמו בשלב 12 ולהסיר את supernatant. חזור על לשטוף 3 פעמים.
- הוסף חוצץ denaturing 10μl (מסופק עם Endo-H חוד בערכה) ועד גלולה חרוז לרתיחה דגימות במשך 5 דקות (כאשר חלבונים סך מנותחים, deglycosylation מבוצע על המסנן Microcon, שלב 17).
- ספין למטה חרוזים (16000Xg למשך 30 שניות), ולהעביר את supernatant לתוך צינור Eppendorf חדש. ואז 0.5μl של האנזים H אנדו מתווספים מדגם זה יחד עם 10 μl של למאגר תגובה (מסופק גם עם אנדו חוד H קיט), וכן דגימות מודגרת על 37 מעלות צלזיוס במשך 3 שעות.
- כדי להפריד את glycans שוחרר מן החלבונים, המדגם הוא מדולל עם מים 5 פעמים deionized והניח על גבי מסנן מולקולרית (Microcon Ultracel YM30), עם 30kDa חתוכים, centrifuged אז 3 דקות ב 14000Xg. החל 50μl מים deionized ו צנטריפוגה חוזרת של הדגימות. כשלון זה חוזר על עצמו פעמים 2 יותר, תוך שמירה על זרימה דרך.
- אם אתה מנתח גליקופרוטאינים הכולל, להחיל את supernatant של lysates (משלב 9) כדי לסנן את Microcon. שטפו את תמצית עם 100 μl של חיץ E, 3 פעמים על ידי צנטריפוגה חזר על 14000Xg דקות 3. הוסף 3 μl של חיץ 10X התגובה H אנדו 1.5 μl של האנזים אנדו H ל retentate Microcon ו דגירה במשך 3 שעות ב 37 ° C. Glycans שפורסמו הם eluted עם מים deionized על ידי 3 centrifugations חוזרות ונשנות, כמו בשלב 16.
- אם תרצה, retentates מן השלבים 16 ו 17, המכיל אנדו H עמידים גליקופרוטאינים מודגרת אז μl 15 של חיץ C עם 200mU של N-F glycosidase, על 37 מעלות צלזיוס למשך 16 ח Elution עם מים deionized מתבצעת כמו בשלב 16.
- מניחים את הצינור המכיל את התגובה H אנדו flow-through (שלבים 16 ו -17) ב concentrator SpeedVac, ויבש דגימות לחלוטין (זה יכול להיעשות עד 45 ° C כדי להאיץ את התהליך הזה).
- כדי להכין את דגימות עבור HPLC, resuspend את כדורי יבש 12 μl של הממס HPLC (אצטוניטריל: מים, 60:40, חומצה זרחתית 1%).
- התאמת מכשיר HPLC (מחובר בטור Spherisorb) אל זרם בלתי פוסק של הממס (1 mL / min) והלחץ (ערך מסוים בין 1000 ו - 2000 psi), ואת המקום אספן חלק לשנות צינור בכל דקה 1.
- טען את הדגימות לתוך המכשיר HPLC ולהתחיל את אספן חלק בו זמנית.
- איסוף השברים של 48 מ"ל 1 מ לרוץ כל המדגם מהריצה של תערובת oligosaccharide סטנדרטי.
- העברת 500 μl של שבריר לכל בקבוקון הנצנץ, ומערבבים את תכולת עם 3 מ"ל של נוזל מים בליל הנצנץ.
- טען את צלוחיות לקרוא מונה הנצנץ.
- Readout לדקה הוא זמם כפונקציה של מספר שברים.
- הערכים לדקה בתוך לשיא מייצגים מינים glycan ספציפיים כדלקמן: שברים 18-21 מתאימות M5, M6 ל 22-26 שברים, שברים 27-31 כדי M7, שברים 32-35 כדי M8, שברים 36-39 כדי M9, שברים 40-42 כדי G1M9 ושברים 43-45 כדי G2M9.
- סכום הערכים עותקים לדקה עבור שברים בתוך שיא כל משקפת את הסכום המוחלט של מין glycan ספציפיים. כדי לפצות על העובדה כי מינים המכיל שאריות מנוז יותר לרכוש התווית יותר, "טוחנת כמות יחסית" של כל מין glycan מחושב כדלקמן: הסכום המוחלט של כל מין glycan מחולק במספר שאריות מנוז שהוא מכיל . ערך זה מחולק אז בסכום של הסכומים טוחנת היחסי של כל המינים glycan להשיג כדי להשיג את "אחוזים מסך" לכל מיני glycan ספציפיים.
| צ'ייס (ח) | 0 | 4 |
| יצא עם אנדו H (CPM) | 90000 | 16800 |
| יצא עם N-glycosidase (CPM) F ב | 20400 | 3900 |
| גליקופרוטאינים ב retentate (CPM) ג | 371700 | 127695 |
| Dolichol-אוליגוסכרידים ב retentate (CPM) ד | 4350 | 540 |
| Dolichol-אוליגוסכרידים ב retentate (%) דואר | 1.4 ± 0.7 | 0.2 ± 0.2 |
טבלה 1. ניתוח שחרורו של N-linked שרשראות סוכר עם deglycosidases ואת נוכחותם של dolichol-אוליגוסכרידים בדגימות גליקופרוטאין.
אנו להחיל את ההליך הדופק כדי לרדוף lysate מתאי NIH 3T3. לאחר סינון Microcon, שכותרתו N-linked אוליגוסכרידים שוחררו בעיקר אחרי הדופק תיוג (סוג מנוז גבוהה) עם טיפול נוסף עם F N-glycosidase לאחר תקופה מרדף, אשר יתאים לסוג מורכבות (Golgi עיבוד glycans) עם אנדו H, אנדו H אוליגוסכרידים עמידים. זה ניתוח כמותי נקבע כי dolichol-אוליגוסכרידים, היוו חלק משמעותי של התווית retentate הראשונית.
הערות:
- תאים NIH 3T3 היו הדופק שתויגו עם [2-3 H] מנוז ורדפו להשלים עם בינוניות. לאחר תמוגה התא סינון דרך Microcon YM30, גבוה מנוז N-linked אוליגוסכרידים שוחררו retentates ידי הדגירה עם אנדו ח
- אנדו H עמידות החומר retentates Microcon מ (א) הודגר אז עם F N-glycosidase ושוחרר אוליגוסכרידים נמדד מונה הנצנץ.
- Retentates Microcon שהושגו כמו (א) לפני טיפול H אנדו, חולצו 4 פעמים עם כלורופורם: מתנול: מים 10:10:03 להסיר glycolipids מבשר, ואת החומר unextracted solubilized ב NaOH 1N ו נספר מונה הנצנץ.
- Dolichol-אוליגוסכרידים היו מטוהרים מן קטעים (ג) כפי שמתואר 1 ו נספר מונה הנצנץ.
- ממוצע של 3 ניסויים אחוז dolichol-אוליגוסכרידים (ד) עותקים לדקה סך retentate (ג + ד).
נציג תוצאות
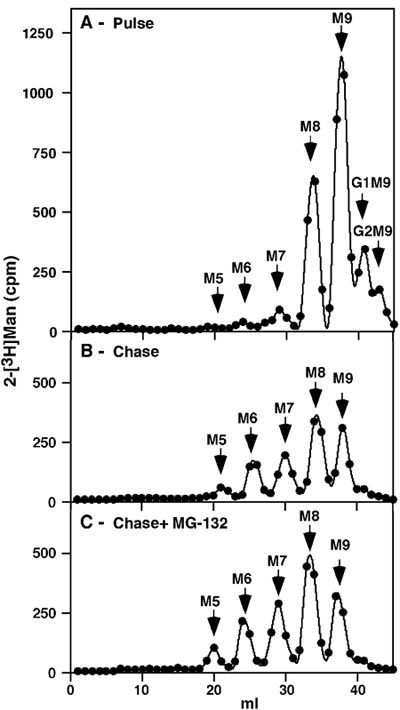
באיור 1. Pulse-מרדף ניתוח הכולל גליקופרוטאינים NIH 3T3 בתאים שלא טופלו ועל עיכוב proteasomal לאחר 1h הדופק עם תיוג. [2-3-H] השגנו פרופיל צפוי עם כמה glucosylatedמבשרי הנותר (Glc 2 Man 9 GlcNAc 2 (G2M9) ו G1M9), אבל רוב התווית נוכח M9 ו M8 מינים, כיוון שזה תוצאה של זמירה של גלוקוז כל אחד שאריות מנוז (איור 1). מבשרי לא קטן מנוז חינם או אחרים התגלו, המעידים על יסודיות של טיהור. בעקבות ארוכה למדי 8h מרדף היה נרחב יותר זמירה כדי M7-6 ו כמות קטנה של M5, אבל המינים העיקריים המשיך להיות M8 M9 ו (איור 1 ב '). אם המרדף בוצע בנוכחות מעכב proteasomal (30 מיקרומטר MG-132), היה רק הצטברות קלה של מינים אלה גזוז אותו (איור 1 ג').
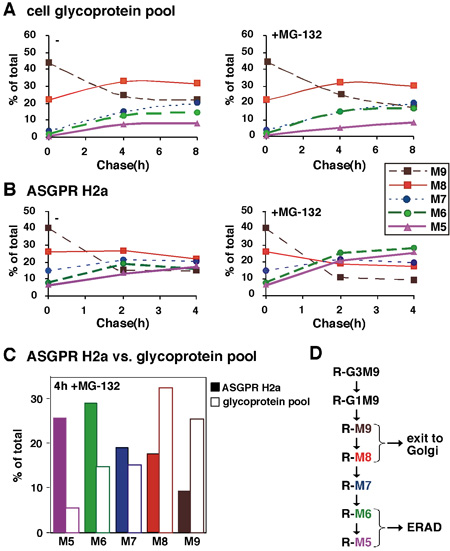
איור 2. ניתוח כמותי של שרשראות סוכר המצע ERAD לעומת סך גליקופרוטאינים. (א) ניסוי דומה לזה בתרשים 1, טוחנת כמויות היחסי של כל המינים oligosaccharide חושבו בהתבסס על תוכן מנוז. אנו המיר את הערכים המתקבלים לדקה לכל מיני glycan, אחוז אחד המינים ביחס לסכום הכולל של הסכומים טוחנת היחסי של כל המינים היה נוכח זממו אז כפונקציה של הזמן לרדוף בממוצע של שני ניסויים. (ב) דומים ל (A) אלא glycans שוחרר מן המצע ERAD ASGPR H2a נותחו לאחר תיוג הדופק ולרדוף עד 4H, בנוכחות או העדר מעכב proteasomal MG-132. (ג) ערכים עבור 4H לרדוף בנוכחות של MG-132 מבית (א) ו - (ב) מושווים עבור ASGPR H2a ובריכת גליקופרוטאין. (ד ') תוכנית של רשת N-linked סוכר זמירה תהליכי המיון. סוכר זמירה תהליכים שיובילו M6-5 קשור חלבונים (R) הממוקדות ERAD לעומת M9-8 על אלה יציאה Golgi ומעבר. תוצאות המחקר מראות כי התהליך ERAD קשורה מנוז זמירה של N-glycans להניב מינים עם 5-6 שאריות מנוז הנותרים.
Discussion
ניתוח הדופק מרדף של glycans בתאים חיים עם הפרדה HPLC מספק שיטה ללמוד את הדינמיקה של שינויים מבניים oligosaccharide לאורך החיים של גליקופרוטאין. יש ראיות הולכות ומצטברות כי שינויים כאלה הם מעורבים בייצור אותות לקיפול ER, בקרת איכות ומערכות 2-5 סחר. השיטה יכול להיות מיושם לא רק ?...
Acknowledgements
אנו מודים זהבית פרנקל סנדרה Tolchinsky לקבלת סיוע טכני. מחקר הקשורים לעבודה זו נתמכת על ידי מענקי הקרן הלאומית למדע (1229-1207) ואת גרמניה פרויקט שיתוף פעולה ישראלי (DIP-DFG).
Materials
| Name | Company | Catalog Number | Comments |
| 600E Multisolvent delivery System controller | Waters | WAT062710 | |
| Acetonitrile LiChrosolv (gradient grade for liquid chromatography) | Merck & Co., Inc. | 1.0003 | |
| Microcon Amicon Ultra 0.5 ml 30K or Centricon ultracel YM-30 | EMD Millipore | UFC503024 or 4208 | |
| Concentrator 5301, incl. 48 x 1.5 / 2.0 ml fixed-angle rotor | Eppendorf | 5301 000.016 | |
| Dialyzed F–tal Calf Serum | Biological Industries | 04-011-1A | |
| Dulbecco’s Modified Eagle’s Medium | GIBCO, by Life Technologies | 41965039 | |
| Dulbecco’s Modified Eagle’s Medium - glucose free | Sigma-Aldrich | D5030 | |
| Dulbecco’s Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D1408 | |
| EDTA disodium salt(Titriplex Iii) | Merck & Co., Inc. | 1084180250 | |
| Endo Hf Kit (1,000,000 units/ml) | New England Biolabs | p0703S | |
| F–tal Calf Serum (FCS) | Biological Industries | 04-001-1A | |
| Frac-100 fraction collector | Amersham | 18-1000-77 | |
| LS 6500 Liquid Scintillation Counting systems | Beckman Coulter Inc. | 510720 | |
| Mannose, D-[2-3H(N)]- (Specific Activity: 15-30Ci/mmol) | PerkinElmer, Inc. | NET570A | |
| N-carbobenzoxyl-leucinyl-leucinyl-leucinal (MG-132) | Calbiochem | 474790 | |
| N-glycosidase F (1000 units/ml) | Roche Group | 11365177 | |
| N-octylglucoside | Sigma-Aldrich | O3757 | |
| NIH 3T3 cells | American Type Culture Collection | CRL-1658 | |
| Opti-Flour | PerkinElmer, Inc. | 6013199 | |
| Phosphoric acid solution ( 49-51%, for HPLC) | Fluka | 79607 | |
| Protease Inhibitor Cocktail | Sigma-Aldrich | P2714 | |
| Protein A-Sepharose beads | Repligen | IPA300 | |
| Rabbit polyclonal anti-H2 carboxy-terminal 6 | |||
| Sodium deoxycholate | Sigma-Aldrich | 30970 | |
| Sodium dodecyl sulfate | Bio-Rad | 161-0301 | |
| Sodium phosphate | Sigma-Aldrich | 342483 | |
| Sodium pyruvate solution (100mM) | Sigma-Aldrich | S8636 | |
| Spherisorb NH2 Column, 5 μm, 4.6 x 250 mm | Waters | PSS831115 | |
| Triton X-100 | VWR | 306324N | |
| Vibra-Cell ultrasonic processors VCX 750 | Sonics and Materials, Inc. | 690-003 | |
| Buffer A: 1% Triton X-100, 0.5% w/v sodium deoxycholate, Protease inhibitor cocktail 2% v/v in PBS | |||
| Buffer B: 0.5% w/v SDS, Protease inhibitor cocktail 2% v/v in PBS | |||
| Buffer C: N-glycosidase F reaction buffer: 200mM Na3PO4, pH 8.0, 4mM EDTA, 1.5% N-octylglucoside | |||
| NIH 3T3 stably expressing H2a 6 | |||
| Buffer D: 0.5% Triton X-100, 0.25% w/v sodium deoxycholate,0.5% w/v SDS, Protease inhibitor cocktail 2% v/v in PBS | |||
| Buffer E: 0.5% w/v SDS, 1% v/v 2-Mercapt–thanol, Protease inhibitor cocktail 2% v/v in PBS | |||
| 2-mercapt–thanol | Sigma-Aldrich | M3148 |
References
- Parodi, A. J., Behrens, N. H., Leloir, L. F., Carminatti, H. The role of polyprenol-bound saccharides as intermediates in glycoprotein synthesis in liver. Proc Natl Acad Sci U S A. 69 (11), 3268-3272 (1972).
- Avezov, E., Frenkel, Z., Ehrlich, M., Herscovics, A., Lederkremer, G. Z. Endoplasmic reticulum (ER) mannosidase I is compartmentalized and required for N-glycan trimming to Man5-6GlcNAc2 in glycoprotein ER-associated degradation. Mol Biol Cell. 19 (1), 216-225 (2008).
- Frenkel, Z., Gregory, W., Kornfeld, S., Lederkremer, G. Z. Endoplasmic reticulum-associated degradation of mammalian glycoproteins involves sugar chain trimming to Man6-5GlcNAc2. J Biol Chem. 278 (36), 34119-34124 (2003).
- Hosokawa, N. Enhancement of endoplasmic reticulum (ER) degradation of misfolded Null Hong Kong alpha1-antitrypsin by human ER mannosidase I. J Biol Chem. 278 (28), 26287-26294 (2003).
- Jakob, C. A., Burda, P., Roth, J., Aebi, M. Degradation of misfolded endoplasmic reticulum glycoproteins in Saccharomyces cerevisiae is determined by a specific oligosaccharide structure. J Cell Biol. 142 (5), 1223-1233 (1998).
- Tolchinsky, S., Yuk, M. H., Ayalon, M., Lodish, H. F., Lederkremer, G. Z. Membrane-bound versus secreted forms of human asialoglycoprotein receptor subunits. Role of a juxtamembrane pentapeptide. J Biol Chem. 271 (24), 14496-14503 (1996).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved