A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
انزيم مرتبط Immunospot الفحص (ELISPOT) : القياس الكمي للردود TH - 1 المناعة الخلوية ضد مولدات المضادات الجرثومية
In This Article
Summary
ويمكن تحقيق الأهداف وتحديد الحصانة على التكيف الميكروبي في أمراض مجهولة بواسطة استخدام مقايسة immunospot انزيم مرتبط.
Abstract
حصانة التكيفية عنصرا هاما في إزالة مسببات الأمراض داخل الخلايا. القدرة على كشف وتحديد هذه الاستجابات في البشر هو أداة مهمة للتشخيص. في مقايسة immunospot انزيم مرتبط (ELISPOT) تكتسب شعبية لقدرته على تحديد الاستجابات المناعية الخلوية ضد المستضدات الجرثومية ، بما في ذلك السكان كبت المناعة مثل المصابين بفيروس نقص المناعة البشرية ، وزرع ، واستخدام الستيرويد. هذا الاختبار لديه القدرة على قياس استجابات مناعية ضد مستضدات جرثومية محددة ، فضلا عن تمييز ما إذا كانت هذه الاستجابات TH1 TH2 أو في حرف. ولا يقتصر ELISPOT إلى موقع الالتهاب. فمن تنوعا في قدرته على تقييم لالاستجابات المناعية داخل الدم المحيطي ، وكذلك المشاركة الفعالة من المواقع مثل غسيل القصبات ، السائل الشوكي الدماغي ، واستسقاء. الكشف عن الاستجابات المناعية ضد المستضدات واحدة أو متعددة هو ممكن ، فضلا عن الحواتم محددة داخل البروتينات الميكروبية. هذا يسهل فحص الكشف عن الاستجابات المناعية مع مرور الوقت ، فضلا عن التمييز في مستضدات معترف بها من قبل خلايا تي المضيفة. المقايسات ELISPOT اللون المزدوج متاحة للكشف عن التعبير في وقت واحد من اثنين من السيتوكينات. تطبيقات هذه التقنية الحديثة لتشمل تشخيص مرض السل خارج الرئة ، فضلا عن التحقيق في مساهمة مستضدات المعدية للأمراض المناعة الذاتية.
Protocol
لبروتوكول التالية ، ونحن نستخدم خلايا الدم المحيطية وحيدات النوى (PBMC) وخلايا الفائدة. ومع ذلك ، يمكن استخدام هذا البروتوكول مع أنواع الخلايا الأخرى. إجراء الفحص في نسيج الثقافة هود باستخدام تقنية معقمة.
اليوم 1 : إعداد لوحة والخلايا
- تأخذ بها لوحة ELISPOT وفتحه في غطاء محرك السيارة.
- غسل لوحة 3 مرات مع 150 ميكرولتر من 1X PBS باستخدام pipettor الأقنية ، إذا كانت متوفرة ، واحد خلاف ذلك جيدا pipetting مقبولة.
- تأخذ بها مجموعة من الخزانات وفتحه في غطاء محرك السيارة.
- إضافة 2 ميكروغرام / مل من التقاط الأجسام المضادة ، ومكافحة الإنسان إنترفيرون - γ ، إلى 11 ملل من 1X PBS. دوامة جيدا. نقل مزيج الأجسام المضادة إلى الخزان.
- مكان 100 ميكرولتر من الحل في كل طلاء به جيدا الأقنية.
- في لوحة التفاف parafilm.
- وضع لوحة في الثلاجة طوال الليل. لوحات جيدة لأسابيع. والقاعدة هي أنه إذا كان هناك لا يزال اليسار السائل في الآبار ، ويمكن استخدام لوحة.
خلية التحضير
إذا PBMCs الطازجة ثم عد الخلايا واحتضان بين عشية وضحاها في 37 مع 5 ٪ CO 2 درجة مئوية. لPBMC تخزينها في النيتروجين السائل ، وذوبان للخلايا هو ضروري. البروتوكول على النحو التالي :
- ذوبان الجليد في cryovial من الخلايا في 37 درجة مئوية حتى حمام ماء مذاب تماما تقريبا.
- resuspend فورا في 5 مل من R10 وسائل الإعلام.
- تدور لمدة 5 دقائق في غرام × 225
- Resuspend مرة أخرى في 5 مل من R10 وسائل الإعلام وعدد من الخلايا قادرة على البقاء به التريبان الأزرق.
- جلب التركيز إلى 2 × 10 6 خلايا / مل في وسائل الاعلام R10.
- بقية الليل في 37 درجة مئوية مع نسبة 5 ٪ CO 2.
اليوم 2 : إعداد لوحة الهاتفي
- تسمية غطاء لوحة مع تحديد عدد العينات ، وظروف جيدة ، والتاريخ.
- غسل لوحة 6 مرات مع 150 ميكرولتر من 1X PBS العقيمة باستخدام أسلوب التفريغ وصمة عار. يجب الحرص على عدم رش لوحة بينما الإغراق. هذا يمكن أن يتسبب في الآبار من لوحة لتحويل الأرجواني.
- إضافة 100 ميكرولتر من R20 إلى كل بئر.
- احتضان لوحة عند 37 درجة مئوية لمدة 1 ساعة.
- في حين أن لوحة ويحتضنها ، عد الخلايا التي كانت تقع بين عشية وضحاها.
- تدور تعليق خلية في 1500 دورة في الدقيقة لمدة 5 دقائق. صب وطاف وresuspend الكرية بحيث يكون لديك تركيز النهائي من 1X10 6 خلايا في 1mL R10 في وسائل الإعلام.
- بعد حضانة 1 ساعة ، إزالة R20 باستخدام أسلوب التفريغ وصمة عار. يجب الحرص على عدم رش لوحة بينما الإغراق.
- إضافة 100 ميكرولتر من محلول الخلية (10 5 الخلايا) إلى كل بئر. إضافة الببتيدات المناسبة و / أو مولدات المضادات في الآبار في المقابلة مكررة. استخدام غيض ماصة جديدة في كل مرة تذهب الى حل الببتيد العمل. تركيز الببتيد العادي هو 10-40 ميكروغرام / مل. منذ الببتيدات تختلف ، يجب على كل محقق يعاير الببتيدات للحصول على النتائج المثلى.
- في آبار المراقبة السلبية ، فقط إضافة الخلايا (أي الببتيد)
- في آبار المراقبة الايجابية ، إضافة راصة دموية نباتية (PHA ؛ 10 ميكروغرام / مل ؛ سيغما).
- يحضن بين عشية وضحاها في 37 درجة مئوية مع نسبة 5 ٪ CO 2 (~ 18 ساعة).
اليوم 3 : تطوير بلايت
- غسل لوحة 6 مرات مع 150 ميكرولتر 1xPBS باستخدام أسلوب التفريغ وصمة عار.
- إضافة إلى 100 برنامج تلفزيوني ميكرولتر كل بئر من لوحة باستخدام pipettor الأقنية.
- وضع لوحة في الثلاجة لمدة 15 دقيقة.
- تأخذ لوحة من الثلاجة وضعها في نسيج الثقافة هود.
- إعداد الحل الضد البيوتين
- إضافة 0.5 ميكروغرام / مل من الأجسام المضادة البيوتين (ماب 7 - B6 - 1) لبرنامج تلفزيوني 11mL.
- دوامة الحل لمزيج جيد.
- إذا كان التخطيط لإضافة حل باستخدام الأقنية ، سكبه داخل الخزان.
- تجاهل من قبل برنامج تلفزيوني عبها عليه في سلة المهملات. يجب الحرص على عدم رش لوحة بينما الإغراق.
- مكان 100 ميكرولتر من الحل في كل بئر.
- احتضان لوحة في نسيج الثقافة غطاء في درجة حرارة الغرفة لمدة ساعة.
- غسل لوحة 6 مرات مع 150μL 1xPBS باستخدام أسلوب التفريغ وصمة عار. على غسل ال 6 ، وترك في برنامج تلفزيوني على لوحة حتى يكون لديك استعداد للStreptavidin الأضداد.
- إعداد Streptavidin الأضداد.
- إضافة 5.5 لتر μ Streptavidin الأضداد (Streptavidin - ALP) لبرنامج تلفزيوني 11mL (1:2000 تمييع).
- دوامة الحل لمزيج جيد.
- إذا كان التخطيط لإضافة حل باستخدام الأقنية ، سكبه داخل الخزان.
- تجاهل PBS المتبقية في الآبار وصمة عار على طبق من ذهب.
- إضافة 100 ميكرولتر من محلول Streptavidin إلى كل بئر.
- احتضان لوحة في نسيج الثقافة غطاء في درجة حرارة الغرفة لمدة 1 ساعة.
- غسل الأطباق 6 مرات مع برنامج تلفزيوني باستخدام أسلوب التفريغ وصمة عار. على غسل ال 6 ، وترك في برنامج تلفزيوني على لوحة حتى كنت قد قدمت الحل اللون.
- العمل في الظلام. تعد الركيزة الفوسفاتيز القلوية الحل (الفوسفاتيز القلوية الركيزة الرابعة BCIP كيت / NBT) :
- إضافة 4 قطرات من كاشف الركيزة 1-11 العازلة تريس مل ، دوامة جيدا. إضافة 4 قطرات من كاشف الركيزة 2 إلى تريس العازلة ، دوامة جيدا. إضافة 4 نقاط من 3 إلى كاشف الركيزة تريس العازلة ، دوامة جيدا.
- تجاهل PBS المتبقية وصمة عار على طبق من ذهب.
- إضافة 100 ميكرولتر من محلول اللون على كل جانب من لوحة باستخدام الأقنية.
- بدوره على ضوء بعد 5 إلى 10 دقائق من لون النامية.
- السماح للالكواشف اللون على البقاء على لوحة حتى تبدأ البقع لتحويل الأرجواني ومظلمة جدا. وينبغي أن تأخذ هذا في أي مكان من 5 إلى 20 دقيقة. يجب الحرص على عدم ترك حل الركيزة لفترة طويلة جدا لان ذلك قد يسبب خلفية عالية.
- غسل لوحة ELISPOT 3 مرات مع مياه الحنفية.
- يترك ليجف لمدة ساعة تقريبا أو بين عشية وضحاها.
- قراءة لوحة إما يدويا أو مع قارئ لوحة ELISPOT.
- متجر لوحة في مربع بعيدا عن التعرض للضوء.
ممثل النتائج :
ويهدف إلى ELISPOT quantitate الاستجابات المناعية ضد المستضدات الجرثومية. كل بقعة يشير إلى وجود خلية واحدة تستجيب ، معربا عن خلوى في المصالح. ويمكن احتساب النقاط يدويا أو باستخدام لوحة ELISPOT القارئ.
وينبغي أن التقييم الذي تم إجراؤه بشكل صحيح ELISPOT تبدأ التحقيق في السيطرة السلبية لإنتاج خلفية خلوى في المصالح. في آبار المراقبة السلبية يتوقع المرء أن يرى أي بقع ، على الرغم من الخلفية قليلا (اللون الأرجواني) قد تكون موجودة. عادة ، يجب أن يكون هناك أقل من المتوسط من خمس نقاط لكل بئر. آبار مراقبة إيجابية تؤكد أنه تم إجراء تفاعل بشكل صحيح ، وأن الخلايا تستجيب لتحفيز مستضدي. في آبار المراقبة الإيجابية التي تتوقع أن نرى الخلفية العميقة الأرجواني نظرا لالتقاء مجموعة من البقع (Fig1). يجب أن يكون هناك قليل من دون خلفية بيضاء. إذا كان عنصر التحكم الإيجابية والسلبية عينات مراقبة ملائمة ، يمكن للمرء ثم عد الآبار التي تحتوي على مستضد من الفائدة. وسوف يعكس "الأمثل" النتيجة خلفية عالية (الآبار والأرجواني) ، أي بقع أو بقع قليلة جدا ، ومركز فارغة ، وبقع محددة بشكل واضح أو بقع متموجة. وهناك قائمة من النصائح لحل المشاكل (الجدول 1).
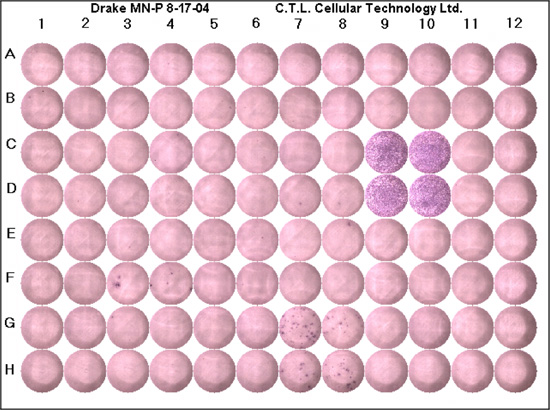
الشكل 1. ممثل لوحة ELISPOT. وينبغي أن تحتوي كل لوحة تحكم إيجابية ، ومراقبة سلبية والببتيد الفائدة التي أجريت في الحد الأدنى في اثنين من الآبار. C9 ، C10 ، وD9 D10 هي آبار المراقبة الايجابية ، وكما ترون هناك لون ارجواني عميق ، وخلايا متكدسة ويكاد أي خلفية بيضاء. آبار المراقبة السلبية G11 ، G12 ، H11 و H12. هذه الآبار لا الخلفية ولا بقع ارجوانية كما هو متوقع. البقع G7 ، G8 ، وH7 H8 ، توضح الاستجابات الخلوية لالببتيدات الميكروبية ، وبقع ارجوانية تمثل خلية واحدة تعبر عن استجابة خلوى في المصالح.
الجدول 1
| مراقبة | مشكلة ممكن | الحل الممكن |
| ارتفاع الخلفية | 1. جانبي الغشاء لا يغسل بشكل صحيح 2. الكثير من خلايا إفراز خلوى 3. لوحة لم يجف بشكل صحيح 4. أكثر من لوحة وضعت | 1. اغسل وجهي بالماء المقطر الغشاء قبل وبعد وضع اللون. الكواشف قد تسرب من خلال الغشاء الى قاعدة لوحة ، وهذه الخلفية يمكن أن يسبب ارتفاع إذا لم يتم غسلها بعيدا. 2. خفض عدد الخلايا في جيدا ، وسوف يتطلب هذا التحسين 3. الجافة لوحة لفترة أطول قبل القراءة 4. تقليل الوقت النامية |
| لا بقع / اماكن قليلة جدا | 1. لا يكفي خلايا إفراز خلوى / البروتين من الفائدة 2. ضمان تحفيز الخلايا بشكل صحيح 3. الخلايا لا المحتضنة للترقد اونج أو اتخاذ ما يكفي من الوقت للرد على المنشطات 4. عدم كفاية اللون التنمية 5. لا يكفي الابتدائية أو الثانوية الأضداد | 1. زيادة عدد الخلايا. وسوف يتطلب هذا التحسين 2. أيضا استخدام عنصر تحكم التحفيز الإيجابي -- وهي مادة منبهة الذي تعرفه سوف تحفز التعبير خلوى الخاص / البروتينات ذات الاهتمام 3. زيادة فترة حضانة الخلايا أو استخدام الطريقة غير المباشرة (قبل علاج الخلايا مع منبه) 4. رصد التنمية اللون مع مجهر العامة وضمان أنه تم تخزين الكواشف النامية بشكل صحيح ولم يفقد النشاط 5. وسوف تركز على الضد الابتدائي و / أو الثانوية هناك حاجة إلى زيادة. وسوف يتطلب هذا التحسين. |
| مناطق فارغة | 1. لا الغشاء ما قبل المعالجة 2. قد جفت غشاء بها في مرحلة ما 3. خلايا موزعة بالتساوي | 1. هو سابقة التجهيز الكافي مع ضمان غشاء الايثانول 70 ٪ (كل الأغشية لا حاجة الى ذلك حتى تحقق مع المورد الخاص بك). يغسل جيدا بعد ذلك في برنامج تلفزيوني مع 3X 2. ضمان الغشاء لا يجف 3. تأكد من خليط الخلايا برفق لديك تعليق خلية جيدة مثلي pipetting قبل الخروج الى الآبار |
| مركز فارغة | 1. الأضرار الناجمة عن غسيل | 1. قد معدل التدفق في غسالة آلية (أو pipetting) تكون مرتفعة للغاية. ضرورة إجراء مزيد من الغسيل لطيف |
| ايجابيات كاذبة | 1. المجاميع الضد الثانوية 2. خلايا لا تزال على الغشاء 3. خلية ثقافة التلوث | 1. تصفية الضد الثانوية 2. ضمان تغسل جميع الخلايا من الغشاء مع توين PBS 20 قبل الحضانة الضد الثانوية. والخلايا المتبقية على شكل بقع غشاء إعطاء غير النظامية 3. كما تبقي الكواشف معقمة ونظيفة بقدر الإمكان. تضمن تقنية زراعة الخلايا الخاص هو العقيم. تحقق من ايجابيات كاذبة عن طريق تشغيل مراقبة وسائل الإعلام سلبية. عن حركة الصفائح ، انظر بقع محددة بشكل واضح |
| متكدسة البقع | 1. الفقراء طلاء ، الكثير من الأضداد 2. المطول خلية ثقافة 3. الإفراط في تحفيز الخلايا | 1. تقليل تركيز الأجسام المضادة الأولية 2. وتعد الخلايا المحتضنة ، والمزيد من خلوى / أنها سوف تفرز البروتين. وهذه النتيجة في جو من البقع التي ستبدأ لدمج وتصبح تمييزه. 3. تقليل الوقت الخلية حضانة الخطوة الثقافة. ونتيجة الإفراط في التحفيز في الكثير من خلوى / البروتين الذي تفرزه الخلايا. وسوف تنتج هذه البقع التي سيتم البدء في دمج وتصبح تمييزه. تقليل كمية من المنشطات في وسائل الإعلام أو الثقافة أو الثقافة لأقصر فترة من الوقت |
| معرفة اماكن سيئة | 1. الغشاء ليس قبل المعالجة (إذا كان الغشاء الخاص بك يتطلب هذا ، تحقق مع المورد) 2. حركة الصفائح خلال حضانة الخلية | 1. يجب أن يكون غشاء قبل تعامل مع الايثانول أو هذا يمكن أن يؤدي في البقاع ، تعريف غامض سيئة. وسوف يكون من الصعب على القارئ أن يميز هذه 2. لا تسمح لوحة لنقل حضانة خلال الخلية والخلايا التي انتقلت سوف يخلق أكثر من بقعة واحدة. وإذا كان ممكنا استخدام حاضنة مخصصة أنه لن يتم فتح أثناء الحضانة. لا تنصت على لوحة بعد إضافة خلايا |
| الإيجابية التحكم الآبار منخفضة | 1. التخلف -- قد يكون نتيجة لاستخدام Streptavidin - ALP و / أو حلول BCIP / NBT التي لم يتم تقديمهم إلى درجة حرارة الغرفة | 1. جلب الكواشف إلى درجة حرارة الغرفة قبل إضافة إلى الآبار |
| كثافة البقع يجعل من الصعب تقدير لهم | 1. تم إضافة العديد من الخلايا في الآبار | 1. التخفيفات تجعل من الخلايا (أي 1 × 10 6 ، 5 × 10 5 ، 1 × 10 5 ، 5 × 10 4 ، 1 × 10 4 خلايا لكل بئر) لتحديد العدد الأمثل من الخلايا التي من شأنها أن تؤدي إلى تكوين بقع مميزة |
Discussion
برزت مقايسة ELISPOT باعتبارها واحدة من أهم والمقايسات المستخدمة على نطاق واسع لرصد الاستجابات المناعية في البشر ومجموعة متنوعة من الأنواع الأخرى. مع مقايسة ELISPOT ، يمكن قياس الترددات الخلايا المناعية على مستوى خلية واحدة دون توسع أو التلاعب السكان الخلية. وقد تم تطبيقها...
Disclosures
Acknowledgements
بدعم جزئي من المنحة 1 فاندربيلت CTSA UL1 RR024975 من المركز الوطني لبحوث الموارد والمعاهد الوطنية للصحة. وقد تم تمويل هذا العمل من قبل المعاهد الوطنية للصحة R01 HL 83839 ؛ R01 رقم 65744.
Materials
A. إعداد وسائل الإعلام

باء إعداد الاحتياطي تريس
- إضافة 800 مل من DDH 2 O إلى الدورق L 1.
- قياس 12 غراما من تريس وإضافة إلى الكأس.
- إضافة 0.12 جرام من كلوريد المغنيسيوم hexahydrate (MgCl 2 : 6H 2 O) في الكأس.
- اثارة مع قضيب التحريك المغناطيسي على لوحة التحريك التلقائي.
- حل مرة واحدة ، ودرجة الحموضة إلى 9.5 الحل.
- إضافة 200 مل من DDH 2 O إلى الدورق ، مما جعلها تصل إلى 1000mL.
- تصفية حل مع مرشح 0.22 ميكرون.
جيم المواد اللازمة لتحليل ELISPOT :

References
- Dosanjh, D. P., Hinks, T. S., Innes, J. A., Deeks, J. J., Pasvol, G., Hackforth, S., Varia, H., Millington, K. A., Gunatheesan, R., Guyot-Revol, V., Lalvani, A. Improved diagnostic evaluation of suspected tuberculosis. Ann Intern Med. 148, 325-336 (2008).
- Sung, H. K. E. Diagnosis of abdominal tuberculosis by T-cell based assays on peripheral blood and peritoneal fluid mononuclear cells. Journal of Infection. 59, 409-415 (2009).
- Kim, S. -. H. Diagnosis of Central Nervous System Tuberculosis by T-Cell-Based Assays on Peripheral Blood and Cerebrospinal Fluid Mononuclear Cells. Clinical and Vaccine Immunology. , 1356-1362 (2008).
- Drake, W. P., Dhason, M. S., Nadaf, M., Shepherd, B. E., Vadivelu, S., Hajizadeh, R., Newman, L. S., Kalams, S. A. Cellular recognition of Mycobacterium tuberculosis ESAT-6 and KatG peptides in systemic sarcoidosis. Infect Immun. 75, 527-530 (2007).
- Allen, S. S., Evans, W., Carlisle, J., Hajizadeh, R., Nadaf, M., Shepherd, B. E., Pride, D. T., Johnson, J. E., Drake, W. P. Superoxide dismutase A antigens derived from molecular analysis of sarcoidosis granulomas elicit systemic Th-1 immune responses. Respir Res. 25, 36-36 (2008).
- Mutsvangwa, J., Millington, K. A., Chaka, K., Mavhudzi, T., Cheung, Y. B., Mason, P. R., Butterworth, A. E., Corbett, E. L., Lalvani, A. Identifying recent Mycobacterium tuberculosis transmission in the setting of high HIV and TB burden. Thorax. 65, 315-320 (2010).
- Streeck, H., Frahm, N., Walker, B. D. The role of IFN-gamma Elispot assay in HIV vaccine research. Nat Protoc. 4, 461-469 (2009).
- Chaudhary, N., Staab, J. F., Marr, K. A. Healthy human T-Cell Responses to Aspergillus fumigatus antigens. PLoS One. 5, e9036-e9036 (2010).
- Manigold, T., Mori, A., Graumann, R., Llop, E., Simon, V., Ferr, S. M., Valdivieso, F., Castillo, C., Hjelle, B., Vial, P. Highly differentiated, resting gn-specific memory CD8+ T cells persist years after infection by andes hantavirus. PLoS Pathog. 6, e1000779-e1000779 (2010).
- Ndongala, M. L., Kamya, P., Boulet, S., Peretz, Y., Rouleau, D., Tremblay, C., Leblanc, R., Côté, P., Baril, J. G., Thomas, R., Vézina, S., Boulassel, M. R., Routy, J. P., Sékaly, R. P., Bernard, N. F. Changes in function of HIV-specific T-cell responses with increasing time from infection. Viral Immunol. 2, 159-168 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved