A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Enzyme-linked Immunospot Assay (ELISPOT): כימות Th-1 תגובות חיסוניות נגד אנטיגנים נייד מיקרוביאלית
In This Article
Summary
זיהוי מטרות מיקרוביאלי של חסינות אדפטיבית במחלות אידיופטית ניתן להשיג על ידי שימוש assay האנזים צמוד immunospot.
Abstract
חסינות מסתגלת היא מרכיב חשוב אישור של פתוגנים תאיים. היכולת לזהות ולכמת התגובות הללו בבני אדם הוא כלי אבחוני חשוב. Assay enzyme-linked immunospot (ELISPOT) הוא צובר פופולריות ביכולתה לזהות התגובה החיסונית התאית נגד אנטיגנים של חיידקים, כולל אוכלוסיות immunosuppressed כגון אלה עם HIV, השתלה, ואת השימוש בסטרואידים. Assay זה יש את היכולת לכמת את התגובה החיסונית נגד אנטיגנים ספציפיים של חיידקים, כמו גם להבחין אם התגובות האלה Th1 או Th2 אופי. ELISPOT אינה מוגבלת לאתר של דלקת. זה צדדי ביכולתה להעריך את התגובה החיסונית בתוך דם היקפיים, כמו גם אתרים של מעורבות פעילה כגון שטיפה ברונכואלוואולרית, נוזל השדרה מוחין, מיימת. זיהוי של המערכת החיסונית כנגד אנטיגנים בודדות או מרובות אפשרי, כמו גם epitopes חלבונים ספציפיים בתוך חיידקים. Assay זה מאפשר זיהוי של המערכת החיסונית לאורך זמן, כמו גם הבחנות מוכר על ידי אנטיגנים לתאי T הפונדקאי. Dual ELISPOT מבחני צבע זמינים עבור גילוי של ביטוי סימולטני של שני ציטוקינים. יישומים אחרונים של טכניקה זו כוללים אבחנה של שחפת extrapulmonary, כמו גם חקירה של התרומה של אנטיגנים זיהומיות למחלות אוטואימוניות.
Protocol
בשביל הפרוטוקול הבא, אנו משתמשים בתאי דם היקפיים mononuclear (PBMC) כמו התאים של עניין. עם זאת, פרוטוקול זה ניתן להשתמש עם סוגי תאים אחרים. בצע את assay במנדף רקמות התרבות באמצעות טכניקה סטרילית.
יום 1: הכנת צלחת תאים
- קחו את הצלחת ELISPOT ופתח אותו למכסה המנוע.
- לשטוף את הצלחת 3 פעמים עם 150 μL של 1X PBS באמצעות pipettor רב, אם ניתן, גם pipetting יחיד אחרת מקובל.
- קח את חבילת מאגרים לפתוח אותו למכסה המנוע.
- הוסף 2 מיקרוגרם / מ"ל של הנוגדן ללכוד, אנטי אנושי אינטרפרון-γ, עד 11 MLS של 1X PBS. וורטקס היטב. העברת תערובת נוגדנים למאגר.
- מקום 100 μL של הפתרון ציפוי זה לתוך זה גם שימוש רב.
- לעטוף את הצלחת parafilm.
- מניחים את צלחת במקרר למשך הלילה. הצלחות טובים במשך שבועות. כלל האצבע הוא שאם יש עדיין נשאר נוזלי את הבארות, את הצלחת יכול לשמש.
תא הכנה
אם PBMCs הם טריים ואז לספור את התאים דגירה לילה בשעה 37 ° C עם 5% CO 2. עבור PBMC מאוחסנים חנקן נוזלי, מפשיר של תאים הכרחי. הפרוטוקול הוא כדלקמן:
- ההפשרה cryovial של תאים 37 ° C אמבט מים עד מופשר כמעט לחלוטין.
- Resuspend מיד ב 5 מ"ל של R10 התקשורת.
- ספין במשך 5 דקות ב 225 x ז
- Resuspend שוב ב 5 מ"ל של R10 מדיה לספור את התאים קיימא באמצעות trypan כחול.
- תביאו הריכוז 2 x 10 6 תאים / מ"ל ב R10 התקשורת.
- מנוחה בין לילה ב 37 ° C עם 5% CO 2.
יום 2: קביעת-Up פלייט
- צלחת עם מכסה לייבל מספר זיהוי הדגימה, תנאים טוב, ותאריך.
- לשטוף את הצלחת 6 פעמים עם 150 μL של סטרילית 1x PBS באמצעות ה-dump שיטת כתם. היזהר לא להתיז את הצלחת בעת ההטלה. הדבר עלול לגרום בארות הצלחת להפוך סגול.
- הוספת 100 μL של R20 היטב כל אחד.
- דגירה את הצלחת על 37 מעלות צלזיוס במשך שעה 1.
- בעוד צלחת הוא דוגרים, לספור את התאים היו נח בן לילה.
- ספין ההשעיה תא בסל"ד 1500 למשך 5 דקות. למזוג supernatant ו resuspend גלולה, כך יש לך ריכוז סופי של 1x10 6 תאים לכל 1mL ב R10 התקשורת.
- לאחר דגירה 1 שעה, להסיר את R20 באמצעות ה-dump שיטת כתם. היזהר לא להתיז את הצלחת בעת ההטלה.
- הוספת 100 μL של פתרון תאים (10 5 תאים) כדי היטב כל אחד. הוסף פפטידים מתאימים ו / או אנטיגנים על בארות המקביל כפולים. השתמש קצה פיפטה חדשה בכל פעם שאתה נכנס הפתרון עובד פפטיד. ריכוז הפפטיד רגיל הוא 10-40 מיקרוגרם / מ"ל. מאז פפטידים להשתנות, כל חוקר צריך לכיל פפטידים כדי להשיג תוצאות אופטימליות.
- ב בארות בקרה שלילית, רק להוסיף תאים (לא פפטידים)
- ב בארות בקרה חיובית, להוסיף phytohemagglutinin (PHA; 10 מיקרוגרם / מ"ל; סיגמא).
- דגירה לילה בשעה 37 ° C עם 5% CO 2 (~ 18 שעות).
יום 3: פיתוח פלייט
- לשטוף את הצלחת 6 פעמים עם 150 1xPBS μL באמצעות ה-dump שיטת כתם.
- הוספת 100 PBS μL היטב כל הצלחת באמצעות pipettor רב.
- שים את צלחת במקרר למשך 15 דקות.
- קחו את הצלחת מהמקרר ומניחים אותו על מכסה המנוע בתרבית רקמה.
- הכן את הפתרון נוגדן ביוטין
- הוסף 0.5 מיקרוגרם / מ"ל של נוגדן ביוטין (מב 7-B6-1) כדי 11mL PBS.
- הפתרון וורטקס לערבב היטב.
- אם מתכננים להוסיף את הפתרון באמצעות רב, לשפוך אותה לתוך המאגר.
- בטל PBS על ידי מצליף אותה לפח. היזהר לא להתיז את הצלחת בעת ההטלה.
- מקום 100 μL של פתרון זה לתוך זה היטב.
- דגירה את הצלחת מכסה את הרקמה תרבות בטמפרטורת החדר למשך שעה אחת.
- לשטוף 6 פעמים צלחת עם 150μL 1xPBS באמצעות ה-dump שיטת כתם. ביום לשטוף את ה 6, תשאיר את PBS על הצלחת עד שהכנת את הנוגדן streptavidin.
- הכן את הנוגדן streptavidin.
- הוסף 5.5 μ l streptavidin נוגדן (streptavidin-ALP) כדי 11mL PBS (1:2000 דילול).
- הפתרון וורטקס לערבב היטב.
- אם מתכננים להוסיף את הפתרון באמצעות רב, לשפוך אותה לתוך המאגר.
- בטל PBS שנותרו בארות למחוק את הצלחת.
- הוספת 100 μL של פתרון streptavidin היטב כל אחד.
- דגירה את הצלחת מכסה את הרקמה תרבות בטמפרטורת החדר למשך שעה 1.
- לשטוף צלחות 6 פעמים עם PBS באמצעות ה-dump שיטת כתם. ביום לשטוף את ה 6, תשאיר את PBS על הצלחת עד שביצעת את הפתרון צבע.
- עבודה בחושך. הכן את phosphatase אלקליין המצע פתרון (אלקליין תשתית phosphatase ערכת IV BCIP / NBT):
- הוסף 4 טיפות של ריאגנט המצע 1-11 מ"ל טריס חיץ, מערבולת היטב. הוסף 4 טיפות של ריאגנט המצע 2 עד טריס חיץ, מערבולת היטב. הוסף 4 טיפות של ריאגנט המצע 3 עד טריס חיץ, מערבולת היטב.
- בטל PBS הנותרים למחוק את הצלחת.
- הוספת 100 μL של הפתרון צבע היטב כל הצלחת באמצעות רב.
- כבה את האור לאחר 5 עד 10 דקות של צבע מתפתחות.
- אפשר ריאגנטים צבע להישאר על הצלחת עד הכתמים מתחילים להפוך סגולים כהים למדי. זה אמור לקחת בין 5 עד 20 דקות. להיזהר לא להשאיר את פתרון המצע על יותר מדי זמן, כי כך עלול לגרום רקע גבוה.
- לשטוף את הצלחת ELISPOT 3 פעמים עם מי ברז.
- השאירו לייבוש למשך כשעה או לילה.
- קראו צלחת ידנית או עם קורא צלחת ELISPOT.
- אחסן את הצלחת בקופסה הרחק חשיפה לאור.
נציג תוצאות:
ELISPOT נועדה לכמת את התגובה החיסונית נגד אנטיגנים של חיידקים. כל נקודה מציין התא מגיב אחד, המבטא את ציטוקינים של עניין. הכתמים ניתן לספור ידנית או באמצעות קורא צלחת ELISPOT.
הערכה כי ELISPOT שבוצעה כהלכה צריך להתחיל עם החקירה של שליטה שלילי לייצור הרקע של ציטוקינים של עניין. ב בארות בקרה שלילית שהיינו מצפים לראות שום כתמים, אם כי קצת רקע (צבע סגול) רשאי להיות נוכח. בדרך כלל, לא צריך להיות פחות מהממוצע של חמש נקודות לכל טוב. בארות בקרה חיובית לאשר את התגובה שבוצעה כהלכה, וכי התאים מגיבים לגירוי antigenic. ב בארות בקרה חיובית שהיית מצפה לראות רקע סגול עמוק עקב מפגש של כתמים (Fig1). צריך להיות קצת רקע לא לבן. אם הביקורת חיובית דגימות בקרה שלילית מתאימים, אז אפשר לספור את בארות המכיל את האנטיגן של עניין. תוצאה "לא טובים", יבואו לידי ביטוי על ידי רקע גבוה (בארות הם סגול), ללא כתמים או נקודות מעטים מאוד, מרכז ריקים, כתמים מוגדר כהלכה או כתמים ומחוברות. רשימה של עצות לפתרון בעיות מסופק (טבלה 1).
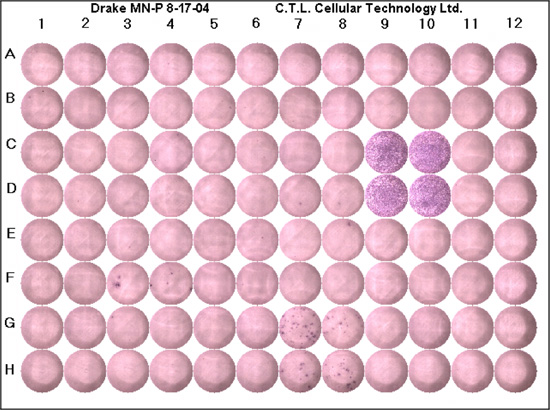
באיור 1. נציג צלחת ELISPOT. כל צלחת צריכה להכיל ביקורת חיובית, שליטה שלילי פפטיד של עניין שנערך מינימום של שתי בארות. C9, C10, D10 ו - D9 הם בארות שליטה חיובית, כפי שניתן לראות יש צבע סגול עמוק, תאים ומחוברות וכמעט כל רקע לבן. בארות לשלוט שליליים G11, G12, H11 ו H12. בארות אלה אין רקע סגול ואין כתמים כצפוי. נקודות ה-G7, G8, H7 ו H8, ממחישות התגובות הסלולר פפטידים חיידקים; כתמים סגולים מייצגים תא תגובה אחת ביטוי ציטוקינים של עניין.
טבלה 1
| תצפית | בעיה אפשרית | פתרון אפשרי |
| גבוהה רקע | 1. שני הצדדים של הממברנה לא נשטף כראוי 2. יותר מדי תאים מפרישים ציטוקינים 3. פלייט לא מיובש כראוי 4. מעל צלחת שפותח | 1. שטפו את שני הצדדים של הממברנה עם מים מזוקקים לפני ואחרי התפתחות הצבע. ריאגנטים עלול לדלוף דרך הממברנה לתוך הבסיס של הבסיס, אלה יכולים לגרום רקע גבוה אם לא נשטף. 2. הפחת את מספר התאים בכל טוב, זה יחייב אופטימיזציה 3. יבש את הצלחת עוד לפני קריאת 4. לצמצם את זמן פיתוח |
| אין נקודות / כתמים מעטים | 1. לא מספיק תאים מפרישים ציטוקינים / חלבון עניין 2. ודא תאים מגורה בצורה נכונה 3. תאים לא מודגרות עבור lאונג מספיק או עלול לקחת זמן להגיב ממריץ 4. צבע לקוי פיתוח 5. לא מספיק ראשוני או משני הנוגדנים | 1. הגדלת מספר התאים. זה ידרוש אופטימיזציה 2. גם להשתמש בקרה גירוי חיובי - ממריץ שאתה יודע יניעו ביטוי של ציטוקינים שלך / חלבון עניין 3. להגדיל את זמן הדגירה התא או להשתמש בשיטה עקיפה (טרום לטפל בתאים עם ממריץ) 4. צג התפתחות צבע עם מיקרוסקופ תקורה להבטיח כי ריאגנטים בפיתוח אוחסנו כראוי ולא איבדו את פעילות 5. ריכוז הנוגדן העיקרי ו / או משנית יהיה צורך מוגבר. זה ידרוש אופטימיזציה. |
| בלנק תחומי | 1. ממברנה לא טרום טיפול 2. ממברנה התייבש בשלב כלשהו 3. תאים מופצים בצורה לא אחידה | 1. ודא קרום הוא pretreated כראוי עם אתנול 70% (ממברנות כל לא צריך את זה כדי לבדוק עם הספק שלך). לשטוף היטב עם PBS 3X לאחר מכן 2. ודא קרום לא יבש 3. ודא שאתה לערבב בעדינות את התאים יש השעיה תא הומולוגיים טוב לפני pipetting אל הבארות |
| בלנק מרכז | 1. נזקי כביסה | 1. ספיקה על מכונת כביסה אוטומטיים (או pipetting) עשוי להיות גבוה מדי. זקוק הליך כביסה עדינה יותר |
| שקר חיובי | 1. נוגדן אגרגטים משני 2. תאים עדיין על הממברנה 3. תרבית תאים זיהום | 1. סינון נוגדנים משני 2. ודאו כי כל התאים נשטפים מן הקרום עם PBS Tween 20 לפני הדגירה נוגדנים משני. תאים משמאל על הממברנה ייתן כתמים בצורת סדיר 3. שמור ריאגנטים כמו סטרילי ונקי ככל האפשר. ודא תרבות הסלולרי שלך הטכניקה aseptic. בדוק חיוביות שגויות על ידי הפעלת שליטה בתקשורת שלילית. עבור התנועה צלחת, לראות כתמים מוגדרים היטב |
| ומחוברות כתמים | 1. ציפוי המסכן, נוגדן רב מדי 2. תא ממושכת תרבות 3. תאים מעל מגורה | 1. הפחתת ריכוז נוגדן ראשוני 2. ככל התאים מודגרת יותר, ציטוקינים / חלבון הם מפרישים. זה יגרום כתמים גדולים יותר יתחילו להתמזג ולהיות נבדל. 3. הפחת תרבית תאים צעד זמן הדגירה. גירוי יתר תגרום הרבה ציטוקינים / חלבון להיות מופרש על ידי התא. זה יהיה לייצר כתמים כי יתחילו להתמזג ולהיות נבדל. הפחת את כמות ממריץ בתקשורת תרבות או תרבות בסכום זמן קצר יותר |
| לא מוגדרים כתמים | 1. ממברנה לא טרום טיפול (אם הקרום שלך דורש את זה, לבדוק עם הספק) 2. פלייט תנועה במהלך הדגירה התא | 1. קרום חייב להיות מראש שטופלו אתנול או זה יכול לגרום, כתמים מטושטשים מוגדרים היטב. זה יהיה קשה לקורא להבחין בין אלה 2. אל תאפשר הצלחת להעביר במהלך הדגירה התא כמו תאים עברו תיצור יותר מאשר נקודה אחת. אם אפשר להשתמש חממה ייעודית כי לא ייפתחו במהלך הדגירה. אל הברז צלחת לאחר הוספת תאים |
| חיובי בקרה בארות נמוך | 1. נחשלות - עלול להיות תוצאה של שימוש streptavidin-ALP ו / או BCIP / NBT פתרונות שלא הובאו לטמפרטורת החדר | 1. תביאו ריאגנטים לטמפרטורת החדר לפני שמוסיפים את הבארות |
| צפיפות נקודות מקשה לכמת אותם | 1. תאים רבים מדי נוספו הבארות | 1. הפוך את דילולים של תאים (כלומר, 1 x 10 6, 5 x 10 5, 1 x 10 5, 5 x 10 4, 1 x 10 4 תאים לכל טוב) כדי לקבוע את המספר האופטימלי של התאים תגרום להיווצרות כתמים ברורים |
Discussion
Assay ELISPOT התפתחה כאחד מבחני החשוב ביותר בשימוש נרחב כדי לפקח על המערכת החיסונית בבני אדם וכן מגוון של מינים אחרים. עם assay ELISPOT, תדרים תא החיסון ניתן למדוד ברמת תא בודד ללא הרחבה או מניפולציה של אוכלוסיות תאים. Assay ELISPOT הוחל נרחב לחקור ספציפית אנטיגן התגובה החיסונית במחלות...
Disclosures
Acknowledgements
נתמך בחלקו על ידי מענק ונדרבילט CTSA 1 UL1 RR024975 של המרכז הלאומי למשאבי מחקר, המכונים הלאומיים לבריאות. עבודה זו מומנה על ידי NIH R01 HL 83839; R01 AI 65744.
Materials
א הכנת מדיה

ב הכנת מאגר טריס
- מוסיפים 800 מ"ל של DDH 2 O ל L 1 כוס.
- מדוד 12 גרם של טריס ומוסיפים כוס.
- הוסף hexahydrate 0.12 גרם של מגנזיום כלוריד (MgCl 2: 6 שעות 2 O) לתוך כוס.
- מערבבים עם מוט בחישה מגנטי על צלחת ערבוב אוטומטי.
- לאחר מומס, pH 9.5 הפתרון.
- מוסיפים 200 מ"ל של DDH 2 O ל כוס, מביאים אותו עד 1000mL.
- סנן את הפתרון עם מסנן 0.22 מיקרומטר.
ג חומרים הדרושים לניתוח ELISPOT:

References
- Dosanjh, D. P., Hinks, T. S., Innes, J. A., Deeks, J. J., Pasvol, G., Hackforth, S., Varia, H., Millington, K. A., Gunatheesan, R., Guyot-Revol, V., Lalvani, A. Improved diagnostic evaluation of suspected tuberculosis. Ann Intern Med. 148, 325-336 (2008).
- Sung, H. K. E. Diagnosis of abdominal tuberculosis by T-cell based assays on peripheral blood and peritoneal fluid mononuclear cells. Journal of Infection. 59, 409-415 (2009).
- Kim, S. -. H. Diagnosis of Central Nervous System Tuberculosis by T-Cell-Based Assays on Peripheral Blood and Cerebrospinal Fluid Mononuclear Cells. Clinical and Vaccine Immunology. , 1356-1362 (2008).
- Drake, W. P., Dhason, M. S., Nadaf, M., Shepherd, B. E., Vadivelu, S., Hajizadeh, R., Newman, L. S., Kalams, S. A. Cellular recognition of Mycobacterium tuberculosis ESAT-6 and KatG peptides in systemic sarcoidosis. Infect Immun. 75, 527-530 (2007).
- Allen, S. S., Evans, W., Carlisle, J., Hajizadeh, R., Nadaf, M., Shepherd, B. E., Pride, D. T., Johnson, J. E., Drake, W. P. Superoxide dismutase A antigens derived from molecular analysis of sarcoidosis granulomas elicit systemic Th-1 immune responses. Respir Res. 25, 36-36 (2008).
- Mutsvangwa, J., Millington, K. A., Chaka, K., Mavhudzi, T., Cheung, Y. B., Mason, P. R., Butterworth, A. E., Corbett, E. L., Lalvani, A. Identifying recent Mycobacterium tuberculosis transmission in the setting of high HIV and TB burden. Thorax. 65, 315-320 (2010).
- Streeck, H., Frahm, N., Walker, B. D. The role of IFN-gamma Elispot assay in HIV vaccine research. Nat Protoc. 4, 461-469 (2009).
- Chaudhary, N., Staab, J. F., Marr, K. A. Healthy human T-Cell Responses to Aspergillus fumigatus antigens. PLoS One. 5, e9036-e9036 (2010).
- Manigold, T., Mori, A., Graumann, R., Llop, E., Simon, V., Ferr, S. M., Valdivieso, F., Castillo, C., Hjelle, B., Vial, P. Highly differentiated, resting gn-specific memory CD8+ T cells persist years after infection by andes hantavirus. PLoS Pathog. 6, e1000779-e1000779 (2010).
- Ndongala, M. L., Kamya, P., Boulet, S., Peretz, Y., Rouleau, D., Tremblay, C., Leblanc, R., Côté, P., Baril, J. G., Thomas, R., Vézina, S., Boulassel, M. R., Routy, J. P., Sékaly, R. P., Bernard, N. F. Changes in function of HIV-specific T-cell responses with increasing time from infection. Viral Immunol. 2, 159-168 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved